Антиоксидантный эффект нано- и микрочастиц типичных компонентов природных воздушных взвесей in vitro
Автор: Голохваст К.С., Бородин Е.А., Штарберг М.А., Памирский И.Э., Паничев А.М., Мишаков И.В., Ведягин А.А., Гульков А.Н.
Рубрика: Влияние экологии на внутренние болезни
Статья в выпуске: 1-7 т.12, 2010 года.
Бесплатный доступ
В опытах in vitro исследовано влияние типичных компонентов воздушных взвесей (α-кварца, полевого шпата и вулканического стекла) на аскорбат- и НАДФН-зависимое на процесс перекисного окисления липидов в микросомах печени крыс.
Наночастицы, микрочастицы, антиоксиданты, кварц, полевой шпат, вулканическое стекло, перекисное окисление липидов
Короткий адрес: https://sciup.org/148100297
IDR: 148100297 | УДК: 57.042;
Текст научной статьи Антиоксидантный эффект нано- и микрочастиц типичных компонентов природных воздушных взвесей in vitro
Памирский Игорь Эдуардович, кандидат биологических наук, ассистент кафедры биологической химии Паничев Александр Михайлович, доктор биологических наук, ведущий научный сотрудник лаборатории экологии и охраны животных.
Мишаков Илья Владимирович, кандидат химических наук, старший научный сотрудник
Ведягин Алексей Анатольевич, кандидат химических наук, ученый секретарь, старший научный сотрудник Гульков Александр Нефедович, доктор технических наук, профессор, директор антиоксиданты, кварц, полевой шпат, вулкани-
(например, цеолититы и глины) являются по-лиминеральными горными породами. В связи с этим, оценивая информацию, которые дают авторы некоторых публикаций, посвященных исследованию медико-биологических свойств цеолититов, у читателей нередко возникает ряд вопросов, на которые нет ясного ответа. Так, например, часто не указывается конкретное месторождение и физико-химический состав изучаемых образцов, не уточняется размер частиц и не приводятся методы, которыми он определялся; обычно не показано с какой именно минеральной фазой в составе горных пород связываются наблюдаемые биомедицинские эффекты. Данные вопросы, несомненно, возникают из-за того, что изучение биологических свойств минеральных частиц является междисциплинарным исследованием на границе биологии, геологии, химии и физики.
Цель настоящей работы: изучение влияния наночастиц кварца, полевого шпата и вулканического стекла – минералов, которые встречаются в качестве сопутствующих примесей в медицинском минеральном сырье, а также – в виде минеральных частиц в атмосфере [13] на процессы перекисного окисления липидов (ПОЛ) in vitro.
Методы исследования. Минералы измельчались с помощью планетарной мельницы Fritch Pulverisette. В итоге размер частиц варьировал от 100 нм до 7 мкм, но подавляющее их число было размером около 1-2 мкм. Контроль размера частиц осуществлялся на лазерном анализаторе частиц Fritch Particle Sizer Ana-lysette 22. На рис. 1 приведена одна из полученных диаграмм.
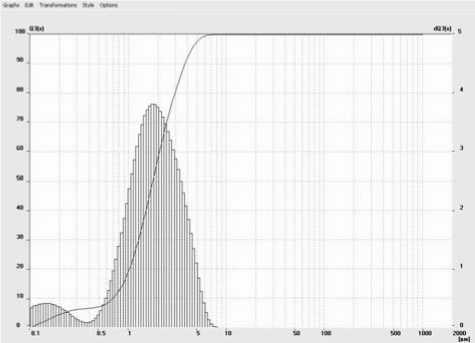
Рис. 1. Диаграмма размерности частиц вулканического стекла, измельченного в планетарной мельнице Fritch Pulverisette 4, полученная с помощью лазерного анализатора Fritch Ana-lysette 22 Nanotec (по оси абсцисс – размер в мкм, по оси ординат – процент частиц определенного размера)
Для выделение фракции микросом мы после забоя животных вскрывали грудную и брюшную полость и в нижнюю полую вену через сердце вводили канюлю. Для удаления гемоглобина печень in situ перфузировали 0,15М раствором KCl, содержащим 5мМ трис-HCl буфер с рН 7,4 (до светло-желтого цвета). Печень удаляли, отжимали на марлевой салфетке, взвешивали и измельчали ножницами. Гомогенат приготавливали в гомогенизаторе Даунса с тефлоновым пестиком при отношении массы ткани к объему р-ра = 1/3. Гомогенизирование проводили в течение одной минуты при двадцати движениях пестика вверх и вниз. Все процедуры проводили, используя растворы, охлажденные до 4-50С. Гомогенат центрифугировали при 9500 g в течение 20 мин. при 30С на лабораторной охлаждающей центрифуге К24D (Германия). Надосадочную жидкость подвергали дальнейшему центрифугированию при 24000 g в течение 120 мин. при 30С. Осадок микросом ресуспендировали в среде выделения до содержания белка 20-25 мг/мл и в дальнейшем использовали в работе.
Определение ПОЛ в суспензии микросом проводилось по следующей методике: в суспензии микросом объемом 1 мл, содержащей 0,8 мМ аскорбата (или 1 мМ НАДФН); 0,2 мМ пирофосфата натрия; 50 мМ трис-НСl буфера с рН 7,4, а также 1,0 мг белка микросом инициировали внесением ионов Fe2+ в конечной концентрации 12 мкМ. Продолжительность инкубации – 5 мин. для аскорбат-зависимого и 20 мин. для НАДФН-зависимого ПОЛ, температура 370С. Реакцию останавливали добавлением 30% раствора ТХУ с ЭДТА в конечной концентрации 1,5 мМ. При исследовании АОА наноминералов в инкубационную смесь вносили минералы в количестве 10мг. В опытах с α-кварцем (в отличие от других компонентов) варьировали вносимое его количество в пределах 1-50 мг. О скорости ПОЛ судили по образованию малонового диальдегида (МДА), определяемого по цветной реакции с тиобарби-туровой кислотой (ТБК) [1]. Антиоксидантный эффект наноминералов рассчитывали по формуле:
АОА нм
МДА контроль
- МДА опыт
МДА контроль
100%
где АОА нм – антиокислительная активность наночастиц минералов; МДА контроль – образование МДА в микросомах; МДА опыт – образование МДА в микросомах в присутствии наноминерала.
Для определения сорбции ионов Fe2+ минералами к 1 мл 1,28 мМ Fe2+ добавляли от 10 до 100 мг минерала. В качестве источника Fe2+ использовалась соль Мора (FeSO 4 ∙(NH 4 ) 2 SO 4 ∙6H 2 O). Тщательно перемешивали содержимое пробирки в течение нескольких минут. Далее смесь центрифугировали для осаждения минерала, отбирали 0,1 мл надосадка и определяли в нем содержание ионов Fe2+ по цветной реакции с К 3 [Fe(CN 6 )].
Результаты и обсуждение. Как видно из полученных результатов (табл. 1) скорость неферментативного аскорбат-зависимого ПОЛ в суспензии микросом снижается в присутствии всех наноминералов от 3,1 нмоль МДА мин-1 мг-1 белка микросом до 1,8-2,5 нмоль МДА мин-1 мг-1 белка микросом. Наибольший антиоксидантный эффект (41%) оказывал α-кварц, наименьший (19%) – полевой шпат. Аналогичный эффект оказывают наноминералы на ферментативное НАДФН-зависимое ПОЛ в суспензии микросом (табл. 2). Как и в случае с аскорбат-зависимым ПОЛ, антиоксидантный эффект при НАДФН-зависимом ПОЛ также сильнее всего выражен у α-кварца (65%), меньше вулканического стекла (30%) и еще меньше (7%) – у полевого шпата.
Таблица 1. Влияние наноминералов в концентрации 10 мг/мл инкубационной смеси на скорость аскорбат-зависимого ПОЛ в микросомах печени (представлены средние значения и ошибки средних)
|
Параметр |
Микросомы |
Микросомы + а-кварц |
Микросомы + полевой шпат |
Микросомы + вулк. стекло |
|
скорость ПОЛ* |
3,1±0,24 |
1,8±0,11 |
2,5±0,15 |
2,1± |
|
АОА нм (%) |
41 |
19 |
33 |
Примечание: здесь и далее * - измеряется в нмоль МДА мин-1 г-1 белка микросом
Таблица 2. Влияние наноминералов на скорость НАДФН -зависимого ПОЛ в микросомах печени (представлены средние значения и ошибки средних)
|
Параметр |
Микросомы |
Микросомы + а-кварц |
Микросомы + полевой шпат |
Микросомы + вулк. стекло |
|
скорость ПОЛ* |
0,26±0,016 |
0,09±0,01 |
0,24±0,013 |
0,18±0,015 |
|
АОА нм (%) |
65 |
7 |
30 |
Мы исследовали зависимость влияния α-кварца на скорость аскорбат-зависимого ПОЛ в микросомах печени от его концентрации в инкубационной смеси (табл. 3). В данном опыте скорость ПОЛ в микросомах составила 2,21 нмоль МДА мин-1 мг-1 белка микросом. При увеличении концентрации α-варца в инкубационной смеси с 1 до 50 мг/мл скорость ПОЛ снизилась до 2,17 - 0,33 нмоль МДА мин-1 мг-1 белка микросом, а антиоксидантный эффект увеличился с 2 до 85%.
Таблица 3. Зависимость влияния а-кварца на скорость аскорбат-зависимого ПОЛ в микросомах печени от его концентрации в инкубационной смеси (представлены средние значения и ошибки средних)
|
Параметр |
Микросомы |
Микросомы + а-кварц (1 мг/мл) |
Микросомы + а-кварц (5 мг/мл) |
Микросомы + а-кварц (10 мг/мл) |
Микросомы + а-кварц (50 мг/мл) |
|
скорость ПОЛ* |
2,21±0,17 |
2,17±0,016 |
1,40±0,011 |
0,84±0,091 |
0,33±0,039 |
|
АОА нм (%) |
2 |
37 |
62 |
85 |
Таким образом, при исследовании влияния α-кварца, полевого шпата и вулканического стекла на ПОЛ в микросомах печени крыс in vitro все 3 наноминерала оказывают антиокcидантный эффект как при неферментативном, так и при ферментативном ПОЛ. Сильнее всего эффект выражен у α-кварца, меньше всего – у полевого шпата. Сила эффекта пропорциональна концентрации α-кварца в инкубационной смеси.
На первый взгляд установленный нами антиоксидантный эффект наноминералов и особенно α-кварца при ПОЛ в микросомах печени представляется весьма неожиданным и объяснить его механизм затруднительно. Вряд ли использованные минералы обладают восстанавливающими свойствами и являются истинными антиксидантами, т. е. ловушками свободных радикалов. В качестве причины эффекта можно представить сорбцию минералами каких-либо компонентов, необходимых для протекания процесса ПОЛ, например ионов Fe2+. Мы проверили это предположение, исследовав способность минералов сорбировать ионы Fe2+. Для исследования сорбции ионов Fe2+ использованными в работе минералами нами был разработан метод количественного определения ионов Fe2+ по качественной реакции ионов Fe2+ с К3[Fe(CN6)]. При относительно низких концентрациях ионов Fe2+ и К3[Fe(CN6)] не происходит выпадения осадка берлинской лазури, и реакция сопровождается лишь развитием сине-голубого окрашивания с максимум при 693 нм. Спектр поглощения цветного продукта не перекрывается с пиком поглощения К3[Fe(CN6)], максимум которого отмечается при 420 нм. Использованная нами концентрация К3[Fe(CN6)] составляла 50 мг/100 мл. Объем инкубационной смеси 3 мл. Линейная зависимость интенсивности развивающейся окраски от количества вносимого Fe2+ отмечается в диапазоне количества вносимого Fe2+ от 20 до 180 нмоль (рис. 2). Из калибровочного графика рассчитали коэффициент мольной экстинкции образующегося цветного комплекса -7150 ед ОП М-1 см-1.
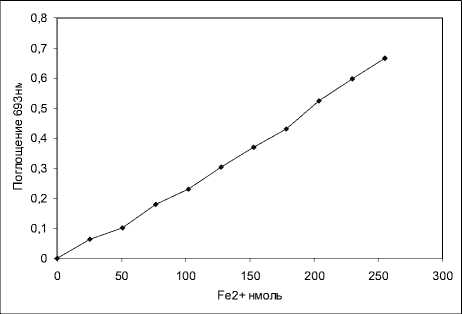
Рис. 2. Калибровочный график для определения ионов Fe2+ по цветной реакции с К 3 [Fe(CN 6 )].
Первоначально для исследования сорбции ионов Fe2+ мы брали 100 мг минералов. Как видно из результатов, представленных в табл. 4, в выбранных экспериментальных условиях полевой шпат сорбировал практически все железо, вулканическое стекло – 98% железа, а α-кварц – только 28%. При исследовании сорбции ионов Fe2+ различными количествами полевого шпата (10-50 мг) установлено, что процент сорбции возрастает с увеличением количества минерала. 1 мг минерала сорбирует 1,21,3 нмоль Fe2+ (табл. 5).
Таблица 4. Сорбция ионов Fe2+наноминералами (100 мг наноминерала) (представлены результаты типичного опыта)
|
Параметр |
Исходный раствор ионов Fe2+ |
α-кварц |
полевой шпат |
Вулканическое стекло |
|
нмоль Fe2+ в растворе |
100 |
72 |
1 |
8 |
|
сорбировано Fe2+ (нмоль) |
- |
28 |
99 |
92 |
|
% сорбции |
28 |
99 |
92 |
Таблица 5. Зависимость сорбции ионов Fe2+ полевым шпатом от количества наноминерала (представлены результаты типичного опыта)
|
Параметр |
Исходный раствор ионов Fe2+ |
Полевой шпат |
||||
|
10 мг |
20 мг |
30 мг |
40 мг |
50 мг |
||
|
нмоль Fe2+ в растворе |
120 |
106 |
105 |
84 |
71 |
55 |
|
сорбировано Fe2+ (нмоль) |
- |
14 |
15 |
36 |
49 |
65 |
|
% сорбции |
- |
12 |
13 |
30 |
41 |
54 |
|
сорбировано Fe2+ (нмоль/ мг наноминерала) |
- |
1,2 |
1,23 |
1,3 |
||
Выводы: исследованные минералы способны сорбировать ионы Fe2+, и это согласуется с их антиоксидантным эффектом при ПОЛ в микросомах печени. Однако прямой зависимости между выраженностью антиоксидантного эффекта минерала и его способностью к сорбции Fe2+ не выявлено. Так, α-кварц оказывает наиболее выраженный антиоксидантный эффект и обладает наименьшими сорбционными свойствами. Из трех исследованных минералов полевой шпат наиболее эффективно сорбирует Fe2+ и проявляет наименьший антиоксидантный эффект. Кроме этого необходимо учитывать, что концентрация ионов Fe2+ в инкубационной смеси при инициировании ПОЛ (12 мкМ) была на 2 порядка ниже их концентрации в растворе при исследовании сорбции ионов Fe2+минералами. Следовательно, объяснить выявленные антиоксидантные свойства минералов при ПОЛ в микросомах печени исключительно способностью минералов сорбировать ионы железа невозможно. Можно предположить, что расхождение литературных данных по вопросу о наличии антиоксидантных или прооксидант-ных свойств у различных минералов может объясняться тем, что в разных экспериментах были взяты частицы минералов с разным размером и различными физико-химическими характеристиками.
Работа выполнена при поддержке Фонда содействия развитию малых форм предприятий в научно-технической сфере (программа У.М.Н.И.К.), грантов СО РАН ПСО-10 №114 и ДВО РАН 09-II-СО-05-002.
Список литературы Антиоксидантный эффект нано- и микрочастиц типичных компонентов природных воздушных взвесей in vitro
- Бородин, Е.А. Перекисное окисление липидов в мембранах эритроцитов и микросом печени и антиокислительная система тканей крыс при длительном действии холода/Е.А. Бородин и др.//Биологические мембраны. 1992. Т. 9, №6. С. 622-627.
- Голохваст, К.С. Антиоксидантные и иммуномодулирующие свойства природных цеолитов/К.С. Голохваст и др.//Тихоокеанский медицинский журнал. 2009. №3. С. 68-70.
- Даугелдь-Дауге, Н.О. Зависимость кластогенной активности цеолита от размеров пылевых частиц и наличия кальция/Н.О. Даугель-Дауге и др.//Токсикологический вестник. 2001. №5. С. 11-13.
- Дурнев, А.Д. Исследование мутагенного действия пыли природных цеолитов и хризотил-асбеста/А.Д. Дурнев и др.//Экспериментальная онкология. 1990. Т. 12, №2. С. 21-24.
- Дурнев, А.Д. Отдаленные последствия мутагенного действия хризотил-асбеста и цеолита in vivo/А.Д. Дурнев и др.//Бюллетень экспериментальной биологии и медицины. 1993. № 115(5). С. 484-486.
- Коркина, Л.Г. Механизм цитотоксического действия натурального цеолита клиноптилолита/Л.Г. Коркина и др.//Фармакология и токсикология. 1984. № 47(5). С. 63-67.
- Коркина, Л.Г. Сравнительная характеристика цитотоксических свойств природных цеолитов/Л.Г. Коркина//Гигиена труда и профессиональные заболевания. 1984. № 12. С. 49-50.
- Курамшина, Н.Г. Южноуральские цеолиты -экобезопасность и влияние на организм птицы, сельскохозяйственных животных/Н.Г. Курамшина и др. -Издательство БашГАУ, 2007. -248 с.
- Пылев, Л.Н. Канцерогенная безопасность цеолита Холинского месторождения/Л.Н. Пылев и др.//Гигиена и санитария. 2003. № 2. С. 53-56.
- Середенин, С.Б. Мутагены (Скрининг и фармакологическая профилактика воздействий)/С.Б. Середенин, А.Д. Дурнев. -М.: Медицина, 1998. 328 с.
- Ilgren, E.B. A reconnaissance study of a potential emerging mexican mesothelioma epidemic due to fibrous zeolite exposure/E.B. Ilgren et al.//Indoor and Built Environment. 2008. №17(6). P. 496-515.
- Final report on the safety assessment of aluminum silicate, calcium silicate, magnesium aluminum silicate, magnesium silicate, magnesium trisilicate, sodium magnesium silicate, zirconium silicate, attapulgite, bentonite, Fuller's earth, hectorite, kaolin, lithium magnesium silicate, lithium magnesium sodium silicate, montmorillonite, pyrophyllite, and zeolite//International Journal of Toxicology. 2003. № 22. P. 37-102.
- Skinner, H.S.W. The Earth, source of health and hazards: an introduction to medical geology//Annu. Rev. Earth Planet. Sci. 2007. №35. P. 177-213.
- Sverko, V. Natural micronized and clinoptilolite mixed with extract Urtica dioica L. as possible antioxidant/V. Sverko et al.//Food Technol. Biotechnol. 2004. V. 42. P. 189-192.
- Thomas, J.A. Toxicological Assessment of Zeolites/J.A. Thomas, B. Ballantyne//J. of the American College of Toxicology. 1992. V. 11, №3. P. 259-273.


