Антиоксидантный статус и функциональное состояние дыхательной системы у новорожденных телят с внутриутробной задержкой развития
Автор: Сафонов В.А., Михалв В.И., Черницкий А.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Функциональная биохимия
Статья в выпуске: 4 т.53, 2018 года.
Бесплатный доступ
Внутриутробная задержка развития эмбриона и плода (ВЗРП), определяемая как несоответствие размеров формирующихся эмбрионов и плодов срокам их гестации - распространенная патология среди сельскохозяйственных животных. Незрелая система антиоксидантной защиты (АОЗ) у новорожденных с ВЗРП предрасполагает к развитию оксидативного стресса и связанных с ним патологических состояний. В 2013 году в условиях крупного молочного комплекса (ООО «Агротех-Гарант Нащекино» Аннинский р-н, Воронежская обл.) проведено сравнительное исследование показателей системы АОЗ и функционального состояния органов дыхания у новорожденных телят при физиологически протекающей беременности и ВЗРП и их влияния на развитие респираторных заболеваний в неонатальный период. Обследовано 53 теленка красно-пестрой породы: 28 - с ВЗРП в анамнезе и 25 - с физиологическим течением беременности у матерей (контрольная группа). Через 24 ч после рождения у телят отбирали пробы волос из кисти хвоста, кровь и конденсат выдыхаемого воздуха (КВВ) для биохимических исследований, определяли частоту сердечных сокращений (ЧСС) и дыхательных движений (ЧДД) в минуту, соотношение ЧСС/ЧДД (индекс Хильдебрандта), дыхательный объем (ДО) и минутный объем дыхания (МОД), объем КВВ, образующийся за 1 мин (V1) и из 100 л выдыхаемого воздуха (V2)...
Внутриутробная задержка развития эмбриона и плода, новорожденные телята, система антиоксидантной защиты, оксидативный стресс, конденсат выдыхаемого воздуха, респираторные болезни, бронхопневмония
Короткий адрес: https://sciup.org/142216582
IDR: 142216582 | УДК: 636.2:619:618.3:577.1 | DOI: 10.15389/agrobiology.2018.4.831rus
Текст научной статьи Антиоксидантный статус и функциональное состояние дыхательной системы у новорожденных телят с внутриутробной задержкой развития
Внутриутробная задержка развития эмбриона и плода (ВЗРП), определяемая как несоответствие размеров формирующихся эмбрионов и плодов срокам гестации, остается серьезной проблемой животноводства (1-3). Научный интерес к ВЗРП обусловлен не только широким распро- странением этого синдрома среди беременных животных (1, 4), но и его негативным влиянием на постнатальный рост и здоровье потомства (1, 57). Для новорожденных с ВЗРП характерна постнатальная гипогликемия, гипоксемия (1, 8), повышенная чувствительность к переохлаждению вследствие нарушения механизмов терморегуляции и низких энергетических запасов организма (8-10). Респираторные дисфункции у новорожденных животных с ВЗРП — один из факторов, приводящих к их гибели в период от рождения до отъема (1, 5, 11).
Хотя клиническое состояние и поведение таких животных может казаться нормальным, их внутренние органы морфологически и функционально незрелы (12-14). В исследовании на свиньях (15) было показано, что незрелая система антиоксидантной защиты у новорожденных с ВЗРП предрасполагает к развитию оксидативного стресса и постнатальных метаболических нарушений.
Мы впервые провели сравнительный анализ показателей системы антиоксидантной защиты и функционального состояния органов дыхания у новорожденных телят при физиологически протекающей беременности и ВЗРП. У новорожденных телят с ВЗРП были выявлены недостаточность ферментативного и неферментативного звеньев системы антиоксидантной защиты, повышение концентрации малонового диальдегида в крови и конденсате выдыхаемого воздуха, возрастание экспирации ферментов различной субклеточной локализации (аланинаминотрансферазы, у -глутамил-трансферазы, аспартатаминотрансферазы), свидетельствующее о повреждении клеток респираторного тракта в условиях оксидативного стресса.
Цель исследования — изучить показатели антиоксидантного статуса и функционального состояния дыхательной системы у новорожденных телят с внутриутробной задержкой развития и влияние этих нарушений на развитие респираторных заболеваний в неонатальный период.
Методика. Было обследовано 53 теленка красно-пестрой породы: 28 — с ВЗРП в анамнезе и 25 — с физиологическим течением беременности у матерей (контрольная группа); наблюдения поводили в 2013 году в ООО «Агротех-Гарант Нащекино» (Аннинский р-н, Воронежская обл.). ВЗРП у коров диагностировали методом трансректальной пальпации и эхографии с использованием ультразвукового сканера Easi-Scan-3 («BCF Technology Ltd.», Великобритания) с линейным датчиком 4,5-8,5 МГц. Критериями недоразвития эмбрионов и плодов считали копчико-теменной размер на 38-45-е сут после осеменения и зачатия менее 16 мм и диаметр корпуса менее 9 мм, в возрасте 60-65 сут — соответственно менее 45 и 16 мм, на 110-115-е сут — диаметр рога-плодовместилища менее 15 см и плацен-том менее 17 мм (2, 4).
Выполняли биохимические исследования проб волоса, крови и конденсата выдыхаемого воздуха (КВВ), взятых у телят через 24 ч после рождения. Пробы волоса отбирали с кисти хвоста, образцы крови получали из яремной вены, используя коммерческие вакуумные системы для забора крови (с EDTA в качестве антикоагулянта). КВВ у телят собирали с помощью разработанного нами устройства (16). Сыворотку получали центрифугированием крови без добавления антикоагулянта при комнатной температуре (4000 об/мин, UC-1612, «ULAB», Китай) в течение 10 мин. Сразу после получения образцы сыворотки и КВВ замораживали и хранили в жидком азоте при - 196 ° С до проведения биохимических исследований.
Пробоподготовку волос проводили методом мокрого озоления, содержание микроэлементов (селена, меди, цинка, железа, кобальта и марганца) в образцах определяли на атомно-адсорбционном спектрофотомет-832
ре AA6300 («Shimadzu», Япония).
При оценке состояния ферментативного звена системы антиоксидантной защиты в крови измеряли активность каталазы (КФ 1.11.1.6) и селензависимой глутатионпероксидазы (ГПО, КФ 1.11.1.9), используя релевантные методы, описанные М.И. Рецким и соавт. (17); активность су-пероксиддисмутазы (СОД, КФ 1.15.1.1) в крови определяли по степени ингибирования аутоокисления адреналина (18). О состоянии неферментативного звена системы антиоксидантной защиты судили по содержанию в сыворотке (плазме) крови витамина А (19), α -токоферола (17), L-аскорбиновой кислоты (20) и общей антиокислительной активности (АОА) плазмы крови (21). Концентрацию малонового диальдегида (МДА) в крови и КВВ определяли на спектрофотометре UV-1700 («Shimadzu», Япония) по реакции с тиобарбитуровой кислотой (17).
Интенсивность железоиндуцированной хемилюминесценции КВВ исследовали с помощью биохемилюминометра БХЛ-07 (ООО «Медозонс», Россия) по методике, описанной Y.G. Voronkova и соавт. (22), с некоторыми изменениями. В измерительную кювету последовательно вносили 0,2 мл КВВ, 0,4 мл 0,02 М калий-фосфатного буфера (рН 7,5) и 0,4 мл 0,01 М раствора сульфата железа (II). Кювету со смесью устанавливали в измерительное гнездо прибора, быстро добавляли 0,2 мл 2 % раствора пероксида водорода и переводили кювету в измерительное положение. Свободнорадикальный процесс регистрировали в течение 30 с, хемилюминесценцию оценивали на основе анализа кинетической кривой по следующим показателям: максимальная интенсивность вспышки (характеризует интенсивность свободнорадикального окисления) — Imax, мВ; светосумма хемилюминесценции (отражает оксидантную активность) — S, мВ ½ с; тангенс угла наклона кинетической кривой к оси времени (характеризует антиоксидантную активность) — tg2 α . Для определения баланса оксидантной и антиоксидантной активности рассчитывали соотношение S/tg2 α (23). Активность аланинаминотрансферазы (АлАТ), γ -глутамилтрансферазы (ГГТ) и аспартатаминотрансферазы (АсАТ) в КВВ исследовали на биохимическом анализаторе Hitachi-902 («Roche Diagnostics», Япония).
У телят определяли частоту сердечных сокращений (ЧСС) и дыхательных движений (ЧДД) в минуту; показатели функции внешнего дыхания (дыхательный объем и минутный объем дыхания) исследовали с помощью спирометра ССП (КПО «Медаппаратура», Украина) и маски с системой клапанов; индекс Хильдебрандта рассчитывали как отношение ЧСС к ЧДД. За животными в течение 30 сут после рождения вели постоянное клиническое наблюдение: состояние при респираторном синдроме оценивали в баллах по системе WI (24), учитывали время появления первых клинических признаков и разгара бронхита, тяжесть течения болезни (0 — отсутствие патологии, 1 — легкое течение, 2 — умеренно-тяжелое течение и 3 — тяжелое течение), осложнение в виде бронхопневмонии.
Статистическую обработку данных выполняли в программах Statistica 8.0 («StatSoft, Inc.», США) и IBM SPSS Statistics 20.0 («IBM Corp.», США). Результаты выражали как среднее арифметическое и стандартное отклонение ( M ±SD), минимальное (min), максимальное значения (max) и медиану ( Me ). Достоверность различий между медианами выборок определяли, используя непараметрический критерий Вилкоксона. Взаимосвязи между показателями выявляли с помощью непараметрических критериев Спирмена ( rS ) и τ -Кендалла ( r τ -K). Нулевая гипотеза при применении всех методов статистической обработки отвергалась при Р < 0,05.
Результаты. В крови телят с ВЗРП было установлено снижение ак- тивности каталазы на 14,4 % (Р < 0,001), ГПО на 14,0 % (Р < 0,001) и СОД на 33,8 % (Р < 0,001), содержания в сыворотке витамина A на 36,7 % (Р < 0,05) и α-токоферола на 38,3 % (Р < 0,001), ОАО плазмы крови на 18,6 % (Р < 0,01) по сравнению с контрольной группой (табл. 1). Статистически достоверных различий между группами телят по концентрации L-аскорбиновой кислоты в плазме крови мы не наблюдали.
-
1. Показатели состояния системы антиоксидантной защиты в крови (сыворотке) у новорожденных телят красно-пестрой породы в норме и при внутриутробной задержке развития плода (ООО «Агротех-Гарант Нащекино», Аннинский р-н, Воронежская обл., 2013 год)
-
2. Содержание микроэлементов в волосе кисти хвоста у новорожденных телят красно-пестрой породы в норме и при внутриутробной задержке развития плода (ООО «Агротех-Гарант Нащекино», Аннинский р-н, Воронежская обл., 2013 год)
|
Показатель 1 M ±SD 1 |
min-max 1 Me |
|
26,7±1,4 Каталаза, мкмоль H2O2/(л•мин) 31 2±3 0 ГПО, ммоль GSH/(л•мин) 6 7 ,8 9 4 5 ± ± 0 0 ,7 7 0 1 0,53±0,07 СОД, усл. ед. 0,80±0,09 0,57±0,22 Витамин А, мкмоль/л 0 90±0 35 5,0±2,2 Α -токоферол, мкмоль/л 8,1±1,6 17,8±6,8 L-аскорбиновая кислота, мкмоль/л 23 4±5 1 42 , ,5±7 , ,7 АОА, % 52,2±4,2 |
23,6-28,7 26,9*** 27,3-35,3 30,6 5,56-7,84 6,90*** 6,71-8,72 8,31 0,43-0,65 0,53*** 0,62-0,92 0,81 0,27-0,87 0,54* 0,60-1,60 0,73 2,8-8,4 4,0*** 5,5-9,9 8,7 10,9-30,6 17,3 17,3-36,6 22,8 27,9-48,0 44,4** 47,6-61,0 51,7 |
П р и м еч а ни е. GSH — восстановленный глутатион, ГПО — глутатионпероксидаза, СОД — суперок-сиддисмутаза, АОА — общая антиокислительная активность плазмы крови. Над чертой — группа телят с внутриутробной задержкой развития ( n = 28), под чертой — группа телят, полученных от коров с физиологическим течением беременности ( n = 25).
*, ** и *** Различия между группами статистически значимы соответственно при P < 0,05, P < 0,01 и P < 0,001.
В волосе новорожденных телят с ВЗРП обнаружено снижение количества практически всех исследуемых микроэлементов (за исключением железа): меди на 28,3 % (P < 0,001), цинка на 10,7 % (P < 0,001), марганца на 9,4 % (P < 0,001), селена на 26,4 % (P < 0,001) и кобальта на 36,8 % (P < 0,001) по сравнению с контрольной группой (табл. 2).
Корреляционный анализ выявил статистически значимые зависимости между содержанием меди в волосе телят и активностью СОД в крови ( rS = +0,55 при P < 0,05), а также содержанием селена в волосе и активностью ГПО в крови ( rS = +0,84 при P < 0,01).
|
Показатель 1 |
M ±SD 1 min-max 1 Me |
|
Железо, мг/кг |
31,7±8,6 20,3-47,0 30,4 37,5±13,0 20,3-65,0 34,4 |
|
Медь, мг/кг |
6,52±1,30 3,15-8,0 7,01* 9,09±1,01 7,4-10,6 9,35 |
|
Цинк, мг/кг |
105,6±14,2 88,7-127,3 98,8* 118,2±15,8 91,3-138,1 121,6 |
|
Марганец, мг/кг |
8,55±0,27 8,11-9,01 8,50* 9,44±1,22 8,11-12,8 9,19 |
|
Селен, мкг/кг |
345,0±67,4 261,0-447,0 317,5* 468,5±69,4 398,0-595,0 457,5 |
|
Кобальт, мкг/кг |
42,5±10,1 25,4-56,0 42,9* 67,3±15,2 51,2-96,8 62,7 |
П р и м еч а ни е. Над чертой — группа телят с внутриутробной задержкой развития ( n = 28), под чертой — группа телят, полученных от коров с физиологическим течением беременности ( n = 25).
* Различия между группами статистически значимы при P < 0,001.
Увеличение концентрации МДА в крови и КВВ телят с ВЗРП соответственно на 26,8 % (P < 0,001) и 119,5 % (P < 0,001) по сравнению с контрольной группой (рис. 1) свидетельствовало о возрастании системной и локальной (легкие) интенсивности пероксидации липидов на фоне функциональной недостаточности ферментативного и неферментативного звеньев системы антиоксидантной защиты.
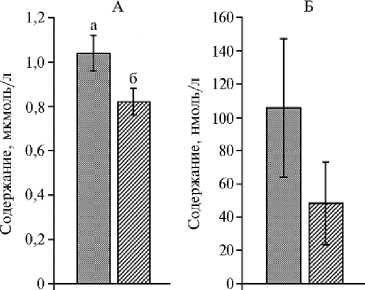
венно на 36,2 % (P < 0,01) и 40,6 %
Рис. 1. Содержание малонового диальдегида (МДА) в крови (А) и в конденсате выдыхаемого воздуха (Б) у новорожденных телят красно-пестрой породы при внутриутробной задержке развития плода (а) и физиологическом течении беременности у коров-матерей (б) ( M ±SD, ООО «Агротех-Гарант Нащекино», Аннинский р-н, Воронежская обл., 2013 год).
При исследовании железоиндуцированной хемилюминесценции КВВ (табл. 3) у новорожденных телят с ВЗРП регистрировали увеличение интенсивности вспышки Imax и светосуммы S КВВ соответст-(P < 0,01) по сравнению с контроль- ной группой, что указывало на повышение оксидантной активности КВВ. Показатели Imax и S/tg2α коррелировали с концентрацией МДА в КВВ: соответственно rS = +0,78 (P < 0,01) и rS = +0,48 (P < 0,01). Достоверных различий между группами телят по величине tg2α мы не обнаружили. Повышение соотношения S/tg2α в КВВ телят с ВЗРП (на 35,5 % по сравнению с контрольной группой, P < 0,01) свидетельствовало о нарушении баланса оксидантной и антиоксидантной активности КВВ и развитии оксидативного стресса. Были обнаружены статистически значимые зависимости между соотношением S/tg2α в КВВ и активностью антиокси- дантных ферментов в крови — каталазы (rS = -0,54 при P < 0,01), ГПО (rS = -0,49 при P < 0,01) и СОД (rS = -0,85 при P < 0,01).
3. Показатели железоиндуцированной хемилюминесценции конденсата выдыхаемого воздуха у новорожденных телят красно-пестрой породы в норме и при внутриутробной задержке развития плода (ООО «Агротех-Гарант Нащеки-но», Аннинский р-н, Воронежская обл., 2013 год)
|
Показатель |
M ±SD |
min-max |
Me |
|
S, мВ ½ с |
417,3±37,6 296,9±49,1 |
374,0-472,0 248,0-422,0 |
411,5* 282,0 |
|
Imax, мВ |
65,8±4,7 |
61,0-73,0 |
64,5* |
|
48,3±10,0 |
40,0-73,0 |
43,0 |
|
|
20,3±1,7 |
18,0-22,5 |
20,3 |
|
|
tg2 α |
19,5±2,4 |
18,0-25,5 |
18,0 |
|
S/tg2 α |
20,6±1,1 |
19,2-22,1 |
20,6* |
|
15,2±1,0 |
13,4-16,5 |
15,7 |
П р и м е ч а н и е. Над чертой — группа телят с внутриутробной задержкой развития ( n = 28), под чертой — группа телят, полученных от коров с физиологическим течением беременности ( n = 25).
* Различия между группами статистически значимы при P < 0,01.
В КВВ телят с ВЗРП происходило увеличение активности АлАТ на 105,9 % (P < 0,001), ГГТ на 416,1 % (P < 0,001), АсАТ на 62,5 % (P < 0,001) по сравнению с контрольной группой (рис. 2). Повышение активности ферментов различной субклеточной локализации (цитоплазматической АлАТ, мембраносвязанной ГГТ, митохондриальной АсАТ) в КВВ у телят с внутриутробной задержкой развития отражает степень структурно-функционального повреждения клеток респираторного тракта в условиях оксида-тивного стресса (от нарушения проницаемости биомембран до цитолиза) и связано с выходом этих компонентов в бронхоальвеолярную жидкость (26,
27). Мы установили наличие статистически значимых зависимостей между активностью ГГТ в КВВ и показателем интенсивности свободнорадикального окисления Imax (rS = +0,51 при P < 0,01), соотношением S/tg2α, отражающим баланс оксидантной и антиоксидантной активности КВВ (rS = +0,74 при P < 0,01), а также активностью в крови ГПО (rS = -0,55 при P < 0,01) и СОД (rS = -0,53 при P < 0,01). Аналогичные зависимости были обнаружены между активностью АсАТ в КВВ и соотношением S/tg2α (rS = +0,41 при P < 0,05), активностью в крови ГПО (rS = -0,52 при P < 0,01) и СОД (rS = -0,38 при P < 0,05), а также между активностью АлАТ активности КВВ tg2α (rS = -0,39
в КВВ и показателем антиоксидантной при P < 0,05).
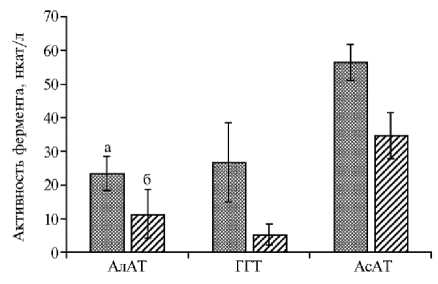
Рис. мого
2. Активность ферментов в конденсате выдыхае-воздуха у новорожденных телят красно-пестрой породы: а — при внутриутробной задержке развития плода, б — при физиологическом течении беременности; АлАТ — аланинаминотрансфераза, ГГТ — γ-глутамилтрансфераза, АсАТ — аспартатаминотрансфераза (M±SD, ООО «Агротех-Гарант Нащекино», Аннинский р-н, Воронежская обл., 2013 год).
Хильдебрандта у телят с ВЗРП (на 7,9 %
У телят с ВЗРП на фоне снижения минутного объема дыхания на 34,0 % (P < 0,001) и дыхательного объема на 20,9 % (P < 0,001) регистрировали повышение интенсивности респираторного влаговыделения: объем КВВ, образующийся за 1 мин и из 100 л выдыхаемого воздуха, возрастал по сравнению с контрольной группой соответственно на 28,6 % (P < 0,01) и 67,3 % (P < 0,001) (табл. 4). Мы обнаружили обратную зависимость между объемом конденсата, образующимся из 100 л выдыхаемого воздуха, и глубиной дыхания (rS = -0,61 при P < 0,01). Увеличение индекса по сравнению с показателем в контрольной группе, P < 0,05) свидетельствовало о расстройстве вегетативной регуляции и перенапряжении кардиореспираторной функциональной системы (25).
4. Показатели респираторной и влаговыделительной функции легких у новорожденных телят красно-пестрой породы в норме и при внутриутробной задержке развития плода (ООО «Агротех-Гарант Нащекино», Аннинский р-н, Воронежская обл., 2013 год)
|
Показатель |
M ±SD |
min-max |
Me |
|
ЧДД, мин - 1 |
46,3±8,1 57,7±15,7 |
23,6-28,7 27,3-35,3 |
44,0* 52,0 |
|
МОД, л |
9,5±2,2 14,4±2,8 |
7,4-12,5 10,6-19,1 |
8,7** 13,4 |
|
ДО, мл |
210,7±55,8 266,3±88,3 |
153-284 156-445 |
195,0** 254,0 |
|
V1, мл |
0,09±0,03 0,07±0,02 |
0,06-0,12 0,05-0,09 |
0,10* 0,07 |
|
V2, мл |
0,92±0,31 0,55±0,09 |
0,59-1,42 0,39-0,72 |
0,84** 0,53 |
П р и м еч а ни е. ЧДД — частота дыхательных движений, МОД — минутный объем дыхания, ДО — дыхательный объем; V1 и V2 — объем конденсата выдыхаемого воздуха, образующийся соответственно за 1 мин и из 100 л выдыхаемого воздуха. Над чертой — группа телят с внутриутробной задержкой развития ( n = 28), под чертой — группа телят, полученных от коров с физиологическим течением беременности ( n = 25).
*, ** Различия между группами статистически значимы соответственно при P < 0,01 и P < 0,001.
Респираторные болезни регистрировали у 48,0 % телят, полученных от коров с физиологическим течением беременности, и у 100 % телят 836
с ВЗРП, тяжелое течение бронхита с осложнением в виде бронхопневмонии — соответственно у 12,0 % и 85,7 % животных. Были установлены статистически значимые зависимости между вероятностью развития бронхопневмонии у телят и соотношением S/tg2 α , отражающим баланс про- и антиоксидантной активности КВВ ( r τ -K = +0,58 при P < 0,01), а также активностью в крови каталазы ( r τ -K = - 0,68 при P < 0,01), ГПО ( r τ -K = - 0,36 при P < 0,05) и СОД ( r τ -K = - 0,62 при P < 0,01).
Быстрый переход плода от внутриутробной гипоксической среды к нормоксии и легочному типу дыхания при рождении сопровождается значительной нагрузкой на все функциональные системы организма (28-30). Начало легочного дыхания сопряжено с повышенной генерацией активных форм кислорода (АФК) и развитием оксидативного стресса (28, 31). Окси-дативный стресс, в свою очередь, связан с целым рядом патологических состояний у новорожденных животных — сердечно-сосудистыми и легочными дисфункциями, лактоацидозом, снижением абсорбции и пассивной передачи питательных веществ и иммуноглобулинов в кишечнике (15, 28, 31). Компенсация избыточной генерации АФК обеспечивается адаптивными изменениями системы антиоксидантной защиты (32-35), главным образом ее ферментативного звена (31, 32, 35).
Поскольку у плода крупного рогатого скота рост волос кисти хвоста начинается с 7-го мес беременности (36, 37), содержание химических элементов в пробах волоса, отобранных с этого участка тела (стержень волоса по всей его длине) в первые сутки после рождения, можно рассматривать как интегральный показатель обеспеченности телят минеральными веществами в последние 3 мес внутриутробного развития. Известно также, что в период, соответствующий 10-15 % срока перед завершением гестации активность антиоксидантных ферментов в тканях плода возрастает на 150-200 % (33, 38). Результаты наших исследований показали, что у телят с внутриутробной задержкой развития по сравнению с потомством коров с физиологическим течением беременности содержание в волосе меди снижено на 28,3 % (P < 0,001), цинка на 10,7 % (P < 0,001), марганца на 9,4 % (P < 0,001), селена на 26,4 % (P < 0,001), кобальта на 36,8 % (P < 0,001). Полученные данные свидетельствуют о том, что при ВЗРП созревание ферментативного звена системы антиоксидантной защиты плода происходит на фоне дефицита меди, цинка, марганца, селена и кобальта. У телят с ВЗРП активность каталазы в крови была снижена на 14,4 % (P < 0,001), ГПО на 14,0 % (Р < 0,001), СОД на 33,8 % (Р < 0,001) по сравнению с контролем. Тесная связь между дефицитом микроэлементов и функциональной недостаточностью ферментативного звена системы антиоксидантной защиты у новорожденных телят подтверждалась наличием корреляций между содержанием меди в волосе и активностью СОД в крови ( rS = +0,55 при P < 0,05), содержанием селена в волосе и активностью ГПО в крови ( rS = +0,84 при P < 0,01). D. Shukla и соавт. (39) доказали участие кобальта в антиоксидантной защите легких, поэтому его дефицит у телят с ВЗРП приобретает особое значение.
У телят с ВЗРП обнаружено также достоверное снижение в сыворотке крови концентрации витамина A, α-токоферола и общей антиокис-лительной активности плазмы крови (см. табл. 1). Развитие оксидативного стресса в легких, однако, оказалось в большей степени связано с недостаточностью ферментативного звена антиоксидантной защиты, что подтверждалось наличием статистически значимых зависимостей между соотношением S/tg2α в КВВ и активностью каталазы (rS = -0,54 при P < 0,01), ГПО (rS = -0,49 при P < 0,01) и СОД (rS = -0,85 при P < 0,01) в крови, а также результатами исследований других авторов (33, 40, 41).
У телят с ВЗРП мы наблюдали увеличение концентрации МДА в крови и КВВ (соответственно на 26,8 % при P < 0,001 и 119,5 % при P < 0,001 по сравнению с контрольной группой), свидетельствующее о возрастании системной и локальной (легкие) интенсивности пероксидного окисления липидов на фоне недостаточности ферментативного и неферментативного звеньев системы антиоксидантной защиты. Наши данные согласуются с результатами исследований Z. Hracsko и соавт. (42), показавших у новорожденных детей с ВЗРП достоверное (по сравнению с потомством матерей с физиологическим течением беременности) увеличение содержания МДА в крови на фоне пониженной активности каталазы, ГПО, СОД и концентрации восстановленного глутатиона.
Структурно-функциональное повреждение клеток респираторного тракта в условиях оксидативного стресса у телят с ВЗРП сопровождалось повышением экспирации ферментов разной субклеточной локализации (цитоплазматической АлАТ, мембраносвязанной ГГТ, митохондриальной АсАТ) и интенсивности респираторного влаговыделения. В предыдущих исследованиях (29) было показано, что увеличение интенсивности респираторного влаговыделения у новорожденных телят наблюдается при гипоксии и ацидозе и связано с нарушением метаболической и респираторной адаптации. Увеличение индекса Хильдебрандта у телят с ВЗРП (на 7,9 % по сравнению с контрольной группой, P < 0,05) свидетельствовало о расстройстве вегетативной регуляции и перенапряжении кардиореспиратор-ной функциональной системы (25). Мы обнаружили статистически значимые зависимости между вероятностью развития бронхопневмонии у телят и соотношением S/tg2 α , характеризующим баланс оксидантной и антиоксидантной активности КВВ ( r τ -K = +0,58 при P < 0,01), а также активностью в крови каталазы ( r τ -K = - 0,68 при P < 0,01), ГПО ( r τ -K = - 0,36 при P < 0,05) и СОД ( r τ -K = - 0,62 при P < 0,01). У телят с ВЗРП тяжелое течение бронхита с осложнением в виде бронхопневмонии в неонатальный период регистрировалось в 7,14 раза чаще (P < 0,001), чем у потомства коров с физиологическим течением беременности.
Таким образом, результаты наших исследований показали, что недостаточность ферментативного и неферментативного звеньев системы антиоксидантной защиты у новорожденных телят при внутриутробной задержке развития приводит к оксидативному стрессу, накоплению токсичных продуктов пероксидного окисления липидов в крови и бронхоальвеолярной жидкости, структурно-функциональному повреждению клеток респираторного тракта и существенно повышает вероятность развития бронхопневмонии в неонатальный период.
Список литературы Антиоксидантный статус и функциональное состояние дыхательной системы у новорожденных телят с внутриутробной задержкой развития
- Wu G., Bazer F.W., Wallace J.M., Spencer T.E. Board-invited review: Intrauterine growth retardation: implications for the animal sciences. J. Anim. Sci., 2006, 84: 2316-2337 ( ) DOI: 10.2527/jas.2006-156
- Нежданов А.Г., Михалёв В.И, Климов Н.Т., Смирнова Е.В. Внутриутробная задержка развития эмбриона и плода у коров. Ветеринария, 2014, 3: 36-39.
- Wang J., Feng C., Liu T., Shi M., Wu G., Bazer F.W. Physiological alterations associated with intrauterine growth restriction in fetal pigs: causes and insights for nutritional optimization. Molecular Reproduction & Development, 2017, 84(9): 897-904 ( ) DOI: 10.1002/mrd.22842
- Nezhdanov A., Shabunin S., Mikhalev V., Klimov N., Chernitskiy A. Endocrine and metabolic mechanisms of embryo and fetal intrauterine growth retardation in dairy cows. Turk. J. Vet. Anim. Sci., 2014, 38(6): 675-680 ( ) DOI: 10.3906/vet-1405-12
- Rossdale P.D., Ousey J.C. Fetal programming for athletic performance in the horse: Potential effects of IUGR. Equine Vet. Educ., 2003, 6: 24-37 ( ) DOI: 10.1111/j.2042-3292.2003.tb01811.x
- Gallo L.A., Tran M., Moritz K.M., Wlodek M.E. Developmental programming: variations in early growth and adult disease. Clin. Exp. Pharmacol. Physiol., 2013, 40(11): 795-802 ( ) DOI: 10.1111/14401681.12092
- Gonzales-Bulnes A., Astiz S., Parraguez V.H., Garcia-Contreras C., Vazquez-Gomez M. Empowering translation research in fetal growth restriction: sheep and swine animal models. Current Pharmaceutical Biotechnology, 2016, 17(10): 848-855 ( ) DOI: 10.2174/1389201017666160519111529
- Greenwood P.L., Hunt A.S., Hermanson J.W., Bell A.W. Effects of birth weight and postnatal nutrition on neonatal sheep: I. Body growth and composition, and some aspects of energetic efficiency. J. Anim. Sci., 1998, 76(9): 2354-2367 ( ) DOI: 10.2527/1998.7692354x
- Mellor D.J. Nutritional and placental determinants of foetal growth rate in sheep and consequences for the newborn lamb. Brit. Vet. J., 1983, 139(4): 307-324 ( ) DOI: 10.1016/S0007-1935(17)30436-0
- Sharma D., Shastri S., Sharma P. Intrauterine growth restriction: antenatal and postnatal aspects. Clinical Medicine Insights: Pediatrics, 2016, 10: 67-83 ( ) DOI: 10.4137/CMPed.S40070
- Thornbury J.C., Sibbons P.D., van Velzen D., Trickey R., Spitz L. Histological investigations into the relationship between low-birth-weight and spontaneous bowel damage in the neonatal piglet. Pediatric Pathology, 1993, 13(1): 59-69 ( ) DOI: 10.3109/15513819309048193
- Ginther O.J., Douglas R.H. The outcome of twin pregnancies in mares. Theriogenology, 1982, 18(2): 237-244 ( ) DOI: 10.1016/0093-691X(82)90108-X
- Lipsett J., Tamblyn M., Madigan K., Roberts P., Cool J.C., Runciman S.I., McMillen I.C., Robinson J., Owens J.A. Restricted fetal growth and lung development: a morphometric analysis of pulmonary structure. Pediatric Pulmonology, 2006, 41(12): 1138-1145 ( ) DOI: 10.1002/ppul.20480
- Rozance P.J., Seedorf G.J., Brown A., Roe G., O'Meara M.C., Gien J., Tang J.-R., Abm-an S.H. Intrauterine growth restriction decreases pulmonary alveolar and vessel growth and causes pulmonary artery endothelial cell dysfunction in vitro in fetal sheep. American Journal of Physiology-Lung Cellular and Molecular Physiology, 2011, 301(6): L860-L871 ( ) DOI: 10.1152/ajplung.00197.2011
- Che L., Xuan Y., Hu L., Liu Y., Xu Q., Fang Z., Lin Y., Xu S., Wu D., Zhang K., Chen D. Effect of postnatal nutrition restriction on the oxidative status of neonates with intrauterine growth restriction in a pig model. Neonatology, 2015, 107(2): 93-99 ( ) DOI: 10.1159/000368179
- Черницкий А.Е., Рецкий М.И., Золотарев А.И. Устройство для сбора конденсата выдыхаемого воздуха у животных. Пат. 134772 (РФ), МПК A61B 5/00. Государственное научное учреждение Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии Российской академии сельскохозяйственных наук (РФ). № 2013135753/14. Заявл. 30.07.2013. Опубл. 27.11.2013. Бюл. № 33 ( ) DOI: 10.13140/RG.2.1.4414.1283
- Рецкий М.И., Шабунин С.В., Близнецова Г.Н., Рогачева Т.Е., Ермолова Т.Г., Фоменко О.Ю., Братченко Э.В., Дубовцев В.Ю., Каверин Н.Н., Цебржинский О.И. Методические положения по изучению процессов свободнорадикального окисления и системы антиоксидантной защиты организма. Воронеж, 2010.
- Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы. Вопросы медицинской химии, 1999, 45(3): 263-272.
- Miller K.W., Yang C.S. An isocratic high-performance liquid chromatography method for the simultaneous analysis of plasma retinol, a-tocopherol and various carotenoids. Anal. Biochem., 1985, 145(1): 21-26 ( ) DOI: 10.1016/0003-2697(85)90321-5
- Okamura M. An improved method for determination of L-ascorbic acid and L-dehydroascorbic acid in blood plasma. Clinica Chimica Acta, 1980, 103(3): 259-268 ( ) DOI: 10.1016/0009-8981(80)90144-8
- Erel O. A novel automated method to measure total antioxidant response against potent free radical reactions. Clin. Biochem., 2004, 37(2): 112-119 ( ) DOI: 10.1016/j.clinbiochem.2003.10.014
- Voronkova Y.G., Popova T.N., Agarkov A.A., Skulachev M.V. Influence of 10-(6'-plastoquino-nyl)decyltriphenylphosphonium (SKQ1) on oxidative status in rats with protamine sulfate-induced hyperglycemia. Biochemistry Moscow, 2015, 80(12): 1606-1613 ( ) DOI: 10.1134/S0006297915120093
- Андронов С.В., Лобанов А.А. Изменение показателей железоиндуцированной хемилюминесценции у жителей Крайнего Севера в зависимости от климатогеографических условий. Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова, 2012, 4(1): 73-77.
- McGuirk S.M. Disease management of dairy calves and heifers. Veterinary Clinics of North America: Food Animal Practice, 2008, 24: 139-153 ( ) DOI: 10.1016/j.cvfa.2007.10.003
- Фудин Н.А., Судаков К.В., Хадарцев А.А., Классина С.Я., Чернышов С.В. Индекс Хильдебрандта как интегральный показатель физиологических затрат у спортсменов в процессе возрастающей этапно-дозированной физической нагрузки. Вестник новых медицинских технологий, 2011, 18(3): 244-248.
- Черницкий А., Рецкий М. Конденсат выдыхаемого воздуха. Использование в диагностике и прогнозировании респираторных болезней телят. LAP LAMBERT Academic Publishing GmbH & Co. KG, Saarbrücken, 2010.
- Черницкий А.Е., Ефанова Л.И., Золотарев А.И., Шахов А.Г., Шабунин С.В., Рецкий М.И. Методическое пособие по прогнозированию и ранней диагностике респираторных болезней у телят. Воронеж, 2013 ( ) DOI: 10.13140/RG.2.2.11326.28481
- Рецкий М.И., Близнецова Г.Н., Шабунин С.В. Метаболические адаптации телят в ранний постнатальный период. Воронеж, 2010.
- Черницкий А.Е., Рецкий М.И., Золотарев А.И. Функциональное становление дыхательной системы у новорожденных телят с разной жизнеспособностью. Сельскохозяйственная биология, 2013, 4: 99-104 ( ) DOI: 10.15389/agrobiology.2013.4.99rus
- Sharma A., Ford S., Calvert J. Adaptation for life: a review of neonatal physiology. Anaesthesia & Intensive Care Medicine, 2011, 12(3): 85-90 ( ) DOI: 10.1016/j.mpaic.2010.11.003
- Mutinati M., Pantaleo M., Roncetti M., Piccinno M., Rizzo A., Sciorsci R.L. Oxidative stress in neonatology. A review. Reprod. Dom. Anim., 2014, 49(1): 7-16 ( ) DOI: 10.1111/rda.12230
- Рецкий М.И. Система антиоксидантной защиты у животных при стрессе и его фармакологической регуляции. Докт. дис. Воронеж, 1997.
- Frank L., Sosenko I.R. Prenatal development of lung antioxidant enzymes in four species. The Journal of Pediatrics, 1987, 110(1): 106-110 ( ) DOI: 10.1016/S0022-3476(87)80300-1
- Harman A.W., McKenna M., Adamson G.M. Postnatal development of enzyme activities associated with protection against oxidative stress in the mouse. Biol. Neonate, 1990, 57(3-4): 187-193 ( ) DOI: 10.1159/000243190
- Surai P.F., Speake B.K., Noble R.C., Sparks N.H. Tissue-specific antioxidant profiles and susceptibility to lipid peroxidation of the newly hatched chick. Biol. Trace Elem. Res., 1999, 68(1): 63-78 ( ) DOI: 10.1007/BF02784397
- Енукашвили А.И. Минеральный состав волосяного покрова крупного рогатого скота в связи с возрастом, полом, сезоном года и физиологическим состоянием. Канд. дис. СПб, 1992.
- Алёхин Ю.Н., Пригородова О.В. Влияние нарушений кормления коров на внутриутробное развитие плода. Науковий вiсник ветеринарної медицини, 2014, 13(108): 21-24.
- Rickett G.M., Kelly F.J. Developmental expression of antioxidant enzymes in guinea pig lung and liver. Development, 1990, 108(2): 331-336.
- Shukla D., Saxena S., Jayamurthy P., Sairam M., Singh M., Jain S.K., Bansal A., Ilavazaghan G. Hypoxic preconditioning with cobalt attenuates hypobaric hypoxia-induced oxidative damage in rat lungs. High Altitude Medicine & Biology, 2009, 10(1): 57-69 ( ) DOI: 10.1089/ham.2008.1028
- Prohaska J.R. Changes in Cu,Zn-superoxide dismutase, cytochrome c oxidase, glutathione peroxidase and glutathione transferase activities in copper-deficient mice and rats. The Journal of Nutrition, 1991, 121(3): 355-363 ( ) DOI: 10.1093/jn/121.3.355
- McElroy M.C., Postle A.D., Kelly F.J. Catalase, superoxide dismutase and glutathione peroxidase activities of lung and liver during human development. Biochim. Biophys. Acta, 1992, 1117(2): 153-158 ( ) DOI: 10.1016/0304-4165(92)90073-4
- Hracsko Z., Orvos H., Novak Z., Pal A., Varga I.S. Evaluation of oxidative stress markers in neonates with intra-uterine growth retardation. Redox Report, 2008, 13(1): 11-16 ( ) DOI: 10.1179/135100008X259097


