Антипсихотик-индуцированная гиперпролактинемия: фармакогенетические аспекты
Автор: Иванова Светлана Александровна, Османова Диана Закировна, Бойко Анастасия Сергеевна, Пожидаев Иван Вячеславович, Федоренко Ольга Юрьевна, Вялова Наталья Михайловна, Полтавская Евгения Григорьевна, Тигунцев Владимир Владимирович, Фрейдин Максим Борисович, Корнетова Елена Георгиевна, Семке Аркадий Валентинович
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 2 (99), 2018 года.
Бесплатный доступ
Лекарственно-индуцированная гиперпролактинемия при приеме антипсихотических средств изучена недостаточно. Целью работы является изучение полиморфных вариантов фармакодинамических и фармакокинетических генов при антипсихотик-индуцированной гиперпролактинемии у больных шизофренией. Было проведено комплексное клиническое и молекулярно-генетическое исследование 446 больных шизофренией, получающих антипсихотическую терапию. Генотипирование проводилось по полиморфным вариантам генов HTR2C, HTR3A, HTR3B, HTR6, HTR2A, HTR1A, HTR1B, DRD1, DRD2, DRD2/ANKK1, DRD3, DRD4, CYP1A2*1F, CYP2D6*3, CYP2D6*4, CYP2D6*6, CYP2C19*3, CYP2C19*17, CYP2C19*2, GSTP1. Выявлены ассоциации полиморфизмов генов серотониновых рецепторов HTR2A (rs6312) и HTR2C (rs12858300, rs569959) с развитием гиперпролактинемии. На основе результатов генотипирования и анализа клинических данных разработана фармакогенетическая панель, которую можно использовать в качестве биологических предикторов развития антипсихотик-индуцированной гиперпролактинемии при шизофрении. Полученные результаты исследований показывают, что полиморфные особенности генов нейромедиаторных рецепторов и системы цитохромов являются важным звеном патогенеза побочных эффектов, наблюдаемых на фоне антипсихотической терапии, у больных шизофренией. Перспективным направлением дальнейших исследований представляется изучение генов, гипотетически задействованных в механизмах возникновения гиперпролактинемии: транспортеров лекарственных средств, генов антиоксидантных ферментов и генов нейротрофических факторов.
Шизофрения, антипсихотик-индуцированная гиперпролактинемия, рецепторы, полиморфизмы генов, фармакогенетика
Короткий адрес: https://sciup.org/142212931
IDR: 142212931 | УДК: 616.895.8:615.03:577.175.328 | DOI: 10.26617/1810-3111-2018-2(99)-21-27
Текст научной статьи Антипсихотик-индуцированная гиперпролактинемия: фармакогенетические аспекты
Основным методом лечения шизофрении является антипсихотическая терапия, которая улучшает долгосрочный прогноз заболевания и способствует переходу в состояние ремиссии [1]. Кроме основного клинического действия антипсихотики обладают широким спектром побочных эффектов, осложняющих течение основного заболевания, усиливая выраженность негативных и когнитивных расстройств, приводя к дополнительной социальной стигматизации больных, ухудшая качество жизни и являясь причиной отказа пациентов от терапии [2, 3, 4, 5].
Одним из распространенных нежелательных явлений антипсихотической терапии является гиперпролактинемия (ГП) [6, 7]. Повышение уровня пролактина, секреция которого, как известно, должна постоянно находиться под ингибирующим контролем дофамина, закономерно возникающее при назначении антипсихотических (антидофаминовых) лекарственных средств, является нежелательным последствием [8, 9]. Преходящие побочные клинические эффекты сводятся к возникновению лактации, нарушениям менструального цикла у женщин, кожным проявлениям, психопатологическим состояниям ан-гедонии. Риском возникновения отдаленных побочных эффектов является возможный остеопороз и значимый рост вероятности онкологической патологии [9].
Особая роль в патогенезе развития антипсихо-тик-индуцированной гиперпролактинемии принадлежит генетическим факторам, которые могут быть основой чувствительности развития осложнений у многих пациентов [1, 4, 10, 11, 12, 13].
По результатам фармакогенетических исследований наибольшее клиническое значение имеет полиморфизм генов, контролирующих синтез и работу ферментов биотрансформации лекарственных средств [14, 15, 16, 17]. Экспрессия различных аллельных вариантов генов, кодирующих изоферменты системы цитохромов Р450, приводит к синтезу форм с измененной активностью, что может быть причиной как замедления, так и ускорения метабо- лизма лекарственных соединений [15].
Идентификация у больных соответствующего аллельного варианта, приводящего к изменениям фармакокинетики лекарственного препарата, позволяет прогнозировать фармакологический ответ на данный препарат и корректировать схему лечения, значительно повышая его эффективность и безопасность.
Генами-мишенями действия психотропных препаратов являются гены нейротрансмиттерных рецепторов. Так, например, развитие тех или иных клинических эффектов блокады D 2 -рецепторов зависит от воздействия на различные дофаминергические пути в центральной нервной системе (ЦНС). Угнетение дофаминергической нейротрансмиссии в мезолимбической системе ответственно за развитие собственно антипсихотического эффекта, в нигростриальной области – за экстрапирамидные побочные эффекты, в туберо-инфундибулярном тракте – за гиперпролактинемию [18].
Внедрение фармакогенетических тестов в клиническую практику позволит индивидуализирован-но подойти к выбору лекарственных средств и режима их дозирования, а в некоторых случаях и к тактике ведения пациентов. Подобные подходы лежат в основе персонализированной медицины [19]. Учитывая вышесказанное, проблема диагностики и коррекции нежелательных эффектов является крайне актуальной как на этапе купирования продуктивной симптоматики, так и в процессе длительного применения психотропных препаратов. Разработка методов, позволяющих индивидуализировать психофармакотерапию, является одной из важнейших задач фундаментальной медицины на современном этапе [20, 21, 22].
Цель исследования – изучение ассоциаций полиморфных вариантов генов нейромедиаторных рецепторов и системы цитохромов с развитием лекарственно-индуцированной гиперпролактинемии.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 446 больных шизофренией (224 женщины и 222 мужчины), проходивших курс лечения в клиниках НИИ психического здоровья. Диагностическая оценка и клиническая верификация проводилась врачами-психиатрами, пациентам установлен диагноз шизофрения (F20) согласно МКБ-10. Средний возраст пациентов составил 41,5±13,4 года (возрастной диапазон – от 18 до 65 лет). Средний возраст мужчин составил 37,8±11,9 года, женщин – 45,2±13,9 года. Длительность заболевания в общей группе больных шизофренией была 15,4±1,5 года, в группе мужчин – 13,1±10,0 года, в группе женщин – 17,6±12,5 года.
Клиническая симптоматика оценивалась по шкале позитивных и негативных синдромов (Positive and Negative Syndrome Scale – PANSS), шкале общего клинического впечатления (Clinical Global Impression – CGI), шкале оценки побочного действия (Udvalg for Kliniske Undersogelser Scale – UKU).
На всех пациентов заполнялся модифицированный вариант карты стандартизированного описания больного шизофренией.
Для оценки побочного эффекта гиперпролактинемии у больных шизофренией на фоне нейролептической терапии проведено определение концентрации пролактина в сыворотке крови, взятой утром натощак, методом твердофазного иммунофермент-ного анализа с использованием набора реагентов PRL TestSystem (Monobind Inc., США). Гиперпролактинемия диагностируется при концентрации пролактина в сыворотке крови выше 20 нг/мл у мужчин и выше 25 нг/мл у женщин [23].
ДНК выделяли из периферической крови стандартным фенол-хлороформным методом. Проведено генотипирование 57 полиморфизмов генов группы «фармакодинамических полиморфизмов» (нейромедиаторных рецепторов серотонина ( HTR2C, HTR3A, HTR3B, HTR6, HTR2A, HTR1A, HTR1B ) и дофамина ( DRD1, DRD2, DRD2/ANKK1, DRD3, DRD4 ) и 9 полиморфных вариантов генов ферментов биотрансформации, участвующих в метаболизме лекарственных средств – гены систем детоксикации ксенобиотиков первой системы цитохромов Р450 ( CYP1A2*1F, CYP2D6*3, CYP2D6*4, CYP2D6*6, CYP2C19*3, CYP2C19*17, CYP2C19*2) и второй системы глутатион-S-трансферазы (GSTP1 ) фаз реакций с использованием генетических анализаторов StepOnePlus (Applied Biosystems, США) и The Mass ARRAY® System (Agena Bioscience, США).
Статистическая обработка результатов проводилась при помощи программы SPSS 20.0 и программы R, используя пакет SNPassoc [24]. Распределение частот генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди– Вайнберга с помощью критерия χ2. Сравнение частот генотипов и аллелей в исследуемых группах проводили по критерию χ2. Различия считались статистически значимыми при р<0,05. Об ассоциации разных генотипов с развитием заболевания судили по величине отношения шансов («odds ratio» – OR). Выборки проверялись на нормальность распределения по критерию Шапиро–Уилка. Значимость различий определяли по t-критерию Стьюдента при нормальном распределении для независимых выборок с вычислением среднего и стандартного отклонения (M±SD). Для независимых выборок при распределении, отличающемся от нормального, достоверность различий определяли по U-критерию Манна-Уитни с вычислением медианы и квартилей (Me (Q1 – Q3). Проведен анализ с помощью построения моделей логистической регрессии, включающих побочный эффект терапии (гиперпролактинемию), в качестве зависимой переменной и полиморфизмов в качестве предикторов. В модели также включили возраст, пол, длительность заболевания, курение, статус ведущей симптоматики и среднюю дозу получаемых антипсихотических препаратов, выраженную в хлорпромазиновом эквиваленте (CPZeq), в качестве ковариат. Проанализированы три генотипические модели: лог-аддитивная, рецессивная и доминантная. Для коррекции p-значений на множественные сравнения исполь- зовали поправку Бонферрони. терапию. Демографическая и клиническая характе-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ ристика обследованных пациентов представлена
Гиперпролактинемия была диагностирована в таблицах 1 и 2.
у 227 пациентов, получающих антипсихотическую
Таблица 1
Демографические и клинические признаки исследованных больных шизофренией с гиперпролактинемией и без побочных эффектов
|
Признак |
Больные с ГП (n=227) |
Больные без ГП (n=219) |
p-value |
|
Возраст (М±SD), лет |
49,19±13,19 |
42,94±13,56 |
0,031 |
|
Мужчины/Женщины |
98/129 |
123/96 |
0,006 |
|
Доза антипсихотика, CPZeq |
400 (225;750) |
400 (280;750) |
0,074 |
|
Длительность заболевания, лет |
11,0 (4,0; 22,0) |
14,0 (8,0; 22,0) |
0,041 |
П р и м е ч а н и е. ГП – гиперпролактинемия; CPZeq – хлорпромазиновый эквивалент. p – уровень статистической значимости различий при сравнении показателей.
Таблица 2
Характеристика исследованных больных шизофренией
|
Показатель |
Суммарная выборка |
Мужчины |
Женщины |
p-value* |
|
Количество |
446 |
221 |
225 |
– |
|
Возраст (М±±SD), лет |
42,1±12,4 |
37,8±11,9 |
45,2±13,9 |
2,6e-8 |
|
Гиперпролактинемия, +/– |
227/219 |
98/123 |
129/96 |
0,008 |
|
Длительность заболевания, Me (Q1 – Q3), лет |
13 (6; 22) |
11 (5; 18) |
15 (7; 26) |
<0,0001 |
|
Курение, +/–/? |
259/179/8 |
173/46/2 |
86/133/6 |
2,2e-16 |
|
CPZeq, Me (Q1 – Q3) |
425 (240; 750) |
500 (300; 750) |
372 (200; 750) |
0,003 |
П р и м е ч а н и е, * – тест Манна-Уитни для количественных признаков и χ2 – для качественных признаков с целью сравнения показателей у мужчин и женщин; CPZeq – хлорпромазиновый эквивалент.
Анализ генов DRD1, DRD2, DRD2/ANKK1, DRD3, DRD4 в группе больных шизофренией показал, что наблюдаемое распределение генотипов для всех изученных генов соответствовало ожидаемому при равновесии Харди–Вайнберга. При проведении сравнения частот генотипов генов DRD1, DRD2, DRD2/ANKK1, DRD3, DRD4 между группами пациентов с гиперпролактинемией и без неё статистически значимых различий выявлено не было.
Статистически значимые результаты были получены для полиморфного варианта rs6312 (χ2=4,685; р=0,030) гена HTR2A в группе женщин с шизофренией. В связи с тем, что ген серотонинового рецептора HTR2C расположен на Х-хромосоме, статисти- ческий анализ полиморфизмов этого гена выполнен отдельно для мужчин и женщин.
Обнаружена ассоциация полиморфного варианта rs12858300 (χ2=9,429; р=0,002) с гиперпролактинемией у женщин. Для варианта rs569959 гена HTR2C у мужчин получены статистически значимые результаты (χ2=6,284; р=0,043) (рис. 1).
Нами не было выявлено статистически значимых результатов, которые бы позволили предположить участие полиморфных вариантов генов HTR3A, HTR3B и HTR6 в развитии гиперпролактинемии у больных шизофренией.
Log-additive
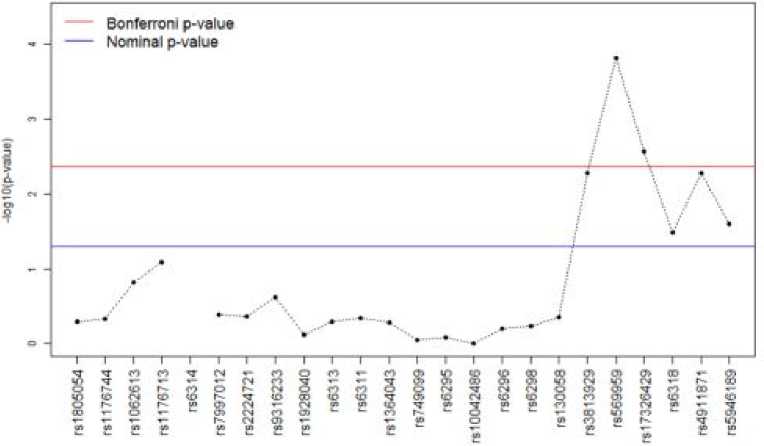
Рисунок 1. P- значения (-log10) для лог-аддитивных моделей ассоциаций полиморфизмов генов серотониновых рецепторов и гиперпролактинемии у больных шизофренией
Проведен анализ ассоциаций гиперпролактинемии с гаплотипами X-хромосомы с учетом ковариат в общей выборке, а также у мужчин и женщин по отдельности. Наиболее выраженная ассоциация с ГП установлена для гаплотипа TGAGGT. Также можно отметить тенденцию к ассоциации с гаплотипом CGGCAC. В обоих случаях в гаплотипе присутствует аллель G полиморфизма rs569959, для которого показана ассоциация с ГП при анализе отдельных полиморфизмов. При этом наиболее статистически значимая ассоциация показана для сочетания rs569959*G и rs17326429*A, для которого установлена ассоциация с гиперпролактинемией, очень близкая к статистически значимой. Таким образом, полученные данные свидетельствуют об ассоциации гиперпролактинемии с гаплотипами X-хромосомы, характеризующимися полиморфизмами rs569959 и rs17326429.
Ассоциации полиморфных вариантов генов системы цитохромов Р450 – CYP1A2 (rs2069521, rs762551), CYP2D6*3 (rs35742686) и полиморфного варианта Val105 (rs1695) гена GSTP1 с развитием ГП у больных шизофренией не выявлены. При сравнении групп больных с гиперпролактинемией и без неё выявлена ассоциация полиморфизма гена CYP2D6 (rs3892097) с развитием ГП у больных шизофренией на фоне антипсихотической терапии (χ2=2,1, р<0,005). Можно сделать вывод о протек-тивной значимости генотипа TT полиморфизма rs3892097 в отношении развития ГП у больных шизофренией на фоне антипсихотической терапии (OR=0,75; 95% CI: 0,634-0,887; р=0,0008).
На основе полученных результатов была разработана молекулярно-генетическая панель для предсказания риска развития гиперпролактинемии у пациентов с шизофренией. На первом этапе был проведен регрессионный анализ с гиперпролактинемией в качестве зависимой дихотомической переменной и полиморфизмами в качестве факторов. После расчета регрессионной модели выбирали предикторы с p-value не более 0,01; 0,05; 0,1; 0,15; 0,20; 0,25; 0,30; 0,35; 0,40 и 0,50 и проводили смешанный дискриминантный анализ с последующей кроссвалидацией для выбранных предикторов. Наилучший набор предикторов устанавливали на основании результатов переклассификации пациентов. Для итоговой модели рассчитывали показатели чувствительности, специфичности, положительное и отрицательное предсказательные значения. Кроме анализа моделей, включающих только генетические данные, был проведен анализ моделей, включающих, наряду с полиморфизмами, другие признаки: пол, возраст, длительность заболевания, CPZeq.
В разработанную фармакогенетическую панель, которую можно использовать в качестве биологических предикторов развития антипсихотик-индуцированной гиперпролактинемии при шизофрении, вошли полиморфные варианты rs1176744
( HTR3B ), rs10042486 ( HTR1A ), rs936461 ( DRD4 ), rs134655 ( DRD2 ), rs179997 ( ATXN1 ), rs1076562 ( DRD2 ), rs3773678 ( DRD3 ), rs167771 ( DRD3 ), rs1587756 ( DRD3 ), rs3892097 ( CYP2D6*4 ), а также женский пол и молодой возраст.
ЗАКЛЮЧЕНИЕ
Методология проведенных исследований основана на классических подходах к проведению фар-макогенетических работ, которые связаны с изучением групп генов, отвечающих за фармакокинетику (в основном это гены системы цитохромов, участвующих в метаболизме лекарственных средств) и фармакодинамику (в основном это гены мишени действия фармакологических средств; в случае антипсихотических препаратов это гены дофаминовых и серотониновых рецепторов). Перспективными направлениями дальнейших исследований представляются новые подходы к фармакогенетическим исследованиям антипсихотик-индуцированной гиперпролактинемии у больных шизофренией на основе изучения генов, гипотетически задействованных в механизмах ее возникновения.
Согласно современным зарубежным трендам выполнения фармакогенетических проектов, перспективными являются исследования генов, которые кодируют транспортеры лекарственных средств, принимающих участие в процессах всасывания, распределения и выведения препаратов из организма. К ним относится ген множественной лекарственной устойчивости MDR1 , кодирующий белок Р-гликопротеин (Pgp). Pgp является белком-переносчиком лекарственных средств с высокой специфичностью, который соединяется с лекарственным веществом и проникает вместе с ним через плазматическую мембрану внутрь клетки. Показано, что от его активности зависит концентрация лекарственного препарата в мозге, так как проникновение через гематоэнцефалический барьер определяется этим белком.
В качестве генов мишеней для психотропных средств, кроме генов нейромедиаторных рецепторов, рассматриваются гены, кодирующие ферменты синтеза и метаболизма нейромедиаторов дофамина и серотонина ( СОМТ, МАО-А, МАО-В, ТPН1, ТPН2 ).
Активация окислительного стресса и нарушение активности антиоксидантных ферментов рассматривается как неспецифический компонент патогенеза психических расстройств и побочных эффектов фармакотерапии, что предполагает наличие возможных ассоциаций генов, кодирующих антиоксидантные ферменты. Полиморфизмы генов нейро-протективных систем и киназ, участвующих в регуляции нейрональных процессов, выдвинуты на роль фармакогенетических маркеров побочных эффектов при шизофрении.
Дальнейшее выявление полиморфных вариантов генов, обладающих предиспонирующим или про-тективным эффектами, и валидизация молекулярногенетических панелей риска развития лекарственно-индуцированной гиперпролактинемии при шизо- френии перспективны для разработки персонализированной терапии.
Список литературы Антипсихотик-индуцированная гиперпролактинемия: фармакогенетические аспекты
- Tandon R., Belmaker R.H., Gattaz W.F., Lopez-Ibor JJ.Jr., Okasha A., Singh B., Stein D.J., Olie J.P., Fleischhacker W.W., Moeller H.J. World Psychiatric Association Pharmacopsychiatry Section statement on comparative effectiveness of antipsychotics in the treatment of schizophrenia; Section of Pharmacopsychiatry, World Psychiatric Association. Schizophrenia Research. 2008. 100 (1-3): 20-38 DOI: 10.1016/j.schres.2007.11.033
- Мосолов С.Н., Рывкин П.В., Сердитов О.В., Ладыженский М.Я., Потапов А.В. Метаболические побочные эффекты современной антипсихотической фармакотерапии. Социальная и клиническая психиатрия.2008. 18 (3): 75-90.
- Müller D.J., Chowdhury N.I., Zai C.C. The pharmacogenetics of antipsychotic-induced adverse events. Current Opinion in Psychiatry. 2013. 26 (2): 144-150 DOI: 10.1097/YCO.0b013e32835dc9da
- Reynolds G.P., McGowan O.O., Dalton C.F. Pharmacogenomics in psychiatry: the relevance of receptor and transporter polymorphisms. British Journal of Clinical Pharmacology. 2014. 77 (4): 654-672 DOI: 10.1111/bcp.12312
- Moore T.J., Furberg C.D. The Harms of Antipsychotic Drugs: Evidence from Key Studies. Drug Safety. 2017. 40 (1): 3-14 DOI: 10.1007/s40264-016-0475-0
- Горобец Л.Н. Нейроэндокринные дисфункции у больных шизофренией и шизоаффективным расстройством в условиях современной антипсихотической терапии (клинико-биохимическое исследование): автореф. дис.. д.м.н. М., 2007: 50.
- Корнетова Е.Г., Иванова С.А., Семке А.В., Бородюк Ю.Н., Бойко А.С. Гиперпролактинемия как побочный эффект антипсихотической терапии больных шизофренией: пособие для врачей. Томск, 2015: 28.
- Tsuboi T., Bies R.R., Suzuki T., Mamo D.C., Pollock B.G., Graff-Guerrero A., Mimura M., Uchida H. Hyperprolactinemia and estimated dopamine D2 receptor occupancy in patients with schizophrenia: analysis of the CATIE data. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 2013. 45: 178182 DOI: 10.1016/j.pnpbp.2013.05.010
- De Hert M., Detraux J., Peuskens J. Second-generation and newly approved antipsychotics, serum prolactin levels and sexual dysfunctions: a critical literature review. Expert Opinion on Drug Safety. 2014. 13(5): 605-624 DOI: 10.1517/14740338.2014.906579
- Ivanova S.A., Osmanova D.Z., Boiko A.S., Pozhidaev I.V., Freidin M.B., Fedorenko O.Y., Semke A.V., Bokhan N.A., Kornetova E.G., Rakhmazova L.D., Wilffert B., Loonen A.J. Prolactin gene polymorphism (-1149 G/T) is associated with hyperprolactinemia in patients with schizophrenia treated with antipsychotics. Schizophrenia Research. 2017. 182: 110-114 DOI: 10.1016/j.schres.2016.10.029
- Ivanova S.A., Osmanova D.Z., Freidin M.B., Fedorenko O.Y., Boiko A.S., Pozhidaev I.V., Semke A.V., Bokhan N.A., Agarkov A.A., Wilffert B., Loonen A.J. Identification of 5-hydroxytryptamine receptor gene polymorphisms modulating hyperprolactinaemia in antipsychotic drug-treated patients with schizophrenia. The World Journal of Biological Psychiatry. 2017. 18(3): 239-246 DOI: 10.1080/15622975.2016.1224926
- Alladi C.G., Mohan A., Shewade D.G., Rajkumar R.P., Adithan S., Subramanian K. Risperidone-Induced Adverse Drug Reactions and Role of DRD2 (-141 C Ins/Del) and 5HTR2C (-759 C/T) Genetic Polymorphisms in Patients with Schizophrenia. Journal of Pharmacology & Pharmacotherapeutics. 2017. 8 (1): 28-32 DOI: 10.4103/jpp.JPP_197_16
- Fedorenko O.Y., Loonen A.J., Vyalova N.M., Boiko A.S., Pozhidaev I.V., Osmanova D.Z., Bokhan N.A, Ivanov M.V., Freidin M.B., Ivanova S.A Hyperprolactinemia and CYP2D6, DRD2, HTR2C genes polymorphism in patients with schizophrenia. Physiology and Pharmacology. 2017. 21 (1): 25-33.
- Сычев Д.А., Раменская Г.В., Игнатьев И.В., Кукес В.Г. Клиническая фармакогенетика/под ред. В.Г. Кукеса, В.П. Бочкова. М., 2007: 248.
- Arranz M.J., Rivera M., Munro J.C. Pharmacogenetics of response to antipsychotics in patients with schizophrenia. CNS Drugs. 2011. 25 (11): 933-969 DOI: 10.2165/11595380-000000000-00000
- Ivanova S.A., Filipenko M.L., Vyalova N.M., Voronina E.N., Poz-hidaev I.V., Osmanova D.Z., Ivanov M.V., Fedorenko O.Y., Semke A.V., Bokhan N.A. CYP1A2 and CYP2D6 Gene Polymorphisms in Schizophrenic Patients with Neuroleptic Drug-Induced Side Effects. Bulletin of Experimental Biology and Medicine. 2016. 160(5): 687690 DOI: 10.1007/s10517-016-3250-4
- Gong L., Zhang C.M., Lv J.F., Zhou H.H., Fan L. Polymorphisms in cytochrome P450 oxidoreductase and its effect on drug metabolism and efficacy. Pharmacogenetics and Genomics. 2017. 27(9): 337346 DOI: 10.1097/FPC.0000000000000297
- Loonen A.J., Ivanova S.A. New insights into the mechanism of drug-induced dyskinesia. CNS Spectrums. 2013. 18 (1): 15-20.
- Kirchheiner J., Fuhr U., Brockmöller J. Pharmacogenetics-based therapeutic recommendations-ready for clinical practice? Nature Reviews. Drug Discovery. 2005; 4 (8): 639-647 DOI: 10.1038/nrd1801
- Иванова С.А., Федоренко О.Ю., Смирнова Л.П., Семке А.В. Поиск биомаркеров и разработка фармакогенетических подходов к персонализированной терапии больных шизофренией. Сибирский вестник психиатрии и наркологии. 2013. 1: 12-16.
- Иванова С.А., Федоренко О.Ю., Бохан Н.А., Лунен А. Фармакогенетика тардивной дискинезии. Томск, 2015: 120.
- Иващенко Д.В., Кибитов А.О., Сычёв Д.А. Фармакогенетика антипсихотиков на практике: обзор современной доказательной базы и перспектив персонализации фармакотерапии шизофрении. Психическое здоровье. 2017. 15 (2): 91-95.
- Peuskens J., Pani L., Detraux J., De Hert M. The effects of novel and newly approved antipsychotics on serum prolactin levels: a comprehensive review. CNS Drugs. 2014. 28 (5): 421-453 DOI: 10.1007/s40263-014-0157-3
- Gonzalez J.R., Armengol L., Sole X., Guino E., Mercader J.M., Estivill X., Moreno V. SNP assoc: an R package to perform whole genome association studies. Bioinformatics. 2007. 23 (5): 654-655 DOI: 10.1093/bioinformatics/btm025


