Антистафилококковая активность титановых 3D-имплантатов с магнийсодержащим многокомпонентным покрытием
Автор: Гордина Е.М., Божкова С.А., Лабутин Д.В., Богма М.В., Ерузин А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Клинический случай
Статья в выпуске: 4 т.31, 2025 года.
Бесплатный доступ
Введение. Благодаря своим превосходным характеристикам титан на протяжении десятилетий успешно используют в качестве искусственных имплантатов в ортопедической хирургии. Однако любое хирургическое вмешательство, связанное с установкой имплантата, имеет риск развития имплантатассоциированной инфекции (ИАИ), возбудителями которой более чем в половине случаев являются стафилококки. Цель исследования — оценка антибактериальной, антибиопленочной активности и цитосовместимости многокомпонентного покрытия с оксидами магния и серебра на поверхности 3D-образцов титана. Материалы и методы. Комплекс MgO-AgO-MgO наносили на 3D-образцы медицинского титана. Элементный анализ проведен с помощью сканирующего электронного микроскопа ТМ 4000 Plus. Для выявления антибактериальной активности в отношении S. aureus образцы сутки инкубировали совместно с бактериями. Биопленки S. aureus формировали путем погружения тестируемых образцов в питательную среду с бактериями. После суточной инкубации образцы промывали, помещали в УЗ-мойку, а затем выполняли посев соникационной жидкости методом секторных посевов. Цитосовместимость покрытия оценивали на культуре эукариотических клеток линии Vero. Результаты. Элементный анализ и картирование подтвердили равномерное распределение оксидов на поверхности 3D-образцов титана. Разработанное покрытие характеризовалось антибактериальной активностью против S. aureus в течение трех суток. Установлено, что комплекс MgO-AgO-MgO обеспечивал эффективное препятствие адгезии S. aureus и формированию микробной пленки, в то время как на контрольных образцах регистрировали образование биопленки стафилококками. Однако анализ цитосовместимости полученных 3D-образцов показал отсутствие жизнеспособных клеток после 72 ч инкубации в среде с экстрактом из образцов титана с покрытием. Обсуждение. Разработанный комплекс MgO-AgO-MgO несмотря на снижение антибактериальных свойств на четвертые сутки значимо предупреждал микробную адгезию на поверхность образов, что обеспечивало защиту имплантата от образования микробной биопленки. Выявленная цитотоксичность комплекса, по-видимому, обусловлена значительной активацией реакций перекисного окисления липидов, которая и вызвала подавление жизнеспособности эукариотических клеток. Заключение. Покрытие MgO-AgO-MgO предупреждает возможность первичного взаимодействия возбудителя и абиотической поверхности, что является одним из основных факторов в профилактике развития ИАИ и её рецидивов после ревизионных операций с заменой имплантата. Однако высокий уровень цитотоксичности требует дальнейшей модификации техники нанесения покрытия и его состава.
Имплантат-ассоциированная инфекция, антибактериальное покрытие, магний, оксиды, серебро, S. aureus
Короткий адрес: https://sciup.org/142245425
IDR: 142245425 | УДК: 616.728.2/.3-089.843-77-022.1:615.281.9 | DOI: 10.18019/1028-4427-2025-31-4-487-494
Текст научной статьи Антистафилококковая активность титановых 3D-имплантатов с магнийсодержащим многокомпонентным покрытием
Инфекции, возникающие после установки имплантата, могут вызывать серьезные проблемы, связанные с длительным назначением антибактериальных препаратов, отторжением имплантата и риском развития серьезных осложнений [1, 2]. Заболеваемость перипротезной инфекцией (ППИ) после первичного хирургического вмешательства при тотальном эндопротезировании тазобедренного и коленного суставов составляет от 0,2 % до 2 % [1]. Увеличение продолжительности жизни приводит к росту количества эндопротезирований во всем мире, и по оценкам специалистов количество случаев ППИ значительно возрастет в ближайшие десятилетия [3]. S. Kurtz et al. подсчитали, что к 2030 г. эндопротезирований тазобедренного сустава будут выполнять на 613 % больше, чем в 2015 г., а коленного сустава — больше на 174% [4]. Имплантат-ассоциированные инфекции (ИАИ), особенно вызванные устойчивыми к антибактериальным препаратам бактериями, существенно влияют на экономические затраты системы здравоохранения [5].
Как правило, для профилактики развития послеоперационных инфекционных осложнений назначают системные антибактериальные препараты широкого спектра [6, 7]. Однако антибиотику сложно достичь достаточно высокой концентрации в инфекционном очаге костной ткани. Кроме того, системное введение антибиотиков повышает вероятность нежелательных побочных реакций и риск развития устойчивости бактерий к антибиотикам.
Новые технологии, такие как 3D-печать, открыли потенциальные возможности в проектировании медицинских имплантатов, поскольку позволяют изготовить имплантат в соответствии с анатомией конкретного пациента [8–11]. Наиболее часто используемые биосовместимые материалы для производства медицинских 3D-имплантатов — это титан и титановые сплавы [12, 13]. Для ортопедических имплантатов титан и его сплавы считаются превосходящими кобальт–хром и нержавеющую сталь из-за их более низкого модуля упругости и лучшей биосовместимости [14].
Металлические поверхности, как правило, не обладают достаточными антибактериальными свойствами, поэтому значительное количество исследований в настоящее время направлены на разработку методов изменения свойств поверхности с целью обеспечения имплантируемым устройствам антибактериальных эффектов [15–17]. Предложено много разнообразных стратегий для придания имплантатам антибактериальных свойств, в частности модификация поверхности. Методы физикохимической модификации вызывают изменения в химическом составе поверхности и наноструктуре, которые влияют на взаимодействие имплантата с бактериальной клеткой, нарушая молекулярное распознавание бактериями, и/или физически не допускают адгезию возбудителя и образование биопленки [18]. Такое существование в условиях биопленки позволяет бактериям уклоняться от различных антибактериальных препаратов и факторов иммунной системы, распространяться в новые локусы и инфицировать ранее не зараженные ткани организма, тем самым обеспечивая хроническое течение заболевания и невозможность тотальной эрадикации возбудителя [18–21].
Нанесение антибактериальных покрытий в качестве перспективного метода модификации поверхности имплантатов должно обеспечивать высокие антибактериальные свойства, препятствовать прикреплению бактерий к поверхности и образованию биопленок.
Цель исследования — оценка антибактериальной, антибиопленочной активности и цитосовместимости многокомпонентного покрытия с оксидами магния и серебра на поверхности 3D-образцов титана.
МАТЕРИАЛЫ И МЕТОДЫ
Комплекс MgO-AgO-MgO наносили на 3D-образцы медицинского титана в соответствии с оригинальной методикой (Приоритет 202590080 от 23.12.2024). Полученные образцы представлены на рис. 1.

Рис. 1. 3D-образцы титана: а — образец без тестируемого покрытия; б — образец с комплексом MgO-AgO-MgO
Для исследования поверхности 3D-образцы фиксировали на держатель и помещали в камеру сканирующего электронного микроскопа (СЭМ) ТМ 4000 Plus (Hitachi), имеющую спектрометр энергетической дисперсии XFlash 610 Mini. Разрешение спектрометра — 143 эВ, точность измерения — 0,01–1 %. Для определения состава покрытий выполняли элементный анализ при ускоряющем напряжение 15 кэВ, рабочее расстояние — 10 мм, зондовый ток — 1,4 нА, глубина зондирования — 0,5–1 мкм, угол отбора характеристического рентгеновского излучения — 25 ° . Детекцию осуществляли по всей поверхности образца в нескольких точках путем оценки испускаемого рентгеновского излучения. Стереофотографии образцов получали на микроскопе МСП-1 ЛОМО.
Для выявления наличия и длительности антибактериальной активности в отношении S. aureus АТСС 29213 комплекса MgO-AgO-MgO 3D-образцы погружали в 1 мл бульона Мюллера – Хинтона (МХБ), содержащего 1 х 10 6 КОЕ/мл бактерий и инкубировали 24 ч при температуре 37 ° С. В качестве контроля в МХБ вносили образцы без покрытия. При наличии статистически значимой разницы между значениями оптической плотности (ОП) инкубационных сред с тестируемыми образцами и контролем (инкубационные среды с образцами без покрытия) комплекс MgO-AgO-MgO считали активным. Если через сутки инкубации в пробирках регистрировали признаки роста бактерий, то выполняли посев бульонных культур, а через сутки — индентификацию выросших колоний. МХБ без признаков роста сливали и заменяли на 1 мл МХБ с 1 × 106 КОЕ/мл S. aureus АТСС 29213, процедуру повторяли ежедневно до появления признаков роста в опытных пробирках.
Биопленки эталонного штамма S. aureus ATCC 29213 формировали путем погружения тестируемых 3D-образцов титана в 3 мл LB-бульона, содержащего 1 × 105 КОЕ/мл бактерий, инкубировали при температуре 37 ºС в течение 24 ч, после чего планктонную культуру удаляли, образцы дважды промывали физиологическим раствором и высушивали. Образцы переносили в 1 мл физиологического раствора в пробирки типа эппендорф и помещали в УЗ-мойку на 5 мин при 37 ºС. Далее содержимое пробирок перемешивали с помощью вортекса и 100 мкл соникационной жидкости засевали на поверхность Колумбийского агара. Чашки инкубировали 24 ч при 37 ºС и затем выполняли подсчет. Для подтверждения видовой принадлежности выросших колоний выполняли идентификацию методом MALDI-TOF MS.
Клетки Vero выращивали в среде Dulbecco MEM/F12 с высоким содержанием глюкозы и 10 % эмбриональной бычьей сыворотки, 100 Ед/мл пенициллина и 100 мг/мл стрептомицина (Capricorn, Германия), разделяя каждые 3–4 дня в соотношении 1:3. Для получения экстракта исследуемые образцы титана помещали в 3 мл среды для культивирования клеток и инкубировали 24 ч в шейкере со скоростью 150 об/мин при +37 ºС. Для оценки жизнеспособность клетки Vero засевали в количестве 2000 в лунки 96-луночного планшета. После прикрепления клеток через 24 ч в лунки добавляли 200 мкл полученного ранее экстракта в среде для культивирования. Клетки Vero в лунках со стандартной средой без экстракта использовали в качестве контроля. Раствор 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ) вносили в лунки через 72 ч в конечной концентрации 1 мг/мл и инкубировали еще 3 ч. После удаления MTT в лунки добавляли 100 мкл диметилсульфоксида и инкубировали в шейкере со скоростью 200 об/мин в течение 5 мин. Далее на спектрофотометре INNO-S измеряли разницу ОП при длине волн 570 нм и 620 нм с вычитанием сигнала пустых лунок. Жизнеспособность Vero определяли как долю ОП 570–620 нм в исследуемых образцах относительно контроля. Эксперимент повторяли три раза.
Статистический анализ . Анализ результатов проводили в программе Prism 9.0 (GraphPad, США) методом непарного t-теста. Значения p < 0,05 считали статистически значимыми.
РЕЗУЛЬТАТЫ
Результаты элементного анализа и картирование подтвердили наличие и равномерное распределение оксида серебра (AgО) и оксида магния (MgO) на поверхности 3D-образцов титана. Содержание серебра (Ag) составило 39,3 %, магния (Mg) — 10,6 %, кислорода (О) — 15,5 %. Примеси других элементов не регистрировали (рис. 2, 3).
Установлено, что полученные 3D-образцы титана с MgO-AgO-MgO характеризовались наличием антибактериальной активности против эталонного штамма S. aureus ATCC 29213 (MSSA) в течение трех суток (рис. 4). В пробирках с образцами с покрытием MgO-AgO-MgO отсутствовали признаки роста бактерий в отличие от нативных образцов, в пробирках с которыми был осадок и мутная питательная среда. Методом MALDI-TOF-MS подтверждено наличие в пробирках именно S. aureus .
cps/eV
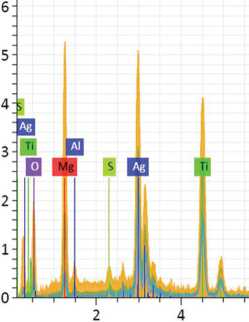
6 8 10 12
Рис. 2. Результаты элементного анализа титанового 3D-образца с комплексом MgO-AgO-MgO
Normalized mass concentration (%)
Spectrum О Mg Al S Ti Ag LI 15026 10.97 9.78 1.50 0.66 31.77 45.33
LI 15027 15.09 11.63 1.15 0.56 32.11 39.45
LI 15028 14.63 10.44 1.69 0.52 35.95 36.77
LI 15030 21.30 10.80 0.84 0.83 30.47 35.77
Mean 15.50 10.66 1.29 0.64 32.58 39.33
Sigma 4.29 0.77 0.38 0.14 2.36 4.29
SigmaMean 2.14 0.39 0.19 0.07 1.18 2.15

Рис. 3. Распределение серебра (Ag), магния (Mg) и кислорода (O) на поверхности титанового (Ti) 3D-образца
Energy [keV]

Рис. 4. Пробирки с инкубационными средами 3D-образцов и бактерий через сутки инкубации
Тестируемые образцы с оригинальным покрытием характеризовались также наличием антибиопле-ночной активности. Комплекс MgO-AgO-MgO обеспечивал эффективное препятствие адгезии S. aureus и формированию микробной пленки на поверхности 3D-образцов титана, в то время как на контрольных образцах стафилококки образовали биопленку с достаточным количеством бактериальных клеток для инициации инфекционного процесса (табл. 1). Следует отметить, что на четвертые сутки инкубации, несмотря на наличие признаков роста бактерий в пробирках с экспериментальными образцами, адгезия стафилококков к их поверхности была значимо меньшей в сравнении с контрольными образцами.
Анализ цитосовместимости полученных 3D-образцов в экспериментах ex vivo на культуре эукариотических клеток линии Vero показал отсутствие жизнеспособных клеток после 72 ч инкубации в среде с экстрактом из образцов титана с покрытием. При этом среда с экстрактом образцов без покрытия не оказывала выраженного влияния на жизнеспособность клеток Vero (рис. 5).
Количество микробных клеток на поверхности образцов
Таблица 1
|
Сутки |
Количество микробных клеток, КОЕ/мл |
р |
|
|
Образцы с комплексом MgO-AgO-MgO |
Контрольные образцы без покрытия |
||
|
1-е |
5 ± 2 |
1 × 108 ± 0 |
< 0,05 |
|
2-е |
5 ± 2 |
1 × 108 ± 0 |
< 0,05 |
|
3-е |
10 ± 3 |
1 × 108 ± 0 |
< 0,05 |
|
4-е |
1 × 102 ± 30 |
1 × 108 ± 0 |
< 0,05 |
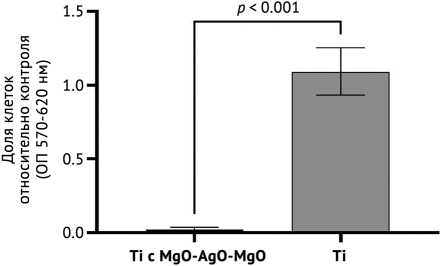
Рис. 5. Жизнеспособность клеток Vero через 72 ч после инкубации с экстрактами образцов титана
ОБСУЖДЕНИЕ
Биоматериалы играют ключевую роль в текущем успехе ортопедических и стоматологических операций. Чистый титан и его сплавы являются наиболее часто используемыми материалами для постоянных имплантатов, контактирующих с костью. Благодаря своим превосходным механическим и химическим свойствам, хорошей коррозионной стойкости и биосовместимости титан на протяжении десятилетий успешно использовуют в качестве искусственных имплантатов в ортопедической хирургии. Однако любое хирургическое вмешательство, связанное с установкой имплантата, имеет риск развития ИАИ. Более чем в 55 % случаев возбудителями ортопедической инфекции являются стафилококки [22]. По данным ретроспективного исследования динамики спектра возбудителей ортопедической инфекции за 12 лет доля S. aureus составила 31,3 %, S. epidermidis — 18,7 %, коагулазоотрицательных стафилококков (кроме S. epidermidis ) — 5,8 % [22]. Стафилококки способны образовывать биопленки на поверхности имплантатов и окружающих тканях, интернализировать остеобласты и остеоциты, поэтому ключевым моментом является предупреждение формирования зрелой биопленки на имплантате и, как следствие, персистирующего микробного очага [23].
Резистентность бактерий к наночастицам металлов является крайне редким явлением, поэтому значительный интерес представляют данные о возможности их применения для модификации поверхностей за счет нанесения активного покрытия с частицами металлов и придание антиадгезивных и антибактериальных свойств имплантатам. В состав полученных нами покрытий входят оксиды магния и серебра. Ионы магния играют ключевую роль в образовании кристаллов гидроксиапатита [24]. Магний стимулирует пролиферацию остеобластов и способствует формированию костей, снижение уровня магния влияет на экспрессию провоспалительных цитокинов, которые, в свою очередь, вызывают резорбцию кости [25]. Антибактериальная активность магния известна [26, 27]. В работе C.C. Coelho et al. выявлены антибактериальные свойства оксида магния, внесенного в заменитель костной ткани на основе гидроксиапатита [28]. Q. Zhao et al. показали антибактериальный эффект комплекса магния и диоксида титана в отношении стафилококков [29]. S. Xiang et al. также регистрировали антибактериальные свойства комплекса с магнием на поверхности титана [30]. Следует отметить, что в данных работах отсутствуют данные о длительности сохранения антибактериальной активности разработанных авторами покрытий с магнием. Полученное нами многокомпонентное покрытие 3D-образцов титана со сложным комплексом оксидов магния и серебра MgO-AgO-MgO показало выраженные антибактериальные свойства против S. aureus АТСС 29213 в течение трех суток. Известно, что адгезия патогенов включает две стадии [31]: на первой стадии происходит начальное обратимое взаимодействие между бактериями и поверхностями имплантатов, в то время как на второй необратимой стадии возникают специфические и неспецифические взаимодействия между белками клеточной стенки бактерий и связывающими молекулами поверхности имплантата. Разработанный нами комплекс MgO-AgO-MgO несмотря на снижение антибактериальных свойств на четвертые сутки инкубации значимо предупреждает микробную адгезию на поверхность титановых 3D-образов, что обеспечивает защиту имплантата от образования микробной биопленки.
Крайне важно понимать, что кроме выраженных антибактериальных свойств любая модификация поверхности имплантата должна быть безопасна для окружающих имплантат тканей организма. Известно, что титановые дентальные имплантаты, покрытые оксидом магния, характеризуются антибактериальными свойствами in vitro и цитосовместимостью. Q. Zhao et al. модифицировали поверхность титана диоксидом титана, легированным магнием. Авторы показали, что такой комплекс способствует адгезии, пролиферации и дифференциации остеобластов, а также остеогенезу через сигнальный путь ERK/c-Fos и ранней остеоинтеграции титановых имплантатов [29]. S. Xiang et al. разработали покрытие с магнием, которое потенцировало жизнеспособность, пролиферацию и остеогенную дифференциацию мезенхимальных стволовых клеток костного мозга [30].
Установлено, что антибактериальный эффект оксидов металлов, в том числе магния, реализуется за счет развития окислительного стресса, повреждения клеточной стенки бактерий и нарушений в белках и ДНК [32]. По-видимому, выявленная нами цитотоксичность полученных титановых 3D-образцов с MgO-AgO-MgO может быть обусловлена значительной активацией реакций перекисного окисления липидов, которая и вызывает подавление жизнеспособности эукариотических клеток линии Vero.
ЗАКЛЮЧЕНИЕ
Полученное нами оригинальное покрытие имеет высокий клинический потенциал в качестве многофункционального антибактериального покрытия поверхностей ортопедических имплантатов, напечатанных на 3D-принтере, предупреждает возможность первичного взаимодействия возбудителя с абиотической поверхностью, что является одним из основных факторов в профилактике развития ИАИ и её рецидивов после ревизионных операций с заменой имплантата. Однако высокий уровень цитотоксичности требует дальнейшей модификации техники нанесения покрытия или его состава для снижения уровня цитотоксичности при сохранении антибактериальной активности комплекса.


