Антитела класса G, специфичные к бензо[а]пирену, эстрадиолу и прогестерону у женщин с колоректальным раком и раком молочной железы
Автор: Аверьянов А.В., Антонов А.В., Животовский А.С., Костянко М.В., Вафин И.А., Колпинский Г.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Цель исследования - определение уровня антител класса G, специфичных к бензо[а]пирену (IgG-Bp), эстрадиолу (IgG-Es) и прогестерону (IgG-Pg) у больных колоректальным раком и раком молочной железы. Материал и методы. С помощью неконкурентного иммуноферментного анализа исследовали содержание этих антител в сыворотке крови здоровых женщин (n=401), больных колоректальным раком (n=219) и раком молочной железы (n=1469). Статистический анализ результатов проводили с помощью программы Statistica 8.0. Результаты. У больных колоректальным раком по сравнению со здоровыми лицами чаще встречались высокие значения IgG-Bp>7 (66 % vs 25 %, p6 (58 % vs 45 %, p=0,002, OR=1,7), а также индивидуальные соотношения антител: IgG-Bp/IgG-Es>1 (74 % vs в 34 %, p1,5 (75 % vs 28 %, p1,5 (58 % vs 38 %, p6 (57 % vs 33 %, p5 (62 % vs 53 %, p=0,003, OR=1,4), а также соотношения IgG-Bp/IgG-Es>1 (55 % vs 34 %, p1,3 (71 % vs 36 %, p1,4 (62 % vs 44 %, p
Антитела, бензо[а]пирен, эстрадиол, прогестерон, рак толстой кишки, рак молочной железы
Короткий адрес: https://sciup.org/140296678
IDR: 140296678 | УДК: 618.19+616.34]-006.6-078 | DOI: 10.21294/1814-4861-2022-21-5-52-58
Текст научной статьи Антитела класса G, специфичные к бензо[а]пирену, эстрадиолу и прогестерону у женщин с колоректальным раком и раком молочной железы
В мире и в России одними из наиболее часто встречающихся злокачественных заболеваний у женщин являются колоректальный рак (КРР) и рак молочной железы (РМЖ) [1]. Воздействие химических канцерогенов в настоящее время рассматривается как одна из основных причин развития злокачественных заболеваний. Большую канцерогенную опасность представляют полициклические ароматические углеводороды (ПАУ), широко распространенные в окружающей среде как продукты сжигания органического топлива на предприятиях топливно-энергетического комплекса, черной металлургии, коксохимии и других. Интенсивным источником ПАУ является автотранспорт. В больших количествах ПАУ содержатся в дыме сигарет и образуются в процессе приготовления пищи на открытом огне [2]. Индикаторным соединением ПАУ является бензо[а]пирен (Bp). Инициация канцерогенеза происходит путем об- разования генотоксических метаболитов ПАУ под действием цитохромов P450 и их аддуктов с ДНК. Аддукты метаболитов Bp с ДНК обнаруживаются в нормальных и опухолевых клетках у здоровых женщин и больных КРР и РМЖ [3–6]. Кроме того, у здоровых женщин и больных РМЖ были выявлены аддукты генотоксических метаболитов эстрадиола (Es) с ДНК [7, 8]. Известно, что низкомолекулярные метаболиты Bp и Es сами по себе не распознаются иммунной системой, но в составе аддуктов с макромолекулами, ДНК и белками они становятся гаптенами и приобретают способность индуцировать образование специфических антител. Были обнаружены ассоциации антител к Bp, Es и прогестерону (Pg) с РМЖ и раком легкого у женщин [9]. Выявлены взаимосвязи между содержанием в сыворотке стероидных гормонов и уровнями указанных антител [10]. Предполагается, что образование антител, специфичных к ПАУ и стероидным гормонам, у больных КРР имеет характерные особенности по сравнению с больными РМЖ, поскольку ПАУ воздействуют на эпителиальные клетки толстой кишки непосредственно, попадая с пищей и питьевой водой, а на эпителий молочной железы опосредованно ‒ через циркулирующую кровь.
Цель исследования – определение уровня антител класса G, специфичных к Bp, Es, Pg (IgG-Bp, IgG-Es, IgG-Pg), у больных колоректальным раком и раком молочной железы.
Материал и методы
Выполнен анализ сывороточных IgG, специфичных к Bp, Es, Pg, в трех группах женщин в период постменопаузы. Первая группа включала 219 женщин с КРР, средний возраст – 66 ± 7 лет; вторую составили 1469 женщин с РМЖ, средний возраст – 64 ± 8 лет; в третью вошла 401 условно здоровая женщина без онкопатологии, средний возраст – 57 ± 6 лет. Сыворотки крови условно здоровых женщин получены в областном центре крови, а женщин с РМЖ и КРР ‒ в областном клиническом онкологическом диспансере г. Кемерова. Письменное согласие на забор периферической крови получено от всех женщин, принимавших участие в исследовании, согласно установленным Хельсинкской декларацией 1975 г. и утвержденным Приказом Минздрава РФ № 266 от 19.06.2003 этическим нормам.
Исследования проводились по методике неконкурентного иммуноферментного анализа, описанного ранее [9], с использованием в качестве адсорбированных антигенов конъюгатов Es, Pg и Bp с бычьим сывороточным альбумином (БСА) и анти-IgG антитела, меченные пероксидазой хрена, для выявления связавшихся антител. Уровни исследуемых антител выражали в условных единицах, рассчитанных по формуле
IgG-X = (ODX-БСА – ODБСА) / ODБСА., где X = Bp, Es, Pg; ODX-БСА – оптическая плотность связывания с конъюгатом гаптен-БСА; ODБСА – связывание с БСА.
Статистический анализ результатов проводили с помощью программы Statistica 8.0 (StatSoftInc., USA). Ненормальность распределения данных подтверждали критерием Шапиро–Уилка. Статистически значимые различия между группами определяли с помощью U-критерия Манна–Уитни, log-регрессии и критерия χ2с поправкой Йейтса на непрерывность вариации, при уровне значимости p<0,05. Для определения пороговых значений уровней АТ (cut-off) использовался ROC-анализ [11]. Оптимальные соотношения чувствительности и специфичности оценивались по наименьшему расстоянию от точки (0,1) до точки на кривой по формуле
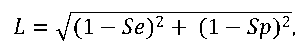
где L – расстояние от точки (0,1) до точки на кривой; Se – чувствительность; Sp – специфичность.
Ассоциации исследуемых IgG с КРР и РМЖ оценивали с помощью величины отношения шансов (ОR) с доверительным интервалом (CI) при 95 % уровне значимости.
Результаты
В сравниваемых группах рассчитаны медианы уровней исследуемых антител и их индивидуальных соотношений (IgG-Bp/IgG-Es, IgG-Bp/IgG-Pg, IgG-Es/IgG-Pg) (табл. 1). Медианы уровней IgG-Bp и IgG-Es оказались значимо выше у больных КРР и РМЖ по сравнению со здоровыми женщинами, для IgG-Pg достоверных различий не обнаружено. Уровни индивидуальных соотношений IgG-Bp/ IgG-Es, IgG-Bp/IgG-Pg, IgG-Es/IgG-Pg также были значимо выше у больных РМЖ и КРР. При сравнении уровней IgG между РМЖ и КРР значимо более высокие значения были обнаружены для IgG-Bp и соотношений IgG-Bp/IgG-Es, IgG-Bp/IgG-Pg у больных КРР.
Анализ данных с помощью множественной log-регрессии не выявил достоверного влияния возраста на уровень антител и их индивидуальных соотношений (данные не представлены). Пороговые значения уровней антител и их индивидуальных соотношений (сut-off), по которым больные КРР и здоровые женщины имели наиболее значимые различия, рассчитали с помощью ROC-анализа. Рассчитанные значения сut-off составили: для IgG-Bp=7, для IgG-Es=6, для IgG-Pg=4; по индивидуальным соотношениям соответсвенно: IgG-Bp/IgG-Es=1, IgG-Bp/IgG-Pg=1,5, IgG-Es/ IgG-Pg=1,5. В табл. 2 и 3 приведены результаты сравнения.
Частота встречаемости высоких уровней IgG-Bp, IgG-Es, а также соотношений IgG-Bp/IgG-Es, IgG-Bp/IgG-Pg и IgG-Es/IgG-Pg была выше у больных КРР по сравнению со здоровыми женщинами (p<0,01). Наибольшие различия между группами были выявлены для соотношения IgG-Bp/IgG-Pg с OR = 7,8. Для IgG-Pg достоверных различий не получено. При сравнении больных РМЖ со здоровыми женщинами были получены аналогичные результаты. Наибольшие различия между группами также были выявлены при анализе соотношения IgG-Bp/IgG-Pg (OR=4,5). Высокие значения IgG-Bp/IgG-Pg>1,3 у больных РМЖ встречались значимо чаще, чем у здоровых женщин (71 % vs 36 %). Различия по IgG-Pg обнаружены не были.
Провели сравнение больных КРР и РМЖ по уровням исследованных антител и их индивидуальных соотношений с учетом значений сut-off, рассчитанных для каждого из этих заболеваний (табл. 4). Частота и высоких уровней IgG-Bp>7, и соотношений IgG-Bp/IgG-Es>1, IgG-Bp/IgG-Pg>1,5
Таблица 1/table 1
Медианы уровней igg к Bp, es и pg и их соотношений у здоровых женщин и больных КРР и РМЖ (Q 25 –Q 75 )
Median levels of igg to Bp, es and pg and their ratios in healthy women and patients with cRc and breast cancer (Q25–Q75)
|
Антитела/ Antibody |
1. Здоровые женщины/ Healthy women (n=401) |
2. Больные КРР/ CRC patients (n=219) |
3. Больные РМЖ/ Breast cancer patients (n=1469) |
p 1–2 |
p 1–3 |
p 2–3 |
|
IgG-Bp |
4,32 (2,7–7,0) |
9,19 (5,4–14,1) |
7,00 (2,7–7,0) |
<0,0001 |
<0,0001 |
<0,0001 |
|
IgG-Es |
5,36 (3,2–8,3) |
6,83 (4,3–10,6) |
6,12 (3,2–8,3) |
0,0010 |
0,0001 |
0,1000 |
|
IgG-Pg |
4,10 (2,6–6,5) |
4,06 (2,3–6,8) |
3,95 (2,6–6,5) |
0,5807 |
0,3512 |
0,9013 |
|
IgG-Bp/IgG-Es |
0,85 (0,6–1,1) |
1,24 (1,0–1,6) |
1,07 (0,6–1,1) |
<0,0001 |
<0,0001 |
<0,0001 |
|
IgG-Bp/IgG-Pg |
1,08 (0,7–1,6) |
1,98 (1,5–2,8) |
1,68 (0,7–1,6) |
<0,0001 |
<0,0001 |
<0,0001 |
|
IgG-Es/IgG-Pg |
1,31 (0,9–1,8) |
1,58 (1,2–2,2) |
1,58 (0,9–1,8) |
<0,0001 |
<0,0001 |
0,2031 |
Таблица 2/table 2
Частота низких и высоких уровней igg к Bp, es, pg и их соотношений у здоровых женщин и больных КРР Frequencies of low and high levels of igg to Bp, es, pg and their ratios in healthy women and patients with cRc
|
Cоотношения антител/ Antibody ratios |
Здоровые женщины/ Healthy women (n=401) |
Больные КРР/ CRC patients (n=219) |
χ2(p) |
OR (95 %CI) |
|
IgG-Bp ≤ 7 |
302 (75 %) |
75 (34 %) |
ОО ^ /VO ООО 1 А |
0,2 (0,1–0,2) |
|
IgG-Bp > 7 |
99 (25 %) |
144 (66 %) |
98,5 (<0,0001) |
5,9 (4,1–8,5) |
|
IgG-Es ≤ 6 |
221 (55 %) |
91 (42 %) |
ОО/Л ООО 1 А |
0,6 (0,4–0,8) |
|
IgG-Es > 6 |
180 (45 %) |
128 (58 %) |
9,9 (0,0021) |
1,7 (1,3–2,4) |
|
IgG-Pg ≤ 4 |
199 (50 %) |
108 (49 %) |
0 0/0 ООООА |
1,0 (0,7–1,4) |
|
IgG-Pg > 4 |
202 (50 %) |
111 (51 %) |
0,0 (0,9900) |
1,0 (0,7–1,4) |
|
IgG-Bp/IgG-Es ≤ 1 |
266 (66 %) |
58 (26 %) |
оса ллл 1 а |
0,2 (0,1–0,3) |
|
IgG-Bp/IgG-Es > 1 |
135 (34 %) |
161 (74 %) |
88,6 (<0,0001) |
5,6 (3,9–8,0) |
|
IgG-Bp/IgG-Pg ≤ 1,5 |
287 (72 %) |
54 (25 %) |
0,1 (0,1–0,2) |
|
|
IgG-Bp/IgG-Pg > 1,5 |
114 (28 %) |
165 (75 %) |
124,1 (<0,0001) |
7,8 (5,4–11,4) |
|
IgG-Es/IgG-Pg ≤ 1,5 |
249 (62 %) |
91 (42 %) |
09 9 /Л ЛЛЛ 1 А |
0,4 (0,3–0,6) |
|
IgG-Es/IgG-Pg > 1,5 |
152 (38 %) |
128 (58 %) |
23,3 (<0,0001) |
2,3 (1,7–3,3) |
Таблица 3/table 3
Частота низких и высоких уровней igg к Bp, es, pg и их соотношений у здоровых женщин и больных РМЖ
Frequencies of low and high levels of igg to Bp, es, pg and their ratios in healthy women and breast cancer patients
|
Соотношения антител/ Antibody ratios |
Здоровые женщины/ Healthy women (n=401) |
Больные РМЖ/ Breast cancer patients (n=1469) |
χ2(p) |
OR (95 % CI) |
|
IgG-Bp ≤ 6 |
270 (67 %) |
637 (43 %) |
71,5 (<0,0001) |
0,4 (0,3–0,5) |
|
IgG-Bp > 6 |
131 (33 %) |
832 (57 %) |
2,7 (2,1–3,4) |
|
|
IgG-Es ≤ 5 |
187 (47 %) |
562 (38 %) |
8,9 (0,0032) |
0,7 (0,6–0,9) |
|
IgG-Es > 5 |
214 (53 %) |
907 (62 %) |
1,4 (1,1–1,8) |
|
|
IgG-Pg ≤ 4 |
199 (50 %) |
746 (51 %) |
0,1 (0,7213) |
1 (0,8–1,3) |
|
IgG-Pg > 4 |
202 (50 %) |
723 (49 %) |
1,0 (0,8–1,2) |
|
|
IgG-Bp/IgG-Es ≤ 1 |
266 (66 %) |
659 (45 %) |
57,3 (<0,0001) |
0,4 (0,3–0,5) |
|
IgG-Bp/IgG-Es > 1 |
135 (34 %) |
810 (55 %) |
2,4 (1,9–3,1) |
|
|
IgG-Bp/IgG-Pg ≤ 1,3 |
258 (64 %) |
421 (29 %) |
171,9 (<0,0001) |
0,2 (0,2–0,3) |
|
IgG-Bp/IgG-Pg > 1,3 |
143 (36 %) |
1048 (71 %) |
4,5 (3,6–5,7) |
|
|
IgG-Es/IgG-Pg ≤ 1,4 |
225 (56 %) |
558 (38 %) |
41,8 (<0,0001) |
0,5 (0,4–0,6) |
|
IgG-Es/IgG-Pg > 1,4 |
176 (44 %) |
911 (62 %) |
2,1 (1,7–2,6) |
Таблица 4/table 4
Частота низких и высоких уровней igg к Bp, es и pg и их соотношений у женщин с КРР или РМЖ Frequencies of low and high levels of igg to Bp, es and pg and their ratios in women with cRc or breast cancer
Ранее было показано, что высокое содержание IgG-Es в сыворотке крови у здоровых женщин в постменопаузе коррелирует с повышением уровня IgG-Bp и содержанием Es в крови [13]. Высокие концентрации Es увеличивают риск развития злокачественных заболеваний молочной железы, так как стимулируют пролиферацию клеток-мишеней, а его метаболиты обладают генотоксическим действием. В модельных экспериментах было установлено, что при иммунизации животных против Es у последних наблюдалось повышение содержания Es в крови [14]. Авторы полагают, что специфические антитела против Es, образующиеся после такой иммунизации, связывают Es в сыво- ротке крови, что приводит к нарушению обратных связей в гипоталамо-гипофизарной системе и как результат – к усилению продукции Es в яичниках. Поэтому весьма вероятно, что повышение уровней IgG-Es способствует повышению содержания в сыворотке крови Es и возрастанию риска возникновения РМЖ.
Список литературы Антитела класса G, специфичные к бензо[а]пирену, эстрадиолу и прогестерону у женщин с колоректальным раком и раком молочной железы
- Zlokachestvennye novoobrazovaniya v Rossii v 2019 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2020. 214 s.
- Khudolei V.V. Kantserogeny: kharakteristiki, zakonomernosti, mekhanizmy deistviya. SPb., 1990, 419 s.
- Gunter M.J., Divi R.L., Kulldorff M., Vermeulen R., Haverkos K.J., Kuo M.M., Strickland P., Poirier M.C., Rothman N., Sinha R. Leukocyte polycyclic aromatic hydrocarbon-DNA adduct formation and colorectal adenoma. Carcinogenesis. 2007; 28(7): 1426-9. https://doi.org/10.1093/carcin/bgm022.
- Jamin E.L., Riu A., Douki T., Debrauwer L., Cravedi J.P., Zalko D., Audebert M. Combined genotoxic effects of a polycyclic aromatic hydrocarbon (B(a)P) and an heterocyclic amine (PhIP) in relation to colorectal carcinogenesis. PLoS One. 2013; 8(3). https://doi.org/10.1371/journal.pone.0058591.
- Harris D.L., Washington M.K., Hood D.B., Roberts L.J., Ramesh A. Dietary fat-influenced development of colon neoplasia in Apc Min mice exposed to benzo(a)pyrene. Toxicol Pathol. 2009; 37(7): 938-46. https://doi.org/10.1177/0192623309351722.
- Agudo A., Peluso M., Munnia A., Luján-Barroso L., Barricarte A., Amiano P., Navarro C., Sánchez M.J., Quirós J.R., Ardanaz E., Larrañaga N., Tormo M.J., Chirlaque M.D., Rodríguez-Barranco M., SánchezCantalejo E., Cellai F., Bonet C., Sala N., González C.A. Aromatic DNA adducts and breast cancer risk: a case-cohort study within the EPIC-Spain. Carcinogenesis. 2017; 38(7): 691-8. https://doi.org/10.1093/carcin/bgx047.
- Santen R.J., Yue W., Wang J.P. Estrogen metabolites and breast cancer. Steroids. 2015; 99(Pt A): 61-6. https://doi.org/10.1016/j.steroids.2014.08.003.
- Yu F.L. 17Beta-estradiol epoxidation as the molecular basis for breast cancer initiation and prevention. Asia Pac J Clin Nutr. 2002; 11(7): 460-6. https://doi.org/10.1046/j.1440-6047.11.s.7.4.x.
- Glushkov A.N., Polenok E.G., Gordeeva L.A., Mun S.A., Kostyanko M.V., Antonov A.V., Titov V.A., Verzhbitskaya N.E., Vafin I.A. Immunologicheskii disbalans pri rake molochnoi zhelezy i rake legkogo u zhenshchin v postmenopauze. Meditsinskaya immunologiya. 2018; 20(6): 927-34. https://doi.org/10.15789/1563-0625-2018-6-927-934.
- Glushkov A.N., Polenok E.G., Mun S.A., Gordeeva L.A., Kostyanko M.V., Lutsenko V.A., Kolpinskii G.I., Brezhneva E.V., Vafin I.A. Individual'nyi immunologicheskii fenotip i gormonal'nyi balans u zhenshchin v postmenopauze. Rossiiskii immunologicheskii zhurnal. 2020; 23(1): 61-8. https://doi.org/10.15789/1028-7221-007-IPA.
- Hajian-Tilaki K. Receiver Operating Characteristic (ROC) Curve Analysis for Medical Diagnostic Test Evaluation. Caspian J Intern Med. 2013; 4(2): 627-35.
- De Buck S.S., Augustijns P., Muller C.P. Specific antibody modulates absorptive transport and metabolic activation of benzo[a]pyrene across Caco-2 monolayers. J Pharmacol Exp Ther. 2005; 313(2): 640-6. https://doi.org/10.1124/jpet.104.081034.
- Glushkov A.N., Polenok E.G., Mun S.A., Gordeeva L.A. Inversion of natural immuno-hormonal interactions under influence of antibodies against environmental chemical carcinogens. Med Hypotheses. 2020; 144. https://doi.org/10.1016/j.mehy.2020.109981.
- Rawlings N.C., Kennedy S.W., Henricks D.M. The active immunization of the cyclic ewe against an estrone protein conjugate. Theriogenology. 1979; 12(3): 139-51. https://doi.org/10.1016/0093-691x(79)90080-3.
- Hogan A.M., Collins D., Baird A.W., Winter D.C. Estrogen and gastrointestinal malignancy. Mol Cell Endocrinol. 2009; 307(1-2): 19-24. https://doi.org/10.1016/j.mce.2009.03.016.
- Sasso C.V., Santiano F.E., Campo Verde Arboccó F., Zyla L.E., Semino S.N., Guerrero-Gimenez M.E., Pistone Creydt V., López Fontana C.M., Carón R.W. Estradiol and progesterone regulate proliferation and apoptosis in colon cancer. Endocr Connect. 2019; 8(3): 217-29. https://doi.org/10.1530/EC-18-0374.

![Антитела класса G, специфичные к бензо[а]пирену, эстрадиолу и прогестерону у женщин с колоректальным раком и раком молочной железы Антитела класса G, специфичные к бензо[а]пирену, эстрадиолу и прогестерону у женщин с колоректальным раком и раком молочной железы](/file/cover/140296678/antitela-klassa-g-specifichnye-k-benzo-a-pirenu-jestradiolu-i-progesteronu-u.png)
