Аортальные аллографты в хирургическом лечении протезного инфекционного эндокардита
Автор: Богачев-прокофьев А.В., Шарифулин Равиль Махарамович, Железнев С.И., Караджа А.В., Афанасьев А.В., Пивкин А.Н., Залесов А.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 1 т.27, 2023 года.
Бесплатный доступ
Актуальность. Протезный инфекционный эндокардит - наиболее тяжелая форма инфекционного эндокардита, встречающаяся у 1-6 % пациентов с искусственными клапанами сердца. Патология по-прежнему ассоциируется с неблагоприятным прогнозом, высокой госпитальной летальностью. Цель. Оценка результатов протезирования корня аорты аортальными аллографтами у пациентов с протезным инфекционным эндокардитом. Методы. В ретроспективный анализ включили взрослых пациентов с протезным инфекционным эндокардитом аортального клапана, которым было выполнено протезирование корня аорты аортальными аллографтами в период с 2011 по 2022 г. Результаты. Из 15 пациентов, включенных в исследование, ранний инфекционный эндокардит отмечен у 60,0 %. Ведущий возбудитель - Staphylococcus aureus (26,7 %). Ранняя летальность составила 13,3 %. Тромбоэмболические осложнения развились у 2 (13,3 %) пациентов. Медиана времени послеоперационного наблюдения - 48,5 (6-140) мес. Зарегистрирован один отдаленный летальный исход. Выживаемость через 5 лет составила 79,0 %. Возврат инфекционного эндокардита отмечен у одного пациента. Два пациента перенесли повторные операции: один - по поводу ложной аневризмы проксимального анастомоза, второй - структурной дегенерации аллографта. Пятилетняя свобода от повторных операций составила 91,7 %. Заключение. Протезирование корня аорты аортальными аллографтами, демонстрирующими высокую свободу от возврата инфекционного процесса, - эффективный метод лечения пациентов с протезным инфекционным эндокардитом.
Аортальный аллографт, протезный инфекционный эндокардит
Короткий адрес: https://sciup.org/142237539
IDR: 142237539 | DOI: 10.21688/1681-3472-2023-1-7-16
Текст научной статьи Аортальные аллографты в хирургическом лечении протезного инфекционного эндокардита
Протезный инфекционный эндокардит (ПИЭ) — наиболее тяжелая форма инфекционного эндокардита (ИЭ), которая встречается у 1–6 % пациентов с искусственными клапанами сердца [1]. Несмотря на совершенствование антибактериальной терапии, хирургических технологий, анестезиологического обеспечения, патология по-прежнему ассоциируется с неблагоприятным прогнозом, высокой госпитальной летальностью [2–4]. При деструктивных вариантах ПИЭ протезирование корня аорты с помощью аортальных аллографтов предпочтительно [2]. В данном исследовании оценены результаты протезирования корня аорты аортальными аллографтами у пациентов с протезным инфекционным эндокардитом.
Методы
В ретроспективное исследование включены взрослые пациенты (≥ 18 лет), которым в период с сентября 2011 г. по сентябрь 2022 г. выполнили протезирование корня аорты аортальными алло-графтами по поводу ПИЭ. Исключены лица, которым аортальные аллографты имплантировали по другим показаниям. Исследование соответствует принципам Хельсинкской декларации. Письменное информированное согласие пациентов на участие в исследовании не бралось, поскольку проводился ретроспективный анализ анонимных данных.
Хирургические технологии
Все операции выполняли через полную срединную стернотомию. Применяли центральную канюляцию восходящей аорты и правого предсердия моноканюлей; при наличии показаний для вмешательств на митральном или трикуспидальном кла- панах выполняли раздельную канюляцию верхней и нижней полых вен. Для защиты миокарда использовали кристаллоидную кардиоплегию (Custodiol, Dr. Köhler Pharma, Альсбах-Хенлайн, Германия) с антеградной подачей раствора в корень аорты или устья коронарных артерий.
После эксплантации протеза, санации очагов инфекции осуществляли оценку состояния корня аорты. Показанием к применению аортальных алло-графтов считали парааннулярное распространение инфекционного процесса с деструкцией стенки корня аорты (рис. 1), а также ПИЭ, вызванный мульти-резистентной флорой (например грибковой).
Иссекали синусы аорты. Устья коронарных артерий выкраивали в виде «кнопок». Затем прошивали выходной отдел левого желудочка П-образ-ными швами на прокладках нитью полипропилен 5/0 (рис. 2A). Швы проводили через проксимальную юбку аллографта, ориентируя его культей левой коронарной артерии напротив устья левой коронарной артерии (рис. 2B). Проксимальную линию швов в области мышечной части аллографта укрепляли полоской из ксеноперикарда шириной 3–5 мм. Швы завязывали на буже, чтобы предотвратить чрезмерное сужение выходного отдела левого желудочка (рис. 2C). В стенке аллографта формировали отверстия с последующей реимплантацией устьев коронарных артерий обвивным швом нитью 6/0 (рис. 2D). На заключительном этапе формировали дистальный анастомоз между аллографтом и аортой непрерывным обвивным швом нитью полипропилен 5/0 (рис. 2E).
С 2011 по 2016 г. применяли аортальные алло-графты, изготовленные в ННИИПК им. акад. Е.Н. Ме-шалкина (г. Новосибирск), с 2017 г. — криосохранен-ные аллографты производства ИП Болсуновский В.А. (г. Санкт-Петербург).
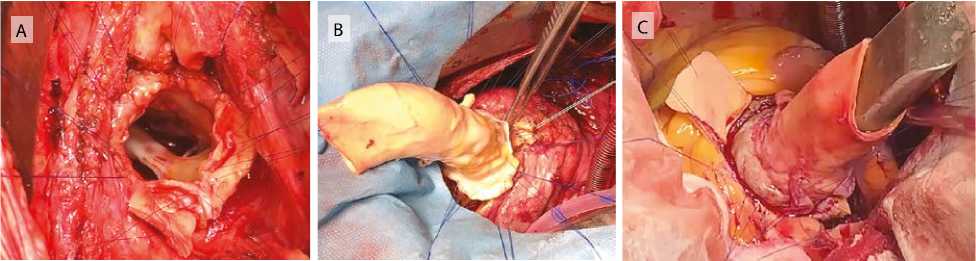
Рис. 2. Этапы операции: выходной отдел левого желудочка прошит отдельными П-образными швами (A); прошивание проксимальной юбки аллографта (B);
завязывание швов проксимального анастомоза на буже (C);
реимплантация устьев коронарных артерий (D);
финальный вид (E)
Обследованиев послеоперационном периоде
Интраоперационно после отключения от искусственного кровообращения всем пациентам проводили чреспищеводное ультразвуковое исследование для оценки гемодинамики на аллографте. Контрольную трансторакальную эхокардиографию выполняли перед выпиской и в дальнейшем рекомендовали проходить ежегодно.
Статистический анализ
Статистическую обработку результатов осуществляли с помощью пакета программ STATA версии 14.0 (StataCorp, Колледж Стейшн, США). Результаты представлены как медиана и 25-й, 75-й процентили (для количественных признаков) или абсолютные и относительные частоты (для качественных признаков). Выживаемость, свободу от осложнений вычисляли по методике Каплана – Майера и представляли в виде процентов и 95% доверительного интервала (ДИ). Статистически значимыми считали различия данных при р < 0,05.
Результаты
В исследование включили 15 человек. Преобладали пациенты с ранним ПИЭ (60 %). В 20 % случаев опе- рации предшествовали системные эмболии. Позитивную гемокультуру получили у 73,3 %, чаще других выявляли Staphylococcus aureus. Предоперационная характеристика пациентов представлена в табл. 1.
Наиболее часто имплантировали аллографт 25 мм. В 53,3 % случаев выполняли сопутствующие вмешательства (табл. 2).
30-дневная летальность составила 13,3 % (2 случая). Причиной неблагоприятного исхода послужила сердечная недостаточность у пациентов с деструкцией фиброзного тела и перегородок сердца, подвергнутых сложным реконструктивным вмешательствам (операции Commando и закрытию фистул заплатами из ксеноперикарда). Два пациента перенесли нарушения мозгового кровообращения в раннем послеоперационном периоде (13,3 %). Рецидивов ИЭ на госпитальном этапе не зарегистрировано. Прочие данные интраоперационного и раннего послеоперационного периодов представлены в табл. 2.
После выписки обследовали 92,3 % пациентов, неизвестны данные одного больного в связи с потерей контакта с ним. Медиана времени послеоперационного наблюдения составила 48,5 [14,5; 73,0] (6–140) мес. В отдаленном периоде зарегистрирован один летальный исход: у пациента, перенесшего инсульт в раннем послеоперационном периоде и находившегося на продленной искусственной
Табл. 1. Исходная характеристика пациентов
|
Количество, n |
15 |
|
|
Возраст, лет |
60 [46; 67] |
|
|
Пол, женский, n (%) |
6 (40,0) |
|
|
Рост, см |
166,5 [161,0; 170,0] |
|
|
Вес, кг |
70 [57; 86] |
|
|
Площадь поверхности тела, м 2 |
1,8 [1,65; 2,05] |
|
|
Функциональный класс сердечной |
II |
2 (13,3) |
|
недостаточности по классификации Нью-Йоркской ассоциации кардиологов, n (%) |
III |
5 (33,3) |
|
IV |
8 (53,3) |
|
|
Фракция выброса левого желудочка, % |
59,0 [47,0; 69,0] |
|
|
Анамнез не менее двух кардиохирургических операций, n (%) |
5 (33,3) |
|
|
Длительность ИЭ, мес. |
4 [2; 7] |
|
|
Время после первичной операции, мес. |
8,5 [3,0; 18,5] |
|
|
менее 12 мес., n (%) |
9 (60,0) |
|
|
ИЭ механического протеза, n (%) |
8 (53,3) |
|
|
Анамнез системной эмболии, n (%) |
3 (20,0) |
|
|
Позитивная гемокультура, n (%) |
11 (73,3) |
|
|
Staphylococcus aureus |
4 (26,7) |
|
|
Staphylococcus heamolyticus |
1 (6,7) |
|
|
Возбудитель (гемокультура + интраоперационный посев), n (%) |
Streptococcus |
2 (13,3) |
|
Enterococcus spp. |
2 (13,3) |
|
|
Propionibacterium acnes |
1 (6,7) |
|
|
Burkholderia gladioli |
1 (6,7) |
|
|
Aspergillus |
1 (6,7) |
|
|
Negative culture |
3 (20,0) |
|
|
Критерии Duke, n (%) |
Определенный ИЭ |
11 (73,3) |
|
Возможный ИЭ |
4 (26,7) |
|
|
Вегетации |
6 (40,0) |
|
|
Данные эхокардиографии, n (%) |
Фистула |
2 (13,3) |
|
Абсцесс Отрыв протеза |
8 (53,3) 2 (13,3) |
|
|
Ложная аневризма |
2 (13,3) |
|
Примечание. ИЭ — инфекционный эндокардит.
Данные представлены как n (%) или как Me [Q1; Q3].
Табл. 2. Интраоперационный и ранний послеоперационный периоды
Экстренная операция 6 (40,0)
|
180 |
||
|
Время окклюзии аорты, мин |
[158; 198] |
|
|
Время искусственного |
237 |
|
|
кровообращения, мин |
[205,5; 245,5] |
|
|
21 мм |
1 (6,7) |
|
|
Диаметр |
22 мм |
1 (6,7) |
|
23 мм |
2 (13,3) |
|
|
аллографта, |
||
|
n (%) |
24 мм |
2 (13,3) |
|
25 мм |
9 (60,0) |
|
|
Всего |
8 (53,3) |
|
|
Коронарное шунтирование |
2 (13,3) |
|
|
Пластика митрального |
3 (20,0) |
|
|
клапана |
||
|
Сопутствую- |
Пластика трикуспидаль- |
4 (26,7) |
|
щие вмеша- |
ного клапана |
|
|
тельства, |
Протезирование ми- |
|
|
n (%) |
трального клапана (операция Commando) |
1 (6,7) |
|
Протезирование дуги аорты |
2 (13,3) |
|
|
Закрытие аорто-правопредсердной фистулы |
1 (6,7) |
|
|
Время пребывания в ОИТ, сут. |
3,5 [3,0; 5,5] |
|
|
Отсроченное ушивание грудной клетки, n (%) |
4 (26,7) |
|
|
Искусственная вентиляция легких ≥ 48 ч, n (%) |
4 (26,7) |
|
|
Продолжительность госпитального периода после операции, сут. |
14 [13; 19] |
|
|
30-дневная летальность |
2 (13,3) |
|
|
Инфаркт миокарда |
1 (6,7) |
|
|
Острая почечная |
||
|
Осложнения |
недостаточность |
3 (20,0) |
|
раннего |
(гемодиализ) |
|
|
послеопера- |
Рестернотомия, |
0 |
|
ционного |
гемостаз |
|
|
периода, n (%) |
Имплантация кардиостимулятора |
1 (6,7) |
|
Рецидив инфекционного эндокардита |
0 |
|
|
ОНМК |
2 (13,3) |
|
|
Данные эхо-кардиографи при выписке |
Пиковый градиент на аллографте, мм рт. ст. |
9,0 [7,0; 10,0] |
|
Средний градиент на и аллографте, мм рт. ст. |
4,0 [3,0; 6,9] |
|
|
Аортальная недостаточность ≥ 2 степени, n (%) |
0 |
|
Примечание. ОИТ — отделение интенсивной терапии;
ОНМК — острое нарушение мозгового кровообращения.
Данные представлены как n (%) или как Me [Q1; Q3].
Рис. 3. Выживаемость
(кривая Каплана – Майера)s
Примечание.
ДИ — доверительный £30
интервал. m30
95% ДИ
0 12 24 36 48 60 72 84 96 108 120
Время после операции, мес.
Число пациентов в группе риска 15 10 8 7 6 6 4 2 2 2 1
вентиляции легких, смерть наступила через 6 мес. на фоне прогрессирования полиорганной недостаточности. Выживаемость через 5 лет составила 79,0 % [95% ДИ 48,1; 92,7] (рис. 3).
У одного пациента отметили возврат ИЭ с формированием через 3 мес. ложной аневризмы проксимального анастомоза, которую успешно устранили во время повторной операции заплатой из ксеноперикарда. Свобода от реинфекции через
5 лет составила 91,7 % [95% ДИ 53,9; 98,8]. Еще один пациент перенес повторную операцию через 10 лет по поводу дегенерации аллографта, выполнили процедуру Росса. Пятилетняя свобода от всех повторных операций составила 91,7 % [95% ДИ 53,9; 98,8] (рис. 4).
В отдаленном послеоперационном периоде отметили увеличение градиентов на аллографте, однако в пределах допустимых значений (табл. 3, рис. 5).
Рис. 4. Свобода от повторных операций (кривая Каплана – Майера)
Примечание.
ДИ — доверительный интервал.
95% ДИ
0 12 24 36 48 60 72 84 96 108
Время после операции, мес.
Число пациентов в группе риска 15 9 7 6 6 6 4 2 2 2
Табл. 3. Отдаленный послеоперационный период
|
Срок наблюдения, мес. |
48,5 [14,5; 73,0] |
|
|
Обследовано пациентов, n (%) |
12 (92,3) |
|
|
Отдаленная летальность |
1 (8,3) |
|
|
Острое нарушение мозгового кровообращения |
1 (8,3) |
|
|
Осложнения отдаленного |
Большие геморрагические осложнения |
0 |
|
послеоперационного периода, n (%) |
Реинфекция |
1 (8,3) |
|
Реоперация |
2 (16,7) |
|
|
Репротезирование аллографта |
1 (8,3) |
|
|
Пятилетняя выживаемость, % [95% ДИ] |
79,0 [48,1; 92,7] |
|
|
Пятилетняя свобода от реопераций, % [95% ДИ] |
91,7 [53,9; 98,8] |
|
|
Данные эхокардиографии в отдаленном периоде |
Пиковый градиент на аллографте, мм рт. ст. |
18,2 [11,0; 21,0] |
|
Средний градиент на аллографте, мм рт. ст. |
8,0 [6,0; 10,0] |
|
|
Аортальная недостаточность ≥ 2 степени, n (%) |
1 (9,1) |
|
Примечание. ДИ — доверительный интервал. Данные представлены как n (%), Me [Q1; Q3] или % [95% ДИ].
Обсуждение
Результаты данного исследования демонстрируют, что аортальные аллографты, имплантируемые в условиях деструкции корня аорты инфекционным процессом, обладают высокой резистентностью к возврату ИЭ. Пятилетняя свобода от ИЭ и повторных операций составила 91,7 % [95% ДИ 53,9; 98,8].
ПИЭ, осложненный деструкцией парааннулярных структур, является наиболее тяжелым вариантом ИЭ аортального клапана [1]. Согласно действующим рекомендациям Европейского общества кардиологов (англ. European Society of Cardiology) по лечению ИЭ
2015 г., неконтролируемая инфекция с признаками деструкции фиброзного кольца, формированием абсцессов, ложных аневризм, фистул является показанием к ургентному хирургическому вмешательству (класс I) [2]. В ряде исследований было продемонстрировано, что только раннее хирургическое вмешательство, независимо от тяжести состояния пациента, позволяет улучшить результаты лечения [3; 4]. Нарушение мозгового кровообращения при установленных показаниях к хирургии не должно быть поводом отказа от операции, за исключением случаев грубого неврологического дефицита [2].
Рис. 5. Диаграммы размаха (boxplots) для пикового и среднего градиентов на аллографте на момент выписки и в отдаленном периоде
|
-1- |
|||||
|
Медиана L 1□ 25% – 75% I Минимум – Максимум |
|||||
Пиковый градиент, Пиковый градиент, Средний градиент, Средний градиент, выписка отдаленный период выписка отдаленный период
30-дневная летальность в нашей серии была достаточно высокой: 13,3 %. Однако она сопоставима с летальностью в публикациях, посвященных хирургическому лечению ИЭ, которая составляет 10,4–23,0 % [3; 4]. Оба неблагоприятных исхода в нашем исследовании отмечены при наиболее тяжелых вариантах эндокардита с вовлечением центрального фиброзного тела сердца и перегородок сердца. По данным центров, обладающих наибольшим опытом лечения таких форм ИЭ, госпитальная летальность достигает 24,0–28,3 %, а 5-летняя выживаемость — всего 41,8–48,0 % [5; 6].
Согласно рекомендациям [2], у пациентов как с ИЭ нативного аортального клапана, так и с ПИЭ при распространенных вариантах деструкции фиброзного кольца, когда имеется нарушение лево-желудочково-аортальной непрерывности, следует отдать предпочтение протезированию корня аорты аортальным аллографтом или ксеноаортальным корнем (класс IIa). Аортальный аллографт, полностью лишенный синтетических материалов, шовного материала, демонстрирует высокую резистентность к рецидиву инфекции. В исследовании S. Solari и соавт., в котором были проанализированы результаты лечения 112 пациентов с ИЭ с применением аортальных аллографтов, свобода от возврата ИЭ через 10 лет составила 96,3 %, через 15 лет — 91,2 % (средний срок наблюдения 7,8 года) [7]. M. Musci и соавт. (221 пациент, средний срок наблюдения 5,2 года) описали свободу от повторных операций на аллографте по поводу реинфекции через 10 лет 92,9 и 92,1 % для ИЭ нативного аортального клапана и ПИЭ соответственно [8].
В настоящем исследовании свобода от возврата ИЭ через 5 лет составила 91,7 %, однако медиана времени послеоперационного наблюдения была меньше, около 4 лет. Подавляющее количество повторных эпизодов ИЭ приходится на первый год после операции, поэтому имеющиеся данные позволяют говорить о высокой резистентности аллографтов к реинфекции в нашей серии.
Ряд авторов сравнивали результаты применения аллографтов и традиционных механических и биологических протезов при ИЭ. В некоторых работах, включая метаанализ [9; 10], не выявлены различия между группами по частоте возврата инфекции. На наш взгляд, эти исследования имеют серьезные ограничения: ретроспективный дизайн, различия в подходах к применению аллографтов, разнородность сравниваемых групп. Поэтому к их выводам нужно относиться критично. Пациенты, которым имплантируют аллографты, в большинстве случаев относятся к более тяжелой когорте с более обширными деструктивными изменениями корня аорты. Применение методики Propensity score matching не позволяет устранить несопоставимость групп по степени вовлечения парааннулярных структур в инфекционный процесс. С одной стороны, при ограниченных абсцессах фиброзного кольца, после санации которых нет нарушения целостности аорты, успешно могут быть применены стандартные протезы. Но в случаях обширной деструкции корня аорты, по нашему мнению, альтернативы аллографтам нет. Кроме того, при наличии резистентной вирулентной микрофлоры, такой как грибковая, только аортальные аллографты позволят купировать инфекционный процесс, так как синтетический материал традиционных протезов может стать местом аккумуляции микроорганизмов и быть источником рецидива ИЭ [11]. Еще одно преимущество алло-графтов — возможность использовать переднюю створку митрального клапана для реконструкции митрально-аортального контакта и передней створки митрального клапана [12; 13]. Кроме того, ал-лографты демонстрируют низкие трансклапанные градиенты и практически исключают возможность развития пациент-протезного несоответствия в послеоперационном периоде [14].
По данным литературы, ксенокорни также демонстрируют высокую резистентность к реинфекции. В исследовании А. Heinz и соавт. из 126 пациентов, которым были имплантированы ксенокондуиты Freestyle по поводу деструктивных форм ИЭ, только 1 больной перенес реоперацию из-за возврата инфекционного эндокардита (3,1 %) [15].
Основным недостатком применения аортальных аллографтов является подверженность дегенерации в отдаленном периоде, что объясняется высоким содержанием эластиновых волокон в стенке аорты. В цитируемом выше исследовании S. Solari и соавт. свобода от реопераций через 15 лет составила 47,3 % и была статистически значимо меньше у пациентов младше 40 лет [7]. По данным M. Musci, 10-летняя свобода от всех повторных операций на аллографте в группе ИЭ нативного аортального клапана была 77,6 %, а при ПИЭ — 79,3 % [8]. В единственном рандомизированном клиническом исследовании по сравнению результатов применения ксеноаортальных корней (90 пациентов) и аортальных аллографтов (76 пациентов) с достаточно продолжительным сроком наблюдения (13,8 года) 20-летняя свобода от реопераций была сопоставима между группами: 67,9 % для Freestyle и 67,2 % для аллографта [16]. Следует отметить, что доля пациентов с ИЭ в данной публикации была небольшой (2,4 %).
В нашем исследовании 5-летняя свобода от повторных операций на аллографте составила 91,7 %, однако продолжительность послеоперационного наблюдения была относительно небольшой. Учитывая дефицит импортных аортальных ксенокор-ней и отсутствие в настоящее время на рынке отечественных аналогов, считаем протезирование корня аорты аортальным аллографтом методом выбора при лечении деструктивных форм ПИЭ независимо от возраста пациентов, а также деструктивных форм ИЭ нативного аортального клапана у пациентов старше 60 лет. У молодых пациентов при ИЭ нативного аортального клапана, осложненных пара-аннулярными абсцессами, мы отдаем предпочтение процедуре Росса [17]. В многоцентровом исследовании по применению процедуры Росса у пациентов с ИЭ (n = 31) продемонстрирована высокая резистентность аутографта к возврату инфекции, кумулятивная частота ИЭ легочного аутотрансплантата через 8 лет составила 5 % [18].
Авторы из НМИЦ ССХ им. А.Н. Бакулева проанализировали результаты лечения пациентов с ИЭ аортального клапана, осложненным парааннулярны-ми абсцессами, с помощью процедуры Росса (n = 7) и аортальных аллографтов (n = 20). Обе методики продемонстрировали высокую свободу от возврата ИЭ. По мнению авторов, протезирование корня аорты аортальным аллографтом и легочным аутографтом — методики выбора при деструктивных формах ИЭ аортального клапана [19].
Ограничения
Ограничениями исследования являются ретроспективный дизайн, отсутствие группы сравнения, небольшое количество пациентов и относительно непродолжительный срок отдаленного наблюдения. Проведение рандомизированных клинических исследований с группой сравнения невозможно по этическим соображениям ввиду отсутствия альтернативного варианта хирургического лечения у этой крайне тяжелой группы пациентов.
Заключение
Протезирование корня аорты аортальными ал-лографтами, демонстрирующими высокую свободу от возврата инфекционного процесса, — эффективный метод лечения пациентов с протезным инфекционным эндокардитом.
Список литературы Аортальные аллографты в хирургическом лечении протезного инфекционного эндокардита
- Wang A. Statement from the International Collaboration on Endocarditis on the current status of surgical outcome in infective endocarditis. Ann Cardiothorac Surg. 2019;8(6):678-680. PMID: 31832359; PMCID: PMC6892721. https://dx.doi. org/10.21037/acs.2019.05.19
- Habib G., Lancellotti P., Antunes MJ., Bongiorni M.G., Casalta J.-P., Del Zotti F., Dulgheru R., El Khoury G., Erba P.A., lung B., Miro J.M., Mulder B.J., Plonska-Gosciniak E., Price S., Roos-Hesselink J., Snygg-Martin U., Thuny F., Mas P.T., Vilacosta I., Zamorano J.L.; ESC Scientific Document Group. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015;36(44):3075-3128. PMID: 26320109. https://dx.doi.org/10.1093/eurheartj/ehv319
- Chu V.H., Park L.P., Athan E., Delahaye F., Freiber-ger T., Lamas C., Miro J.M., Mudrick D.W., Strahilevitz J., Tribouilloy C., Durante-Mangoni E., Pericas J.M., Fernández-Hidalgo N., Nacinovich F., Rizk H., Krajinovic V., Giannitsioti E., Hurley J.P., Hannan M.M., Wang A.; International Collaboration on Endocarditis. Association between surgical indications, operative risk, and clinical outcome in infective endocarditis: a prospective study from the International Collaboration on Endocarditis. Circulation. 2015;131(2):131-140. PMID: 25480814. https://dx.doi.org/10.1161/CIRCULATI0NAHA.114.012461
- Lalani T., Chu V.H., Park L.P., Cecchi E., Corey G.R., Durante-Mangoni E., Fowler Jr V.G., Gordon D., Grossi P., Hannan M., Hoen B., Muñoz P., Rizk H., Kanj S.S., Selton-Suty C., Sexton DJ., Spelman D., Ravasio V., Tripodi M.F., Wang A.; International Collaboration on Endocarditis-Prospective Cohort Study Investigators. In-hospital and 1-year mortality in patients undergoing early surgery for prosthetic valve endocarditis. JAMA Intern Med. 2013;173(16):1495-1504. PMID: 23857547. https://dx.doi.org/10.1001/jamainternmed.2013.8203
- Davierwala P.M., Marin-Cuartas M., Misfeld M., Deo S.V., Lehmann S., Garbade J., Holzhey D.M., Borger M.A., Bakhtiary F. Five-year outcomes following complex reconstructive surgery for infective endocarditis involving the intervalvular fibrous body. Eur J Cardiothorac Surg. 2020;58(5):1080-1087. PMID: 32380545. https://dx.doi.org/10.1093/ejcts/ezaa146
- Navia J.L., Elgharably H., Hakim A.H., Witten J.C., Haupt M.J., Germano E., Houghtaling P.L., Bakaeen F.G., Pettersson G.B., Lytle B.W., Roselli E.E., Gillinov A.M., Svensson L.G. Long-term outcomes of surgery for invasive valvular endocarditis involving the aortomitral fibrosa. Ann Thorac Surg. 2019;108(5):1314-1323. PMID: 31254508. https://dx.doi. org/10.1016/j.athoracsur.2019.04.119
- Solari S., Mastrobuoni S., De Kerchove L., Navarra E., Astarci P., Noirhomme P., Poncelet A., Jashari R., Rubay J., El Khoury G. 0ver 20 years experience with aortic homograft in aortic valve replacement during acute infective endocarditis. Eur J Cardiothorac Surg. 2016;50:1158-1164. PMID: 27229671. https://dx.doi.org/10.1093/ejcts/ezw175
- Musci M., WengY., Hübler M., Amiri A., Pasic M., Kosky S., Stein J., Siniawski H., Hetzer R. Homograft aortic root replacement in native or prosthetic active infective endocarditis: twenty-year single-center experience. J Thorac Cardiovasc Surg. 2010;139(3):665-673. PMID: 19767017. https://dx.doi. org/10.1016/j.jtcvs.2009.07.026
- Kim J.B., Ejiofor J.I., Yammine M., Camuso J.M., Walsh C.W., Ando M., Melnitchouk S.I., Rawn J.D., Leacche M., MacGillivray T.E., Cohn L.H., Byrne J.G., Sundt T.M. Are homografts superior to conventional prosthetic valves in the setting of infective endocarditis involving the aortic valve? J Thorac CardiovascSurg. 2016;151(5):1239-1246. PMID: 26936004. https://dx.doi.org/10.1016Xi.itcvs.2015.12.061
- Yanagawa B., Mazine A., Tam D.Y., Juni P., Bhatt D.L., Spindel S., Puskas J.D., Verma S., Friedrich J.O. Homograft versus conventional prosthesis for surgical management of aortic valve infective endocarditis: a systematic review and meta-analysis. Innovations (Phila). 2018;13(3):163-170. PMID: 29912740. https://dx.doi.org/10.1097/ IMI.0000000000000510
- Sharifulin R., Bogachev-Prokophiev A., Varnek Y., Klimko N., Malakhova O., Volkov A., Murashev I., Pivkin A., Karaskov A. Successful treatment of an aortotomy site aspergillus infection. Ann Thorac Surg. 2019;108(4):e253-e255. PMID: 30910659. https://dx.doi.org/10.1016/_i.athoracsur.2019.02.036
- Elgharably H., Hakim A.H., Unai S., Hussain S.T., Shrestha N.K., Gordon S., Rodriguez L., Gillinov A.M., Svensson L.G., Navia J.L. The incorporated aortomitral homograft for double-valve endocarditis: the 'hemi-Commando' procedure. Early and midterm outcomes. Eur J Cardiothorac Surg. 2018;53(5):1055-1061. PMID: 29253091. https://dx.doi.org/10.1093/ejcts/ezx439
- Чернов И.И., Екимов С.С., Мотрева А.П., Кондратьев Д.А., Маркина М.И., Тарасов Д.Г. Лечение протезного эндокардита с использованием аортально-митрального гомо-графта. Клиническая и экспериментальная хирургия. Журнал им. акад. Б.В. Петровского. 2015;3:70-72. Chernov I.I., Ekimov S.S., Motreva A.P., Kondratyev D.A., Markina M.I., Tarasov D.G. Double valve replacement with aorto-mitral homograft in patient with prosthestic endocarditis. Clin Experiment Surg. Petrovsky J. 2015;3:70-72. (In Russ.)
- Спиридонов С.В., Шкет А.П., Чеснов Ю.М., Щетинко Н.Н., Одинцов В.О., Шумовец В.В., Андрущук В.В., Комаров-ский А.А., Островский Ю.П. Непосредственные результаты протезирования аортального клапана с использованием аллографтов. Новости хирургии. 2014;22(4):443-448. https://dx.doi.org/10.18484/2305-0047.2014A443 Spirydonov S.V., Shket A.P., Chesnov Yu.M., Shchetinko N.N., Odintsov V.O., Shumovets V.V., Andrushchuk V.V., Komarovsky A.A., Ostrovsky Yu.P. The immediate results of aortic valve replacement with allografts. Novosti Khirurgii. 2014;22(4):443-448. (In Russ.) https://dx.doi. org/10.18484/2305-0047.2014.4.443
- Heinz A., Dumfarth J., Ruttmann-Ulmer E., Grimm M., Müller L.C. Freestyle root replacement for complex destructive aortic valve endocarditis. J Thorac Cardiovasc Surg. 2014;147(4):1265-1270. PMID: 23849892. https://dx.doi. org/10.1016/j.jtcvs.2013.05.014
- Melina G., De Robertis F., Gaer J.A., Angeloni E., El-Hamamsy I., Bahrami T., Pepper J.R., Takkenberg J.J.M., Yacoub M.H. Long-term survival after xenograft versus homograft aortic root replacement: Results from a prospective randomized trial. J Thorac Cardiovasc Surg. 2019;161(1):57-65. PMID: 31735388. https://dx.doi.org/10.1016/j.jtcvs.2019.09.119
- Караськов А.М., Опен А.Б., Демидов Д.П., Железнев С.И., Демин И.И., Астапов Д.А. Операция Росса как метод радикальной коррекции аортальной недостаточности при инфекционном эндокардите высокой степени активности. Патология кровообращения и кардиохирургия. 2011;(3):71-73. Karaskov A.M., Open A.B., Demidov D.P., Zheleznev S.I., Demin I.I., Astapov D.A. Ross operation as a method of radical correction of aortic insufficiency in infectious endocarditis of high activity levels. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2011;(3):71-73. (In Russ.)
- Chauvette V., Bouhout I., Lefebvre L., Tarabzoni M., Chamberland M.E., Poirier N., Demers P., Chu M.W.A., Perron J., El-Hamamsy I. The Ross procedure is a safe and durable option in adults with infective endocarditis: a multicentre study. Eur J Cardiothorac Surg. 2020;58(3):537-543. PMID: 32236477. https://dx.doi.org/10.1093/ejcts/ezaa078
- Сулейманов Б.Р., Муратов Р.М., Бритиков Д.В., Соболева Н.Н., Титов Д.А. Использование алло- и аутографтов (операция Росса) при активном инфекционном эндокардите с деструкцией корня аорты. Анналы хирургии. 2016;21(3):180-186. Suleymanov B.R., Muratov R.M., Britikov D.V., Soboleva N.N., Titov D.A. The use of allo- and autografts (Ross procedure) in active infective endocarditis with the aortic root destruction. Annaly khirurgii = Annals of Surgery. Russian Journal. 2016;21(3):180-186. (In Russ.)


