Аорто-дигестивные фистулы: редкая причина желудочно-кишечных кровотечений
Автор: Белов Дмитрий Владимирович, Гарбузенко Д.В., Андриевских С.И., Ануфриева С.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 4 т.25, 2021 года.
Бесплатный доступ
Аорто-дигестивные фистулы - редкая, но чрезвычайно опасная причина массивных желудочно-кишечных кровотечений с высоким риском летального исхода. Цель обзора - рассмотреть современные принципы диагностики и лечения заболевания. Для поиска научных публикаций использовали базу данных PubMed, поисковую систему Google Scholar, Российский индекс научного цитирования, а также пристатейные списки литературы. Соответствующие теме обзора статьи, опубликованные за последние 25 лет (1996-2021 гг.), определяли по ключевым словам: желудочно-кишечное кровотечение, аорто-дигестивная фистула, диагностика, лечение. Критерий включения - желудочно-кишечное кровотечение, ассоциированное с аорто-дигестивной фистулой. У пациентов с аневризмой аорты или перенесших ее протезирование должна быть повышенная настороженность относительно аорто-дигестивных фистул. Это позволит при желудочно-кишечном кровотечении и исключении других источников быстро верифицировать диагноз и своевременно провести лечение на основании данных мультиспиральной компьютерной томографии с внутривенным болюсным контрастированием. В неотложной ситуации для быстрого гемостаза у нестабильных больных наиболее оправданно эндоваскулярное протезирование аорты. Радикальным вмешательством следует считать «открытую» реконструкцию аорты in situ с одновременным устранением дефекта полого органа и санацией связанных со свищом очагов инфекции.
Аорто-дигестивная фистула, желудочно-кишечное кровотечение
Короткий адрес: https://sciup.org/142230805
IDR: 142230805 | DOI: 10.21688/1681-3472-2021-4-23-29
Текст обзорной статьи Аорто-дигестивные фистулы: редкая причина желудочно-кишечных кровотечений
Аорто-дигестивные фистулы — редкая, но чрезвычайно опасная причина массивных желудочнокишечных кровотечений, которые без экстренного хирургического вмешательства в большинстве случаев сопровождаются почти абсолютной летальностью [1]. Цель обзора — рассмотреть современные принципы диагностики и лечения заболевания. Аорто-дигестивные фистулы необходимо предполагать у всех пациентов с аневризмой аорты или перенесших ее протезирование. Это позволит при желудочно-кишечном кровотечении оперативно верифицировать диагноз и провести лечение. Несмотря на то что в неотложных случаях для быстрого гемостаза у нестабильных больных наиболее оправданно эндоваскулярное протезирование аорты, радикальным вмешательством должна быть «открытая» реконструкция аорты in situ с одновременным устранением дефекта полого органа и санацией связанных со свищом очагов инфекции.
С тех пор как O. Dubrueil в 1818 г. впервые сообщил о свище между аортой и пищеводом [2], аорто-дигестивные фистулы были описаны практически во всех отделах желудочно-кишечного тракта [3]. Наиболее часто (в 60–80 % случаев) они локализуются в двенадцатиперстной кишке [4], прежде всего в ее горизонтальной (нижней) части [5] из-за близкого расположения фиксированной в забрюшинном пространстве брюшной части аорты [6].
Классификация
Общепринятой классификации аорто-дигестив-ных фистул не существует, однако анализ литературы позволяет разделить их по следующим признакам. По механизму: первичные (вследствие аневризмы аорты, механической травмы, воспаления (лучевые, инфекционные и т. д.)) и вторичные (после «открытого» или эндоваскулярного протезирования аорты). По пути распространения патологического процесса: с аорты или органов желудочно-кишечного тракта. По локализации: аорто-пищеводные, аорто-желудочные, аорто-дуоденальные, аорто-тонкокишечные, аорто-толстокишечные.
Первичные аорто-дигестивные фистулы встречаются с частотой 0,04–0,07 % и обычно ассоциируются с аневризмой аорты, когда в результате ее механической компрессии и пульсации развиваются ишемия и воспаление стенки соответствующего органа желудочно-кишечного тракта [7]. Это приводит к очаговому некротически-язвенному поражению слизистой оболочки и часто — к незначительным «сторожевым», самостоятельно останавливающимся желудочно-кишечным кровотечениям [8]. В дальнейшем обусловленное инфекцией воспаление может привести к разрушению стенки аорты и формированию аорто-дигестивной фистулы, тогда кровотечения становятся профузными и трудно контролируемыми [9; 10].
Также первичные аорто-дигестивные фистулы могут быть следствием инфекционно-воспалительного процесса [11], прорастания опухоли [12], повреждения стенки полого органа инородным телом [13], а при неизмененной аорте — осложнением дивертикулита сигмовидной кишки [14], на фоне радиационно-индуцированного хронического воспаления кишечной стенки [15] и в результате ряда других более редких причин.
Вторичные аорто-дигестивные фистулы возникают в 0,4–4,0 % случаев, как правило, после «открытого» или эндоваскулярного протезирования аорты [9]. Сроки их формирования варьируют от 11 сут. до 25 лет [15]. Развитию способствуют такие факторы, как миграция и изгиб трансплантата, эндолики, местная инфекция [16], которые приводят к несостоятельности анастомоза и образованию ложной аневризмы аорты [17]. Еще одна причина — близкое расположение трансплантата и органа желудочно-кишечного тракта [18]. Переход воспалительного процесса на его стенку в сочетании с ишемией приводят к локальному некрозу и при участии внутрипросветной микрофлоры — аорто-дигестивной фистуле [9].
Клиника и диагностика
Основными клиническими проявлениями аор-то-дигестивных фистул являются желудочно-кишечные кровотечения, боли в груди или животе, реже — в спине, иногда выявляют признаки системной воспалительной реакции [7] или пульсирующее образование в брюшной полости [19]. У некоторых пациентов заболевание протекает малосимптомно, что затрудняет диагностику [14; 20].
Ассоциированные с аорто-дигестивными фистулами желудочно-кишечные кровотечения следует предполагать у каждого пациента с аневризмой аорты или после ее протезирования [21]. В зависимости от локализации они могут проявляться рвотой кровью либо «кофейной гущей», меленой либо выделением малоизмененной крови из заднего прохода [7]. Во многих случаях вначале развивается небольшое самостоятельно останавливающееся «сторожевое» кровотечение, которое в дальнейшем может быть массивным, угрожающим жизни [22], причем интервал между ними варьирует от 5 ч до 5 мес., в среднем — 4 сут. [23].
Инструментальная диагностика аорто-дигестив-ных фистул затруднена. Эндоскопическое исследование помогает исключить другие причины острого желудочно-кишечного кровотечения [24], тогда как сами аорто-дигестивные фистулы могут быть выявлены только в четверти случаев [7]. Их наиболее достоверные признаки — пульсирующее субэпителиальное образование со стигмами состоявшегося кровотечения [25], части трансплантата в просвете соответствующего органа желудочно-кишечного тракта [26; 27]. Однако при активном кровотечении или, наоборот, спонтанном гемостазе часто не удается установить источник, а иногда аорто-дигестив-ные фистулы ошибочно принимают за язвы, полипы или эрозии. Затрудняет эндоскопическую диагностику и труднодоступная локализация, в частности в горизонтальной (нижней) или восходящей части двенадцатиперстной кишки либо дистальнее связки Трейтца [6]. При подозрении на аорто-дигестив-ную фистулу из-за высокой угрозы профузного кровотечения следует отказаться от биопсии [28].
Желудочно-кишечное кровотечение без установленного источника, обнаруженное во время эндоскопического исследования у больных аневризмой аорты, может свидетельствовать об аор-то-дигестивной фистуле и необходимости провести срочную мультиспиральную компьютерную томографию (МСКТ) с внутривенным болюсным контрастированием. Благодаря широкой доступности, короткому периоду сбора данных и высокому разрешению (чувствительность 50–94 %, специфичность 85–100 %) МСКТ стала методом первой линии диагностики [29]. Важное преимущество перед эндоскопическими и ангиографическими методами — отсутствие риска рецидива или усугубления имеющегося кровотечения [7]. К основным признакам аорто-дигестивной фистулы по данным МСКТ относятся: газ в забрюшинном пространстве или стенке аорты (чувствительность 40 %, специфичность 100 %) [16]; сдавление и сморщивание кишечной стенки по направлению к аневризмати-чески измененной аорте [30], исчезновение между ними жировой прослойки (чувствительность 90 %, специфичность 33 %) [15]; разрушение стенки аорты (чувствительность 89 %, специфичность 75 %), экстравазация контраста в полый орган [7]; ложная аневризма анастомоза протеза аорты рядом со стенкой полого органа со скоплением жидкости (чувствительность 90 %, специфичность 92 %), отеком и утолщением более 5 мм мягких тканей в области трансплантата [6]. Если аорто-дигестив-ная фистула изначально установлена по данным МСКТ, следует без диагностических и лечебных эндоскопических манипуляций направлять пациента на экстренную операцию, задержка которой может привести к летальному исходу.
Магнитно-резонансная визуализация имеет аналогичную с МСКТ специфичность и чувствительность, но менее доступна в экстренных ситуациях из-за длительного времени получения изображения и сложности контролировать состояние нестабильных пациентов. Недостатками также являются артефакты пульсации и невозможность отличить газ от кальцификации стенки аорты [29].
Аортографию для диагностики заболевания применяют редко, но в некоторых случаях назначают для планирования хирургического вмешательства. Ограничения — способность визуализировать аор-то-дигестивную фистулу только во время активного кровотечения со скоростью более 0,5 мл в минуту [31], высокий риск рецидива кровотечения при манипуляции в области тромбированного участка поврежденной аорты [32].
Сцинтиграфия с помощью однофотонной эмиссионной компьютерной томографии и радиоиндикаторов индия 111 (111In) или технеция 99m (99mTc) с чувствительностью 60–100 % позволяет обнаружить инфекцию сосудистого протеза у бессимптомных пациентов и выявить активное желудочно-кишечное кровотечение, связанное с аор-то-дигестивной фистулой [29]. Недостатки метода аналогичны минусам магнитно-резонансной визуализации: длительность исследования и недоступность специального оборудования.
Несмотря на возможности методов лучевой диагностики, в обычной клинической практике в случае профузного продолжающегося желудочно-кишечного кровотечения диагностировать аорто-дигестив-ную фистулу позволяет лишь лапаротомия [24; 33].
Лечение
В связи с высокой летальностью ассоциированное с аорто-дигестивной фистулой желудочно-кишечное кровотечение является показанием к экстренному хирургическому вмешательству.
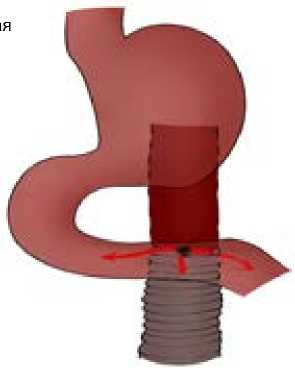
Рис. 2. Резекция двенадцатиперстной кишки, репротезирование аорты с укрытием прядью большого сальника
Эндоскопические методы остановки кровотечения (стентирование пищевода, клипирование, инъекции гемостатических и сосудосуживающих средств, коагуляция, использование клеевых композиций) малоэффективны и увеличивают частоту рецидива [8]. Для быстрого гемостаза у нестабильных пациентов наиболее оправданно эндоваскулярное протезирование аорты [34]. Эффективность метода — 80 %, однако A.P. Dimech и соавт. сообщили, что инфекционные осложнения в месте установки трансплантата из-за дефекта стенки полого органа повышают летальность в 30-дневном периоде до 40 %, в течение 6 мес. — до 80 % [15]. За исключением случаев паллиативного лечения больных с тяжелой сопутствующей патологией эндоваскулярное протезирование аорты должно быть промежуточной мерой перед окончательным хирургическим вмешательством. Далее важно провести разобщение аневризмы с просветом кишки и санацию гнойных очагов. При «открытых» операциях эти манипуляции выполняют вместе с реконструкцией аорты. Вопрос о необходимости замены эндотрансплантата после экстренной остановки кровотечения обсуждается [7; 35].
Объем «открытой» операции при аорто-дигестив-ной фистуле зависит от общего состояния пациента, локализации и степени повреждения аорты и полого органа, тяжести местного инфекционно-воспалительного процесса [13]. При умеренном инфицировании предпочтительна реконструкция аорты in situ дакроновым или политетрафторэтиленовым трансплантатом, при этом дополнительное укрытие его прядью большого сальника является независимым предиктором выживания [7; 36]. Для повыше- ния устойчивости к инфекции применяют протезы, импрегнированные серебром и обработанные антибиотиками, а также гомографты аорты [3].
Экстраанатомическое шунтирование, как правило, рекомендуют в тех случаях, когда из-за сильного загрязнения свища протезирование невозможно. Однако процедура связана с более высокой летальностью по сравнению с реконструкцией аорты in situ (25–90 против 27–30 %) [37] и в 40–60 % случаев может сопровождаться кровотечением из линии шва аорты, разрывом ее культи, рецидивом аорто-дигестивной фистулы, тромбозом трансплантата [7].
Небольшие дефекты полых органов обычно ушивают, при крупных повреждениях выполняют эзофагэктомию (при повреждении пищевода) [13], резекцию тонкой либо толстой кишки [15]. При реконструктивных вмешательствах на двенадцатиперстной кишке для профилактики рецидива свища сосудистый протез рекомендуется дополнительно укрывать прядью большого сальника (рис. 1, 2) [38; 39]. Так, C. Rodrigues dos Santos и соавт. при многофакторном анализе 791 пациента с первичными и вторичными аортодуоденальными фистулами обнаружили, что реконструкция аорты in situ и укрытие сосудистого протеза прядью большого сальника являются независимыми предикторами выживания [39].
На протяжении 4–6 нед. после вмешательства необходимо проводить антибактериальную терапию с учетом бактериологического исследования операционного материала [7]. Даже при отрицательных результатах такого исследования следует назначить лечение антибиотиками 7–10 дней [40].
Заключение
Из-за способности вызывать желудочно-кишечные кровотечения следует предполагать аорто-дигестивные фистулы у всех пациентов с аневризмой аорты или перенесших ее протезирование. Повышенная настороженность позволит на основании данных МСКТ с внутривенным болюсным контрастированием быстро верифицировать диагноз и своевременно провести лечение. В неотложной ситуации для успешного гемостаза у нестабильных больных наиболее оправданно эндоваскулярное протезирование аорты. Сроки и объем радикального оперативного вмешательства при аорто-дигестивных фистулах окончательно не утверждены и зависят от соматического статуса пациента, наличия сопутствующей патологии, распространенности инфекционного процесса. В то же время наиболее приемлема «открытая» реконструкция аорты in situ с одновременным устранением дефекта полого органа и санацией возникших на фоне свища очагов инфекции. Не решен вопрос о целесообразности замены установленного во время кровотечения стент-графта. Ранние выявление и стратификация пациентов с аневризмой аорты по группам риска, определение оптимальной лечебной тактики и усовершенствование техники хирургического пособия снижают риск формирования аорто-дигестив-ных фистул. Для оценки эффективности связанных с ними лечебно-диагностических мероприятий необходимы дальнейшие клинические испытания с участием большого количества пациентов.
Список литературы Аорто-дигестивные фистулы: редкая причина желудочно-кишечных кровотечений
- Inoue K., Fukunaga R., Matsubara Y., Aoyagi Y., Matsuda D., Kyuragi R., Morisaki K., Matsumoto T., Oki E., Maehara Y. Primary aortoduodenal fistula with a history of distal gastrectomy. Acute Med Surg. 2016;4(1):105-108. PMID: 29123844. PMCID: PMC5667283. https://doi.org/10.1002/ams2.224
- Dubrueil O. Observations sur la Perforation de l'esophage et de l'aorte thoracique par une portion d'os avale: avec de reflexions. J Univ Sci Med. 1818;9:357-363.
- Chiesa R., Melissano G., Marone E.M., Kahlberg A., Marrocco- 16. Trischitta M.M., Tshomba Y. Endovascular treatment of aortoesophageal and aortobronchial fistulae. J Vasc Surg. 2010;51(5):1195-1202. PMID: 20304579. https://doi. org/10.1016/j.jvs.2009.10.130
- Ong J., Swift C., Al-Naeeb Y. Aortogastric fistula: A rare glimpse 17. of catastrophe. Clin Gastroenterol Hepatol. 2020;18(7):e72. PMID: 30928456. https://doi.org/10.1016/j.cgh.2019.03.033
- Chong V.H., Telisinghe P.U., Chong C.F. Tuberculous aortoduodenal fistula: a rare cause of upper gastrointestinal bleeding. Singapore MedJ. 2010;51(5):e85-e88. PMID: 20593135.
- Ramsay A.C., Ramsay M.P., Meekins P.E. Aortoenteric fistula in a 25-year-old man. J Emerg Med. 2013;45(4):533-536. PMID: 23777774. https://doi.Org/10.1016/i.iemermed.2013.04.019
- Ishimine T., Tengan T., Yasumoto H., Nakasu A., Mototake H., Miura Y., Kawasaki K., Kato T. Primary aortoduodenal fistula: A case report and review of literature. Int J Surg Case Rep. 2018;50:80-83. PMID: 30086478; PMCID: PMC6085234. https://doi.org/10.1016/Uiscr.2018.07.019
- Reich J., Li R., Hartigan A. Massive bleeding from an odd location. Gastroenterology. 2016;150(7):e11-e12. PMID: 27143593. https://doi.org/10.1053/i.gastro.2016.01.041
- Tsuneki T., Yuasa Y., Fukuta M., Maki H., Matsuo Y., Mori O., Eto Sh., Fujiwara S., Tomibayashi A., Otani T. Secondary aorto-duodenal fistula successfully treated with a novel surgical method: A case report. Int J Surg Case Rep. 2020;72:17-21. PMID: 32506022; PMCID: PMC7276383. https://doi. org/10.1016/j.ijscr.2020.05.041
- Абдулгасанов Р.А., Гасымов Э.Г. Аортокишечные фистулы: причины, диагностика, лечение, профилактика. Анналы хирургии. 2017;22(3):137-142. [Abdulgasanov R.A., Gasymov E.G. Aortoenteric fistula: causes, diagnosis, treatment, prevention. Annaly Khirurgii = Russian Annals of Surgery. 2017;22(3):137-142. (In Russ.)] https://doi.org/10.18821/1560-9502-2017-22-3-137-142
- Makimoto Sh., Takami T., Shintani H., Kataoka N., Yamaguchi T., Tomita M., Shono Y., Kuroyanagi S. Cases of two patients with aortoduodenal fistula who underwent emergency operation. Int J Surg Case Rep. 2020;69:87-91. PMID: 32305028; PMCID: PMC7163285. https://doi.org/10.1016/Ujscr.2020.03.036
- Nachmias B., Bloom A.I., Gural A. Diagnostic and management difficulty of bleeding aorto-duodenal fistula associated with Hodgkin's lymphoma. Diagnostics (Basel). 2021;11(3):389. PMID: 33668895; PMCID: PMC7996524. https://doi. org/10.3390/diagnostics11030389
- Shen J.-Y., Zhang H.-W., Fan K.-J., Liao H., Zhang E.-Y., Hu J. Aortoesophageal fistula and arch pseudoaneurysm after removing of a swallowed chicken bone: a case report of one-stage hybrid treatment. BMC Surg. 2018;18(1):3. PMID: 29325526; PMCID: PMC5765606. https://doi.org/10.1186/ s12893-018-0335-1
- Khalaf Ch., Houlind K.C. Case report: Primary aortosigmoid fistula - A rare cause of lower gastrointestinal bleeding. Int J Surg Case Rep. 2017;40:20-22. PMID: 28918295; PMCID: PMC5602515. https://doi.org/10.1016/Ujscr.2017.08.063
- Dimech A.P., Sammut M., Cortis K., Petrovic N. Unusual site for primary arterio-enteric fistula resulting in massive upper gastrointestinal bleeding - A case report on presentation and management. Int J Surg Case Rep. 2018;49:8-13. PMID: 29920412; PMCID: PMC6005793. https://doi.org/10.1016/j. ijscr.2018.05.023
- Nguyen C.L., Lindsay A., McLachlan R., Islam S., Qasabian R., Loa J. Aortoduodenal fistula 2 years after elective endovascular repair of an abdominal aortic aneurysm. ANZ J Surg. 2020;90(11):2374-2376. PMID: 32077559. https://doi. org/10.1111/ans.15773
- Kahlberg A., Rinaldi E., Piffaretti G., Speziale F., Trimarchi S., Bonardelli S., Melissano G., Chiesa R., MAEFISTO collaborators. Results from the Multicenter Study on Aortoenteric Fistulization After Stent Grafting of the Abdominal Aorta (MAEFISTO). J Vasc Surg. 2016;64(2):313-320.e1. PMID: 27289529. https://doi.org/10.1016/Uvs.2016.04.008
- Zaki M., TawfickW., Alawy M., ElKassaby M., Hynes N., Sultan S. 29. Secondary aortoduodenal fistula followin9 endovascular repair of inflammatory abdominal aortic aneurysm due to Streptococcus anqinosus infection: a case report and literature review. Int J Surg Case Rep. 2014;5(10):710-713. PMID: 25201477; PMCID: PMC4189064. https://doi.orq/10.1016A ijscr.2013.10.016
- Куликовский В.Ф., Шевцов Ю.Н., Карпачев А.А., Солошенко А.В., Ярош А.Л., Лопин А.В., Мухачев Д.Л., Касьянов Б.В. Желудочно-кишечное кровотечение, вызванное ложной симптомной аневризмой инфра-ренального отдела брюшной аорты. Хирургия. Журнал им. НИ. Пирогова. 2017;(3):102-103. [Kulikovsky V.F., Shevtsov Yu.N., Karpachev A.A., Soloshenko A.V., Yarosh A.L., Lopin A.V., Mukhachev D.L., Kasyanov B.V. Gastrointestinal bleedinq caused by false symptomatic infrarenal abdominal aortic aneurysm. Pirogov Russian Journal of Surgery. 2017;(3):102-103. (In Russ.)] https://doi.orq/10.17116/hirurqia20173102-103
- Тимен Л.Я. Клинико-эндоскопические наблюдения первичной аорто-эзофагеальной фистулы. Описание двух случаев. Русский медицинский журнал. Медицинское обозрение. 2015;23(17):1060-1062. [Timen L.Ya. Clinical and endoscopic observations of the primary aortoesophaqeal fistula. Description of two cases. Russian Medical Journal. 2015;23(17):1060-1062. (In Russ.)]
- Berqqvist D., Bjorkman H., Bolin T., Dalman P., Elfstrom J., Forsberq O., Johansen L., Karacaqil S., Karlqvist P.A., Lanne T., Plate G., Ribbe E., Spanqen L., Stenbaek J., Thomsen M., Wiklund B., Anqquist K.A. Secondary aortoenteric fistulae -chanqes from 1973 to 1993. Eur J Vasc Endovasc Surg. 1996;11(4):425-428. PMID: 8846176. https://doi.orq/10.1016/ s1078-5884(96)80175-4
- Ichita Ch., Sasaki A., Sumida Ch., Kimura K., Nishino T., Tasaki J., Masuda S., Koizumi K., Kawachi J., Kako M. Clinical and endoscopic features of aorto-duodenal fistula resultinq in its definitive diaqnosis: an observational study. BMC Gastroenterol. 2021;21(1):45. PMID: 33526013; PMCID: PMC7851914. https://doi.orq/10.1186/s12876-021-01616-9
- Sonq Y., Liu Q., Shen H., Jia X., Zhanq H., Qiao L. Diaqnosis and manaqement of primary aortoenteric fistulas - experience learned from eiqhteen patients. Surgery. 2008;143(1):43-50. PMID: 18154932. https://doi.orq/10.1016/j.surq.2007.06.036
- Shahrokh Sh., Zali M.R. An unusual cause of upper qastrointestinal bleedinq. Gastroenterol Hepatol Bed Bench. 2014;7(3):183-185. PMID: 25120901; PMCID: PMC4129571.
- Gurakar M., Shah P., Kaspar M. Contained aortic rupture with hematoma and qastrointestinal bleedinq. Clin Gastroenterol Hepatol. 2020;18(2):e19-e20. PMID: 31941598. https://doi. orq/10.1016/j.cqh.2018.10.039
- Nazarewicz G.V., Jain R. Upper qastrointestinal bleedinq caused by aortoesophaqeal fistula. Clin Gastroenterol Hepatol. 2016;14(12):A22. PMID: 27546580. https://doi.orq/10.1016/j. cqh.2016.08.013
- Bala M., Sosna J., Appelbaum L., Israeli E., Rivkind A.-I. Eniqma of primary aortoduodenal fistula. World J Gastroenterol. 2009;15(25):3191 -3193. PMID: 19575502; PMCID: PMC2705745. https://doi.orq/10.3748/wjq.15.3191
- Tomouk T., Kusumawidjaja D., Libzo N. A rare cause of melena with an unusual findinq on qastroscopy. Clin Gastroenterol Hepatol. 2016;14(1):e3-e4. PMID: 26001335. https://doi. orq/10.1016/j.cqh.2015.05.024
- Vu Q.D.M., Menias C.O.,BhallaS., Peterson C.,Wanq L.L.,BalfeD.M. Aortoenteric fistulas: CT features and potential mimics. Radiographics. 2009;29(1):197-209. PMID: 19168845. https:// doi.orq/10.1148/rq.291075185
- Luo J., Tanq W., Wanq M., Xiao Y., Tan M., Jianq Ch. Case series of aortoenteric fistulas: a rare cause of qastrointestinal bleedinq. BMC Gastroenterol. 2021 ;21 (1 ):49. PMID: 33530944; PMCID: PMC7856786. https://doi.orq/10.1186/s12876-021-01629-4
- Белов Д.В., Гарбузенко Д.В., Лукин О.П., Ануфриева С.С. Синдром Хейда, как редкая причина желудочно-кишечных кровотечений у больных с аортальным стенозом. Кардио-васкулярная терапия и профилактика. 2021;20(1):2503. [Belov D.V., Garbuzenko D.V., Lukin O.P., Anufrieva S.S. Heyde's syndrome as a rare cause of qastrointestinal bleedinq in aortic stenosis patients. Cardiovascular Therapy and Prevention. 2021;20(1):2503. (In Russ.)] https://doi.orq/10.15829/1728-8800-2021-2503
- Saers S.J.F., Scheltinqa M.R.M. Primary aortoenteric fistula. Br J Surg. 2005;92(2):143-152. PMID: 15685700. https://doi. orq/10.1002/bjs.4928
- Панасюк А.И., Кыштымов С.А., Иноземцев Е.О., Григорьев Е.Г. Вторичный аорто-дуоденальный свищ. Рецидивирующее кровотечение. Трудности топической диагностики и лечебно-тактические ошибки (случай из клинической практики). Актуальные проблемы медицины. 2020;43(1):146-154. [Panasyuk A.I., Kyshtymov S.A., Inozemcev E.O., Griqoryev E.G. Secondary aorto-duodenal fistula. Recurrent bleedinq. Difficulties of topical diaqnosis and tactical errors (case from clinical practice). Challenges in Modern Medicine. 2020;43(1):146-154. (I n Russ.)] https://doi.orq/10.18413/2687-0940-2020-43-1-146-154
- Kim B.Y., Kim K.B. Primary aortoduodenal fistula causes massive melena: A case report. Korean J Gastroenterol. 2021;77(3):132-135. PMID: 33758109. https://doi.orq/10.4166/kjq.2021.006
- Joshi G., Oqbudinkpa Ch., Stecher J., Khoury R.E., Resnick D.J., Jacobs Ch.E., White J.V., Schwartz L.B. Treatment of post-evar aortoduodenal fistula without endoqraft excision. Vasc Endovascular Surg. 2021;55(3):282-285. PMID: 33047669. https://doi.orq/10.1177/1538574420966455
- Kakkos S.K., Bicknell C.D., Tsolakis I.A., Berqqvist D. Editor's choice - Manaqement of secondary aorto-enteric and other abdominal arterio-enteric fistulas: A review and pooled data analysis. Eur J Vasc Endovasc Surg. 2016;52(6):770-786. PMID: 27838156. https://doi.orq/10.1016/j.ejvs.2016.09.014
- Spanos K., Kouvelos G., Karathanos C., Matsaqkas M., Giannoukas A.D. Current status of endovascular treatment of aortoenteric fistula. Semin Vasc Surg. 2017;30(2-3):80-84. PMID: 29248124. https://doi.orq/10.1053/j.semvascsurq.2017.10.004
- Ranasinqhe W., Loa J., Allaf N., Lewis K., Sebastian M.G. Primary aortoenteric fistulae: the challenqes in diaqnosis and review of treatment. Ann Vasc Surg. 2011;25(3):386.e1-386.e5. PMID: 21269801. https://doi.orq/10.1016/j.avsq.2010.09.021
- Rodriques dos Santos C., Casaca R., Mendes de Almeida J.C., Mendes-Pedro L. Enteric repair in aortoduodenal fistulas: a forqotten but often lethal player. Ann Vasc Surg. 2014;28(3):756-762. PMID: 24456836. https://doi. orq/10.1016/j.avsq.2013.09.004
- Alzobydi A.H., Guraya Sh.S. Primary aortoduodenal fistula: a case report. World J Gastroenterol. 2013;19(3):415-417. PMID: 23372367; PMCID: PMC3554829. https://doi.orq/10.3748/wjq. v19.i3.415


