Апелин - пептид, повышающий устойчивость органов и клеток к ишемии и реперфузии. Молекулярный механизм (обзор)
Автор: Попов С. B., Нарыжная Н. В., Сиротина М. А., Маслов Л. Н., Мухомедзянов А. В., Курбатов Б. К., Горбунов А. С., Килин М., Крылатов А. В., Подоксенов Ю. К., Азев В. Н., Суфианова Г. З., Хлесткина М. С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Ишемические-реперфузионные повреждения органов лежат в основе таких распространенных патологий, как ишемический инсульт и инфаркт миокарда и являются причиной смертности и инвалидизации населения. Кроме того, ишемическое повреждение легких наблюдается при тромбоэмболии легочной артерии. Успехи трансплантологии, как и широкое применение аортокоронарного шунтирования, ставят проблему ишемии и реперфузии органов при этих манипуляциях. Прогресс, достигнутый в прошедшие три десятилетия в отношении лечения инсульта и острого инфаркта миокарда (ОИМ), в последние годы замедлился. Поскольку пациенты с инсультом, ОИМ, ишемическим повреждением почки или легкого поступают в стационар после развития патологии, воздействовать на его формирование уже невозможно. Однако возможно повлиять на реперфузионное повреждение органов. Значительный прогресс в повышении эффективности трансплантации почек, в лечении инсульта, эмболии легочных артерий и ОИМ может быть достигнут за счет разработки новых препаратов, способных с высокой эффективностью предотвращать реперфузионное повреждение органов. Прототипами препаратов подобного действия могут стать синтетические аналоги апелина с длительным периодом полувыведения. Было обнаружено, что апелины могут повышать толерантность сердца, головного мозга, почек и легких к ишемии/реперфузии (И/Р). Апелины ингибируют апоптоз и активируют аутофагию кардиомиоцитов. Нейропротекторное, кардиопротекторное, ренопротекторное и пульмонопротекторное действие апелинов реализуется через внутриклеточный сигналлинг, включающий протеинкиназы, митохондриальную пору переменной проницаемости и АТФ-чувствительные К+-каналы. Устойчивые к воздействию ферментов аналоги апелина являются перспективными пептидами для лечения ОИМ, инсульта и И/Р повреждений легких и почек.
Апелины, ишемия/реперфузия, головной мозг, сердце, почки, легкие
Короткий адрес: https://sciup.org/149144439
IDR: 149144439 | УДК: 616-005.4:577.112 | DOI: 10.29001/2073-8552-2023-38-4-29-39
Текст обзорной статьи Апелин - пептид, повышающий устойчивость органов и клеток к ишемии и реперфузии. Молекулярный механизм (обзор)
the work was supported by the Russian Science Foundation, Grant No. 22-15-00048. The section “Synthetic analogues of apelins” is supported by the state assignment 122020300042-4. Popov S.V., Naryzhnaya N.V., Sirotina M.A., Maslov L.N., Mukhomedzyanov A.V., Kurbatov B.K., Gorbunov A.S., Kilin M, Krylatov A.V., Podeksenov Y.K., Azev V.N., Sufianova G.Z., Khlestkina M.S. Apelin is a peptide increasing tolerance of organs and cells to ischemia and reperfusion. The molecular mechanism (the review). The Siberian Journal of Clinical and Experimental Medicine. 2023;38(4):29–39.
Заболевания, в основе патогенеза которых лежит ишемическое-реперфузионное (И/Р) повреждение органов, являются социально значимыми и составляют значимую долю в структуре смертности и инвалидизации населения. Так, госпитальная летальность у больных инсультом составляет около 7%; госпитальная летальность у пациентов с инфарктом миокарда с подъемом сегмента ST (ИМпST), несмотря на высокую эффективность чрескожного коронарного вмешательства (ЧКВ), составляет 5–6%; существенного изменения этих показателей в последние годы не наблюдается [1, 2]. Инфаркт легкого наблюдается у 29% больных с тромбоэмболией легочной артерии, госпитальная летальность у этих больных составляет 8% [3]. И/Р повреждение почек часто наблюдается после трансплантации почки, при этом летальность у пациентов с этим осложнением может достигать 24% [4]. Эти данные красноречиво говорят о необходимости разработки новых фармакологических средств для защиты органов от реперфузионного повреждения.
Прототипом для создания новых лекарственных препаратов для лечения инсульта, острого инфаркта миокарда (ОИМ), инфаркта легкого и И/Р повреждения почек могут стать апелины – биологически активные пептиды, обладающие протекторными свойствами при И/Р миокарда, головного мозга, почек, легких, кишечника. В представленной статье проанализированы современные данные о кардиопротекторном, нейропротекторном, ре-нопротекторном, пульмонопротекторном действии апе-линов, механизмах этих эффектов, а также перспективы создания синтетических аналогов апелинов для защиты органов от И/Р повреждений.
Часть 1. Открытие апелинового рецептора и апелинов
В 1993 г. был обнаружен и клонирован ген, названный APJ, кодирующий неизвестный рецептор, связанный с G-белком (GPCR) [5]. Оказалось, что APJ рецептор близок по структуре к рецептору ангиотензина, однако он не взаимодействует с ангиотензином II [5]. Транскрипты APJ были выявлены во многих отделах головного мозга. В 1998 г. был обнаружен пептидный агонист рецептора APJ [6]. Этот пептид был назван апелином [6]. Установлено, что апелин образуется из предшественника препроапелина, который состоит из 77 аминокислотных остатков [6]. В последующих работах было обнаружено, что из препроапелина образуется ряд биологически активных пептидов, получивших общее название апелины: апелин-55, апелин-36, апелин-17 и апелин-13 и апелин-12 [7]. Из этих пептидов наибольшей биологической активностью обладает апелин-13.
В 2013 г. был обнаружен ген ELABELA , кодирующий пептид другого эндогенного агониста апелинового рецептора – elabela (apela, апела) состоящий их 32 аминокислот [8]. Апела имеет высокое сродство к апелиновому рецептору (Ki = 38,2 нМ), а ее мРНК была выявлена в сердце крысы [9].
Апелины широко распространены в органах и тканях человека и животных. Максимальное содержание мРНК апелина-13 установлено в легких и молочных железах, вероятно, из-за того, что ткань молочной железы содержит большое количество адипоцитов, синтезирующих апелин [10]. Высокое содержание апелина наблюдается в яичниках, спинном и головном мозге, жировых депо. Матричная РНК этого пептида выявлена в почках и сердце, но ее количество в этих органах в 50 раз ниже, чем в молочных железах или легких [10]. Следует отметить, что уровень апелина-13 в плазме крови значительно ниже, чем в органах; апелины, вероятно, синтезируются in situ , а не доставляются кровью в органы.
Показано, что апелины участвуют в регуляции сердечно-сосудистых и цереброваскулярных, желудочно-кишечных и иммунных функций, а также в росте и развитии костей. Апелины иногда называют адипокинами, хотя апелин-13 в больших количествах синтезируется в легких [10]. Пироглутамильная производная апелина-13 Pyr1-apelin-13, имеющая высокое сродство к апелиновому рецептору, стимулирует потемнение белых адипоцитов и бурый адипогенез [11]. Следует отметить, что физиологическая роль апелинов в организме изучена недостаточно, исследования в этом направлении продолжаются.
Часть 2. Ренопротекторное действие апелинов
Иммуногистохимическое исследование выявило экспрессию апелина и апелинового рецептора в почках крыс
-
[12] . Апелин был обнаружен во всех почечных клетках, в то время как экспрессия апелинового рецептора наблюдалась в дистальных канальцах, проксимальных извитых канальцах и петле Генле, а в юкстагломерулярном аппарате этот рецептор не был обнаружен [12]. Апелин может проявлять ренопротекторные свойства: апелин-13 дозе 5 мкг/кг, который вводили дважды в сутки в течение 3 дней, предотвращал реперфузионный некроз и апоптоз почечной ткани при односторонней 30-минутной окклюзии почечной артерии и последующей реперфузии [13].
Кроме того, апелин-13 улучшал восстановление функции почек, а также снижал экспрессию провоспали-тельных цитокинов: молекулы межклеточной адгезии-1 (ICAM-1) и моноцитарного хемотаксического белка-1 (MCP-1) [13]. Можно предположить, что ренопротектор-ный эффект апелина-13 является результатом противовоспалительного действия этого пептида. Это предположение было подтверждено в эксперименте на модели 45-минутной ишемии и 3-часовой реперфузии почки крысы [14]. Предварительное введение апелина-13 (100 мкг/ кг, внутрибрюшинно) снижало уровни провоспалительных цитокинов: сывороточного фактора некроза опухоли-α (ФНО-α), интерлейкина-1β (ИЛ-1β) и ИЛ-6, повышало активность супероксиддисмутазы (СОД) в ткани почек, что сопровождалось снижением концентрации мочевины и креатинина в сыворотке крови [14]. F. Gholampour и соавт. получили косвенные доказательства того, что почечный апелин-13 участвует в ренопротекторном эффекте дистантного прекондиционирования – было выявлено усиление экспрессии гена апелина при этом воздействии [15].
В исследовании X. Zhang и соавт. был выявлен неф-ропротекторный эффект введения лентивирусного вектора апелина у крыс со стрептозотоцин-индуцированным диабетом при И/Р почки [16]. Введение лентивирусного вектора способствовало снижению концентрации в сыворотке крови крыс креатинина, TNF-α, IL-1β и IL-6, мочевины, а также привело к ограничению продукции активных форм кислорода (АФК) в почечной ткани, уменьшению выраженности гистологических повреждений почечных клеток и апоптоза [16].
Обнаружен нефропротекторный эффект аналогов элабела при 45-минутной окклюзии почечной артерии: применение этих пептидов предотвращало индуцированное гипоксией/реоксигенацией повреждение эпителиальных клеток почечных канальцев HK-2 и уменьшало продукцию АФК в этих клетках [17].
Приведенные данные указывают на то, что апелин-13 и элабела повышают толерантность почек к И/Р. Возможно, ренопротекторный эффект апелина-13 опосредован подавлением воспаления (рис. 1).
Часть 3. Пульмонопротекторное действие апелинов
Как упоминалось выше, экспрессия апелинов в ткани легкого высока. В легочной ткани крыс обнаружены пре-проапелин, апелин-12, апелин-13, апелин-36 и апелино-вый рецептор [18]. Внутривенное введение апелина-13 в дозе 1 мкг/кг при остром повреждении легких уменьшало выраженность повреждений легочной ткани, снижало концентрацию лактата в сыворотке крови и содержание малонового диальдегида (МДА) в легочной ткани; снижало TNF-α, IL-1β в бронхоальвеолярном лаваже [19]. Следовательно, апелин-13 может повышать толерантность легких к И/Р (см. рис. 1).
8»
ПОЧКИ ф толерантности к IR ф активности SOD в ткани 4 апоптоза и некроза
ЛЕГКИЕ ф толерантности к IR
4 повреждения легочной ткани
A
4 уровней TNF-a, IL-10, IL-6
4 экспрессии ICAM-1 и МСР-1
4 концентрации мочевины и креатинина в сыворотке крови
4 продукции ROS в ткани почек
4- концентрации лактата в сыворотке крови
4 содержания MDA в ткани легких
4 TNF-a, 11-10 в бронхоальвеолярном лаваже
СЕРДЦЕ
АПЕЛИНЫ
ф толерантности к IR ф уровня глутатиона в миокарде
4 апоптоза и некроза ф аутофагии
-
4 концентрации лактата в сыворотке крови
-
4 концентрации лактата в ткани миокарда
4 выброса LDH
4 уровней TNF-a, IL-10, IL-6
4 продукции ROS, содержания MDA и нитротирозина в ткани миокарда
МОЗГ ф толерантности к IR
-
ф экспрессии VEGF
-
4 апоптоза
-
4 нейровоспаления
-
4 активности индуцибельной NO-синтазы
-
4 экспрессии ICAM-1 иТМЕ-аеткани мозга
-
4 продукции ROS и содержания малонового диальдегида в ткани мозга
Рис. 1. Защитные эффекты апелинов
Примечание: IR – ишемия/реперфузия, ICAM-1 – молекула межклеточной адгезии-1, IL-1β – интерлейкин-1β, IL-6 – интерлейкин-6, LDH – лактатдегидрогеназа, MCP-1 – моноцитарный хемотаксический белок-1, MDA – малоновый диальдегид, ROS – активные формы кислорода, SOD – суперок-сиддисмутаза, TNF-α – фактор некроза опухоли-α, VEGF – фактор роста эндотелия сосудов.
-
Fig. 1. Protective effects of apelins
Note: IR – ischemia/reperfusion, ICAM-1 intercellular adhesion molecule-1, IL-1β - interleukin-1β, IL-6 – interleukin-6; LDH – lactate dehydrogenase, MCP-1– monocyte chemotactic protein-1, MDA – malondialdehyde, ROS – reactive oxygen species, SOD – superoxide dismutase, TNF-α – tumor necrosis factor-α, VEGF – vascular endothelial growth factor.
Часть 4. Нейропротективное действие апелинов
О нейропротекторном действии апелина свидетельствуют многочисленные исследования, большинство из которых проведено на модели окклюзии-реперфузии средней мозговой артерии (СМА) при интерцеребровен-трикулярном введении апелина. Обнаружено, что интра-церебровентрикулярное введение апелина-13 (25, 50 и 100 мкг) крысам или мышам с окклюзией СМА (60 мин) и реперфузией (24 ч) приводило к уменьшению объема инфаркта мозга, уменьшению его отека и неврологического дефицита [20]. Выявлено, что нейропротекторный эффект апелина-13 сопровождается снижением окислительного стресса в головном мозге, уменьшением экспрессии TNF-α, мРНК IL-1β и мРНК ICAM-1, что свидетельствует о взаимосвязи нейропротекторного эффекта апелина-13 с подавлением воспаления [21] (см. рис. 1).
Обнаружено, что уменьшение размера мозгового инфаркта при интрацеребровентрикулярном введении апелина-13 (10 мкг/кг) сопровождается антиапоптотиче-ским эффектом апелина-13: уменьшением количества TUNEL-позитивных клеток, повышением Bcl-2 и снижением каспазы-3 в ткани головного мозга у крыс и мышей с окклюзией СМА [22].
Сходные нейропротекторные, антиапоптотические эффекты при окклюзии/реперфузии СМА обнаружены и для апелина-12 [23].
Следует отметить, что апелин-13 оказывает нейро-протекторный эффект у крыс не только при профилактическом введении, но и при введении после начала ишемии перед моделированием реперфузии [21, 24].
Показано, что нейропротекторный эффект интраце-ребровентрикулярного введения апелина-13 сопровождается увеличением экспрессии аквапорина-4 в ткани мозга и уменьшением реперфузионного повреждения гематоэнцефалического барьера (ГЭБ) [24]. Эти эффекты были менее выражены у мышей с нокаутом по аквапори-ну-4. Авторами был сделан вывод о том, что аквапорин-4 и поддержание целостности ГЭБ играют определенную роль в нейропротекторных эффектах апелина-13 [24]. Помимо этого авторы предположили, что определенный вклад в этот эффект вносят увеличение экспрессии фактора роста эндотелия сосудов (VEGF) и снижение активности iNO-синтазы под влиянием апелина-13.
В исследовании на культуре эндотелиоцитов линии bEnd-3 показано, что апелин-13 в концентрации 4 нМ повышает выживаемость клеток при кислородно-глюкозной депривации и реоксигенации [25]. При этом детектировали возрастание экспрессии маркеров аутофагии LC3II и Beclin-1 и снижение фосфорилирования киназы-ингиби-тора аутофагии mTOR (mammalian target of rapamycin). Эти результаты позволяют предположить, что нейропро-текторный эффект апелина-13 может быть опосредован через активацию аутофагии эндотелиоцитов мозга, которые являются важным компонентом ГЭБ.
Таким образом, интрацеребровентрикулярное введение апелина-13 при ишемии и реперфузии головного мозга снижает его И/Р поражение, ослабляет неврологический дефицит, способствует ингибированию апоптоза, нейровоспалениея и окислительного стресса. Применение апелина-13 повышает выживаемость эндотелиальных клеток микрососудов головного мозга в условиях аноксии/ реоксигенации посредством стимуляции аутофагии и ингибирования mTOR (см. рис. 1). Эффективность периферического введения апелина-13 для защиты головного мозга при ишемии остается предметом дискуссии.
Часть 5. Кардиопротекторное действие апелинов Апелины и рецептор апелина у крысы и человека
Апелин-12 был обнаружен в миокарде левого желудочка, гладкомышечных и эндотелиальных клетках коронарных артерий человека [13]. Высокое содержание апе-лина было зарегистрировано в периваскулярных тучных клетках и эндотелиальных клетках в миокарде крысы, но не было выявлено в фибробластах и кардиомиоцитах желудочков и предсердий крыс [12]. Мессенджер РНК Apela была обнаружена в сердце крысы, и ее содержание оказалось 2 раза выше уровня мРНК апелина [9].
Апелиновый рецептор представлен в миокарде левого и правого желудочков крыс, а также в ткани предсердий [12]; кардиомиоцитах и клетках гладкой мускулатуры сосудов, в эндотелиальных клетках, эпикардиальных коронарных артериях, но не обнаружен в фибробластах и тучных клетках у крыс [26].
Клинические исследования показали, что апелин и элабела повышены у пациентов с ИМ: по данным Y. Dönmez и соавт., уровень elabela в плазме крови у пациентов с ИМпST составляет 11,3 против 2,2 нг/мл у здоровых добровольцев [27]. Вместе с тем выявлено, что низкие уровни апелина в сыворотке (<0,54 нг/мл) связаны с более высоким уровнем липопротеинов-холестерина низкой плотности в сыворотке, пиковыми уровнями фракции креатинкиназы MB (CK-MB) и тропонина-I (TNI), количеством инфаркт-связанных артерий и потребностью в инотропной поддержке. Частота MACE была значительно выше в группе с низким содержанием апелина, чем в группе с высоким содержанием апелина. Многомерный анализ пропорциональных рисков Кокса, скорректированный с учетом клинических и ангиографических характеристик, показал, что низкий уровень апелина в сыворотке крови может являться предиктором частоты MACE. Однако в другом исследовании сообщается, что, напротив, высокая концентрация в плазме крови апелинов (апелин-12, апелин-13 и апелин-36) у пациентов с ИМпST ( n = 260) при поступлении связана с более высоким риском смертности и сердечной недостаточности в течение 6 мес. [28].
Влияние апелинов на сократительную функцию сердца
В исследовании на модели изолированного сердца крысы обнаружен дозозависимый положительный инотропный эффект апелина-16 в диапазоне концентраций от 0,01 до 1 нмоль/л (EC50 составляет 33 пмоль/л) [29]. Этот эффект оказался зависимым от активации фосфолипазы C (ФЛC) и протеинкиназы С (ПКС); блокатор изоформы-1 Na+-H+-обменника (sodium/hydrogen exchanger, NHE) зонипорид, и блокатор Na+-Ca2+-об-менника (sodium/calcium exchanger, NCX) KB-R7943 ослабляли, но не устраняли положительный инотропный эффект апелина-16. При этом апелин-16 не влиял на потенциал-зависимые токи К+ или ток Са2+ L-типа в изолированных кардиомиоцитах желудочков крысы [29]. Следовательно, инотропный эффект апелина-16 может реализоваться через ФЛС, ПКC, NHE и NCX.
Было выявлено, что положительный инотропный эффект апелина-16 связан со стимуляцией Са2+-АТФа- зы саркоплазматического ретикулума (СР, sarcoplasmic reticulum Ca2+-ATPase, SERCA), увеличением выброса [Ca2+]i и снижением его содержания в СР в электрически стимулированных изолированных кардиомиоцитах крыс [29]. При этом ингибитор ПКС хелеритрин ослаблял положительный инотропный эффект апелина-16, однако не влиял на амплитуду [Ca2+]i [29]. Можно предполагать, что ПKC и SERCA независимо участвуют в индуцированном апелином-16 положительном инотропном эффекте апелина-16 [29]. Увеличение активности SERCA, как и увеличение плотности рианодиновых рецепторов в кардиомиоцитах под влиянием апелина, было обнаружено в более поздних исследованиях [30].
В исследовании на изолированном сердце крысы выявлено, что apela, также как и апелин, проявляет дозозависимый положительный инотропный эффект (начиная с 1 нмоль/л) и вызывает вазодилатацию коронарных артерий (начиная с 3 нмоль/л) при участии ERK1/2 киназы [9].
У крыс с реноваскулярной гипертензией апелин-13 (40 и 60 мкг/кг внутривенно) вызывал положительный инотропный и гипотензивный эффекты [31]. Обнаружено, что этот эффект опосредован через активацию Gi/o-бел-ков и ПКС. Кроме того, инотропный эффект апелина-16 не проявлялся в присутствии антагониста κ-опиоидных рецепторов (κ-OР) нор-биналторфимина. Исследователи предположили, что существует гетеродимеризация между апелиновым рецептором и κ-опиоидным рецептором [31].
Таким образом, апелины вызывают положительный инотропный эффект in vitro и in vivo . Этот эффект опосредован белками ФЛC, ПKC, Gi/o, ERK1/2, NHE, NCX, SERCA и, возможно, взаимодействием с κ-OР. Однако исследования с антагонистом апелиновых рецепторов не были проведены, поэтому не известно, является ли этот эффект рецептор-зависимым.
Кардиопротекторный эффект апелинов при ишемии и реперфузии сердца
Впервые о кардиопротекторном действии апелинов сообщили в 2007 г. J.C. Simpkin и соавт. В экспериментах in vitro и на модели коронароокклюзии-реперфузии у крыс и мышей обнаружили уменьшение размера инфаркта (РИ) при применении апелина-13 и апелина-36 [32].
Эти данные были в дальнейшем подтверждены на модели 35-минутной глобальной ишемии и реперфузии изолированного перфузируемого сердца крысы: обнаружено, что добавление апелина-12 в перфузионный раствор перед ишемией или в начале реперфузии улучшает восстановление сократительной способности миокарда; максимальный эффект был зафиксирован при концентрации апелина-12 140 мкмоль/л [33]. Апелин-12 был более эффективен, если его применяли до ишемии. Применение апелина-12 (140 мкмоль/л) перед ишемией способствовало повышению уровня АТФ в миокарде на 58%. Этот пептид снижал содержание лактата в ткани миокарда на 20%, уменьшал выброс ЛДГ во время реперфузии, следовательно, кардиопротекторный эффект апелина-12 может быть связан с улучшением энергетического обмена в сердце [33].
В опытах in vivo апелин-12 в дозе 0,5 мг/кг показал ин-фаркт-лимитирующую эффективность при 40-минутной коронароокклюзии и реперфузии у крыс [34]. При этом РИ снижался на 34% [34, 35]. Внутрибрюшинное введение апе- лина-13 (15 мкг/кг/сут) в течение 5 дней приводило к снижению РИ после коронароокклюзии и реперфузии у крыс [36].
На модели изолированного сердца крысы при глобальной И/Р в условиях кардиоплегии при добавлении в кардиоплегический раствор до ишемии или после ишемии апелина-12 и его аналогов (AI или АII) в конечной концентрации 70, 140 и 140 мкмоль/л наблюдали улучшение восстановления сократимости сердца при реперфузии и снижение выхода лактатдегидрогеназы, которое сопровождалось сохранением энергетического статуса митохондрий – уровня АТФ, фосфокреатинина [37].
Проведен анализ кардиопротекторных свойств апе-лина-12 и его аналога Nα-MeArg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-ProPhe-OH (AI) на модели И/Р как in vivo , так и in vitro при реперфузии. Оба пептида (0,35 мкмоль/кг) ограничивали РИ in vivo ; улучшали восстановление сократимости миокарда in vitro при реперфузии [38].
Была обнаружена способность апелина предупреждать окислительный стресс в миокарде при ишемии [30, 39].
Выявлено, что инфаркт-лимитирующее действие апелина-13 при его введении внутривенно после коро-нароокклюзии за 15 мин до реперфузии сердца крыс сопровождается снижением выраженности апоптоза в миокарде, активности каспазы-3, уровня фосфорилированных N-концевых киназ c-Jun (p-JNK) и активированной каспазы-12 [40]. Сходный эффект обнаружен у elabela при внутривенном введении (700 мкг/кг) на модели коронароокклюзии и реперфузии in vivo [41]. При этом elabela повышала уровень АТФ и глутатиона (GSH) в сердце, снижала продукцию АФК и содержание МДА в миокарде [41].
Показано, что апелин-13 помимо ингибирования апо-тоза способен активировать аутофагию в клетках линий H9c2 и HL-1 [42], этот эффект апелина-13 опосредован активацией AMP-активируемой протеинкиназы (AMP-activated protein kinase, AMPK) и ингибированием mTOR [42]. Интрамиокардиальное введение аденовируса, кодирующего апелин, может стимулировать аутофагию в ткани миокарда у мышей со стрептозотоцин-индуциро-ванным диабетом [43].
Выявлено, что необратимая окклюзия коронарных артерий снижает уровень апелина и содержание апе-линовых рецепторов в миокарде через 7 дней после коронароокклюзии у мышей [44]. При этом нокаут гена, кодирующего апелин, снижал выживаемость мышей, стимулировал апоптоз в ткани миокарда после окклюзии коронарных артерий, способствовал инвазии нейтрофилов и макрофагов в сердце после коронароокклюзии, повышал уровень TNF-α, IL-1β, IL-6 в миокарде и усугублял сократительную дисфункцию после коронароокклюзии [44].
Представленные данные свидетельствуют о способности апелинов повышать толерантность сердца к И/Р, предупреждать окислительный стресс, некроз и апоптоз кардиомиоцитов (см рис. 1).
Часть 6. Сигнальный механизм защитного действия апелинов
В настоящий момент предполагают, что эффекты апелинов реализуется посредством их взаимодействия с апелиновым рецептором, который связан с G-белками (G-protein coupling receptor). Так, показано, что апелин-13 и апелин-36 стимулируют рецепторы, связанные с белками Gi1 и Gi2, активация которых приводит к ингибирова- нию аденилатциклазы и фосфорилированию ERK1/2 киназы или Akt-киназы [45, 46]; апелин может активировать белки Gs, Gq11, Gi/o Gi и G12/13 [47]. Доказано, что белки Gq и Gi вовлечены в нейропротекторный эффект апели-на-13 у крыс при окклюзии-реперфузии СМА [20] (рис. 2).
Показано, что интрацеребровентрикулярное введение апелина-13 крысам повышает уровень p-ERK1/2 в нервной ткани [48], а ингибитор этой киназы устраняют нейропротекторный эффект апелина-13 при И/Р головного мозга [24]. Подобные результаты получены в отношении роли активации фосфоинозитид-3-киназы (PI3-ки-назы) [24], p-AMPK, GSK-3β [22], ингибирования киназ p-JNK и p-p38 [23] в нейропротекторном действии апели-на (см. рис. 2).
Было высказано предположение, что нейропротектор-ный эффект апелина-13 может быть опосредован ингибированием окислительного стресса, поскольку интраце-ребровентрикулярное введение этого пептида повышало уровень восстановленного глутатиона в ткани головного мозга и повышало активность глутатионпероксидазы [22]. Показано, что этот эффект реализуется за счет повышения апелином-13 экспрессии Nrf2 (nuclear factor erythroid 2-related factor 2) – фактора транскрипции, который стимулирует экспрессию ферментов, участвующих в защите от окислительного стресса [22].
Киназы, участвующие в регуляции толерантности сердца к И/Р, по-видимому, принимают участие в кар-диопротекторном действии апелинов. При реперфузии изолированного сердца мыши апелин-13 в концентрации 1 мкмоль/л уменьшал РИ, увеличивал уровни p-PI3-ки-назы и p-Akt-киназы [32]. При этом ингибитор PI3-киназы LY294002 и ингибитор ERK1/2 U0126 устраняли кардио-протекторный эффект апелина-13 [32]. В другом исследовании апелин-13 использовали в конечной концентрации 0,5 мкмоль/л при реперфузии. Апелин-13 ограничивал РИ на 50% и улучшал восстановление сократимости при реперфузии [49].
Сообщают, что кардиопротекторный эффект апе-лина-13 на модели изолированного перфузируемого сердца крысы не проявлялся в присутствии ингибитора матриксной металлопротеиназы (ММП) GM6001, ингибитора PI3-киназы LY294002, ингибитора тирозинкина-зы AG1478, рецептора эпидермального фактора роста (Epidermal growth factor receptor, EGFR) PP2, ингибитора киназы Src, блокатора митохондриального КАТФ-канала (митоКАТФ-канал) 5-HD, и ингибитора гуанилатциклазы (ГЦ) ODQ [49]. Эти данные показывают, что митоКАТФ-ка-нал, МПП, Src-киназа, EGFR и гуанилилциклаза участвуют в кардиопротекторном эффекте апелина-13.
Эти данные были подтверждены in vivo – LY294002, ингибитор PI3-киназы и PD98059, ингибитор ERK1/2 нивелировали инфаркт-лимитирующий эффект апели-на-13 при коронароокклюзии-реперфузии у крыс [40, 45]. Апелин-13 повышал уровень фосфорилирования киназы p-гликогенсинтазы-3β (Glycogen synthase kinase-3β, p-GSK-3β), p-Akt и p-ERK1/2 в ткани миокарда [50]. Обнаружена зависимость инфаркт-лимитирующего эффекта апелина-13 у крыс с коронароокклюзией и реперфузией от состояния MPT поры (mitochondrial permeability transition pore) – конечного эффектора действия киназ: «открыватель» этой поры аттрактилозид предупреждал инфаркт-лимитирующий эффект апелина-13 [50]. Таким образом, возможный киназный механизм действия апе-лина-13 включает Akt-GSK-3β-mPTP.
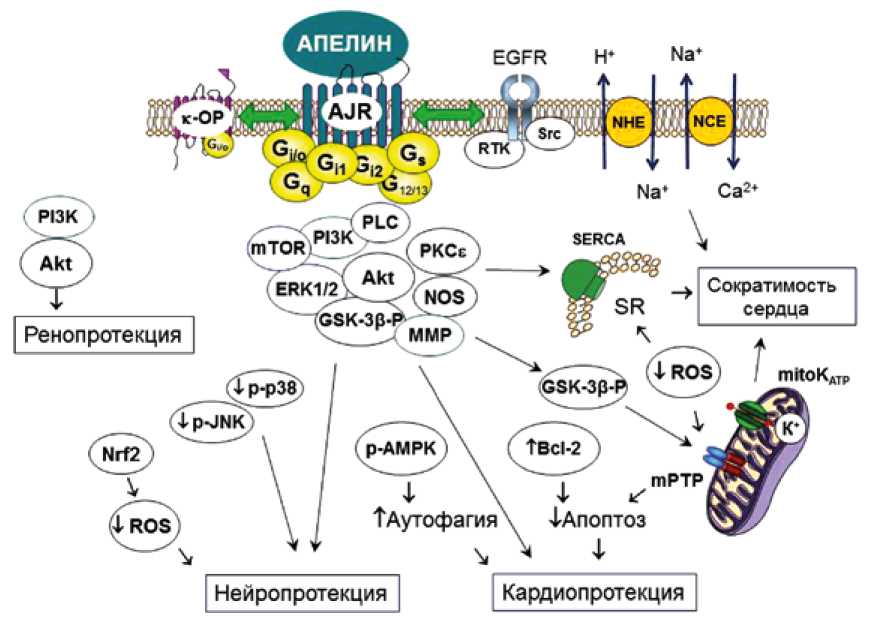
Рис. 2. Сигнальные механизмы защитных эффектов апелина
Примечание: κ-ОР – каппа опиоидный рецептор, AJR – апелиновый рецептор, р-AMPK – фосфорилированная 5’-аденозинмонофосфат (АМФ)-акти-вируемая протеинкиназа, Akt – Akt-киназа, Bcl2 – В-клеточная лимфома 2, EGFR – рецептор эндотелиального фактора роста, NOS – эндотелиальная NO-синтаза, ERK1/2 – киназа-1/2, регулируемая внеклеточным сигналом, p-JNK – фосфорилированная янусная киназа, Gi/oi1i2qs1213 – G-белки, GSK-3β-р – фосфорилированная киназа гликогенсинтазы-3β, mitoKATP –митохондриальный АТФ-чувствительный калиевый кана,л,, m,,P, T,P – пора переменной митохондриальной проницаемости, mTOR – мишень рапамицина у млекопитающих, NCE – натрий-кальциевый обменник, NHE – натрий-водородный обменник, Nrf2 – ядерный фактор, связанный с эритроидным фактором 2, редокс-чувствительный фактор танскрипции, PI3K – фосфоинозитид-3-киназа, p-p38 – фосфорилированная киназа p38, PKCε – протеинкиназа С эпсилон, SERCA – саркоплазматическая Ca2+-АТФаза, ROS – активные формы кислорода, RTK – рецепторная тирозинкиназа, srk – srk-киназа, MMP – матриксная металлопротеиназа, PLC – фосфолипаза С, SR – саркоплазматический ретикулум.
-
Fig. 2. The signaling mechanisms of protective effects of apelins
Note: κ-ОР – kappa opioid receptor, AJR – apelin receptor, p-AMPK – phosphorylated 5′-adenosine monophosphate (AMP)-activated protein kinase, Akt – Akt-kinase, Bcl2 – B-cell lymphoma 2, EGFR – endothelial growth factor receptor, NOS – endothelial NO-synthase, ERK1/2 – extracellular signal-regulated kinase-1/2, p-JNK – phosphorylated Janus kinase, Gi/oi1i2qs1213 – G-proteins, GSK-3β-p – phosphorylated glycogen synthase kinase-3β, mitoKATP – mitochondrial ATP-sensitive potassium channel, mPTP – mitocho, n, d, r,ia, l ,permeability transition pore, mTOR – mammalian target of rapamycin, NCE – sodium calcium exchanger, NHE – sodium hydrogen exchanger, Nrf2 – Nuclear factor erythroid 2-related factor 2, nuclear redox sensing factor, PI3K – phosphoinositide 3-kinase, p-p38- форфорилированая киназа p38, PKCε – protein kinase C epsilon, SERCA – sarcoplasmic reticulum Ca2+ ATPase, АФК – active oxygen spices, RTK – receptor tyrosine kinase, srk – srk-kinase, MMP – matrix metalloproteinase, PLC – phospholipase C, SR – sarcoplasmic reticulum.
Выявлено, что улучшение сократительной способности изолированного сердца при реперфузии под влиянием апелина-13 зависит от активации PKCε и открытия ми-тоКАТФ-канала [30]. Группа О.И. Писаренко обнаружила, что хелеритрин, ингибитор ПКС, U-73122, ингибитор ФЛС, амилорид, ингибитор Na+/H+-обменника и KB-R7943, ингибитор Na+/Ca2+-обменника, устраняли положительный инотропный эффект аналога апелина-12 при реперфузии изолированного сердца крысы [51]. U0126, ингибитор киназы митоген-активируемой протеинкиназы, LY294002, ингибитор PI3-киназы и 5-HD, блокатор митоКАТФ-кана-лов, нивелировали положительный инотропный эффект аналога апелина-12 при реперфузии сердца. Эти же ингибиторы устраняли инфаркт-лимитирующий эффект аналога апелина-12, применяемого в дозе 0,35 мкмоль/ кг in vivo [51].
Выявлено, что кардиопротекция, индуцированная апелином-12, опосредована активацией NO-синтазы
(NO-synthase, NOS) при реперфузии сердца крысы как in vivo , так и in vitro [35, 52, 53]. Так, L-NNA, ингибитор NOS, устранял кардиопротекторный эффект апелина-12 [52] и апелина-13 [53] при реперфузионном повреждении изолированного сердца крысы, а L-NAME, ингибитор NOS, нивелировал инфаркт-лимитирующий эффект апели-на-13 при реперфузии у крыс in vivo [35].
Апелин-12 снижал содержание МДА в ткани миокарда, стимулировал активность глутатионпероксидазы, СОД и каталазы в сердце при реперфузии как in vivo, так и in vitro [38, 54]. Аналог апелина-12 AI и апелин-12 снижали концентрацию аддукта (соединение, возникающее при взаимодействии свободного радикала с молекулой) ДМПО в коронарном оттоке при реперфузии изолированного сердца крысы, что говорит об ингибировании продукции АФК [38, 54]. Апелин-13 продемонстрировал антиоксидантный эффект при реперфузии сердца крысы [30]. Таким образом, апелин-индуцированная кардиопро- текция может быть опосредована усилением антиоксидантной защиты сердца.
Показано, что PI3-киназа и Akt участвуют в ренопро-текторном эффекте Fc-Elabela-21 [17].
Таким образом, нейропротекторный эффект апели-на-13 сопровождается стимуляцией PI3-киназы, ERK1/2, AMPK и ингибированием GSK-3β. Кардиопротекторный эффект апелинов связан со стимуляцией PI3-киназы, Akt, ERK1/2, NOS, SOD, глутатионпероксидазы, ММП, EGFR, киназы Src, митоКАТФ-канала, ГЦ, ФЛС, ПКC, Na+/H+-об-менника, Na+/Ca2+-обменника и с закрытием пор МРТ. Ренопротекторный эффект аналога элабела связан с активацией PI3-киназы и Akt (см. рис. 2).
Часть 7. Синтетические аналоги апелинов
Известно, что эндогенные агонисты апелиновых рецепторов имеют короткий период полувыведения. Период полуэлиминации апелина-13 в крови у крыс равен 2,3 мин [55], а при внутрибрюшинном введении – 30 мин [36]. Период полувыведения Pyr1-апелина-13 составляет около 24 мин в плазме крыс in vitro [56]. Сообщалось, что эндогенные пептиды элабела-32, апелин-13 и Pyr1-апелин-13 проявляли долгосрочный кардиопротекторный эффект при хроническом ежедневном однократном введении у животных с ИМ или перегрузкой давлением [57, 58]. Этот эффект удивителен, если учесть короткий период полуэлиминации этих пептидов. Очевидно, что энзимоустойчивые аналоги апелина с длительным периодом полувыведения могут стать новыми препаратами для лечения ОИМ, инсульта, инфаркта легкого и инфаркта кишечника.
Сообщают о синтезе стабильных аналогов апелина длительного действия (Lys8GluPAL)амид апелина-13 и pGlu(Lys8GluPAL)амид апелина-13 [59]. Введение этих пептидов в течение 28 дней снижало уровень глюкозы в плазме крови, уменьшало потребление пищи и массу тела; эти пептиды повышали уровень инсулина в плазме [59]. Сообщалось о синтезе аналога апелина-13, с периодом полувыведения in vivo 3,7 ч [60]. Период полувыведения in vivo синтетического аналога элабелы Fc-Elabela-21 у мышей составлял около 44 ч [17]. Вместе с тем следует отметить, что исследования кардиопротекторных, нейро-протекторных, ренопротекторных, пульмонопротектор- ных эффектов синтетических аналогов апелинов до настоящего времени не проводили.
Заключение
Результаты исследований, приведенные в настоящем обзоре, показали, что апелины могут повышать толерантность органов (мозга, сердца, почек, легких) к И/Р. Хорошо изучены нейропротекторные и кардиопротекторные эффекты апелинов.
Анализ данных показал, что интрацеребровентрику-лярное введение апелина-13 предотвращает появление ишемических и реперфузионных повреждений головного мозга. В этом эффекте апелина-13 участвует PI3-кина-за. Неясна роль других киназ, апелинового рецептора, КАТФ-каналов и MPT пор в нейропротекторном эффекте апелина-13. Маловероятно, что апелин-13 может повышать толерантность мозга к И/Р после внутривенной инъекции, потому что это большая водорастворимая молекула с коротким периодом полувыведения. Однако большие водорастворимые молекулы могут проникать через ГЭБ, если они имеют длительный период полувыведения – более 6 ч. Можно предположить, что синтетические аналоги апелина-13 с длительным периодом полувыведения также могут проникать через ГЭБ и проявлять нейропротекторный эффект.
Апелины могут повышать толерантность сердца к И/Р как in vivo , так и in vitro . Этот эффект сопровождается активацией аутофагии, а также ингибированием апоптоза. Кардиопротекторный эффект апелинов снижается или исчезает при повышении их концентрации. Не ясно, является ли это результатом присутствия примесей пептидов или следствием взаимодействия апелинов с другим рецептором (неапелиновым рецептором).
Нейропротекторный эффект апелина-13 при И/Р головного мозга связан с активацией PI3-киназы, ERK1/2, AMPK и ингибированием GSK-3β. Кардиопротекторный эффект апелинов связан с закрытием MPT пор, ингибированием GSK-3β и активацией следующих ферментов: ММП, Akt, ERK1/2, NOS, PI3-киназы, СОД, глутатионпероксидазы, EGFR, Src-киназы, гуантилатциклазы, ПЛК, ПКС. Na+/ H+-обменник, Na+/Ca2+-обменник и митоКАТФ-каналы участвуют в апелин-индуцированной кардиопротекции.
Список литературы Апелин - пептид, повышающий устойчивость органов и клеток к ишемии и реперфузии. Молекулярный механизм (обзор)
- Hage A., Stevens L.M., Ouzounian M., Chung J., El-Hamamsy I., Chauvette V. et al. Impact of brain protection strategies on mortality and stroke in patients undergoing aortic arch repair with hypothermic circulatory arrest: evidence from the Canadian Thoracic Aortic Collaborative. Eur. J. Cardiothorac. Surg. 2020;58(1):95-103. https://doi.org/10.1093/ ejcts/ezaa023.
- Ya’qoub L., Gad M., Saad A.M., Elgendy I.Y., Mahmoud A.N. National trends of utilization and readmission rates with intravascular ultrasound use for ST-elevation myocardial infarction. Catheter Cardiovasc. Interv. 2021;98(1):1-9. https://doi.org/10.1002/ccd.29524.
- Lio K.U., O’Corragain O., Bashir R., Brosnahan S., Cohen G., Lakhter V. et al. Clinical outcomes and factors associated with pulmonary infarction following acute pulmonary embolism: a retrospective observational study at a US academic centre. BMJ Open. 2022;12(12):e067579. https://doi.org/10.1136/bmjopen-2022-067579.
- Swinarska J.T., Stratta R.J., Rogers J., Chang A., Farney A.C., Orlando G. et al. Early graft loss after deceased-donor kidney transplantation: What are the consequences? J. Am. Coll. Surg. 2021;232(4):493-502. https://doi.org/10.1016/j.jamcollsurg.2020.12.005.
- O’Dowd B.F., Heiber M., Chan A., Heng H.H., Tsui L.C., Kennedy J.L. et al. A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11. Gene. 1993;136(1- 2):355-360. https://doi.org/10.1016/0378-1119(93)90495-o.
- Tatemoto K., Hosoya M., Habata Y., Fujii R., Kakegawa T., Zou M.X. et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor. Biochem. Biophys. Res. Commun. 1998;251(2):471-476. https://doi.org/10.1006/bbrc.1998.9489.
- Hu G., Wang Z., Zhang R., Sun W., Chen X. The role of apelin/apelin receptor in energy metabolism and water homeostasis: A comprehensive narrative review. Front. Physiol. 2021;12:632886. https://doi.org/10.3389/ fphys.2021.632886.
- Chng S.C., Ho L., Tian J., Reversade B. ELABELA: a hormone essential for heart development signals via the apelin receptor. Dev. Cell. 2013;27(6):672-680. https://doi.org/10.1016/j.devcel.2013.11.002.
- Perjés Á., Skoumal R., Tenhunen O., Kónyi A., Simon M., Horváth I.G. et al. Apelin increases cardiac contractility via protein kinase Cεand extracellular signal-regulated kinase-dependent mechanisms. PLoS One. 2014;9(4):e93473. https://doi.org/10.1371/journal.pone.0093473.
- Kawamata Y., Habata Y., Fukusumi S., Hosoya M., Fujii R., Hinuma S. et al. Molecular properties of apelin: tissue distribution and receptor binding. Biochim. Biophys. Acta. 2001;1538(2-3):162-171. https://doi.org/10.1016/ s0167-4889(00)00143-9.
- Than A., He H.L., Chua S.H., Xu D., Sun L., Leow M.K. et al. Apelin enhances brown adipogenesis and browning of white adipocytes. J. Biol. Chem. 2015;290(23):14679-14691. https://doi.org/10.1074/jbc.M115. 643817.
- Sekerci R., Acar N., Tepekoy F., Ustunel I., Keles-Celik N. Apelin/APJ expression in the heart and kidneys of hypertensive rats. Acta. Histochem. 2018;120(3):196-204. https://doi.org/10.1016/j.acthis.2018.01.007.
- Chen M.M., Ashley E.A., Deng D.X., Tsalenko A., Deng A., Tabibiazar R. et al. Novel role for the potent endogenous inotrope apelin in human cardiac dysfunction. Circulation. 2003;108(12):1432-1439. https://doi.org/10.1161/01.CIR.0000091235.94914.75.
- Bircan B., Çakır M., Kırbağ S., Gül H.F. Effect of apelin hormone on renal ischemia/reperfusion induced oxidative damage in rats. Ren. Fail. 2016;38(7):1122-1128. https://doi.org/10.1080/0886022X.2016.1184957.
- Gholampour F., Bagheri A., Barati A., Masoudi R., Owji S.M. Remote ischemic perconditioning modulates apelin expression after renal ischemia-reperfusion injury. J. Surg. Res. 2020;247:429-437. https://doi.org/10.1016/j.jss.2019.09.063.
- Zhang X., Zhu Y., Zhou Y., Fei B. Activation of Nrf2 signaling by apelin attenuates renal ischemia reperfusion injury in diabetic rats. Diabetes Metab. Syndr. Obes. 2020;13:2169-2177. https://doi.org/10.2147/DMSO. S246743.
- Xu F., Wu M., Lu X., Zhang H., Shi L., Xi Y. et al. Effect of Fc-Elabela-21 on renal ischemia/reperfusion injury in mice: Mediation of anti-apoptotic effect via Akt phosphorylation. Peptides. 2022;147:170682. https://doi.org/10.1016/j.peptides.2021.170682.
- Fan X.F., Xue F., Zhang Y.Q., Xing X.P., Liu H., Mao S.Z. et al. The Apelin-APJ axis is an endogenous counterinjury mechanism in experimental acute lung injury. Chest. 2015;147(4):969-978. https://doi.org/10.1378/chest.14-1426.
- Xia F., Chen H., Jin Z., Fu Z. Apelin-13 protects the lungs from ischemia-reperfusion injury by attenuating inflammatory and oxidative stress. Hum. Exp. Toxicol. 2021;40(4):685-694. https://doi.org/10.1177/0960327120961436.
- Wu F., Qiu J., Fan Y., Zhang Q., Cheng B., Wu Y. et al. Apelin-13 attenuates ER stress-mediated neuronal apoptosis by activating Gα /Gαtions during twitches in isolated rat cardiac myocytes. Am. J. Physiol. Heart Circ. Physiol. 2008;294(6):H2540-H2546. https://doi.org/10.1152/ajpheart.00046.2008.
- Xin Q., Cheng B., Pan Y., Liu H., Yang C., Chen J. et al. Neuroprotective effects of apelin-13 on experimental ischemic stroke through suppression of inflammation. Peptides. 2015;63:55-62. https://doi.org/10.1016/j. peptides.2014.09.016.
- Duan J., Cui J., Yang Z., Guo C., Cao J., Xi M. et al. Neuroprotective effect of Apelin 13 on ischemic stroke by activating AMPK/GSK-3β/Nrf2 signaling. J. Neuroinflammation. 2019;16(1):24. https://doi.org/10.1186/s12974019-1406-7.
- Liu D.R., Hu W., Chen G.Z. Apelin-12 exerts neuroprotective effect against ischemia-reperfusion injury by inhibiting JNK and P38MAPK signaling pathway in mouse. Eur. Rev. Med. Pharmacol. Sci. 2018;22(12):3888-3895. https://doi.org/10.26355/eurrev_201806_15273.
- Chu H., Yang X., Huang C., Gao Z., Tang Y., Dong Q. Apelin-13 protects against ischemic blood-brain barrier damage through the effects of Aquaporin-4. Cerebrovasc. Dis. 2017;44(1-2):10-25. https://doi.org/10.1159/000460261.
- Zhang R., Wu F., Cheng B., Wang C., Bai B., Chen J. Apelin-13 prevents the effects of oxygen-glucose deprivation/reperfusion on bEnd.3 cells by inhibiting AKT-mTOR signaling. Exp. Biol. Med. (Maywood). 2023;248(2):146-156. https://doi.org/10.1177/15353702221139186
- Mughal A., Sun C., O’Rourke S.T. Activation of large conductance, calcium-activated potassium channels by nitric oxide mediates apelin-induced relaxation of isolated rat coronary arteries. J. Pharmacol. Exp. Ther. 2018;366(2):265-273. https://doi.org/10.1124/jpet.118.248682.
- Dönmez Y., Acele A. Increased Elabela levels in the acute ST segment elevation myocardial infarction patients. Medicine (Baltimore). 2019;98(43):e17645. https://doi.org/10.1097/MD.0000000000017645.
- Sans-Roselló J., Casals G., Rossello X., González de la Presa B., Vila M., Duran-Cambra A. et al. Prognostic value of plasma apelin concentrations at admission in patients with ST-segment elevation acute myocardial infarction. Clin. Biochem. 2017;50(6):279-284. https://doi.org/10.1016/j.clinbiochem.2016.11.018.
- Wang C., Du J.F., Wu F., Wang H.C. Apelin decreases the SR Ca2+ content but enhances the amplitude of [Ca2+] transient and contrac contractions during twitches in isolated rat cardiac myocytes. Am. J. Physiol. Heart Circ. Physiol. 2008;294(6):H2540-H2546. https://doi.org/10.1152/ajpheart.00046.2008.
- Wang C., Liu N., Luan R., Li Y., Wang D., Zou W. et al. Apelin protects sarcoplasmic reticulum function and cardiac performance in ischaemia-reperfusion by attenuating oxidation of sarcoplasmic reticulum Ca2+-ATPase and ryanodine receptor. Cardiovasc. Res. 2013;100(1):114-124. https://doi.org/10.1093/cvr/cvt160.
- Rostamzadeh F., Najafipour H., Yeganeh-Hajahmadi M., Esmaeili-Mahani S., Joukar S., Iranpour M. Heterodimerization of apelin and opioid receptors and cardiac inotropic and lusitropic effects of apelin in 2K1C hypertension: Role of pERK1/2 and PKC. Life Sci. 2017;191:24-33. https://doi.org/10.1016/j.lfs.2017.09.044.
- Simpkin J.C., Yellon D.M., Davidson S.M., Lim S.Y., Wynne A.M., Smith C.C. Apelin-13 and apelin-36 exhibit direct cardioprotective activity against ischemia-reperfusion injury. Basic Res. Cardiol. 2007;102(6):518-528. https://doi.org/10.1007/s00395-007-0671-2.
- Писаренко О.И., Шульженко В.С., Пелогейкина Ю.А., Студнева И.М., Кхатри Д.Н., Беспалова Ж.Д. и др. Влияние экзогенного апелина-12 на функциональное и метаболическое восстановление изолированного сердца крысы после ишемии. Кардиология. 2010;50(10):44-49.
- Писаренко О.И., Серебрякова Л.И., Пелогейкина Ю.А., Студнева И.М., Кхатри Д.Н., Цкитишвили О.В. и др. Уменьшение реперфузионного повреждения сердца in vivo с помощью пептида апелина-12 у крыс. Бюллетень экспериментальной биологии и медицины. 2011;152(7):79-82.
- Писаренко О.И., Серебрякова Л.И., Пелогейкина Ю.А., Студнева И.М., Кхатри Д.Н., Цкитишвили О.В. и др. Участие NO-зависимых механизмов действия апелина в защите миокарда от ишемического/реперфузионного повреждения. Кардиология. 2012;52(2):52-58. Pisarenko O.I., Serebriakova L.I., Pelogeĭkina Iu.A., Studneva I.M., Kkhatri D.N., Tskitishvili O.V. et al. Involvement of NO-dependent mechanisms of apelin action in myocardial protection against ischemia/reperfusion damage. Kardiologiia. 2012;52(2):52-58. (In Russ.).
- Abbasloo E., Najafipour H., Vakili A. Chronic treatment with apelin, losartan and their combination reduces myocardial infarct size and improves cardiac mechanical function. Clin. Exp. Pharmacol. Physiol. 2020;47(3):393-402. https://doi.org/10.1111/1440-1681.13195.
- Pisarenko O.I., Shulzhenko V.S., Pelogeykina Y.A., Studneva I.V. Enhancement of crystalloid cardioplegic protection by structural analogs of apelin-12. J. Surg. Res. 2015;194(1):18-24. https://doi.org/10.1016/j. jss.2014.11.007.
- Писаренко О.И., Беспалова О.И., Ланкин В.З., Тимошин А.А., Серебрякова Л.И., Шульженко В.С. и др. Антиоксидантные свойства апелина-12 и его структурного аналога при экспериментальной ишемии и реперфузии. Кардиология. 2013;53(5):61-67.
- Pisarenko O., Shulzhenko V., Studneva I., Pelogeykina Y., Timoshin A., Anesia R. et al. Structural apelin analogues: mitochondrial ROS inhibition and cardiometabolic protection in myocardial ischaemia reperfusion injury. Br. J. Pharmacol. 2015;172(12):2933-2945. https://doi.org/10.1111/ bph.13038.
- Tao J., Zhu W., Li Y., Xin P., Li J., Liu M. et al. Apelin-13 protects the heart against ischemia-reperfusion injury through inhibition of ER-dependent apoptotic pathways in a time-dependent fashion. Am. J. Physiol. Heart Circ. Physiol. 2011;301(4):H1471-H1486. https://doi.org/10.1152/ ajpheart.00097.2011.
- Yu P., Ma S., Dai X., Cao F. Elabela alleviates myocardial ischemia reperfusion-induced apoptosis, fibrosis and mitochondrial dysfunction through PI3K/AKT signaling. Am. J. Transl. Res. 2020;12(8):4467-4477.
- Chen Y., Qiao X., Zhang L., Li X., Liu Q. Apelin-13 regulates angiotensin ii-induced Cx43 downregulation and autophagy via the AMPK/mTOR signaling pathway in HL-1 cells. Physiol. Res. 2020;69(5):813-822. https://doi.org/10.33549/physiolres.934488.
- Hou X., Zeng H., Tuo Q.H., Liao D.F., Chen J.X. Apelin gene therapy increases autophagy via activation of sirtuin 3 in diabetic heart. Diabetes Res. (Fairfax). 2015;1(4):84-91. https://doi.org/10.17140/DROJ-1-115.
- Wang W., McKinnie S.M., Patel V.B., Haddad G., Wang Z., Zhabyeyev P. et al. Loss of apelin exacerbates myocardial infarction adverse remodeling and ischemia-reperfusion injury: therapeutic potential of synthetic apelin analogues. J. Am. Heart Assoc. 2013;2(4):e000249. https://doi.org/10.1161/JAHA.113.000249.
- Masri B., Morin N., Pedebernade L., Knibiehler B., Audigier Y. The apelin receptor is coupled to Gi1 or Gi2 protein and is differentially desensitized by apelin fragments. J. Biol. Chem. 2006;281(27):18317-18326. https://doi.org/10.1074/jbc.M600606200.
- Bai B., Cai X., Jiang Y., Karteris E., Chen J. Heterodimerization of apelin receptor and neurotensin receptor 1 induces phosphorylation of ERK(1/2) and cell proliferation via Gαq-mediated mechanism. J. Cell. Mol. Med. 2014;18(10):2071-2081. https://doi.org/10.1111/jcmm.12404.
- Chapman N.A., Dupré D.J., Rainey J.K. The apelin receptor: physiology, pathology, cell signalling, and ligand modulation of a peptide-activated class A GPCR. Biochem. Cell. Biol. 2014;92(6):431-440. https://doi.org/10.1139/bcb-2014-0072.
- Moon M.J., Oh D.Y., Moon J.S., Kim D.K., Hwang J.I., Lee J.Y. et al. Cloning and activation of the bullfrog apelin receptor: Gi/o coupling and high affinity for [Pro1]apelin-13. Mol. Cell. Endocrinol. 2007;277(1-2):51- 60. https://doi.org/10.1016/j.mce.2007.07.008.
- Folino A., Accomasso L., Giachino C., Montarolo P.G., Losano G., Pagliaro P. et al. Apelin-induced cardioprotection against ischaemia/ reperfusion injury: roles of epidermal growth factor and Src. Acta Physiol. (Oxf.). 2018;222(2):e12924. https://doi.org/10.1111/apha.12924.
- Yang S., Li H., Tang L., Ge G., Ma J., Qiao Z. et al. Apelin-13 protects the heart against ischemia-reperfusion injury through the RISK-GSK-3βmPTP pathway. Arch. Med. Sci. 2015;11(5):1065-1073. https://doi.org/10.5114/ aoms.2015.54863.
- Pisarenko O.I., Shulzhenko V.S., Studneva I.M., Serebryakova L.I., Pelogeykina Y.A., Veselova O.M. Signaling pathways of a structural analogue of apelin-12 involved in myocardial protection against ischemia/reperfusion injury. Peptides. 2015;73:67-76. https://doi.org/10.1016/j.peptides.2015.09.001.
- Писаренко О.И., Пелогейкина Ю.А., Шульженко В.С., Студнева И.М., Беспалова З.Д., Азмуко А.А. и др. Влияние ингибирования новообразования на метаболическое восстановление ишемизи рованного сердца крысы апелином-12. Биомедицинская химия.2012;58(6):702-711
- Rastaldo R., Cappello S., Folino A., Berta G.N., Sprio A.E., Losano G. et al. Apelin-13 limits infarct size and improves cardiac postischemic mechanical recovery only if given after ischemia. Am. J. Physiol. Heart Circ. Physiol. 2011;300(6):H2308-H2315. https://doi.org/10.1152/ ajpheart.01177.2010.
- Pisarenko O.I., Lankin V.Z., Konovalova G.G., Serebryakova L.I., Shulzhenko V.S., Timoshin A.A. et al. Apelin-12 and its structural analog enhance antioxidant defense in experimental myocardial ischemia and reperfusion. Mol. Cell. Biochem. 2014;391(1-2):241-250. https://doi.org/10.1007/ s11010-014-2008-4.
- Reed A.B., Lanman B.A., Holder J.R., Yang B.H., Ma J., Humphreys S.C. et al. Half-life extension of peptidic APJ agonists by N-terminal lipid conjugation. Bioorg. Med. Chem. Lett. 2020;30(21):127499. https://doi.org/10.1016/j.bmcl.2020.127499.
- Trân K., Murza A., Sainsily X., Coquerel D., Côté J., Belleville K. et al. A systematic exploration of macrocyclization in apelin-13: impact on binding, signaling, stability, and cardiovascular effects. J. Med. Chem. 2018;61(6):2266-2277. https://doi.org/10.1021/acs.jmedchem.7b01353.
- Li L., Zeng H., Chen J.X. Apelin-13 increases myocardial progenitor cells and improves repair postmyocardial infarction. Am. J. Physiol. Heart Circ. Physiol. 2012;303(5):H605-H618. https://doi.org/10.1152/ajpheart.00366.2012.
- Azizi Y., Faghihi M., Imani A., Roghani M., Zekri A., Mobasheri M.B. et al. Post-infarct treatment with [Pyr1]apelin-13 improves myocardial function by increasing neovascularization and overexpression of angiogenic growth factors in rats. Eur. J. Pharmacol. 2015;761:101-108. https://doi.org/10.1016/j.ejphar.2015.04.034.
- O’Harte F.P.M., Parthsarathy V., Hogg C., Flatt P.R. Long-term treatment with acylated analogues of apelin-13 amide ameliorates diabetes and improves lipid profile of high-fat fed mice. PLoS One. 2018;13(8):e0202350. https://doi.org/10.1371/journal.pone.0202350.
- Tran K., Sainsily X., Côté J., Coquerel D., Couvineau P., Saibi S. et al. Size-Reduced Macrocyclic Analogues of [Pyr1]-apelin-13 Showing Neg Negative Gα12 Bias Still Produce Prolonged Cardiac Effects. J. Med. Chem. 2022;65(1):531-551.


