Апробирование системы детекции целевых групп микроорганизмов для экологического мониторинга пресноводных экосистем
Автор: Белькова Наталья Леонидовна, Дзюба Елена Владимировна, Деникина Наталья Николаевна, Кондратистов Юрий Леонидович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Природопользование и мониторинг
Статья в выпуске: 1-9 т.14, 2012 года.
Бесплатный доступ
Актуальность использования молекулярно-генетических методов для проведения экологического мониторинга водных объектов обусловливает необходимость разработки методов количественной оценки состава микробных сообществ. Применение ДНК фага λ как внутреннего контроля показало, что для эффективного выделения суммарных нуклеиновых кислот из природных проб необходимо оценивать численность бактериальных клеток и анализировать концентрации, не превышающие 10 5–10 6 КОЕ/мл. ПЦР в реальном времени позволила выявить невысокие концентрации энтерококков в поверхностных водах природных пресных водоемов Восточной Сибири в летний период по калибровочным кривым, основанным на концентрациях клеточных суспензий в КОЕ/мл. Детекция спектра таксономических групп и сравнительный анализ их значений СТ характеризуют структуру микробных сообществ и могут быть использованы для мониторинга их состояния и прогноза его изменений.
Микробные сообщества, пресные водоемы, молекулярно-генетические методы, экологический мониторинг, специфичная амплификация в режиме реального времени
Короткий адрес: https://sciup.org/148201081
IDR: 148201081 | УДК: 57.08:579.26:574.5
Текст научной статьи Апробирование системы детекции целевых групп микроорганизмов для экологического мониторинга пресноводных экосистем
Сложность взаимосвязей в водных микробных сообществах, изменчивость их структуры и ее зависимость от сезонных и физико-химических параметров, растущая антропогенная нагрузка на водоемы, обусловливают необходимость совершенствования системы микробиологического мониторинга пресноводных экосистем [1, 2]. В настоящее время актуальной является задача создания современной методологической основы программы мониторинга, которая позволила бы не только обнаружить в тестируемых объектах патогенных и условно-патогенных бактерий, но и провести комплексную диагностику состояния пресноводных микробных сообществ с целью определения степени потенциальной опасности этой среды для здоровья человека [3, 4].
Известно, что бактерии играют значительную роль в биогеохимических процессах в озерных экосистемах и существенно влияют на кАчество озерных вод, однако доминирующие бактериальные таксоны, активно участвующие в этих превращениях, большей частью остаются не охарактеризованными [5]. Молекулярно-генетические
подходы, используемые для исследования бактериальные таксоны, активно участвующие в этих превращениях, большей частью остаются не охарактеризованными [5]. Молекулярно-генетические подходы, используемые для исследования разнообразия и состава бактериальных сообществ пресноводных экосистем, позволяют выявить численно доминирующие микроорганизмы и охарактеризовать их распространение. Ранее нами было показано, что для количественной оценки состава и структуры пресноводных микробных сообществ основными целевыми группами организмов должны быть протеобактерии, планктомицеты, цианобактерии и цитофаги-флавобактерии [6, 7].
Цель работы – апробация системы детекции целевых групп микроорганизмов в составе микробных сообществ различных пресноводных водоемов для их экологического мониторинга.
Материалы и методы. Отбор проб и первичная пробоподготовка . Для апробации системы отбирали пробы поверхностной воды из пресных водоемов Восточной Сибири и глубинную воду (оз. Байкал) в стерильные емкости объемом 5 л (табл. 1). Для проведения молекулярно-генетических исследований использовали бактериальный материал, сконцентрированный на бактериальном фильтре (диаметр пор 0,22 мкм, объем воды для фильтрации – не менее 1,5 л) и зафиксированный 70% этанолом. Выделение ДНК из чистых культур и бактериального материала, сконцентрированного на фильтре, проводили с помощью коммерческих наборов Bacterial genomic DNA isolation kit
(Axygen, США) и ДНК-сорб Б (ФГУН ЦНИИ эпидемио-логии Роспотребнадзора, Москва) по адаптированным ранее методикам [8]. Для проведения количественных оценок использовали: 1) серию десятикратных разведений клеточной суспензии чистых культур (начальные концентрации клеток составили 3,6×108 КОЕ/мл для Enterococcus sp., 2,3×108 – для Aeromonas sp. и 3,0×108 – для Pseudomonas putida), 2) ДНК фага λ, которую для контроля эффективности выделения ДНК добавляли в концентрациях 2,5, 12,5 или 25 мкг/мл к каждой аликвоте клеточной суспензии.
Таблица 1. Характеристика мест отбора проб и результаты детекции представителей эубактерий (EUB), таксономических групп гаммапротеобактерии (GAM) и цитофаги-флавобактерии (CF), а также количественная оценка Enterococcus sp. (ENT)
|
Название |
Место обора (общее количество проб, шт.) |
EUB* |
GAM |
CF |
ENT (КОЕ/мл) среднее ± СО |
|
озеро Байкал, южная котловина, центральная станция |
|||||
|
LB-1 |
25 м (8) |
14,48 |
25,79 |
32,88 |
нд** |
|
LB-2 |
600 м (8) |
16,86 |
24,97 |
25,69 |
нд |
|
LB-3 |
1000 м (8) |
18,49 |
23,00 |
30,50 |
нд |
|
LB-4 |
1200 м (8) |
13,67 |
28,56 |
28,41 |
нд |
|
река Ангара, Братское водохранилище |
|||||
|
А1 |
пос. Железнодорожный (3) |
13,45 |
23,11 |
25,11 |
0,01±0,005 |
|
А2 |
г. Усолье-Сибирское (3) |
12,96 |
24,06 |
24,24 |
0,14±0,035 |
|
А3 |
г. Свирск (3) |
12,82 |
22,17 |
30,04 |
0,22±0,061 |
|
А4 |
пос. Балаганск (3) |
13,30 |
24,47 |
31,61 |
0,01±0,001 |
|
А5 |
пос. Ключи (3) |
15,03 |
25,06 |
21,67 |
2,02±0,085 |
|
А6 |
ст. Подволочная (3) |
16,18 |
24,08 |
21,99 |
6,43±0,977 |
|
А7 |
пос. Шумилово (3) |
15,15 |
25,67 |
24,28 |
0,23±0,070 |
|
А8 |
ст. Наратай (3) |
20,96 |
28,11 |
24,18 |
2,87±1,504 |
|
А9 |
ст. Долоновское расширение (3) |
18,13 |
26,76 |
34,13 |
66,29±12,682 |
|
А10 |
плотина БрГЭС (3) |
20,94 |
28,82 |
30,83 |
3,56±0,689 |
|
пресноводные озе |
ра Восточных Саян |
||||
|
S1 |
оз. Изумрудное (12) |
15,86 |
24,97 |
25,69 |
0,19±0,029 |
|
S2 |
оз. Малое Черное (8) |
12,63 |
23,00 |
30,50 |
0,36±0,071 |
|
S3 |
оз. Большое Черное (12) |
11,83 |
28,56 |
28,41 |
0,36±0,013 |
|
S4 |
оз. Перевальное (4) |
12,12 |
25,99 |
23,38 |
1,27±0,143 |
|
S5 |
оз. Тухурен-Нур (4) |
10,59 |
20,52 |
25,66 |
0,01±0,006 |
|
S7 |
оз. Аршантай-Нур (20) |
14,22 |
24,43 |
18,43 |
0,01±0,005 |
|
холодные родники на территории национального па |
рка «Алханай», Забайкальский край |
||||
|
Al1 |
Родник 1 (12) |
18,30 |
28,39 |
24,55 |
0,08±0,009 |
|
Al2 |
Родник 2 (12) |
17,73 |
25,73 |
25,54 |
0,27±0,020 |
|
Al3 |
Родник 3 (12) |
20,94 |
26,31 |
28,11 |
0,07±0,006 |
|
Al4 |
Ручей Сухой Убжогое (8) |
18,13 |
25,71 |
26,76 |
0,04±0,003 |
Примечание: * Для детектируемых групп представлены значения СТ; ** не детектированы
Полимеразная цепная реакция. Структуры праймеров, использованных в работе, приведены в таблице 2 [8, 9]. Детекцию целевых групп микроорганизмов вели в режиме реального времени на амплификаторах Rotor-Gene 6000 (Corbett Research, Австралия) и CFX®-Real Time System C1000 Thermal Cycler (BioRad, США), используя набор iTaqTM SYBR® Green Supermix with ROX (BioRad, США) или TaqMan зонды для специи-фической детекции (табл. 2, Биосан, Новосибирск).
Результаты и обсуждение. При проведении микробиологического мониторинга важна не только детекция отдельных санитарно-показательных групп микроорганизмов, но и количественные оценки отдельных видов бактерий или представителей крупных таксонов. Для корректного анализа в этом случае необходимо введение внутренних контролей и калибровочных стандартов. С этой целью проведен эксперимент по использованию ДНК фага λ как внутреннего контроля при выделении суммарных нуклеиновых кислот. Из рис. 1
видно, что эффективность выделения ДНК коммерческим набором с сорбентом выше при невысоких концентрациях бактериального материала. Количественные оценки, проведенные с использованием ПЦР в реальном времени со специфичными зондами для Enterococcus sp. показали, что потери ДНК фага λ при использовании клеточ-ных суспензий с концентрациями бактериальных клее-ток от 107 до 108 КОЕ/мл составляют до 70% и существенно ниже при концентрациях от 10 до 105 КОЕ/мл – не более 20%. Аналогичные результаты были получены при неспецифической детекции ампликонов на групп-специфичных праймерах на эубактерии и гаммапротеобактерии, полученных для культур Aeromonas sp. и Pseudomonas putida . Таким образом, для эффективного выделения суммарных нуклеиновых кислот из природных проб необходимо оценивать численность бактериальных клеток и использовать концентрации, не превышающие 105-106 КОЕ/мл.
Таблица 2. Структуры праймеров, использованных в работе
|
Название праймера |
Структура 5’–3’ |
Целевая филогенетическая группа |
|
консервативные праймеры |
||
|
EUB500R |
TTACCGCGGCTGCTGGFACG |
эубактерии |
|
EUB338L |
ACTCCTACGGGAGGCAGCAG |
эубактерии |
|
специфичные праймеры |
||
|
GAM395L |
CMATGCCGCGTGTGTGAA |
гаммапротеобактерии |
|
EUB296L |
GAGAGGAAGGTCCCCCAC |
цитофаги-бактероиды |
|
EUB412R |
CGCTACTTGGCTGGTTCAG |
цитофаги-бактероиды |
|
ECST784L |
AGAAATTCCAAACGAACTTG |
Enterococcus |
|
ENC854R |
CAGTGCTCTACCTCCATCATT |
Enterococcus |
|
lambda11F |
GGTGGCGACGACTCCTGGAGCCCG |
фаг λ |
|
lambda11R |
TTGACACCAGACCAACTGGTAATG |
фаг λ |
|
специфичные зонды для ПЦР в реальном времени |
||
|
EUB375 |
CCATTGACCAATATTCCTCACTGCTGCCT |
цитофаги-бактероиды |
|
EUB975 |
CCTGGTAAGGTTCTTCGCGTTGC |
цитофаги-бактероиды |
|
GPL813TQ |
TGGTTCTCTCCGAAATAGCTTTAGGGCTA |
Enterococcus |
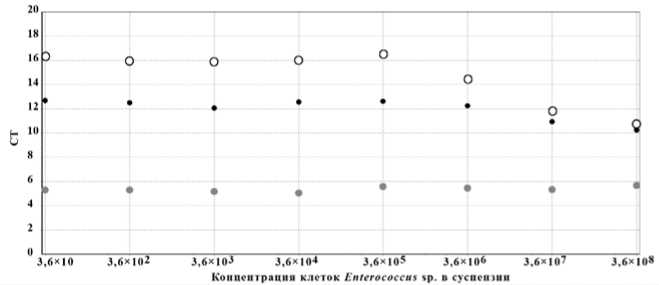
Рис. 1 . Определение оптимальной концентрации исходной бактериальной суспензии и фаговой ДНК, используемой в качестве внутреннего контроля. Белые кружки – ДНК фага λ 25 мкг/мкл; черные – 12,5 мкг/мкл, серые – 2,5 мкг/мкл
При построении калибровочных кривых необходимо учитывать не только концентрацию выделенной ДНК, но и титр жизнеспособных клеток, который может быть учтен как число колониеобразующих единиц, дающих рост на питательной среде. Поэтому для разработки метода количественных оценок использовали суспензию Enterococcus sp. с известными концентрациями колониеобразующих единиц. График калибровочной кривой для Enterococcus sp., использованный для количественной оценки энтерококков в природных водах представлен на рис. 2, а результаты анализа в таблице 1. Следует отметить, что в поверхностных водах природных пресных водоемов Восточной Сибири в летний период отмечены невысокие концентрации энтерококков, а в глубинных водах озера Байкал в зимний период они не были детектированы с помощью данной диагностической системы.
Учитывая сложные цепи превращений, осуществляемые микроорганизмами в процессе биологического круговорота вещества, любое нарушение среды их обитания может повлечь за собою разрушение отлаженных закономерностей. Именно поэтому важен контроль за жизнедеятельностью микробных сообществ, и особенно тех представителей, которые могут резко изменить экологическую или санитарную обстановку в отдельных природных водоемах. К таким группам относят представителей гамма-протеобактерий и цитофагов-флавобактерий.
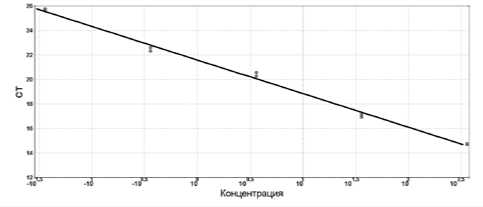
Рис. 2. График калибровочной кривой для детекции Enterococcus sp. с помощью специфичного TaqMan зонда. В реакцию использовали следующие концентрации клеток тестируемой культуры 3,6×106, 3,6×105, 3,6×104, 3,6×103 и 3,6×102 КОЕ/мл
В таблице 1 представлены результаты их детекции в сравнении с детекцией представителей эубактерий в разных природных водоемах. В данной работе для сравнения графиков накопления ампликонов использовали пороговый метод, определяли значение СТ, выраженное в циклах ПЦР, характеризующее каждый график. Сравнивая эти 3. значения, можно судить о начальной концентрации ДНК в исследуемых растворах: чем оно меньше, тем больше анализируемой ДНК в пробе. Следует отметить, что с помощью порогового метода детек- 4.
тированы невысокие концентрации гаммапротео-бактерий и цитофагов-флавобактерий относительно значений для эубактерий во всех пресных озерах. Детекция спектра таксономических групп и сравнительный анализ их значений СТ позволяет 5 характеризовать структуру микробных сообществ .
и ее изменение в зависимости от физико-химических условий водоемов. 6.
Выводы: методы детекции микроорганизмов на основе видо- и групп-специфичной полимеразной цепной реакции могут быть использованы для характеристики разнообразия и состава природных микробных сообществ, а применение рутинных аналитических процедур позволяет провести количественные оценки с целью мониторинга их состояния и прогноза его изменений. 7.
Работа выполнена в рамках ГК № 16.512.11.2130 Министерства образования и науки Российской Федерации.
Список литературы Апробирование системы детекции целевых групп микроорганизмов для экологического мониторинга пресноводных экосистем
- Environmental Microbiology: Current technology and water application. Eds. K. Sen, N.J. Ashbolt. -Norfolk: Caister Academic Press, 2011. 316 p.
- Руководство по медицинской микробиологии. Общая и санитарная микробиология. Книга 1/колл. Авторов//под ред. А.С. Лабинской, Е.Г. Волиной. -М.: Издательство БИНОМ, 2008. 1080 с.
- Дзюба, Е.В. Современные подходы и методология экологического мониторинга в условиях водоема и в аквакультуре/Е.В. Дзюба, Н.Л. Белькова, Н.Н. Деникина и др.//Известия Самарского научного центра РАН. 2009. Т. 11, №1(3). С. 466-471.
- Беликов, С.И. Молекулярная экология как основа современной методологической базы оценки состояния окружающей среды/С.И. Беликов, Н.Н. Деникина, Н.Л. Белькова и др.//Известия Самарского научного центра РАН. 2010. Т. 12, №1(4). С. 1103-1107.
- Newton, R.J. A Guide to the Natural History of Freshwater Lake Bacteria/R.J. Newton, S.E. Jones, A. Eiler et al.//Microbiol. Mol. Biol. Rev. 2011. Vol. 75, No. 1. P. 14-49.
- Белькова, Н.Л. Технологический потенциал унификации молекулярно-генетического анализа структуры и функционального статуса микробных сообществ для мониторинга и биоиндикации/Н.Л. Белькова, Н.Н. Деникина, Е.В. Дзюба, Е.В. Суханова//Всероссийская научная школа для молодежи «Инновации в биологии для развития биоиндустрии сельскохозяйственной продукции», 18-25 октября 2010 г. -Владивосток, 2010. С. 77-82.
- Белькова, Н.Л. Разработка системы праймеров разного уровня специфичности для определения состава и структуры микробных сообществ/Н.Л. Белькова, Е.Б. Матюгина, Н.Н. Деникина//Материалы II международной научно-практической конференции «Проблемы современной биологии». -М.: Изд-во «Спутник+», 2011. С. 74-79.
- Белькова, Н.Л. Введение в молекулярную экологию микроорганизмов: Учебно-методическое пособие/Н.Л. Белькова, А.М. Андреева. -Ярославль: Изд-во ООО «Принтхаус», 2009. 91 с.
- Frahm, E. Application of the fluorogenic probe technique (TaqMan PCR) to the detection of Enterococcus spp. and Escherichia coli in water samples/E. Frahm, U. Obst//J. Microbiol. Methods. 2003. Vol. 52. P. 123-131.


