Арахидонил-липиды мононуклеарных клеток крови как биомаркеры для раннего обнаружения разных опухолей
Автор: Акопян Г.В., Торгомян Т.Р., Лазян М.П., Арутюнян К.С., Батикян Т.Б., Алексанян К.А., Тадевосян Ю.В.
Журнал: Juvenis scientia @jscientia
Статья в выпуске: 11, 2017 года.
Бесплатный доступ
В статье исследованы закономерности кратковременного (5 сек) включения и относительно длительного (60 мин) межфракционного перераспределения экзогенной [14C]арахидоновой кислоты (АК) в различные фракции фосфолипидов (ФЛ) и нейтральных липидов (НЛ) мононуклеарных клеток (МНК), выделенных из периферической крови практически здоровых доноров, больных раком молочной железы (РМЖ) и яичников (РЯ). Полученные данные свидетельствуют о достоверных и идентичных нарушениях в механизмах как быстрого, так и пролонгированного АК-модификаций липидов МНК периферической крови при РМЖ и РЯ. Делается заключение о вовлечении процессов АК-модификации жирнокислотного состава липидов клеточных мембран МНК крови в патогенез РМЖ и РЯ.
Мононуклеарные клетки, липиды, арахидоновая кислота, рак молочной железы, рак яичников
Короткий адрес: https://sciup.org/14110433
IDR: 14110433 | УДК: 577 | DOI: 10.15643/jscientia.2017.11.007
Текст научной статьи Арахидонил-липиды мононуклеарных клеток крови как биомаркеры для раннего обнаружения разных опухолей
Введение . Одним из наиболее важных факторов, влияющих на исход рака, является время обнаружения рака, как при первоначальном диагнозе, так и при рецидиве опухоли [1]. В настоящее время большинство случаев рака выявляются относительно поздно, что приводит к высокой смертности.
Основываясь на обнаружении многочисленных биомаркеров рака, предполагалось, что развитие биомаркеров периферической крови хорошо предназначено для улучшения диагностики, управления и лечения злокачественных опухолей [2-4]. Эта так называемая стратегия «основенная на исследовании крови», применима для обнаружения и мониторинга рака с использованием различные клеточные и молекулярные элементы периферической крови (белки, мРНК, циркулирующие опухолевые клетки, метаболиты и др.). Это очень привлекательная стратегия и может способствовать доступным скрининговым программам рака, но часто вытерпивает из-за проблем, возникающих в результате чувствительности и специфичности низких концентра- ций биомаркеров в крови [5], быстрой деградации маркерных молекул in vivo и ex vivo [6], гетерогенности опухолей и сильно варьируемой фоновой экспрессии биомаркеров в незлокачественных тканях [7]. Следовательно, современные диагностические тесты для обнаружение рака довольно недостаточны [8-9], поэтому существует настоятельная необходимость в новых, эффективных неинвазивных молекулярных тестах, основанных на исследования крови, и действующих на ранней стадии заболевания, когда лечебные вмешательства все еще возможны.
В современной науке общепринято, что наиболее жизненно важные функции клеток происходят внутри или вокруг клеточной плазматической мембраны (ПМ), состоящей из белков и липидов. В этом контексте, при воздействии на клетку любого внешнего (физиологического или патогенного) сигнала, в зависимости от его длительности и интенсивности, происходит обратимое либо необратимое, кратковременное или хроническое смещение исходного и установление нового, так называемого изме-
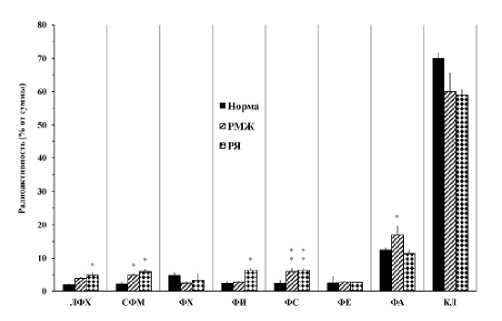
Рисунок 1. Быстрое (5 сек) включение экзогенной [14C]арахидоновой кислоты в фосфолипиды мононуклеарных клеток крови в норме, при раке молочной железы и раке яичников.
Примечание: Здесь и на следующих рисунках данные представлены в процентах от суммы радиоактивности, включенной в мембранные липиды.
На всех рисунках – * – P < 0.5; ** – P < 0.001
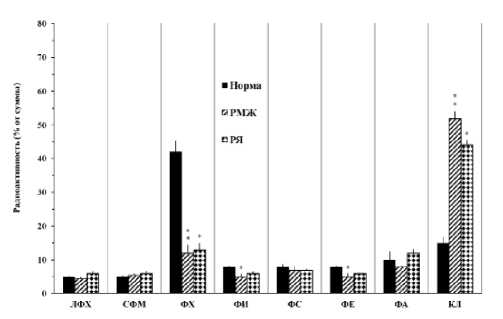
Рисунок 2. Пролонгированное (60 мин) межфракционное перераспределение экзогенной [14C]арахидоновой кислоты в фосфолипиды мононуклеарных клеток крови в норме, при раке молочной железы и раке яичников
ненного «метаболического статуса покоя» ПМ. В этих процессах липидный компонент липопротеинового бислоя ПМ участвует быстрыми и обратимыми сдвигами и активными реакциями модификации. Исходя из результатов ранее проведенных нами исследований [10-13], а также данных литературы [14-15], известно, что подобные сдвиги в модификации жирнокислотного (ЖК) состава мембранных липидов выявляются уже с первых секунд действия на клетку внешних сигналов.
Как известно, по своей функциональной значимости в жизнедеятельности клеток особое место занимают липиды, содержащие арахидоновую кислоту (АК), их метаболиты, а также свободная АК.
Согласно имеющимся данным, АК вовлекается в процессы сигнальной трансдукции [16] или стабилизации мембранных структур [17] в качестве регулятора текучести липидного бислоя. Однако, в научной литературе отсутствуют данные о возможных нарушениях в механизмах АК-модификации липидов мембран мононуклеарных клеток (МНК) периферической крови больных раком.
МНК состоят из лимфоцитов (включая Т и В-клетки, клетки естественного киллера), моноцитов, макрофагов и дендритных клеток и играют разнообразную и важную роль в мониторинге иммунного гомеостаза, в противоопухолевом ответе, а также в хеморезистентности опухлевых клеток. МНК – как легкодоступный клеточный пул крови, в последнее время используются для изучения механизмов развития рака и для открытия новых, неинвазивных биомаркеров [18-19].
В настоящей работе представлены результаты сравнительных исследований процессов кратковременного (5 сек) включения экзогенной [14C]АК в различные фракции фосфолипидов (ФЛ) и нейтральных липидов (НЛ) и ее относительно более длительного (60 мин) межфракционного перераспределения в ПМ МНК, выделенных из периферической крови практически здоровых доноров и больных раком молочной железы (РМЖ) и яичников (РЯ).
Методы исследования. В работе использованы пробы перифрической крови 10-ти практически здоровых доноров, 14-и первичных больных с РМЖ (стадии Т1N0М0 и Т2N1М0) и 9-и больных с РЯ (стадия Т3NхМ1) по классификации ТNМ. Пробы крови были предоставлены Национальным центром онкологии имени В.Фанарджяна МЗ РА. МНК из цельной крови выделяли методом Иннеса и др. [20] в градиенте фиколл-верографина (1 часть 32.8% верографина и 2.4 части 8% водного раствора фиколла 400 000, d =1.076-1.077). Интактность клеток, определяемая окрашиванием трипановым синим, составляла более 90%. При чрезмерном загрязнении МНК эритроцитами последние лизировали гипотоническим шоком. МНК осаждали при 650g в течение 15 мин и ресуспендировали (106 клеток/мл) в минимальной основной среде Игла (фирмы «Sigma», pH 7.4).
Включение экзогенной [14С]АК в липиды ПМ интактных клеток осуществляли ранее описанным методом [10]. Для этого при 37 оС к клеточной супензии добавляли 0.2 мкКю [14С]АК (сп. акт. 56 мКю/ммоль, «Amersham International», Великобритания), в среде Игла (pH 7.4). На 5 сек и 60 мин инкубации реакции останавливали приливанием холодной смеси хлороформ-метанола (1:2, об/об).
Экстракцию липидов осуществляли по методу Блай и Дайер [21]. Фракционирование ФЛ проводили одномерной ТСХ на на фирменных («Merck», Германия) ТСХ пластинках в системе растворителей хлороформ-ацетон-метанол-уксус-ная кислота-вода (6:8:2:2:1, об/об). НЛ фракционировали в смеси растворителей петролейный эфир-диэтиловый эфирмуравьиная кислота (30:10:1, об/об).
Распределение радиоактивности в идентифицированных соответствующими химически чистыми стандартами («Sigma», США) и проявленных в парах йода липидных фракциях определяли сканированием ТСХ пластинок на радиосканере фирмы «Berthold» (Германия). Степень радиоактивности проб определяли в жидкости Брея на сцинтилляционном спектрометре «Roche-Bioelectronique Kontron», модель SL-4221 (Франция). Статистический анализ проводили согласно методу Стьюдента.
Результаты и обсуждение . Результаты исследования процессов быстрого (5 сек) включения АК в мембранные ФЛ МНК практически здоровых доноров (далее будет отмечен как норма) обнаружили (Рис. 1) преимущественного накопления радиоактивности (более 60% от суммы включенной радиоактивности) во фракции кардиолипинов (КЛ). Во фракции фосфатидных кислот (ФК) относительное содержание радиоактивности составило около 13%, а в остальных фракциях колебалось в пределах 2-5%. Обнаруженный нами факт специфичности КЛ, как предпочитаемого акцептора для быстрых процессов эстерификации АК, дополняют литературные данные о ключевой функциональной значимости в жизнедеятельности клеток ЖК состав КЛ фракции [22-23].
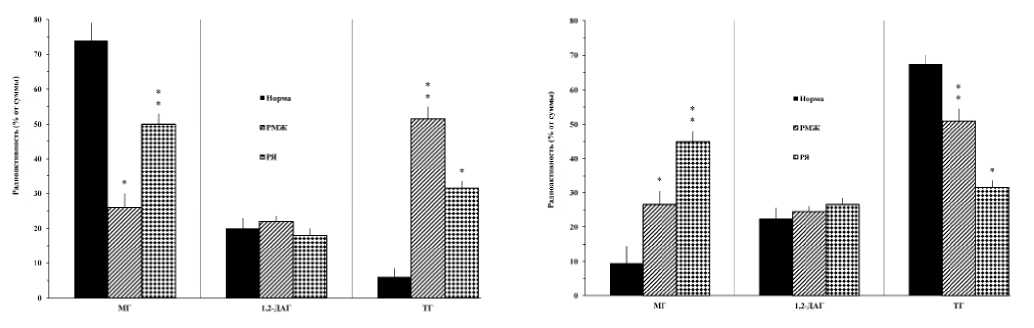
Рисунок 3. Быстрое (5 сек) включение экзогенной [14C]арахидоновой кислоты в нейтральные липиды мононуклеарных клеток крови в норме, при раке молочной железы и раке яичников
Рисунок 4. Пролонгированное (60 мин) межфракционное перераспределение экзогенной [14C]арахидоновой кислоты в нейтральные липиды мононуклеарных клеток крови и в норме, при раке молочной железы и раке яичников
В МНК больных с РМЖ и РЯ в идентичных условиях эксперимента были выявлены (рис. 1), в основном, схожие нарушения в процессах быстрого включения экзогенной АК в исследованные ФЛ фракции. В частности, при двух формах патологии наблюдалось уменьшение относительного содержания КЛ и некоторое повышение всех остальных АК-содержащих ФЛ фракций (лизофосфатидилхолины – ЛФХ, сфингомиелины – СФМ, фосфатидилсерины – ФС и фосфа-тидилинозиты – ФИ и фосфатидные кислоты – ФК). В случае фосфатидилхолинов (ФХ), уровень включенной АК понижена от нормы при РМЖ и РЯ, а во фракции фосфатидилэтано-ламинов (ФЭ) – равномерна норме.
На основании представленных экспериментальных данных, можно заключить, что при РМЖ и РЯ выявленные нарушения АК ацилирования ФЛ на быстрой (5 сек) мембраносвязанной фазе процессов липидных модификации являются характерным признаком для патологических МНК.
Как известно, в быстропротекающих процессах изменения липопротеинового бислоя ПМ участвует, в основном, внутримембранный потенциал модификационных механизмов. В частности, в процессах реконструирования ЖК состава мембранных липидов вовлечен так называемый «цикл Ландса» [24] и включающий ферменты деацилирования (фосфолипазы типа А) и реацилирования (ацилтранс-феразы, трансацилазы) [25-26].
При относительно длительном воздействии внешних факторов, в модификационные процессы липидов вовлекаются также внутриклеточныe кооперативныe механизмы ПМ. Изучение процессов включения и перераспределения АК в мембранные ФЛ в течение 60 мин в норме показало (рис. 2) преимущественное накопление метки (около 45%) в количественно преобладающей во внешнем монослое мембран МНК фракции ФХ. Во фракции КЛ накопление АК составляло около 20%, а в остальных ФЛ фракциях варьировало в пределах 5-10%.
Выявленные закономерности в относительно длительных процессах реацилирования/деацилирования мембранных ФЛ нарушены при РМЖ и РЯ. Так, избирательное накопление ЖК обнаруживаются во фракциях КЛ (до 4050%), а не ФХ (около 15%). В остальных исследованных ФЛ фракциях уровни АК идентифицируются в пределах нормы. На наш взгляд, в процессах как быстрого (5 сек) ацилирования, так и более пролонгированных (60 мин) перераспределения ЖК в мембранных ФЛ выявляются идентичные дефекты в ПМ патологических МНК. Превалирующий субстрат для накопления АК является КЛ при РМЖ и РЯ, что может быть вследствии аналогично активированных ЖК-модифицирующих ферментов – ацилтрансферазов, транс-ацилазов или фосфолипазов.
В следующей серии экспериментов были проведены сравнительные исследования по изучению закономерностей включения АК во фракции моноацилглицеринов (МГ), 1,2-диацилглицеринов (1,2-ДАГ) и триацилглицеринов (ТГ) в мембранах нормальных и патологических МНК.
При 5 сек инкубации МНК с экзогенной АК в норме выявило (рис. 3) включение ЖК во фракции МГ, 1,2-ДАГ и ТГ в соотношении 75, 20 и 5%, соответственно. В экспериментальных сериях с патологическими МНК обнаруживалось достоверное понижение АК во фракции МГ (при РМЖ 25%, при РЯ 45%) и повышение во фракции ТГ (при РМЖ 50%, при РЯ 30%, соответственно) по сравнению с нормой.
При этом уровень АК во фракции 1,2-ДАГ практически остается в пределах нормы. Следовательно, по сравнению с нормой при исследованных двух формах рака обнаруживаются схожие нарушения в механизмах быстрого включения АК во фракции НЛ МНК. Эти сдвиги, вероятно, обусловлены повышением активности ферментных систем межфракционного перераспределения АК по схеме МГ → ДАГ → ТГ, приводящих к быстрому накоплению метки во фракции ТГ, которые выполняют функцию «временного депо» [27] для избытка свободной АК.
Аналогичное исследование в условиях 60 мин инкубации в норме обнаружило (рис. 4) накопление АК во фракции ТГ (около 70%), 1,2-ДАГ (почти 20%) и МГ (10%). Характерно, что при РМЖ и РЯ по сравнению с нормой достоверно подавлялось пролонгированная эстирификация АК во фракции ТГ (50 и 30%, соответственно) на фоне многократного повышения уровня АК в МГ (25 и 45%, соответственно). В этом случае, как и при быстрых процессах ацилирования НЛ, уровни ДАГ оставались в пределах нормы. Эти результаты указывают на торможение при исследованных неоплазиях МГ → ДАГ → ТГ путей пролонгированных фракционных взаимопревращений, активированных при быстрых (5 сек) процессах ацилирования НЛ.
Обобщая вышеприведенные экспериментальные данные, можно заключить, что по сравнению с нормой в липидном бислое ПМ МНК периферической крови больных РМЖ и РЯ преобладают патологические изменения метаболического статуса покоя. В частности, МНК больных характеризуются наличием «дефектных» звеньев в механизмах АК-модификации отдельных фракций как ФЛ, так и НЛ. Некоторые значительно измененные фракции ФЛ (ФХ и КЛ)
и НЛ (МГ, ТГ), в PM МНК могут быть использованы в качестве перспективных биомаркеров, для раннего выявления и оценки злокачественности. Следует отметить, что необходимы дальнейшие исследования для выяснения корреляции между уровнями дефектных липидов и ферментами липидного метаболизма в патогенезе РМЖ и РЯ.
Список литературы Арахидонил-липиды мононуклеарных клеток крови как биомаркеры для раннего обнаружения разных опухолей
- Etzioni R., Urban N., Ramsey S., et al. The case for early detection//Nature Reviews Cancer. 2003. Vol. 3. No. 4. Pp. 243-252.
- Hanash S.M., Balk C.S., Kallioniemi O. Emerging molecular biomarkers-blood-based strategies to detect and monitor cancer//Nature Reviews Clinical Oncology. 2011. Vol. 8. Pp. 142-150.
- Bell D.W., Haber D.A. A blood-based test for epidermal growth factor receptor mutation in lung cancer//Clinical Cancer Research. 2006. Vol. 12. Pp. 3875-3877.
- Ronald J.A., Chuang Hui-Yen, Dragulescu-Andrasi A., et al. Detecting cancers through tumor-activatable minicircles that lead to a detectable blood biomarker//Proceedings of the National Academy of Sciences of the United States of America. 2015. Vol. 112. No. 10. Pp. 3068-3073.
- Nagrath S., Sequist L.V., Maheswaran S., et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology//Nature. 2007. Vol. 450. No. 7173. Pp. 1235-1239.
- Haun J.B., Castro C.M., Wang R., et al. Micro-NMR for rapid molecular analysis of human tumor samples//Science Translational Medicine. 2011. Vol. 3. No. 71 Pp. 1-27.
- Diamandis E.P. Cancer biomarkers: Can we turn recent failures into success?//Journal of the National Cancer Institute. 2010. Vol. 102. No. 19. Pp. 1462-1467.
- Hori S.S., Gambhir S.S. Mathematical model identifies blood biomarker-based early cancer detection strategies and limitations//Science Translational Medicine. 2011. Vol. 3. No. 109. Pp. 1-19.
- Kern S.E. Why your new cancer biomarker may never work: Recurrent patterns and remarkable diversity in biomarker failures//Cancer Research. 2012. Vol. 72. No. 23. Pp. 6097-6101.
- Мелконян М.Г., Акопян Г.В., Тадевосян А.Ю. и др. Ацилирование липидов арахидиновой кислотой и образованое липидных вторичных посредников в анти-CD3/CD28 костимулированных лимфоцитах в норме и при различных формах лейкемии//Медицинская наука Армении. 2007. Т. XLVII. № 2. С. 56-63.
- Тадевосян А.Ю., Батикян Т.Б., Асатрян Л.Ю. и др. Закономерности включения арахидоновой кислоты в липиды мембран нормальных и лейкемических лимфоцитов//Медицинская наука Армении. 1999. Т. 39, № 3. С. 33-40.
- Тадевосян Ю.В., Асатрян Л.Ю., Карагезян К.Г. Процессы деацилирования мембранных фосфолипидов при инициации фосфоинозитидного цикла в синаптосомах крыс и лимфоцитах человека//Нейрохимия. 1992. Т. 11. № 2. С. 194-205.
- Тадевосян Ю.В., Асатрян Л.Ю., Батикян Т.Б. и др. Катаболизм мембранных фосфатидилхолинов в лимфоцитах на ранних стадиях митогенной стимуляции фосфоинозитидного цикла//Биохимия. 1996. Т. 61, вып. 8. С. 1414-1421.
- Suzuki K.G., Fujiwara T.K., Sanematsu F., et al. GPI-anchored receptor clusters transiently recruits Lyn and Gα for temporary cluster immobilization and Lyn activation: single-molecule tracking study//Journal of Cell Biology. 2007. Vol. 177. No. 4. Pp. 717-730.
- Patterson A.D., Maurhofer O., Beyoglu D., et al. Aberrant lipid metabolism in hepatocellular carcinoma revealed by plasma metabolomics and lipid profiling//Cancer Research. 2011. Vol. 71. No. 21. Pp. 6590-6600.
- Gong Y., Zhang Z. Alternative signaling pathways: when, where and why?//FEBS Letters. 2005. Vol. 579, No. 24. Pp. 5265-5274.
- Leekumjorn S., Cho H.J., Wu Y., et al. The role of fatty acid unsaturation in minimizing biophysical changes on the structure and local effects of bilayer membranes//Biochimica et Biophysica Acta. 2009. Vol. 1788. Pp. 1508-1516.
- Koncarevic S., Lößner C., Kuhn K., et al. In-depth profiling of the peripheral blood mononuclear cells proteome for clinical blood proteomics//International Journal of Proteomics. 2014. Vol. 2014. Pp. 1-9
- Silva C., Santa C., Anjo S.I., et al. A reference library of peripheral blood mononuclear cells for SWATH-MS analysis//Proteomics -Clinical Applications. 2016. Vol. 10. No. 7. Pp. 760-764
- Innes J., Runtz M.M., Kim Y.T. et al. Induction of suppressor activity in the autologous mixed lymphocyte reaction and in cultures with ConA//Journal of Clinical Investigation. 1979. Vol. 64. Pp. 1608-1613.
- Bligh E.G., Dyer W.I. A rapid method for lipid extraction and purification//Canadian Journal of Biochemistry and Physiology. 1959. Vol. 37. Pp. 911-917.
- Li X.X., Tsoi B., Li Y.F., Kurihara H., et al. Cardiolipin and its different properties in mitophagy and apoptosis//Journal of Histochemistry & Cytochemistry. 2015. Vol. 63. No. 5. Pp. 301-311.
- Xu Y., Kelley R.I., Blanck T.J., et al. Remodeling of cardiolipin by phospholipid transacylation//Journal of Biological Chemistry. 2003. Vol. 278. No. 51. Pp. 51380-51385.
- Lands W.E.M. Stories about acyl chains//Biochimica et Biophysica Acta. 2000. Vol. 1483. Pp. 1-14.
- Perez R. Matabosch X., Llebaria A., et al. Blockade of arachidonic acid incorporation into phospholipids induces apoptosis in U937 promonocytic cells//Journal of Lipid Research. 2006. Vol. 47. Pp. 484-491.
- Yamashita A., Sugiura T., Waku K. Acyltransferases and transacylases involved in fatty acid remodeling of phospholipids and metabolism of bioactive lipids in mammalian cells//Journal of Biochemistry. 1997. Vol. 122. Pp. 1-16.
- Igal R.A., Whang S., Gonzalez-Baro M., et al. Mitochondrial glycerol phosphate acyltransferase directs the incorporation of exogenous fatty acids into triacylglycerol//Journal of Biological Chemistry. 2001. Vol. 276. Pp. 42205-42212.


