Артефакты форменных элементов и плазмы крови птиц, их происхождение и диагностическое значение
Автор: Колесник Е.А., Дерхо М.А.
Статья в выпуске: 4 т.248, 2021 года.
Бесплатный доступ
Работа посвящена изучению литературных данных (гуманной и ветеринарной медицины) и практическому анализу артефактов форменных элементов и плазмы в мазках периферической крови птиц в модели бройлерных кур Gallus gallus L. раннего постнатального онтогенеза. Возраст исследуемых клинически здоровых цыплят и молодых кур составил: 1 -сутки, 7-е сутки, 23-е сутки и 42 сутки (n=40). Было изучено 158 (n=158) цветных с высоким разрешением микрофотографий полей зрения, в мазках крови окрашенных по Паппенгейму. В результате этого были идентифицированы единичные артефакты эритроцитов птиц: цитоплазматические вакуоли различного характера, фестончатые «укушенные» края клеток. Обнаружены артефакты плазмы крови: околоклеточная и адгезированная на поверхности клеток окрашенная коагулированная зернистость. В некоторых случаях, данная зернистость имитировала токсические формы гранулоцитов и агранулоцитов периферической крови птиц. Необходимо отличать артефакты клеток и плазмы в мазках периферической крови от адаптационных изменений и симптомов инфекционных, инвазионных и незаразных болезней.
Артефакты эритроцитов, артефакты лейкоцитов, артефакты плазмы крови, этилендиаминтетрауксусная кислота (эдта), морфология крови
Короткий адрес: https://sciup.org/142231402
IDR: 142231402 | УДК: 619:617.58.073 | DOI: 10.31588/2413-4201-1883-248-4-129-135
Текст научной статьи Артефакты форменных элементов и плазмы крови птиц, их происхождение и диагностическое значение
Исследователь, проводя изучение приспособительного процесса индивидуума к факторам среды жизнедеятельности, должен следовать холистическому принципу, то есть изучать реакции с позиции целостного организма. А значит, учитывать взаимодействия и взаимовлияния компонентов систем функций в организме [1, 2].
В этом ключе, необходимо понимать то, что конкретный видовой организм на воздействия окружающей среды отвечает теми морфофизиологическими и биохимическими ресурсами, которыми обладает здесь и сейчас, в независимости от геномного потенциала [1]. При этом ответ организма будет не специфичным и в случае неспецифических адаптационных реакций, и в случае реагирования при развитии той или иной патологии [2]. Примером здесь является система общего адаптационного синдрома с совокупностью этапов стресс-реакции [2]. Механизм специфического иммунного ответа будет вторичным по отношению к первичным базовым и эволюционно рано сформированным механизмам резистентности [1, 2].
В связи с выше обозначенным, важно чётко дифференцировать модификации форменных элементов крови, регистрируемые in vitro вследствие приспособления [3], клинические симптомы патологий [4, 12, 15] и в результате факторов приготовления мазка
[7, 12, 14].
Известно, что антикоагулянты – этилендиаминтетрауксусная кислота
(ЭДТА) в меньшей мере [7, 12, 14], а цитрат натрия [7, 14] и гепарин [4, 7] существенно в большей степени при хранении с ними образцов крови более двух часов при комнатной температуре (+20 – (+25) 0С) вызывают изменения цитоплазмы, мембраны и ядра, осаждение белков плазмы крови, имитирующие симптомы пойкилоцитоза эритроцитов и патологических форм лейкоцитов в мазках периферической крови. В этом случае часто регистрируют псевдоэхиноцитоз [4, 7, 12, 13, 15], они же «клетки заусенцев» [7, 12], встречается псевдостоматоцитоз [4, 13, 15], псевдодакриоцитоз [15], псевдошистоцитоз [15], псевдоакантоцитоз [4]. Регистрируют эритроциты с так называемыми «укушенными» краями (по R.V. Pierre (2002) [15]), то есть, с выемками плазмолеммы, А.И. Воробьёв обозначает данные изменения: эритроциты с
«фестончатыми» краями
При хранении образцов крови с антикоагулянтами более двух часов, может происходить с различной интенсивностью цитоплазматическая вакуолизация нейтрофилов и других гранулоцитов крови [4, 7, 12, 14].
Вместе с тем, обнаруживают псевдотоксические изменения лейкоцитов с множественными гранулами – продуктами артефактной коагуляции плазмы крови, которые адгезируются на поверхности лейкоцитов [4]. Данные артефакты могут имитировать симптомы вирусных и бактериальных инфекций [4]. При которых отмечают базофильно- и оксифильно- окрашенную токсигенную зернистость в грунулоцитах, в основном, в нейтрофилах, и агранулоцитах – встречается в лимфоцитах и моноцитах [4].
Необходимо обозначить механизмы образования артефактов клеток и плазмы крови in vitro.
Так, ЭДТА может вызывать повреждение мембран эритроцитов и лейкоцитов, сокращение эритроцитов из-за гипертонуса цитоплазмы с повышенной ионной концентрацией [12]. Дефекты, связанные с длительным (несколько часов) хранением форменных элементов в антикоагулянте (ЭДТА, цитрат натрия) могут варьироваться от зубчатости, шиповатости мембраны эритроцита до изменения плотности окрашивания [14].
Отмечается, что артефактные эхиноциты и стоматоциты могут формироваться вследствие химической и цитохимической реакции in vitro. В частности, высокий pH (щелочная среда) образующийся при реагировании плазмы с избыточно щелочным стеклом пробирки или предметного стекла вызывает псевдоэхиноцитоз [4, 15] и псевдоакантоцитоз [4, 15]. И наоборот, низкий pH (кислая среда), который аналогично, может быть индуцированным от примесей стекла, приводит к псевдостоматоцитозу [4, 15].
Интересны наблюдения авторов [15], так, псевдостоматоциты, равно, как и псевдоэхиноциты возвращаются к нормальной конфигурации эритроцитов in vitro при помещении их в плазму с физиологическим pH среды.
Стоматоциты также могут образовываться при воздействии на эритроциты различных химических веществ, обычно катионных, амфифильных веществ и лекарственных препаратов, например, фенотиазина и хлорпромазина [15].
Вследствие длительного, или напротив, быстрого высыхания мазков, могут образовываться артефакты, имитирующие различные формы пойкилоцитоза, в том числе эхиноциты, акантоциты, стоматоциты [13, 15].
По данным B.I. Dalal et M.L. Brigden [4], аутоантитела IgG могут вызывать агглютинацию клеток крови в присутствии ЭДТА, но не в цитратной крови.
Тогда как аутоантитела IgM часто не зависят от ЭДТА, поэтому агглютинация также наблюдается с другими антикоагулянтами. Здесь интересно то, что некоторые аутоантитела относятся к холодно-реактивному типу, т.е. активны только при комнатной температуре [4].
Весьма малочисленны литературные данные по артефактам клеток и плазмы крови птиц, представлены в основном, в зарубежных публикациях [5, 6, 8, 9], несмотря на то, что эритроциты птиц (Aves L.) более хрупкие и чувствительны к различным воздействиям в сравнении с млекопитающими (Mammalia L.).
Тем более, учитывая и то обстоятельство что кровь молодых птиц весьма сложна в диагностике, отличается обилием сенситивных незрелых форм эритроцитов [6, 8, 10] и лейкоцитов [6, 8, 11].
Целью работы явилось изучение литературных данных (гуманной и ветеринарной медицины) и практический анализ на предмет артефактов форменных элементов и плазмы в мазках периферической крови птиц в модели бройлерных кур раннего постнатального онтогенеза.
Материал и методы исследований. Работа выполнена в соответствии принципам гуманного обращения с подопытными животными, отмеченных в директивах Европейского Парламента и
Совета ЕС по охране животных, используемых в научных целях (Директива 2010/63/EU). Экспериментальная часть работы выполнена на ООО «Чебаркульская птица» (Чебаркульский р-н, Челябинская обл.). Объектом исследования служили бройлерные цыплята Gallus gallus L. кросса Hubbard ISA F15 промышленного стада, из которых в цехе выращивания (клеточное содержание), согласно принципам случайной выборки и сбалансированных групп, сформировали четыре группы (n = 40).
Возраст цыплят в каждой из групп составил 1, 7, 23 и 42 дня постнатального онтогенеза. Экспериментальные группы кур Gallus gallus L. по Anamnesis vitae клинически (status praesens) соответствовали: fusce sanitas status статусу здоровых животных. Кормление и содержание цыплят осуществляли в соответствии с зоогигиеническими нормами согласно рекомендациям (Руководство Hubbard ISA, URL: http://hubbardbreeders.com). Материалом исследований служила цельная кровь, которую собирали в стандартизированные вакуумные пробирки с ЭДТА путём декапитации птицы в 1- и 7-суточном возрасте и прижизненно – пункцией подкрыльцовой вены у 23- и 42- суточных цыплят [10, 11]. Окраску мазков периферической крови производили по Паппенгейму (А. Pappenheim) [10, 11]. Цветные высокого разрешения микрофотографии получали с помощью большого биологического микроскопа («МББ - 1А», «ЛОМО», Россия), оснащенного микрографической окулярной видеокамерой с матрицей разрешением 5 мегапикселей (Full HD High resolution “HAYEAR” CMOS 5.0 Megapixel microscope video camera, КНР) с визуализацией в программе ToupView (ToupTek Photonics, КНР, URL: http://www.touptek.com/) [10, 11], c построенной светодиодной системой освещения микропрепаратов белым спектром (реализован принцип Кёлера (A. Köhler) [10, 11]. Для наиболее качественного изображения клеток крови, применяли 90-кратный апохроматический объектив масляной иммерсии с апертурой 1,3 («ЛОМО», Россия), позволяющий получать микрофотографии со специальной коррекцией хроматических аберраций. Калибровку видеокамеры производили по шкале объект-микрометра для проходящего света с ценой деления 0,01 мм («ОМП» ГОСТ 7513-55 «ЛОМО», Россия) в программе ToupView. В программе ToupView определяли масштаб изображений и на микрофотографиях размещали масштабную линейку с ценой деления в 10 микрометров (μm). На предмет изучения артефактов клеток и плазмы, был выполнен анализ 158 (n=158)
микрофотографий полей зрения в мазках периферической крови.
Результат исследований. Были идентифицированы различного морфологического характера единичные артефакты эритроцитов, лейкоцитов и плазмы периферической крови (Рисунок 1, 2). А.И. Воробьёв, подчёркивает (https://www.youtube.com/watch?v=Dor_ XUuTW2s), в мазке крови, в норме, могут в небольшом количестве встречаться эритроциты с фестончатыми краями (Рисунок 1: 1.2), это обычно нормальные артефакты вследствие приготовления мазка, то есть, механическом растаскивании ткани крови по поверхности стекла (https://www.youtube.com/watch?v=Dor_ XUuTW2s). Авторы [7;
https://eclinpath.com/atlas/hematology/blood-artifacts/ ] регистрировали вакуоли в цитоплазме эритроцитов. Представлены вакуольные артефакты в эритроцитах птиц, при этом, более мелкие вакуоли сравнительно многочисленны в отдельных эритроцитах (Рисунок 1: 1.1, 1.3), а крупные вакуоли единичны (Рисунок 1: 1.4).
J.W. Harvey отмечает, в процессе высушивания мазков крови, в эритроцитах могут образовываться артефакты, оптически визуализируемые в виде просвечивающихся лакун овальной, округлой или неправильной формы [9, p. 20], эти артефакты, ввиду оптического светопреломления выглядят полосчатыми зелёно-желтыми образованиями (см. рис.1: 1.3, 1.2).
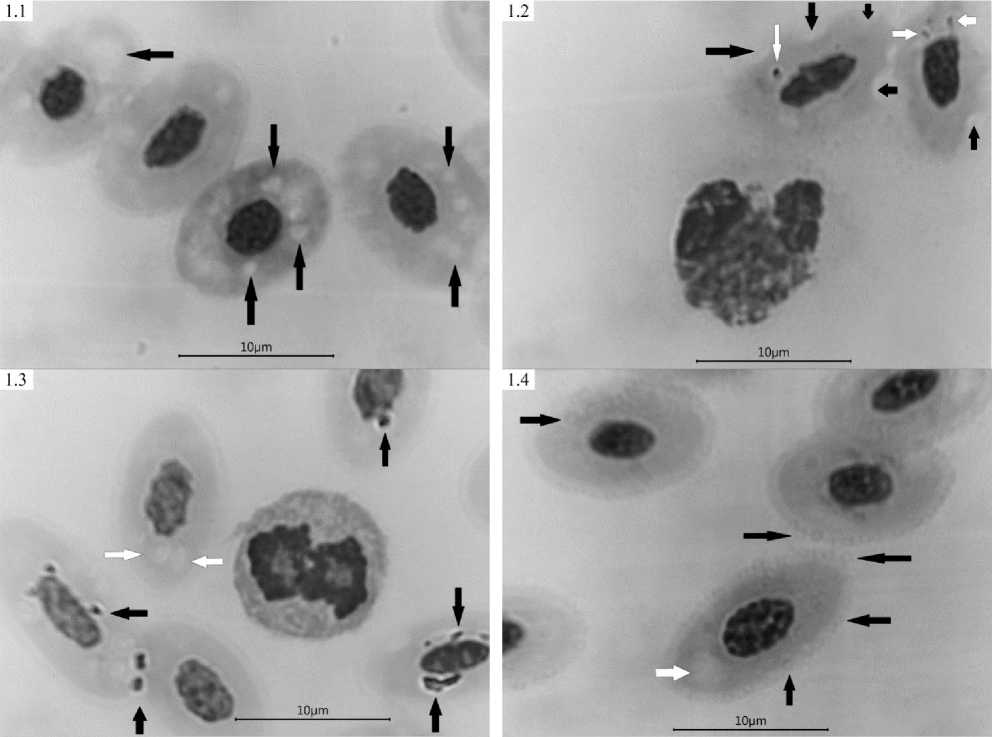
Рисунок 1 – Артефакты форменных элементов и плазмы крови птиц Gallus gallus L., окраска мазков по Паппенгейму, здесь и далее, в скобках указан возраст птиц. Вакуоли в цитоплазме эритроцитов: 1,1 (1-е сут.) – показаны черными стрелками, в центре полихроматофильный эритроцит; 1,3 (23-е сут.) – показаны белыми стрелками, в центре митотический базофильный эритробласт; 1,4 (1-е сут.) – показана белой стрелкой; фестончатые («укушенные») края эритроцитов: 1,2 (23-е сут.) – показаны черными стрелками, в центре сегментоядерный гетерофил; опалесцирующие лакуны в цитоплазме эритроцитов: 1.3 – показаны черными стрелками, 1,2 – показаны белыми стрелками; околоклеточная коагулированная зернистость плазмы: 1,4 (1-е сут.) – показаны черными стрелками. Здесь и далее, цена деления масштабной линейки десять микрометров (10 µm)
Аналогичной природы артефакты T.W. Campbell называет перинуклеарными кольцами [6, p. 40]. Данные образования в эритроцитах автор объясняет особенностью коагуляции стромы эритроцитов в ходе медленного высушивания мазков или воздействия химических фиксаторов, в частности паров формалина [6, p. 40]. P. Clark et al. показывают артефакты в цитоплазме зрелых эритроцитов зеленого карликового гуся (Nettapus pulchellus) в виде рефракционных пятен от красителя, возникающие вследствие недостаточного высыхания клеток перед окрашиванием [8, p. 19, 22].
Подобные артефакты в незначительном количестве неизбежны в практической работе. В помещении возможны колебания температурного и влажностного режимов, к тому же, учитывая физиологическую, сравнительно с млекопитающими животными, высокую температуру тела птиц, эритроциты в ходе приготовления мазка подвергаются существенному температурному шоку, и вследствие этого, могут формироваться подобные изменения.
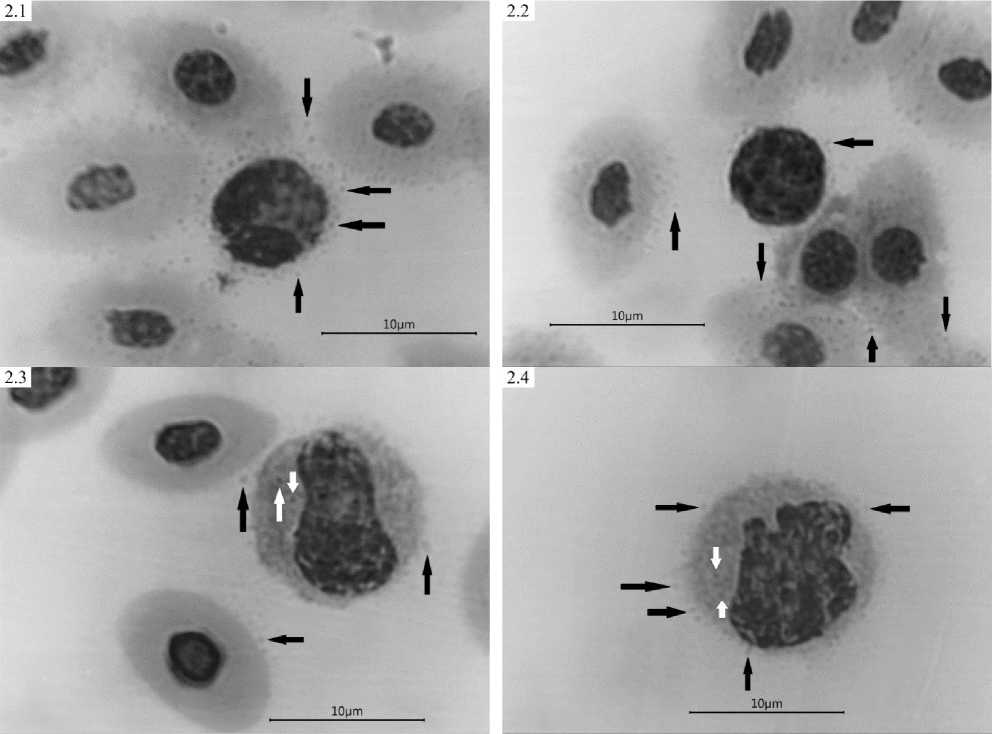
Рисунок 2 – Артефакты плазмы крови птиц Gallus gallus L., окраска мазков по Паппенгейму. Околоклеточная коагулированная зернистость плазмы: 2,1, 2,2 (1-е сут., в центре сегментоядерный гетерофил и базофил соответственно); 2,3, 2,4 (42-е сут., справа и в центре соответственно – моноцит) – показаны черными стрелками; адгезированная коагулированная зернистость плазмы на поверхности клеток: 2,3, 2,4 – показаны белыми стрелками
T.W. Campbell [5] отмечает возможное наличие мелкой зернистости вокруг форменных элементов в мазках крови (см. Рисунок 1: 1,4; Рисунок 2), по мнению автора, это является нормальным артефактом – особенностью коагуляции плазмы крови при фиксации мазка [5, p. 182, 183, p. 194]. При этом нередко, подобная зернистость плазмы крови может окрашиваться (см. Рисунок 1: 1,4; Рисунок 2) и в случае адгезии её на лейкоцитах – имитировать токсические формы гранулоцитов и агранулоцитов (Рисунок 2: 2,3, 2,4).
Заключение. Единичные морфологические изменения клеток и плазмы в мазках периферической крови являются нормальными артефактами полиэтиологичной природы.
Однако, важно дифференцировать артефакты форменных элементов и плазмы от модификаций адаптационного характера и изменений клеток крови, являющихся симптомами инфекционных, инвазионных и незаразных патологий.
Резюме
Работа посвящена изучению литературных данных (гуманной и ветеринарной медицины) и практическому анализу артефактов форменных элементов и плазмы в мазках периферической крови птиц в модели бройлерных кур Gallus gallus L. раннего постнатального онтогенеза. Возраст исследуемых клинически здоровых цыплят и молодых кур составил: 1 – сутки, 7-е сутки, 23-е сутки и 42 сутки (n=40). Было изучено 158 (n=158) цветных с высоким разрешением микрофотографий полей зрения, в мазках крови окрашенных по Паппенгейму. В результате этого были идентифицированы единичные артефакты эритроцитов птиц: цитоплазматические вакуоли различного характера, фестончатые «укушенные» края клеток. Обнаружены артефакты плазмы крови: околоклеточная и адгезированная на поверхности клеток окрашенная коагулированная зернистость. В некоторых случаях, данная зернистость имитировала токсические формы гранулоцитов и агранулоцитов периферической крови птиц. Необходимо отличать артефакты клеток и плазмы в мазках периферической крови от адаптационных изменений и симптомов инфекционных, инвазионных и незаразных болезней.
Список литературы Артефакты форменных элементов и плазмы крови птиц, их происхождение и диагностическое значение
- Колесник, Е. А. Стресс-реакция как защитный иммунный механизм, направленный на восстановление гомеостаза организма / Е.А. Колесник // Вестник Челябинского государственного университета. Образование и здравоохранение. – 2020. – № 4 (12). – С. 5–14. – doi: 10.6084/m9.figshare.16866886.v1.
- Колесник, Е.А. К проблеме физиологического адаптационного гомеостаза в модели организма теплокровных животных / Е. А. Колесник, М. А. Дерхо // Вестник Челябинского государственного университета. Образование и здравоохранение. – 2020. – № 4 (12). – С. 15–30. – doi: 10.6084/m9.figshare.16866820.v2.
- Сайфутдинова, Л.В. Влияние технологического стресс-фактора на морфологические особенности эритроцитов кур / Л.В. Сайфутдинова, М.А. Дерхо // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. – 2020. – Т. 241. – № 1. – С. 171–176. – doi: 10.31588/2413-4201-1883-241-1-171-176.
- Dalal, B.I. Artifacts that may be present on a blood film / B.I. Dalal, M.L. Brigden // Clinics in Laboratory Medicine. – 2002. – V. 22 (1) – P. 81-100. – doi: 10.1016/s0272-2712(03)00068-4.
- Campbell, T.W. Hematology / T.W. Campbell, B.W. Ritchie, G.J. Harrison, L.R. Harrison (Eds.) // In book: Avian Medicine: Principles and Applications. – Lake Worth, Florida: Wingers Publishing, Inc., 1994. – P. 176-198.
- Campbell, T.W. Exotic Animal Hematology and Cytology. Fourth edition / T.W. Campbell. – Ames, Iowa: Wiley-Blackwell. A John Wiley & Sons, Ltd., Publication, 2015. – 403 p.
- Choudhary, S. Storage artefacts in peripheral blood smears / S. Choudhary, R.S. Katkar, D. Nagaram // IP Journal of Diagnostic Pathology and Oncology. – 2018. – Vol. 3 (3) – P. 187-191. – doi: 10.18231/2581-3706.2018.0039.
- Clark, P. Atlas of Clinical Avian Hematology / P. Clark, W.S. J. Boardman, S.R. Raidal. – Oxford: Wiley-Blackwell, 2009. – 200 p.
- Harvey, J.W. Veterinary Hematology: A Diagnostic Guide and Color Atlas / J.W. Harvey. – St. Louis, Missouri: Saunders / Elsevier Inc., 2012. – 384 p. – doi: 10.1111/vcp.12007.
- Kolesnik, E.A. Differential morphophysiological characteristics of erythrocyte precursors and mature erythroid cells in early postnatal ontogenesis of birds / E.A. Kolesnik, M.A. Derkho, V.K. Strizhikov [et al.] // International Journal of Biology and Biomedical Engineering. – 2020. – Vol. 14. – P. 101–108. – doi: 10.46300/91011.2020.14.15.
- Kolesnik, E.A. Functional morphology of birds' blood leukocytes / E. Kolesnik, M. Derkho, V. Strizhikov [et al.] // Journal of Experimental Biology and Agricultural Sciences. – 2020. – V. 8. – No Special Issue 2. – P. 374-380. – doi: 10.18006/2020.8(Spl-2-AABAS).S374.S380.
- Koolwal, M.S. Anticoagulant EDTA Induced Storage effect (Artifacts) on Peripheral Blood Cells / M.S. Koolwal // Journal of Medical Science and Clinical Research. – 2018. – V. 06. – I. 01. – P. 32430-32433. – doi: 10.18535/jmscr/v6i1.05.
- Longo, D.L. Atlas of Hematology and Analysis of Peripheral Blood Smears. Chapter e17. Part 2. Cardinal Manifestations and Presentation of Diseases / D.L. Longo. – New York: The McGraw-Hill Companies, 2012. – P. 12-17.
- Narasimha, A. Anticoagulant induced artefacts in peripheral blood smears / A. Narasimha, H. Kumar, B.R. Prasad // Indian J. Hematol. Blood Transfus. – 2008. – Vol. 24 (2). – P. 43-48. – doi: 10.1007/s12288-008-0027-6 ; PMID: 23100942 ; PMCID: PMC3453045.
- Pierre, R.V. Red cell morphology and the peripheral blood film / R.V. Pierre // Clinics in Laboratory Medicine. – 2002. – Vol. 22 (1) – P. 25-61. – doi: 10.1016/s0272-2712(03)00066-0 ; PMID: 11933577.


