Использование мембранных фильтров при индикации ДНК вируса африканской чумы свиней в комбикорме с помощью ПЦР-РВ
Автор: Кудряшов Д.А., Каторкин С.А., Аронова Е.В., Бурдинская О.Н., Моргунов Ю.П., Газаев И.Х., Цыбанов С.Ж., Колбасов Д.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вирус африканской чумы свиней: культивирование, свойства, индикация
Статья в выпуске: 4 т.49, 2014 года.
Бесплатный доступ
Известно, что распространение вируса африканской чумы свиней (АЧС) происходит при алиментарной передаче возбудителя (например, вследствие использования контаминированных вирусом пищевых и боенских отходов, не подвергнутых термической обработке, комбикормов, не прошедший ветеринарно-санитарную экспертизу и поступающий из районов, неблагополучных по АЧС, в случаях, когда перевозка комбикорма осуществлялась в транспортных средствах, не подвергшихся ветеринарно-санитарной обработке). При анализе комбикормов с использованием метода полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) одно из требований заключается в тщательной очистке образцов от крупных частиц и различных химических примесей, которые могут ингибировать реакцию, изменять свойства сорбента и мембранных фильтров на стадии выделения нуклеиновых кислот. Наша цель заключалась в разработке методики пробоподготовки с использованием мембранных фильтров для изучения возможности индикации ДНК вируса африканской чумы свиней в искусственно контаминированном комбикорме с помощью ПЦР. Для контаминации использовали кровь от свиньи, экспериментально зараженной вирусом АЧС (штамм Ставрополь 2009) с инфекционным титром 5,0 lg ГАЕ 50/см 3. Рабочие разведения вируссодержащего материала - 2,0; 3,0; 4,0 и 5,0 lg ГАЕ 50/см 3. Подготовка проб включала фильтрование через марлю, замораживание-оттаивание, низкоскоростное центрифугирование и разделение на фильтрах с диаметром пор 450 мкм. Последующее выделение ДНК вируса АЧС и ПЦР-РВ выполняли согласно инструкции по применению соответствующей разработанной тест-системы. Установлено, что в подготовленных предложенным способом пробах искусственно контаминированного комбикорма ДНК вируса АЧС выявляется в материале с титром вируса не менее 3,0 lg ГАЕ 50/см 3. Таким образом, включение в диагностическую схему рекомендуемой стадии подготовки проб, описанной выше, при анализе комбикорма позволяет получить очищенный от примесей и сконцентрированный материал, который может быть использован для дальнейших исследований на наличие ДНК вируса АЧС с помощью ПЦР-РВ.
Африканская чума свиней, ачс, вирус африканской чумы свиней, комбикорм, пробоподготовка, мембранные фильтры, пцр в реальном времени, пцр-рв
Короткий адрес: https://sciup.org/142133528
IDR: 142133528 | УДК: 636.4:619:578.835.2:636.085:577.2:57.083
Текст научной статьи Использование мембранных фильтров при индикации ДНК вируса африканской чумы свиней в комбикорме с помощью ПЦР-РВ
Африканская чума свиней (АЧС) — особо опасное высококонтагиозное заболевание, из-за участившихся вспышек которого вопросы диагностики, механизмов патогенеза, эпизоотический мониторинг требуют постоянного внимания специалистов (1-5). Вирус АЧС, который относится к наиболее опасным и экономически значимым патогенам, передается в основном алиментарно (6, 7). Этот способ подразумевает использование для кормления пищевых и боенских отходов, не подвергнутых термической обработке, которые контаминированы вирусом (6). Кроме того, источником заражения может служить комбикорм, не прошедший ветеринарносанитарную экспертизу и поступающий из районов, неблагополучных по АЧС (8). Перевозка комбикорма в транспортных средствах, не подвергшихся ветеринарно-санитарной обработке, хранение в помещениях, инфицированных возбудителем, также может привести к попаданию в него вируса и, как следствие, к заражению поголовья.
Таким образом, поставка комбикорма, контаминированного вирусом АЧС, в благополучные по инфекции регионы, представляет серьезную угрозу для свиноводческих хозяйств как в промышленном, так и в частном секторе. При анализе комбикормов с использованием метода полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) одно из требований заключается в тщательной очистке образцов от крупных час- тиц и различных химических примесей, которые могут ингибировать реакцию, изменять свойства сорбента и мембранных фильтров на стадии выделения нуклеиновых кислот (НК).
Следует также отметить, что масса образцов комбикорма, поступающих в лабораторию, составляет 3-5 кг, и из-за неравномерного распределения возбудителя в таком большом объеме исследуемого материала существует проблема формирования средней пробы (9). Поэтому возникает необходимость введения дополнительной стадии пробоподготовки при индикации генома вируса АЧС в комбикорме с помощью ПЦР-РВ.
Общая схема пробоподготовки комбикорма была разработана ранее Н.А. Лагуткиным с соавт. (10). Однако эта схема не оптимизирована для конкретного возбудителя (вируса АЧС) и не применялась при исследовании проб комбикорма с помощью ПЦР-РВ.
Наша цель заключалась в разработке методики пробоподготовки с использованием мембранных фильтров для изучения возможности индикации ДНК вируса африканской чумы свиней в искусственно контаминированном комбикорме с помощью ПЦР в реальном времени (ПЦР-РВ).
Методика . В эксперименте использовали комбикорм для свиней, в состав которого входят отруби пшеничные, ячмень 2-го класса, мучка ячменная, мел кормовой, жмых подсолнечный, премикс П55 (КК-55 комбикорм для мясного откорма свиней, «Агрос», Россия). Навески комбикорма (4 шт. по 300 г) контаминировали вируссодержащей кровью (30 см3 на каждую пробу), которую получали от свиньи, экспериментально зараженной вирусом АЧС (штамм Ставрополь 2009). Инфекционный титр в исходном препарате крови составлял 5,0 lg ГАЕ50/см3 (1-я навеска), 2-ю навеску контаминировали разведением вируссодержащего материала с титром 4,0; 3-ю — с титром 3,0 и 4-ю — 2,0 lg ГАЕ50/см3. Комбикорм тщательно перемешивали для равномерного распределения вируссодержащего материала по всей массе.
Для элюции вируса в комбикорм добавляли стерильный физиологический раствор в соотношении 1:5 (масса/объем) и перемешивали в течение 5-10 мин при комнатной температуре. Для отработки условий концентрирования и очистки вируса использовали 1-ю навеску комбикорма. Суспензию фильтровали через 8 слоев стерильной марли. Затем полученную жидкость разделили на три аликвоты. Аликвоту № 1 однократно замораживали при температуре - 60 ° С. После оттаивания при комнатной температуре пробы осветляли низкоскоростным центрифугированием при 3000 об/мин в течение 20 мин на центрифуге Eppendorf 5804 (Германия). Полученный супернатант пропускали через мембранный фильтр с диаметром пор 450 мкм (ФМНЦ-0,45) («Владисарт», Россия). Для аликвоты № 2 исключали этап замораживания-оттаивания. Пробу центрифугировали при вышеуказанных условиях, полученный супернатант фильтровали. Аликвоту № 3 фильтровали без предварительного замораживания-оттаивания и центрифугирования.
Следующий этап пробоподготовки был одинаковым для всех аликвот: фильтры измельчали в стерильной фарфоровой чашке со стерильным стеклом; добавляли 0,2 см3 деионизированной воды и 1,0 см3 лизирующего буфера, входящего в состав набора для выделения нуклеиновых кислот («Тест-система для выявления ДНК вируса АЧС методом ПЦР в реальном времени», разработка и производство Всероссийского НИИ ветеринарной вирусологии и микробиологии) (11). Полученную жидкость отбирали в чистые пробирки объемом 1,5 см3, центрифугировали при 13 400 об/мин в течение 30 с на центрифуге Eppendorf mini spin (Германия). Супернатант использовали для выделения НК.
Остальные навески комбикорма (со 2-й по 4-ю) подвергались всем перечисленным процедурам подготовки: приготовление суспензии, фильтрование через марлю, замораживание-оттаивание, центрифугирование, осаждение на мембранном фильтре, получение супернатанта для дальнейшего выделения НК.
ДНК выделяли по модифицированной методике R. Boom с соавт. (12). Постановку ПЦР-РВ осуществляли в амплификаторе Rotor Gene 6000 («Qiagen», Германия) в соответствии с инструкцией по применению тест-системы для выявления ДНК вируса АЧС методом ПЦР в реальном времени (11). Учет результатов ПЦР проводили, анализируя кривые накопления флуоресцентного сигнала с помощью программного обеспечения используемого амплификатора.
Результаты . Выбор диаметра мембранного фильтра основывался на данных, полученных A. Lucas с соавт. (13) в опытах по фильтрованию крови и сыворотки через фильтры Шамберлана, Беркефельда и Зейтца с разным диаметром пор (300, 450, 500, 1000 мкм). Авторами было установлено наличие вируса в фильтратах при диаметре пор 300 и 450 мкм и его отсутствие в фильтратах при диаметре пор 500 и 1000 мкм (7).
При сравнении различных вариантов подготовки проб с исключением некоторых стадий оказалось, что в этих случаях поры фильтра забивались крупными и вязкими частицами комбикорма (аликвоты № 2 и № 3), что делало невозможным накопление фильтрата для последующего выделения НК и постановки ПЦР-РВ. При сохранении всех этапов (аликвота № 1) был получен фильтрат, который использовали на дальнейших стадиях выявления ДНК вируса АЧС с помощью ПЦР-РВ.
В ПЦР-РВ на матрицах ДНК, выделенных из 1-й (аликвота № 1), 2-й, 3-й и 4-й навески комбикорма, положительный результат регистрировали в 1-3-м образцах (рис.). В пробе № 4, контаминированной кровью с наиболее низким титром вируса (2,0 1дГАЕ50/см3), геном вируса АЧС не обнаружили.
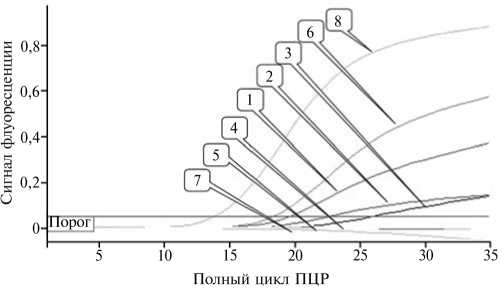
мизированной подготовки проб см. в разделе «Методика»).
График накопления флуоресцентного сигнала при использовании ПЦР в реальном времени (ПЦР-РВ) для анализа образцов комбикорма, контаминированных инокулятами вируса африканской чумы свиней с разным инфекционным титром: 1 — 1-я навеска (аликвота № 1), 2-4 — соответственно 2-4-я навески, 5 — отрицательный контроль выделения ДНК, 6 — положительный контроль выделения ДНК, 7 — отрицательный контроль ПЦР-РВ,
8 — положительный контроль ПЦР-РВ (подробное описание условий инокуляции и опти
Значения порогового цикла, зарегистрированные при исследовании 1-3-й навесок комбикорма, находились в прямой зависимости от величины инфекционного титра вируса в образцах: для 1-й навески величина Ct была наименьшей и равнялась 19,60, тогда как у 3-й навески достигала максимального значения, равного 25,91 (табл.).
Средние значения порогового цикла (C t ) при использовании ПЦР в реальном времени (РВ-ПЦР) для анализа образцов комбикорма, контаминированных инокулятами вируса африканской чумы свиней с разным инфекционным титром ( n = 3)
|
№ пробы |
| Образец | |
C t |
|
1 |
1-я навеска комбикорма (аликвота № 1) |
19,60 |
|
2 |
2-я навеска комбикорма |
22,64 |
|
3 |
3-я навеска комбикорма |
25,91 |
|
4 |
4-я навеска комбикорма |
н.з |
|
5 |
Отрицательный контроль выделения ДНК |
н.з |
|
6 |
Положительный контроль выделения ДНК |
18,35 |
|
7 |
Отрицательный контроль ПЦР-РВ |
н.з |
|
8 |
Положительный контроль ПЦР-РВ |
13,88 |
Примечание. Подробное описание условий инокуляции и оптимизированной подготовки проб см. в разделе «Методика»; н.з. — нет значения Ct.
Таким образом, при исследовании комбикорма на наличие генома вируса африканской чумы свиней (АЧС) с помощью ПЦР в реальном времени (ПЦР-РВ) в диагностическую схему рекомендуется включать стадию подготовки проб, состоящую из приготовления суспензии, фильтрования через марлю, замораживания-оттаивания, низкоскоростного центрифугирования и осаждение на фильтрах с диаметром пор 450 мкм. Проведение полного цикла пробоподготовки комбикорма позволяет получить очищенный от примесей и сконцентрированный материал, который может быть использован для дальнейших исследований на наличие ДНК вируса АЧС с помощью ПЦР-РВ. В подготовленных таким способом образцах ДНК вируса АЧС выявляли при титре от 3,0 lg ГАЕ50/см3.


