Аспекты лучевой диагностики раннего вазогенного отека в зонах гиперперфузии венозного ишемического инсульта
Автор: Семенов С.Е.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.37, 2022 года.
Бесплатный доступ
Цель исследования: изучение особенностей отека мозгового вещества в случаях венозного ишемического инсульта (ВИ) при церебральном венозном синустромбозе (ЦВСТ).Материал и методы. В исследование включены 33 пациента с ВИ в результате ЦВСТ. Группу сравнения составили 33 пациента с артериальным ишемическим инсультом (АИ), контрольную группу (КГ) - 33 человека. Нейровизуализация включала нативную компьютерную томографию (КТ) головного мозга при поступлении и на 5-7-е сут, перфузионную компьютерную томографию (ПКТ) (МСКТ 64) в первые 40 мин поступления в стационар, магнитно-резонансную томографию (МРТ) головного мозга (1,5T) в первые 24-48 ч заболевания.Результаты и обсуждение. Выявлена связь между ранним развитием межклеточного отека, по данным диффузионной МРТ, с инверсией сигнала на диффузионно-взвешенном изображении - DWI (снижение в перифокальной зоне на фоне высокого сигнала цитотоксического отека) и повышением сигнала со средней верхней границей диапазона измеряемого (истинного) коэффициента диффузии - ADC (0,82 ± 0,05)*10-3 мм2 /с, отличной только от центральной зоны, а также умеренным полнокровием перифокальных зон (с увеличением объема кровотока - rCBV и скорости кровотока - rCBF на 27-28%), по данным ПКТ. Эти явления должны являться неблагоприятными факторами развития отека и вероятного кровоизлияния (в 27% случаев при ВИ против 9% при АИ), но сопровождались более благоприятным клиническим исходом ВИ (улучшение в 66% случаев, с полным регрессом неврологического дефицита в 25% случаев против 57% без полного регресса симптоматики при АИ) с меньшей частотой развития некроза/инфаркта (в 50% случаев против ¾ части случаев АИ). Значимая корреляционная связь между показателями площади поражения и относительными значениями КТ-перфузии и МР-диффузии (r = 0,44; р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Венозный инсульт, вазогенный отек, гиперперфузия, магнитно-резонансная томография, диффузионно-взвешенное изображение
Короткий адрес: https://sciup.org/149140019
IDR: 149140019 | УДК: 616.145.11:616.831-005.4-005.1-06:616.831-005.98]-073.86
Текст научной статьи Аспекты лучевой диагностики раннего вазогенного отека в зонах гиперперфузии венозного ишемического инсульта
Semenov S.E. Imaging of early vasogenic edema in hyperperfusion zones of venous ischemic stroke. The Siberian Journal of Clinical and Experimental Medicine. 2022;37(1):47–56.
В 50% случаев церебральный венозный синустром-боз (ЦВСТ) ведет к развитию инфаркта [1], однако при нейровизуализации очаговые изменения в мозге встречаются при этом заболевании чаще, что связано с обратимой ишемией. Роль магнитно-резонансной томографии (МРТ) в диагностике ишемических повреждений мозга, включая венозную ишемию, достаточно высока [2] из-за того, что сигнал Т2 взвешенного изображения (Т2WI) и Т2 последовательность инверсии/восстановления с подавлением сигнала воды (Т2FLAIR) в зоне ишемии, как правило, повышаются в первые несколько часов заболевания. Диффузионно-взвешенные изображения (DWI)
дают возможность визуализировать микроскопическое движение воды, являются очень чувствительными к минимальным изменениям концентрации воды в веществе головного мозга. Это позволяет исследователю регистрировать ограничение диффузии в зоне ишемии почти сразу после начала заболевания.
МР-картина инсульта характеризуется изменением интенсивности сигнала и локальным отеком. Основополагающими факторами повреждения в патогенезе венозного инсульта (ВИ) могут являться ранний вазогенный отек, по данным МР-диффузии, и умеренное увеличение перфузии, по данным перфузионной компьютерной томографии (ПКТ), а не гипоперфузия в отличие от артериальной ишемии [3, 4].
Полагают, что вазогенный и цитотоксический виды отека отличаются на МРТ на диффузионных изображениях и при картировании измеряемого (истинного) коэффициента диффузии (при ADC-картировании). Вазогенный отек проявляется изо- или пониженной интенсивности очагами на DWI и повышением на ADC [5, 6]. Однако в литературе этот вопрос освещен неоднозначно и без связи с нарушениями гемодинамики в фокусе повреждения мозговой ткани и перифокально. Указывается, в частности, что DWI не различает цитотоксический и вазогенный отек, лишь ADC проясняет картину [7, 8]. Границы показателей ADC в норме и при ишемии также известны, но данные различных исследователей противоречивы. По данным крупного исследования, у взрослых людей они находятся в пределах от 0,59*10-3 до 0,95*10-3 мм2/с. При значении вычисленной тенденции ADC более 0,95*10-3 мм2/с делается вывод о возможности глиозных изменений в результате обратимого вазогенного отека; при значении ADC менее 0,59*10-3 мм2/с предполагается возможность возникновения ишемии с переходом клеток на анаэробный путь окисления с усугублением цитотоксического отека и гибелью клеток; при значениях в пределах от 0,59*10-3 до 0,95*10-3 мм2/с делается вывод об уравновешенности диффузионных процессов [9]. При артериальном ишемическом инсульте (АИ) между 3 и 6 ч регистрируются изменения на DWI в виде резкого повышения интенсивности сигнала со снижением ADC <0,70*10-3 мм2/с для серого вещества и <0,45*10-3 мм2/с для белого вещества мозга; показатели ADC в норме для серого вещества составляли >0,84*10-3 мм2/с, для белого вещества >0,60*10-3 мм2/с [6]. Значения ADC, по данным другого исследования [10], в зоне вазогенного, цитотоксического и интерстициального отека составляли 1,30 ± 0,11*10-3; 1,04 ± 0,1*10-3 и 1,91 ± 0,1*10-3 мм2/с соответственно ( р < 0,05).
Цель исследования: изучение особенностей отека мозгового вещества при венозном генезе ишемического инсульта с учетом неоднозначности данных литературы, поиск связи между отеком и микроциркуляторными изменениями.
Материал и методы
В исследование были включены 33 пациента с клиническими признаками ВИ в результате ЦВСТ. Для сравнения изучены показатели 33 пациентов с АИ. Контрольная группа (КГ) состояла также из 33 пациентов без неврологического дефицита и инсульта в анамнезе, ожидающих плановую операцию коронарного шунтирования.
Нейровизуализация включала нативную КТ головного мозга, ПКТ в рамках неотложной диагностики на томографах Siemens Somatom Sensation 64 и General Electric Light Speed TMVCT 64; МРТ головного мозга выполнялась в первые 48 ч заболевания на томографе Toshiba Excelаrt Vantage 1,5 T; контрольная нативная КТ выполнялась на 5–7-е сут. Восемь пациентов с ВИ обследовались в динамике на протяжении 1 года путем выполнения МРТ головного мозга, их показатели не включены в статистику, использованы в описательной части с целью дополнительной характеристики заболевания.
На МРТ оценивали площадь повреждения по T2WI, Т2FLAIR, DWI и ADC-карт (в см2); характеристику отека в очаге вычисляли по DWI (в усл. ед.) и ADC (в *10-3 мм2/с). Затем определяли относительные значения (relative) rDWI и rADC по отношению к противоположной стороне в процентах (за 100% принималось значение в зеркаль- ном ROI противоположного полушария). В ряде случаев выполнялась процедура бесконтрастной МР-перфузии PASL (pulse arterial spin labeling), однако нам не удалось получить изображение стабильно удовлетворительного качества, в связи с чем в статье используется лишь иллюстративный материал этой части исследования.
Изменения микроциркуляции мозга изучали по данным ПКТ, оценивали значение времени прохождения контраста – MTT (в с), скорость мозгового кровотока – CBF (в мл/мин/100 г), объем мозгового кровотока – CBV (в мл/100 г) в фокусе/ядре инфаркта, пенумбре или перифокальной зоне. Изучение относительных значений перфузионных показателей (rMTT, rCBV, rCBF) выполняли в зонах интереса (ROI) пораженных участков мозга и на противоположной стороне.
Статистический анализ данных проводили в программном пакете STATISTICA 6.0 (Лицензия ©2010 Statsoft AXXR003E608729FAN10 от 31.03.2010). Категориальные показатели описывали относительными частотами встречаемости (в %). Количественные показатели, имеющие нормальное распределение, описывали средними значениями и стандартными отклонениями. Нормальность данных проверяли по критерию Шапиро – Уилка. При сравнении нормально распределенных количественных показателей в двух группах использовали критерий Стьюдента для независимых групп, при сравнении нормально распределенных количественных показателей в трех независимых группах однофакторный дисперсионный анализ. При отсутствии нормального распределения количественных показателей или нарушении условия однородности дисперсий для сравнения показателей в трех независимых группах применяли непараметрический критерий Краскела – Уоллиса. Сравнение частот встречаемости в группах проводили по χ2-критерию Пирсона на основе анализа таблиц сопряженности категориальных факторов. Для выявления статистически значимых связей между количественными показателями использовали коэффициент корреляции Спирмена.
Результаты
Сравнивались КТ- и МР-методики в отношении совпадения и корреляции показателей площади ишемического поражения [11]. Не отмечено статистически достоверных различий площади очага инсульта между ВИ и АИ при МРТ: на Т2WI – от 2,33 до 16,89 см2 (7,13 ± 3,78 см2) при ВИ, от 0,5 до 24,59 см2 (7,12 ± 6,82 см2) при АИ; на Т2FLAIR – от 0,79 до 17,54 см2 (6,87 ± 3,94 см2) при ВИ, от 0,5 до 23,95 см2 (5,89 ± 5,91 см2) при АИ; на DWI – от 2,67 до 16,74 см2 (7,16 ± 3,88 см2) при ВИ, от 1,67 до 30,33 см2 (8,31 ± 7,75 см2) при АИ; на ADC – от 2,37 до 14,37 см2 (6,35 ± 3,71 см2) при ВИ, от 1,25 до 34,4 см2 (7,53 ± 7,63 см2) при АИ [12]. На картах СBV при ПКТ размеры очагов при ВИ варьировали от 1,82 до 16,48 см2 (6,56 ± 3,94 см2), при АИ – от 1,5 до 32,57 см2 (9,53 ± ± 9,44 см2), достоверных различий не отмечено ( р > 0,05).
Повышением МР-сигнала на Т2WI и Т2FLAIR, а также понижением (от малозаметного до умеренного) на Т1WI отражались очаги ишемии как при ВИ, так и при АИ. В 90% случаев форма очагов ВИ была неправильной, а контуры неровными и нечеткими, тогда как границы очагов АИ чаще описывались как ровные и четкие. Определение локализации и границ перифокальной зоны выполнялось по совокупной оценке несоответствия участков различной интенсивности на T2WI, Т2FLAIR, DWI, ADC и картах перфузии.
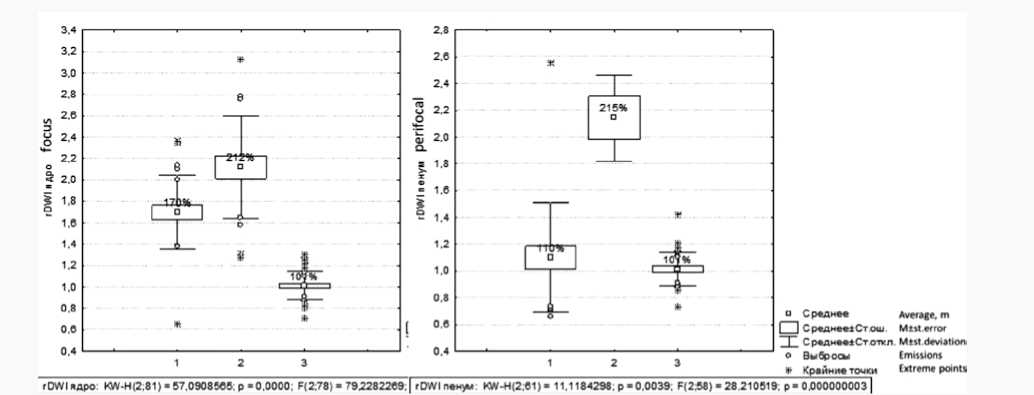
В исследовании были зарегистрированы достоверные различия средних значений отношения интенсивности сигнала на DWI (рис. 1а) в центральных зонах инсуль- та по отношению к здоровой стороне (rDWI, в %) между группами ВИ, АИ и КГ. Тот же показатель в перифокальных зонах достоверно различался (рис. 1б) между группами ВИ и АИ, АИ и КГ, тогда как между группами ВИ и КГ достоверных различий не отмечено.
a
б
Рис. 1. Разброс относительных значений интенсивности МР-сигнала (rDWI) при магнитно-резонансной томографии: в центральной зоне фокусе/ ядре очага ( а ) и в пенумбре/перифокально ( б ) в исследуемых группах (группы по оси х: 1 – ВИ, 2 – АИ, 3 – КГ)
Fig. 1. Dispersion of the relative values of the magnetic resonance signal intensity (rDWI) on magnetic resonance imaging: in the central zone i.e. the focus ( a ) and in the penumbra/perifocal area ( b ) in the studied groups (groups along the x axis: 1 – venous stroke, 2 – arterial stroke, and 3 – control group)
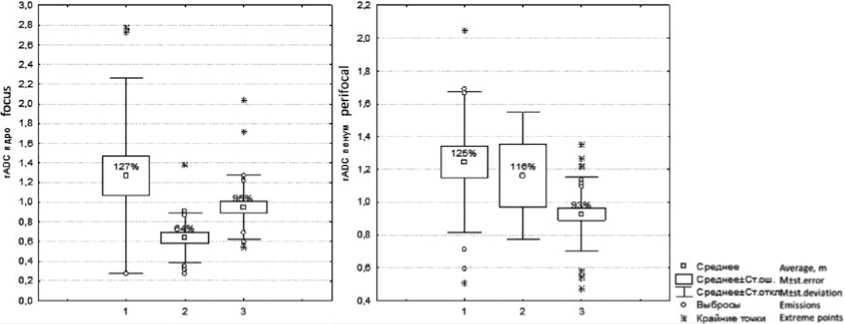
Были зарегистрированы следующие средние значения и стандартные отклонения ADC: для центральных зон (ядра) инфаркта – 0,14 ± 0,02*10-3 мм2/с при АИ и 0,20 ± 0,03*10-3 мм2/с при ВИ; для перифокальных зон по периферии очагов ВИ – 0,46 ± 0,02*10-3 мм2/с, что достоверно отличало их от значений в непораженных зонах «здорового» полушария (ADC = 0,76 ± 0,07*10-3 мм2/с при ВИ и 0,69 ± 0,06*10-3 мм2/с при АИ). Средней верхней границей диапазона ADC в перифокальных зонах при ВИ в сроки до 48 ч были значения 0,82 ± 0,05*10-3 мм2/с. При этом сигнал был выше, чем в зоне ядра ишемии даже визуально. Зарегистрированы достоверные различия средних относительных значений истинного коэффициента диффузии (rADC) между группами ВИ и АИ (рис. 2) в области ядра/центральной части инсульта по отношению к здоровой стороне. В группе ВИ rADC имел значения от 26 до 277%, в группе АИ – от 26 до 138%, в КГ показатель стремился к 100%.
Значения rADC в перифокальных зонах достоверно отличались только между группами ВИ (диапазон от 50 до 204%) и КГ (в среднем 92%), тогда как между группами ВИ и АИ (диапазон от 80 до 168%), а также между АИ и КГ достоверных различий не было зарегистрировано.
| -ADC —дро KW-H(2,77) - 12.«070628, p-0,0018, F( 2,74) - 5 3732431 ^ .ЮС п«-у» KW-HR57) - 032730108, р - 0 0070, F|2,Ml-0,34030882 р-000М| a б
Рис. 2. Разброс относительных значений измеряемого коэффициента диффузии (rADC) в процентах при магнитно-резонансной томографии: в фокусе/ядре очага (а) и в пенумбре/перифокально (б) (группы по оси х: 1-ВИ, 2-АИ, 3-КГ)
Fig. 2. Dispersion of the relative values of apparent diffusion coefficient (rADC) on MRI (in percent): in the focus/nucleus of the lesion (a) and in the penumbra/perifocal area (b) (groups along the x axis: 1 – venous stroke, 2 – arterial stroke, and 3 – control group)
Пик цитотоксического отека при АИ отмечается обычно на 5–7-е сут, затем постепенно присоединяется вазогенный межклеточный отек, характеризующийся снижением сигнала на DWI и инверсией (повышением) на картах ADC. Для венозной ишемии сроки инверсии сигнала на DWI и ADC оказались смещены ближе к манифестации клиники (между 24 и 48 ч от начала заболевания) [12], что, возможно, является относительным явлением [9], связанным с подострым развитием ВИ.
В перифокальной зоне (на периферии зоны цитотоксического отека) ранняя инверсия МР-сигнала была обнаружена в течение 48 ч в 68% случаев ВИ. Отмечалась негомогенность очагов с разнородным сигналом (гипоинтенсивные и гиперинтенсивные зоны на DWI, рис. 3). Появление гипоинтенсивных участков на фоне повышенного сигнала (инверсия сигнала) на ADC зарегистрировано при ВИ в 52% случаев, при АИ появление отмечено только в 6% случаев инсульта. Низкий сигнал на DWI может быть отражением кровоизлияния. Однако дополнительное выполнение последовательностей градиентного эхо – Т2* (или HEMO, SWI, SWAN в зависимости от производителя оборудования) или нативной КТ позволяет исключить первичную геморрагию. Вторичная геморрагическая трансформация к концу первой недели заболевания в виде появления гиперденсных участков на фоне ишемических очагов пониженной плотности на нативных КТ-изображениях была зарегистрирована при первично негеморрагическом ВИ в 27%, при АИ – в 9%. Фактором вторичного геморрагического преобразования очагов инсульта считают вазогенный отек как элемент анатомической недостаточности гематоэнцефалического барьера вследствие эндотелиальной дисфункции [13]. Кроме того, нами, обнаружен дополнительный фактор – полнокровие/гиперемия в центральных зонах ишемии без развития инфаркта и в перифокальных зонах, если инфаркт/некроз развился.
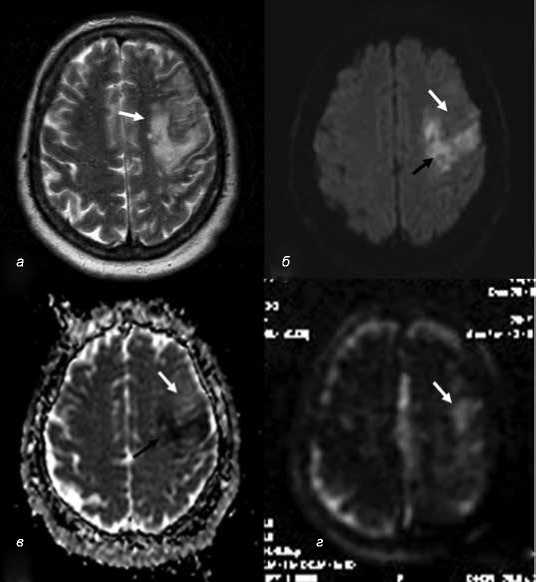
Рис. 3. Венозный инсульт с локализацией в левой лобно-теменной области при тромбозе поперечного и сигмовидного дуральных синусов слева: а ) на Т2WI очаг имеет неровные нечеткие контуры и неравномерно повышенный сигнал; б ) на DWI ( b = 1000) в той же зоне различаются участки с повышенным сигналом (цитотоксический отек – черная стрелка) и слегка пониженным сигналом (вазогенный отек – белая стрелка); в ) на ADC-карте в зоне цитотоксического отека сигнал низкий (черная стрелка, в зоне вазогенного отека – слегка повышен (белая стрелка); г ) на CBF карте PASL МРТ в зоне, соответствующей вазогенному отеку, сигнал повышен (белая стрелка) – признаки гиперемии/гиперперфузии
Fig. 3. Venous stroke with localization in the left fronto-parietal region in the case of thrombosis of the transverse and sigmoid dural sinuses on the left: a ) the focus on T2WI has uneven fuzzy contours and inhomogeneously increased signal; b ) the areas with an increased signal ( b = 1000) on DWI are discernable in the same zone (black arrow indicates cytotoxic edema) and a slightly decreased signal (white arrow indicates vasogenic edema); c ) the signal on the ADC map in the area of cytotoxic edema is low (black arrow) and in the area of vasogenic edema is slightly increased (white arrow); d ) the signal on the PASL MRI cerebral blood flow map in the area corresponding to vasogenic edema is increased (white arrow) showing signs of hyperemia/hyperperfusion
Анализ изменений показателей перфузии мозга, по данным ПКТ, выявил определенные значимые различия фокальных и перифокальных паттернов повреждения при ВИ и АИ. В группе АИ отмечались характерные изменения (аперфузия в зоне ядра инфаркта/некроза и гипо-перфузия/олигемия перифокально/в пенумбре). В группе ВИ регистрировались параметры перфузии, соответствующие фокальной ишемии центральных зон поражения (с уменьшением rCBF в среднем на 23,5%, а rCBV на 12%) и полнокровию перифокальных зон с отклонением в сторону увеличения (rCBF в среднем на 28%, а rCBV в среднем на 27%). Полнокровие было зарегистрировано в отсутствие признаков некроза и при регистрации таковых в областях, соответствующих наибольшим изменениям на T2WI, перифокально. Наряду с выраженным удлинением времени транзита контраста в группе АИ (в среднем rMTT на 90% в центральной части и на 68% в перифокальной зоне) и в фокусе поражения при ВИ (в среднем на 70%) мы регистрировали умеренное удлинение при ВИ пе-рифокально (в среднем на 27%). Некроз в центральной части фокуса повреждения развился в половине случаев ВИ и в ¾ случаев АИ.
В тех случаях, когда удавалось получить удовлетворительное качество изображения МРТ, по методике PASL оценивались относительные значения регионарного мозгового кровотока (rCBF) в пределах тех зон, что отражали ненормальную перфузию при ПКТ. Значения rASL при ВИ и АИ в центральных зонах, соответствующих цитотоксическому отеку, между собой не различались (80 и 84% соответственно), однако достоверно отличались от КГ.
Перифокальные зоны умеренной гиперемии/гиперпер-фузии при ВИ гиперинтенсивны на PASL изображениях и соответствовали территориально зонам вазогенного отека, определяемого на DWI и ADC, а также зонам смешанного сигнала на T2WI (рис. 3 г ), значение rASL при ВИ было 121%, при АИ – 93%, без достоверных различий между ними, но с различием обеих групп от КГ.
С целью поиска связи между более ранним развитием при ВИ элементов вазогенного отека на МРТ и выявленными особенностями гемодинамики этих же зон при ПКТ (гиперемия при ВИ против олигемии при АИ) мы рассмотрели корреляции возможных к подсчету радиологических показателей МРТ и ПКТ по методике Спирмена (таблица).
Таблица. Таблица корреляций радиологических показателей магнитно-резонансной и перфузионной компьютерной томографии при построении прямоугольной матрицы по Спирмену (выделены значимые корреляции на уровне p < 0,05; S – площадь в см2)
Table. Correlations of radiological parameters of magnetic resonance imaging and perfusion computed tomography while constructing a rectangular matrix according to Spearman (significant correlations at the level of p < 0.05 are highlighted; S is area in cm2)
|
МРТ-MRI/ ПКT-pCT |
S DWI, см2 cm2 |
rDWI ядро/ central zone |
rDWI перифок/ perifocal |
S ADC, см2 cm2 |
rADC ядро/ central zone |
rADC перифок/ perifocal |
S Т2WI, см2 cm2 |
S T2FLAIR, см2 cm2 |
|
S CBV, см2 cm2 |
0,95 |
0,12 |
0,13 |
0,83 |
–0,31 |
–0,26 |
0,86 |
0,56 |
|
rMTT ядр/ central zone, % |
0,04 |
0,04 |
0,41 |
0,14 |
0,08 |
–0,27 |
0,09 |
0,02 |
|
rCBF ядр/ central zone, % |
–0,12 |
–0,34 |
–0,40 |
–0,18 |
0,06 |
0,13 |
–0,11 |
–0,02 |
|
rCBV ядр/ central zone, % |
–0,18 |
–0,21 |
–0,04 |
–0,21 |
–0,08 |
0,25 |
–0,10 |
–0,01 |
|
rMTT перифок/ perifocal, % |
0,29 |
0,24 |
0,44 |
0,28 |
–0,18 |
–0,11 |
0,23 |
–0,04 |
|
rCBF перифок/ perifocal, % |
–0,10 |
–0,15 |
–0,40 |
–0,05 |
0,35 |
0,04 |
0,00 |
0,06 |
|
rCBV перифок/ perifocal, % |
–0,05 |
0,21 |
0,59 |
0,05 |
–0,00 |
0,14 |
0,02 |
–0,05 |
Площадь очагов (S, см2) на картах rСBV сильно коррелировала ( r = 0,95) с площадью очагов на DWI, площадью очагов при картировании ADC ( r = 0,83), площадью очагов при импульсной Т2WI последовательности ( r = 0,86) и имела статистически значимую корреляционную связь средней силы ( r = 0,56) с площадью поражения на градиентных Т2FLAIR изображениях. Кроме того, была оценена значимая связь между показателями перфузии и диффузии. Достоверно коррелировали между собой rMTT (ПКТ) и rDWI (МРТ) в перифокальной зоне ( r = 0,44); rCBV при ПКТ и rDWI при МРТ в перифокальной зоне ( r = 0,59).
В 25% случаев ВИ в течение 1–2 нед. произошел полный регресс неврологического дефицита, в остальных случаях имело место улучшение. Отмечался скорый (чаще в течение 1–3 дней) регресс общемозговых симптомов. При АИ полного регресса очагового дефицита мы не наблюдали. Исход в виде улучшения состояния при ВИ – 66%, при АИ – 57%. Вероятно, это отчасти связано с более молодым возрастом пациентов в группе ВИ и, соответственно, большей пластичностью мозга. Ухудшение и летальный исход, в совокупности имея равное представительство в обеих группах (по 15%), разделялись между собой в следующих пропорциях: при ВИ в сравнении с АИ случаев ухудшения состояния было в 3 раза больше, но летальный исход зарегистрирован в 2 раза меньше. Ухудшение состояния пациентов при ВИ было связано с вторичным кровоизлиянием [14].
В 6 случаях из 8 при контрольном исследовании пациентов с ВИ в динамике от 3 нед. до 1 года не удалось обнаружить следы очага венозной ишемии: на DWI признаков отека выявлено не было (рис. 4г), в том числе уже через 3 нед. при таламическом инсульте. На Т2FLAIR изображениях очаг в 3 случаях не визуализировался, в 2 случаях его интенсивность была значительно ниже (рис. 4в), хотя лишь в 2 из 8 случаев зарегистрировано восстановление кровотока по пораженным венозным структурам.
Обсуждение
На изменении сигнала Т2WI была основана классификация венозной ишемии [15]: тип 1 – нет изменений; тип 2 – сигнал повышен, но контрастного усиления после в/в введения гадолиния нет; тип 3 – сигнал повышен, и после в/в введения гадолиния есть контрастное усиление; тип 4 – венозный инфаркт или кровоизлияние. Данная классификация не включает в себя теперь повсеместно используемые в диагностике инсульта Т2FLAIR и DWI, поэтому, на наш взгляд, может иметь лишь ограниченное применение. Отличить по степени повышения сигнала на Т2WI очаг некроза с цитотоксическим отеком от вазогенного отека довольно затруднительно.
Однако обширность повышения сигнала Т2WI свидетельствует о вазогенном отеке [16], а выявленная нами значительной силы корреляция между значениями измерений площади на T2WI и rCBV ( r = 0,86) важна, так как говорит о высокой значимости считающейся очень чувствительной последовательности Т2WI в арсенале МРТ.
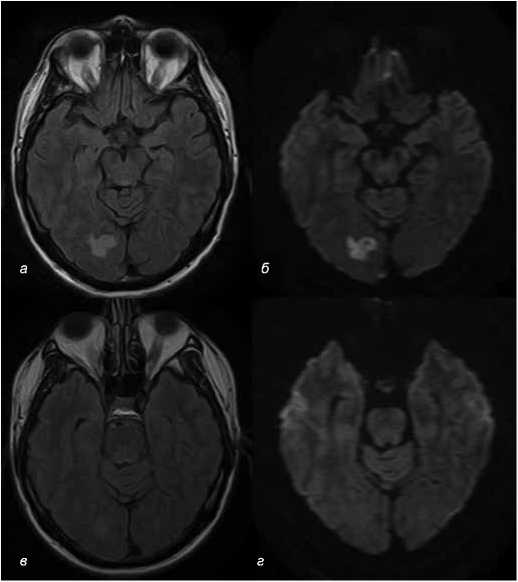
Рис. 4. Динамика интенсивности сигнала очага венозного ишемического инсульта в правой затылочной доле при тромбозе правого поперечного дурального синуса без развития инфаркта/некроза ( а – на первичном Т2FLAIR; б – на первичном DWI) через 3 мес. при повторном МР-исследова-нии – значительное уменьшение интенсивности сигнала на Т2FLAIR ( в ) и исчезновение признаков вазогенного отека на DWI ( г )
Fig.4. Signal intensity dynamics in the venous ischemic stroke focus in the right occipital lobe with thrombosis of the right transverse dural sinus without the development of infarction/necrosis ( a – primary T2FLAIR within the first two days; b – primary DWI within the first two days) and after three months with control magnetic resonance imaging: a significant decrease in the signal intensity on T2FLAIR ( c ) and the disappearance of vasogenic edema signs on DWI ( d )
Очевидно, что Т2WI является достаточно точным инструментом оценки поражения при инсульте с чувствительностью и специфичностью 0,74; а при использовании мультипараметрического подхода в оценке сигнала МРТ (Т2WI, T2FLAIR, DWI) и несоответствия площади поражения на T2FLAIR и DWI (DWI/T2FLAIR mismatch) в пределах терапевтического окна, полезным в отношении вероятной тромболитической терапии [17].
Отличительной особенностью ВИ от АИ является частое наличие признаков фокальной и перифокальной ги-перперфузии/гиперемии, по данным ПКТ, в первые часы заболевания и одновременное присутствие признаков цитотоксического и вазогенного отека [18, 19]. Вероятно, что отличить вазогенный отек от цитотоксического можно путем использования МР-режима DWI и ADC-картирования. Вазогенный отек характеризуется изо- или гипоин-тенсивными очагами на DWI [5, 6], а также повышением интенсивности сигнала и истинного коэффициента диффузии ADC.
При острой ишемии первично развивается цитотоксический отек, но с течением времени происходит комбинация набухания клеток и повреждения сосудов. При венозной ишемии рано развивается и вазогенный отек вследствие дисфункции гематоэнцефалического барьера [20]. В зоне ядра ишемии/аперфузии формируется цитотоксический отек, что не сопровождается увеличением объема интерстиция мозга [13], тогда как в области ишемической полутени (перифокально) отек характеризуется накоплением жидкости в интерстициальном про- странстве и трактуется как вазогенный [21], зависимый от повышения проницаемости гематоэнцефалического барьера с интенсивным движением воды во внеклеточное пространство ткани мозга в зависимости от уровня кровяного давления в капиллярах и, наоборот [13]. Так как прогрессирование венозной ишемии ведет к снижению капиллярно-перфузионного давления, необходимого для поддержания адекватной перфузии, круг замыкается, и прогрессирует цитотоксический отек. Однако «и избыточное перфузионное давление может носить негативный характер за счет нарастания потока жидкости в интерстициальное пространство, и также приводить к прогрессированию отека мозга» [22]. Таким образом, мы получили противоречивые данные в виде более раннего развития вазогенного отека в перифокальных зонах венозного инсульта, что с патофизиологической точки зрения является неблагоприятным фактором для развития и усугубления отека и его осложнений и более благоприятного исхода ВИ в клиническом течении заболевания. Вероятно, это связано с тем, что вазогенный отек в большинстве случаев ВИ при ЦВСТ останавливается на этапе, когда может иметь обратное развитие. Такая промежуточная фаза развития отека мозга, по всей видимости, представляет собой «ионный отек с функциональным нарушением проницаемости анатомически сохранного гематоэнцефалического барьера. Фаза ионного отека характеризуется сохранностью межклеточных плотных контактов сосудистого эпителия, исключающей транспорт ма-кромолекул(белков) изкровивинтерстиций. Отеквэтуфазу формируется за счет трансэпителиального потока натрия из сосудистого пространства, вместе с которым для сохранения электронейтральности перемещаются ионы хлора, а для сохранения осмонейтральности – вода» [13].
Значения скорости (rCBF) и объема кровотока (rCBV) при ПКТ в зоне, перифокальной очагу, отражающие умеренную гиперемию при ВИ, отличаются от олигемии при АИ. Парадоксальное укорочение времени транзита контраста при остром инсульте может иметь место в 58% случаев [23], что отражает высокий коллатеральный кровоток. Следовательно, «данные отклонения могут быть приняты как паттерны дифференциальной диагностики этих состояний. Обнаруженные изменения отражают не выраженное уменьшение кровотока при АИ, а умеренное увеличение его при ВИ, то есть доброкачественную гиперемию» [24]. В ситуации, когда некроз формируется, изменения перфузии и диффузии при АИ и ВИ в центральной зоне поражения не отличаются. Если же повреждение обратимое, то при ВИ наблюдается умеренная (доброкачественная) гиперемия/гиперперфузия, тогда как артериальная пенумбра характеризуется оли-гемией/гипоперфузией. А диффузионная МРТ помогает обнаружить на фоне цитотоксического отека ранние элементы вазогенного отека, отражающегося гипо- или изоинтенсивным сигналом на DWI. При АИ вазогенный отек развивается, как правило, не ранее 5–7 сут, поэтому его обнаружение на момент неотложной диагностики – большая редкость. Появление вазогенного отека на фоне цитотоксического в более ранние сроки при ВИ в сравнении с АИ мы и другие авторы [6] считаем особенностью венозного характера повреждения. Ишемия в данных случаях не первична, а вторична и связана с внешней констрикцией питающих область стаза сосудов из-за вазогенного отека [25]. Однако необходимо учитывать и то, что ограничение диффузии может отсутствовать при инсульте в 6,8% случаев, что показал недавний метаанализ [26], поэтому использование комбинации протоколов диффузии и перфузии имеет большие преимущества [27].
Летальность при ЦВСТ в эпоху COVID-19 (включая как случаи от самой инфекции, так и связанные с вакцинацией) значительно возросла (25–40%) [28, 29]. Но прогноз
Список литературы Аспекты лучевой диагностики раннего вазогенного отека в зонах гиперперфузии венозного ишемического инсульта
- Walecki J., Mruk B., Nawrocka-Laskus E., Piliszek A., Przelaskowski A., Sklinda K. Neuroimaging of cerebral venous thrombosis (CVT) - old dilemma and the new diagnostic methods. Pol. J. Radiol. 2015;80:368-373. DOI: 10.12659/PJR.894386.
- Idiculla P.S., Gurala D., Palanisamy M., Vijayakumar R., Dhandapani S., Nagarajan E. Cerebral Venous Thrombosis: A Comprehensive Review. Eur. Neurol. 2020;83(4):369-379. DOI: 10.1159/000509802.
- Семенов С.Е., Портнов Ю.М., Семенов А.С., Шатохина М.Г. Отличительные особенности перфузионно-диффузионного несоответствия при венозном и артериальном инсульте. Диагностическая и интервенционная радиология. 2018;12(2):40-50. DOI: 10.25512/ DIR.2018.12.2.04.
- Семенов С.Е. Параметрические особенности регионарного мозгового кровотока при венозном ишемическом инсульте (лекция). Acta Biomedica Scientifica. 2019;4(3):138-147. DOI: 10.29413/ABS.2019-4.3.18.
- Corvol J.C., Oppenheim C., Manai R., Logak M., Dormont D., Samson Y. et al. Diffusion-weighted magnetic resonance imaging in a case of cerebral venous thrombosis. Stroke. 1998;29(12):2649-2652. DOI: 10.1161/01.str.29.12.2649.
- Труфанов Г.Е., Фокин В.А., Пьянов И.В., Банникова Е.А. Рентгеновская компьютерная и магнитно-резонансная томография в диагностике ишемического инсульта. СПб.: ЭЛБИ-СПб; 2005:192.
- Baird A.E., Warach S. Magnetic resonance imaging of acute stroke. J. Cereb. BloodFlowMetab. 1998;18(6):583-609. DOI: 10.1097/00004647199806000-00001.
- Kauppinen R.A. Multiparametric magnetic resonance imaging of acute experimental brain ischaemia. Prog. Nucl. Magn. Reson. Spectrosc. 2014;80:12-25. DOI: 10.1016/j.pnmrs.2014.05.002.
- Moritani T., Ekholm S., Westesson P.-L. Diffusion-weighted MR imaging of the brain. Berlin Heidelberg: Springer-Verlag; 2005:229. DOI: 10.1007/b13750.
- Saur D., Kucinski T., Grzyska U., Eckert B., Eggers C., Niesen W. et al. Sensitivity and interrater agreement of CT and diffusion-weighted MR imaging in hyperacute stroke. AJNR Am. J. Neuroradiol. 2003;24(5):878-885.
- Семенов С.Е., Молдавская И.В., Жучкова Е.А., Хромов А.А., Хромова А.Н., Шатохина М.Г. и др. Оценка рутинных топоморфометри-ческих критериев мультиспиральной компьютерной томографии и магнитно-резонансной томографии в диагностике негеморрагического инсульта, вызванного церебральным венозным тромбозом. Клиническая физиология кровообращения. 2013;3:37-45.
- Peeters E., Stadnik T., Bissay F., Schmedding E., Osteaux M. Diffusion-weighted MR imaging of an acute venous stroke: case report. AJNR Am. J. Neuroradiol. 2001;22(10):1949-1952.
- Задворнов А.А., Голомидов А.В., Григорьев Е.В. Клиническая патофизиология отека головного мозга (часть 2). Вестник анестезиологии и реаниматологии. 2017;14(4):52-60. DOI: 10.21292/2078-56582017-14-4-52-60.
- Семенов С.Е., Молдавская И.В., Юркевич Е.А., Шатохина М.Г., Семенов А.С. Диагностика венозного ишемического инсульта. Часть I (Клинический полиморфизм). Обзор. Комплексные проблемы сердечно-сосудистых заболеваний. 2019;8(2):125-134. DOI: 10.17802/2306-1278-2019-8-2-125-134.
- Kawaguchi T., Kawano T., Kaneko Y., Ooasa T., Tsutsumi M., Ogas-awara S. Classification of venous ischaemia with MRI. J. Clin. Neurosci. 2001;8(1):82-88. DOI: 10.1054/jocn.2001.0884.
- McGarry B.L., Kauppinen R.A. Chapter 4. Timing the ischemic stroke by multiparametric quantitative magnetic resonance imaging. In: S. Dehkharghani (edit). Stroke [Internet]. Brisbane (AU): Exon Publications; 2021. DOI: 10.36255/exonpublications.stroke. timingischemicstroke.2021. URL: https://www.ncbi.nlm.nih.gov/books/ NBK572006/
- McGarry B.L., Damion R.A., Chew I., Knight M.J., Harston G.W., Carone D. et al. A Comparison of T2 relaxation-based MRI stroke timing methods in hyperacute ischemic stroke patients: A pilot study. J. Cent. Nerv. Syst. Dis. 2020;12(12):1179573520943314. DOI: 10.1177/1179573520943314.
- Lu A., Shen P.Y., Dahlin B.C., Nidecker A.E., Nundkumar A., Lee P.S. Cerebral venous thrombosis and infarct: Review of imaging manifestations. Appl. Radiol. 2016;45(3):9-17.
- Gogineni S., Gupta D., Pradeep R., Mehta A., Javali M., Acharya P.T. et al. Deep cerebral venous thrombosis - A clinicoradiological study. J. Neurosci. Rural. Pract. 2021;12(03):560-565. DOI: 10.1055/s-0041-1730109.
- Рамазанов Г.Р, Коригова Х.В., Петриков С.С. Диагностика и лечение церебрального венозного тромбоза. Журнал им. Н.В. Склифосов-ского Неотложная медицинская помощь. 2021;10(1):122-134. DOI: 10.23934/2223-9022-2021-10-1-122-134.
- Thrane A.S., Rangroo Thrane V., Nedergaard M. Drowning stars: Reassessing the role of astrocytes in brain edema. Trends Neurosci. 2014;37(11):620-628. DOI: 10.1016/j.tins.2014.08.010.
- Durward Q.J., Del Maestro R.F., Amacher A.L., Farrar J.K. The influence of systemic arterial pressure and intracranial pressure on the development of cerebral vasogenic edema. J. Neurosurg. 1983;59(5):803-809. DOI: 10.3171/jns.1983.59.5.0803.
- Doucet C., Roncarolo F., Tampieri D., Del Pilar Cortes M. Paradoxically decreased mean transit time in patients presenting with acute stroke. J. Comput. Assist. Tomogr. 2016;40(3):409-412. DOI: 10.1097/ RCT.0000000000000366.
- Adamczyk P., Liebeskind D.S. Topic review. MRI Perfusion Imaging in Acute Ischemic Stroke. Los Angeles: University of California; 2016. URL: https://www.asnweb.org/files/Residents%20and%20Fellows%20 Section/Case%20Reports/MRI%20Perfusion%20Imaging%20in%20 Acute%20Ischemic%20Stroke%20-%204%2026%2011.pdf
- Семенов С.Е., Коваленко А.В., Хромов А.А., Молдавская И.В., Хромова А.Н., Жучкова Е.А. и др. Критерии диагностики негеморрагического венозного инсульта методами рентгеновской мульти-спиральной компьютерной (МСКТ) и магнитно-резонансной (МРТ) томографии. Комплексные проблемы сердечно-сосудистых заболеваний. 2012;(1):43-53. DOI: 10.17802/2306-1278-2012-1-43-53.
- Edlow B.L., Hurwitz S., Edlow J.A. Diagnosis of DWI-negative acute ischemic stroke: A meta-analysis. Neurology. 2017;89(3):256-262. DOI: 10.1212/WNL.0000000000004120.
- Campbell B.C., Macrae I.M. Translational perspectives on perfusion-diffusion mismatch in ischemic stroke. Int. J. Stroke. 2015;10(2):153-162. DOI: 10.1111/ijs.12186.
- Hameed S., Wasay M., Soomro B.A., Mansour O., Abd-Allah F., Tu T. et al. Cerebral venous thrombosis associated with COVID-19 infection: An observational, multicenter study. Cerebrovasc. Dis. Extra. 2021;11(2):55-60. DOI: 10.1159/000516641.
- Ferro J.M., de Sousa D.A., Coutinho J.M., Martinelli I. European stroke organization interim expert opinion on cerebral venous thrombosis occurring after SARS-CoV-2 vaccination. Eur. Stroke J. 2021;6(3):CXVI-CXXI. DOI: 10.1177/23969873211030842.
- Anadure R.K., Wilson V., Sahu S., Singhal A., Kota S. A study of clinical, radiological and etiological profile of cerebral venous sinus thrombosis at a tertiary care center. Med. J. Armed. Forces India. 2018;74(4):326-332. DOI: 10.1016/j.mjafi.2017.11.004.


