Ассоциация гена IGF2 с продуктивными качествами свиней ( Sus scrofa) крупной белой породы с учетом половой дифференциации
Автор: Костюнина О.В., Крамаренко С.С., Свеженцева Н.А., Сизарева Е.И., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические основы маркерной селекции, трансгенез
Статья в выпуске: 6 т.50, 2015 года.
Бесплатный доступ
Маркерная селекция - перспективный подход для улучшения хозяйственно полезных признаков домашних животных. В качестве одного из потенциальных генетических маркеров мясных и откормочных качеств свиней рассматривается ген инсулиноподобного фактора роста 2 ( IGF2 ). Целью настоящей работы стало исследование полиморфизма G3072A в гене IGF2 у свиней различных пород и изучение влияния генотипа хряков по IGF2 на продуктивные показатели у потомков с учетом их половой принадлежности на примере крупной белой породы. Полиморфизм IGF2 исследовали у 3215 свиней семи пород - крупная белая и родственные ей породы йоркшир и эдельшвайн (КБ, n = 1247), ландрас (Л, n = 934), дюрок (Д, n = 642), пьетрен (П, n = 87), белорусская мясная (БМ, n = 37), ливенская (ЛИВ, n = 54), эстонская беконная (ЭБ, n = 10), а также у синтетической линии боди (БД, n = 138) и одного терминального кросса (ТМ, n = 66). Для ассоциативных исследований использовали данные по показателям продуктивности у 5908 потомков (5015 свинок и 893 хрячка, крупная белая порода), полученных от хряков ( n = 20) с известным генотипом по IGF2. Учитывали живую массу по завершении выращивания (BW, кг); среднесуточный прирост за весь срок (DG, г) и по периодам выращивания: ранний период - от рождения до 76,41±0,04 сут (DG1, г) и поздний период - от 76,41±0,04 до 170,23±0,05 сут (DG2, г); возраст достижения массы 100 кг (AGE 100kg, сут); среднюю фактическую толщину шпика, измеренную по четырем точкам по завершении выращивания (BF, мм), и толщину шпика, приведенную к 100 кг (BF 100kg, мм). Достоверно более высокие частоты потенциально желательного аллеля А и генотипа АА выявлены у БД (соответственно 0,986 и 0,971), ТМ (0,977 и 0,955), П (0,966 и 0,931) и Д (0,960 и 0,921). Свиньи КБ характеризовались промежуточными значениями этих показателей (0,664 и 0,532). У ЭБ, БМ и Л частота аллеля A варьировала от 0,250 до 0,363, генотипа АА - от 0,100 до 0,243. У локальной породы ЛИВ аллель А идентифицирован не был. По результатам ассоциативных исследований установлена высокодостоверная тенденция к повышению BW, DG1, DG2, DG, BF и BF 100kg и снижению AGE 100kg как у свинок, так и у хрячков в ряду генотипов GG → AG → AA. Расчеты с использованием аддитивно-доминантной модели и двухфакторного дисперсионного анализа свидетельствовали, что интенсивность возрастания (снижения) перечисленных выше показателей в ряду генотипов GG → AG → AA среди хрячков выше, чем среди свинок. Согласно результатам анализа главных компонент (ГК, PCA), первые две ГК (ГК1 и ГК2) описывали 76,23 % изменчивости исходной матрицы для хрячков и 82,49 % - для свинок. Выявлена сильная связь ГК1 с приростом живой массы в поздний срок (для DG2 r = 0,501 у хрячков и r = 0,896 - у свинок) и за весь период выращивания (для DG r = 0,923 и r = 0,929), в то время как ГК2 сильно коррелировала с приростом живой массы в ранний период (для DG1 r = -0,709 и r = -0,769). Показатели аддитивно-доминантной (А и D) модели и эффекты замены аллеля, рассчитанные для ГК1, оказались полностью сходными и не зависели от пола: А = 0,290, p
Свиньи, крупная белая, популяция, откормочные качества, пцр, мутация
Короткий адрес: https://sciup.org/142133637
IDR: 142133637 | УДК: 636.4:636.018:575.162 | DOI: 10.15389/agrobiology.2015.6.736rus
Текст научной статьи Ассоциация гена IGF2 с продуктивными качествами свиней ( Sus scrofa) крупной белой породы с учетом половой дифференциации
Идентификация ДНК-маркеров, оказывающих функциональное влияние или сцепленных с локусами количественных признаков (quantitative trait loci, QTL), и их интродукция в программы селекционно-племенной работы — перспективный способ более результативного генетического совершенствования сельскохозяйственных животных. Молекулярно-генетический подход особенно актуален, если признаки использовались в ряду поколе-736
ний в качестве основных селекционных и потенциал традиционных методов их оценки и отбора практически полностью реализован (1).
Интенсивность роста (скороспелость) — один из главных экономически значимых признаков сельскохозяйственных животных. Селекция по этому показателю в течение нескольких десятков лет позволила получить линии свиней с высоким приростом живой массы. Так, у свиней породы дюрок (селекционная программа Канадского центра совершенствования свиней — Canadian Center for Swine Improvement, CCSI) возраст достижения массы 100 кг, который в 1980 году составлял более 180 сут, снизился до 150 сут в 2013 году (по результатам тестирования 10792 животных в 53 стадах) (2). Дальнейший прогресс в селекции связывают с разработкой программ, основанных на идентификации и использовании ДНК-маркеров, ассоциированных с интенсивностью роста (3). Исходя из влияния на миогенез, участия во многих процессах метаболизма и дифференцировки, к потенциально значимым ДНК-маркерам скороспелости относят ген инсулиноподобного фактора роста 2 — IGF2 (4-6). Он локализован на дистальном конце 2-й хромосомы свиней (7). Установлено (8) и многократно подтверждено в разных популяциях (6, 9-12) существенное влияние мутации G3072A в интроне 3 гена IGF2 на скорость роста, увеличение мышечной массы и отложение жира у животных. Замена A → G происходит от китайских свиней и проникла в западные коммерческие линии благодаря фенотипическому проявлению (13). Она нарушает сайт связывания репрессора ядерного фактора, в результате чего наблюдается 3-кратная постнатальная сверхэкспрессия мРНК IGF2 в скелетных мышцах у свиней, унаследовавших эту мутацию от отца (8). D. Gardan с соавт. (14) изучали влияние генотипа по IGF2 на адипоциты и подкожные ткани и подтвердили, что экспрессия мРНК IGF2 была выше в мышцах (но не в подкожных тканях) свиней, унаследовавших аллель А . Различий в количестве адипоцитов между группами они не выявили, но отметили снижение размера адипоцитов у потомков хряков с аллелем А . Авторы пришли к выводу, что мутация IGF2 способствует гипертрофии мышечных волокон и уменьшает развитие жировых клеток в подкожной ткани. K. Van den Maagdenberg с соавт. (15) при исследовании влияния IGF2 на протеолитическую и липолитическую активность ферментов обнаружили, что свиньи, унаследовавшие отцовский аллель А , имели относительно большую массу при убое, что, вероятно, связано со сниженной деградацией белка.
Преимущество использования IGF2 как маркера — установленный патернальный характер экспрессии (матернальный импринтинг), что позволяет влиять на продуктивность потомства независимо от генотипа матерей, а также позитивное влияние потенциально желательного с точки зрения откормочных качеств аллеля А на воспроизводительные качества (16).
Интеграции IGF2 в качестве маркера в программы селекционноплеменной работы должна предшествовать количественная оценка влияния генотипа по IGF2 на продуктивные показатели потомства (на репрезентативной выборке). Поскольку при определении племенной ценности используются как хрячки, так и свинки, актуален вопрос о том, зависит ли это влияние от пола животных.
Целью настоящих исследований была характеристика аллелофонда свиней разных пород по IGF2 и изучение воздействия генотипа отцов по IGF2 на продуктивные показатели их потомков с учетом половой принадлежности (на примере крупной белой породы).
Методика. Характеристику аллелофонда свиней по IGF2 проводили на 3215 животных следующих пород: корня крупной белой породы (КБ) — крупной белой, йоркшир, эдельшвайн (26 групп, n = 1247), ландрас (Л, 21 группа, n = 934), дюрок (Д, 17 групп, n = 642), пьетрен (П, 3 группы, n = 87), белорусской мясной (БМ, 1 группа, n = 37), ливенской (ЛИВ, 1 группа, n = 54), эстонской беконной (ЭБ, 1 группа, n = 10), а также синтетической линии боди (БД, 1 группа, n = 138) и одного терминального кросса (ТМ, 2 группы, n = 66) (всего более 20 хозяйств из разных областей). Материалом для молекулярно-генетических исследований служили пробы ткани (ушной выщип). ДНК выделяли с помощью набора реагентов Nexttec согласно рекомендациям производителя («Nexttec™ Biotechnologie GmbH», Германия). Полиморфизм IGF2 в позиции G3072A определяли посредством пиросеквенирования по методике A.-S. Van Laere с соавт. (8).
Для ассоциативных исследований пользовались данными племенного учета продуктивных показателей у 5908 свиней крупной белой породы (5015 свинок и 893 хрячка; генетическое ядро, ООО «Знаменский селекционно-гибридный центр», Орловская обл.), полученных от хряков ( n = 20), предварительно генотипированных по IGF2 . Учитывали живую массу по завершении откорма (BW, кг); возраст достижения массы 100 кг (AGE100kg, сут); среднюю фактическую толщину шпика, измеренную по четырем точкам, при фактической живой массе (BF, мм) и толщину шпика, приведенную к 100 кг (BF100kg, мм); среднесуточный прирост за весь срок (DG, г) и по периодам выращивания: ранний период — от 0 до 76,41±0,04 сут (DG1, г), поздний период — от 76,41±0,04 до 170,23±0,05 (DG2, г).
Аддитивную (A) и д о мин а нтную ( D ) ком п онен т ы модели р асс ч ит ы вали по формулам: А = X 22 - X 11; D = X 12 - ( X 11 + X 22)/2, где X 11, X 12, X 22 — средние арифметические оценки показателя продуктивности для соответственно генотипов GG , AG и AA .
Уровень значимости для A и D оценивали с использованием модели множественной линейной регрессии: Y = µ + A X 1 + D X 2 + e, где Y — показатель продуктивности; µ — генеральное среднее; X 1 — кодовая переменная, которая равна - 1 для генотипа GG , 0 — для генотипа AG и +1 — для AA ; X 2 — кодовая переменная, которая равна 0 для генотипов GG и AA и +1 — для генотипа AG ; е — случайная компонента.
Э ф фект аллелей G и A оценива л и, как α 1 = m1 - X , α 2 = m2 - X , где m1 = p • X 11 + q • X 12, m2 = p • X 12 + q • X 22 (p и q — соответственно частота аллелей G и A , X — общее среднее арифметическое для всей группы). Эффект замены аллелей рассчитывали как 2 - 1 • α ( G → A ) = ( α 2 - α 1) • 2 - 1.
Все расчеты проводили в соответствии с описанием (17). Статистическую гипотезу о сходном уровне связи между показателями продуктивности и генотипом по локусу IGF2 среди свиней разного пола проверяли посредством двухфакторного дисперсионного анализа (two-way ANOVA). Анализ главных компонент (principal components analysis, PCA) выполняли на основе корреляционно-ковариационной матрицы семи исследованных признаков продуктивности (отдельно для свинок и хрячков) для выявления латентных признаков, вносящих наибольший вклад в изменчивость свиней в зависимости от их генотипа по локусу IGF2 . Для расчетов использовали программное обеспечение Statistica v. 6.0.
Результаты. Достоверно более высокую встречаемость потенциально желательного аллеля А выявили у свиней пород БД, П, Д, ТМ, используемых в качестве отцовских на втором этапе скрещивания (гибридизации). Свиньи КБ характеризовались промежуточными значениями этого показателя, что, по всей видимости, было следствием их селекции как по мясным и откормочным, так и по воспроизводительным качествам. Относительно низкую частоту аллеля А у свиней Л, а также у породы БМ, полученной на основе ландрасов, можно рассматривать как следствие существенного давления отбора по воспроизводительным качествам. В локальной породе ЛИВ аллель
А не был идентифицирован.
-
1. Распределение частот аллелей гена IGF2 у свиней разных пород (P±Sp)
-
2. Результаты однофакторного дисперсионного анализа (one-way ANOVA), оценивающего влияние генотипа отца по IGF2 на показатели продуктивности потомства у свиней крупной белой породы
Признак
Пол
Генотип
F
p
GG ( n = 976)
AG ( n = 1046)
AA ( n =
2993)
X
S X
X
S X
X
S X
BW
?
100,9
0,32
105,3
0,33
109,0
0,21
211,1
0,0001
5
110,3
1,16
113,1
1,03
118,2
0,59
20,3
0,0001
DG1
?
441,6
1,55
450,8
1,54
454,8
0,97
24,2
0,0001
5
458,0
5,09
456,2
3,82
472,5
2,30
8,2
0,0003
DG2
?
713,9
2,75
756,4
3,16
791,0
1,90
226,3
0,0001
5
802,0
10,33
857,4
27,80
922,9
23,18
3,5
0,0318
DG
?
585,4
2,01
612,2
2,03
633,6
1,32
186,8
0,0001
5
640,0
6,71
657,5
6,48
692,0
4,39
18,1
0,0001
AGE 100kg
?
170,6
0,53
163,1
0,51
157,8
0,30
226,5
0,0001
5
156,1
1,68
152,9
1,46
145,4
0,78
21,5
0,0001
-
3. Параметры аддитивно-доминантной модели зависимости продуктивных показателей у свинок и хрячков крупной белой породы от генотипа отцов по IGF2
Признак
Свинки
Хрячки
A
D 2 -
1• α ( G → A )
A
D 2 - 1
• α ( G → A )
BW
4,068***
0,402ns
1,951
3,950*
- 0,961ns
2,277
DG1
6,581***
2,574ns
2,771
7,246*
- 9,019*
6,034
DG2
38,532***
3,908ns
18,461
60,442*
- 3,131ns
31,567
DG
24,105***
2,685ns
11,501
25,997***
- 7,570ns
15,286
AGE 100kg
- 6,405***
- 1,083ns
- 2,981
- 5,368***
1,822ns
- 3,253
BF
0,598***
0,005ns
0,297
0,859***
0,317ns
0,362
BF 100kg
0,113***
- 0,040ns
0,063
0,375***
0,351**
0,109
|
Порода/кросс |
Аллель А |
Аллель G |
|
БД |
0,986±0,007 f, m, p, z, D, F |
0,014±0,007 f, m, p, z, D, F |
|
ТМ |
0,977±0,013 d, l, v, x, y |
0,023±0,013 d, l, v, x, y |
|
П |
0,966±0,014 c, k, s, t, u |
0,034±0,014 c, k, s, t, u |
|
Д |
0,960±0,005 b, j, o, p, q, r |
0,040±0,005 b, j, o, p, q, r |
|
КБ |
0,664±0,009 a, b, c, d, e, f, g, h |
0,336±0,009 a, b, c, d, e, f, g, h |
|
Л |
0,363±0,013 a, j, k, l, m, n |
0,637±0,013 a, j, k, l, m, n |
|
БМ |
0,338±0,055 e, o, s, v, z, B |
0,662±0,055 e, o, s, v, z, B |
|
ЭБ |
0,250±0,097 h, n, r, u, y, F, G |
0,750±0,097 h, n, r, u, y, F, G |
|
ЛИВ |
0,00 g, q, t, x, B, D, G |
1,00 g, q, t, x, B, D, G |
П р и м еч а ни е. БД — боди, ТМ — терминальный кросс, П — пьетрен, Д — дюрок, КБ — породы корня крупной белой (крупная белая, йоркшир, эдельшвайн), Л — ландрас, БМ — белорусская мясная, ЭБ — эстонская беконная, ЛИВ — ливенская. Исследованные породы приведены в порядке снижения частоты встречаемости желательного аллеля A по IGF2 . Для a, b, c, d, e, f, g, h, j, k, l, m, n, o, q, r, s, t, u, v, x, y, z, B, D, F различия между группами, отмеченными одной буквой, достоверны при p ≤ 0,001; для p, C — при p ≤ 0,01; для I, w, A, E, G — при p ≤ 0,05.
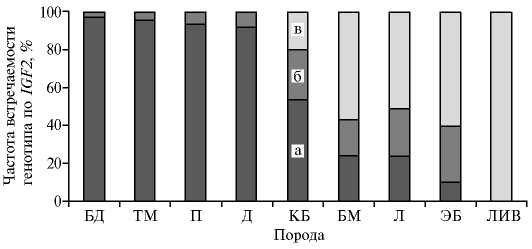
Рис. 1. Распределение частот генотипов АА (а) , AG (б) и GG (в) по IGF2 у свиней различных пород: БД — боди, ТМ — терминальный кросс, П — пьетрен, Д — дюрок, КБ — породы корня крупной белой (крупная белая, йоркшир, эдельш-вайн), БМ — белорусская мясная, Л — ландрас, ЭБ — эстонская беконная, ЛИВ — ливенская. Исследованные породы приведены в порядке снижения частоты желательного генотипа AA .
Частота желательного генотипа AA у свиней отцовских форм БД, ТМ, П, Д была на 38,942,3 % выше, чем у КБ (p < 0,001), на 67,7-73,4 % выше, чем у БМ и Л (p < 0,001) и на 82,187,1 % выше, чем у ЭБ (p < 0,001) (рис. 1).
Полученные данные о распределении частот аллелей и генотипов дают основание полагать, что проводимая в течение ряда поколений селекция по мясным и откормоч- ным качествам способствовала преимущественному закреплению в популяциях свиней мясных пород аллеля A и, наоборот, вымыванию аллеля G по IGF2.
Ассоциативные исследования на свиньях крупной белой породы показали, что признаки продуктивности у потомства (как свинок, так и хрячков) в значительной степени определялись генотипом их отцов по IGF2 (табл. 2). При этом просматривалась высокодостоверная тенденция к повышению показателей BW, DG1, DG2, DG, BF и BF1 00 kg и снижению показателя AGE100kg в ряду генотипов GG ^ AG ^ AA (см. табл. 2).
Продолжение таблицы 2
Детальный анализ проявления показателей продуктивности у потомства в зависимости от генотипа отцов по IGF2 , проведенный с использованием аддитивно-доминантной модели, показал достоверность оценок для аддитивной компоненты (как для свинок, так и для хрячков), хотя степень проявления этой компоненты чаще была выше для свинок (табл. 3).
П р и м еч а ни е. A и D — соответственно аддитивная и доминантная компоненты модели; 2 - 1• α ( G → A ) — эффект замены аллелей; BW — живая масса по завершении откорма, кг; DG1 — среднесуточный прирост в ранний период выращивания (от рождения до 76,41±0,04 сут), г; DG2 — среднесуточный прирост в поздний период выращивания (от 76,41±0,04 до 170,23±0,05 сут), г; DG — среднесуточный прирост за весь период выращивания, г; AGE100kg — возраст достижения массы 100 кг, сут; BF — средняя толщина шпика в четырех точках при фактической живой массе при снятии с откорма, мм; BF100kg — средняя толщина шпика в четырех точках, приведенная к живой массе 100 кг, мм.
* p < 0,05; ** p < 0,01; *** p < 0,001; ns — оценка достоверно не отклоняется от 0.
А
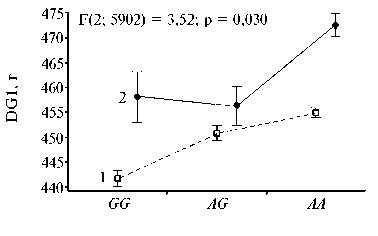
В
Б
Генотип по IGF2
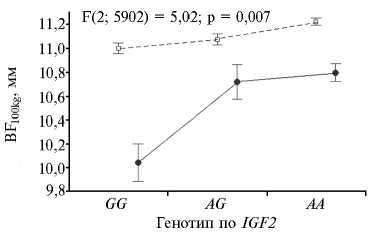
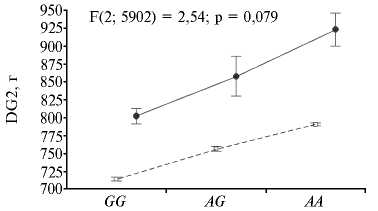
Рис. 2. Рис. 2. Результаты двухфакторного дисперсионного анализа, оценивающего влияние генотипа по IGF2 и пола на среднесуточный прирост в 1-й (DG1; А) и во 2-й периоды выращивания (DG2; Б) , а также на толщину шпика, приведенную к живой массе 100 кг (BF 100kg ; В) у свиней породы крупная белая: 1 — свинки, 2 — хрячки.
Все полученные оценки аддитивной компоненты были положи- тельными, за исключением возраста достижения 100 кг. Значения для доминантной компоненты, оценивающей степень проявления межалелльного взаимодействия в пределах одного локуса среди гетерозигот (то есть гетерозиса), в подавляющем большинстве достоверно не превышали 0. Однако у хрячков оценка доминантной компоненты для признака BF100kg оказалась достоверной, а для DG1 довольно существенно приближалась к первому порогу уровня значимости (p = 0,063) (табл. 3). Рассчитанные оценки эффекта замены аллелей 2-1•α(G → A) среди хрячков были намного выше, чем у свинок, особенно в отношении таких признаков, как DG1 (31,57 г — у хрячков, 18,46 г — у свинок) и BF100kg (соответственно 0,109 и 0,063 мм) (табл. 3). То есть интенсивность возрастания этих показателей в ряду генотипов GG → AG → AA среди хрячков оказалась выше, чем среди свинок, что подтвердил и двухфакторный дисперсионный анализ (рис. 2).
Поскольку как у свинок, так и у хрячков большинство исследованных признаков продуктивности имели очень высокую степень корреляции между собой (корреляционные матрицы не приведены), то анализ нескольких отдельных признаков (одномерный анализ) был заменен анализом всех признаков вместе (многомерный анализ). Анализ факторных нагрузок (то есть коэффициентов корреляции между исходными признаками и соответствующими ГК), рассчитанных на основе корреляционно-ковариационных матриц отдельно для хрячков и свинок, показал, что первые две ГК описывали большую часть изменчивости исходной матрицы (76,23 и 82,49 % соответственно для хрячков и свинок). Структура ГК оказалась сходной у животных разного пола. Первая ГК (ГК1) была тесно связана с показателями, характеризирующими приросты живой массы в поздний период ( r для DG2 0,501 и 0,896 соответственно у хрячков и свинок) и за весь период выращивания ( r для DG 0,923 и 0,929, r для BW 0,940 и 0,982, r для AGE100kg - 0,957 и - 0,966), а также с BF ( r — 0,805 и 0,790). Вторая ГК (ГК2), напротив, коррелировала с показателями, характеризующими прирост живой массы у свиней в ранний период выращивания ( r для DG1 - 0,709 и - 0,769). Следовательно, первые две ГК представляли собой две латентные (относительно независимые) переменные, которые характеризовали увеличение живой массы свиней на протяжении разных этапов постнатального онтогенеза: ГК2 — в ранний период выращивания, ГК1 — в поздний период и за весь срок выращивания.
Показатели аддитивно-доминантной модели, рассчитанные для ГК1, были полностью сходными у свиней крупной белой породы независимо от пола, причем основная роль принадлежала аддитивной компоненте: А = 0,290, p < 0,001; D = - 0,064 (у свинок) и А = 0,351, p < 0,001; D = 0,040 (у хрячков). Эффекты замены аллеля 2 - 1• α ( G → A) также были очень близкими (0,162 — у хрячков, 0,167 — у свинок).
По ГК2 роли аддитивной и доминантной компонент оказались неодинаковыми у свиней разного пола. Для хрячков достоверная оценка была получена только в отношении доминантной компоненты (А = 0,085; D = 0,177, p < 0,05), то есть для них в большей степени проявлялись межаллельные взаимодействия по типу гетерозиса, тогда как у свинок достоверной была аддитивная компонента (А = 0,094, p < 0,001; D = - 0,031).
Эффекты замены аллеля 2 - 1• α ( G → A) для ГК2 также не зависели от пола ( - 0,005 — у хрячков, 0,053 — у свинок). Эти различия определяли особенности расположения центроидов выборок (разного пола и генотипа) свиней в пространстве первых двух ГК (рис. 3).
Один из факторов, определяющих потенциальную эффективность использования ДНК-маркеров в селекции, — исходная частота встречаемости желательного аллеля в популяциях. Учитывая необходимость поддерживать биоразнообразие и линейную структуру стад, а также то, что, как правило, за год стадо обновляется не более чем на 30 %, максимальный эффект от маркерной селекции следует ожидать при низкой исходной частоте встречаемости желательного аллеля (менее 10 %), причем только в средне-и долгосрочной перспективе (3-5 поколений и более). При высокой частоте желательного аллеля (80 % и более) потенциал маркера можно реализовать уже через 1-2 поколения, однако его суммарное действие на все стадо будет относительно невысоким. Наибольшую эффективность маркерной селекции за относительно короткий период (в течение 2-3 поколений) следует ожидать при средних значениях частот желательного аллеля (20-70 %).
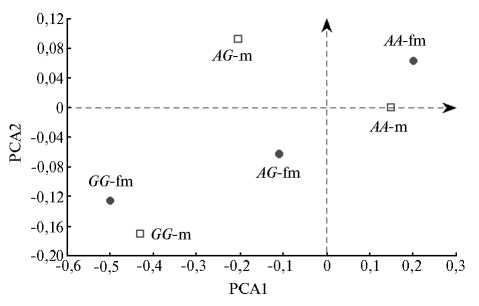
Рис. 3. Ординация центроидов выборок в отношении пола и генотипа по IGF2 в пространстве первых двух главных компонент (PCA) корреляционно-ковариационных матриц для показателей продуктивности у свиней крупной белой породы: AA , AG , GG — генотип по IGF2 , m — хрячки, fm — свинки.
Исследования алле-лофонда свиней по IGF2 выявили различия в распределении частот аллелей и генотипов у животных в зависимости от направления селекции. Наибольшую частоту аллеля А (желательного с точки зрения развития мясных и откормочных признаков) отмечали у свиней мясных пород (боди, дюрок, пьетрен) и терминального кросса, характеризующихся максимальной жесткостью отбора по вышеназванным признакам, что согласуется с результатами исследова- ний зарубежных авторов (13, 18, 19, 20). У свиней материнских пород (крупная белая, ландрас), а также полученных на основе улучшения местных свиней мясными породами (белорусская мясная, эстонская беконная), были зафиксированы промежуточные частоты встречаемости аллеля А. У свиней ливенской породы аллель А не обнаружили. А. Ojeda с соавт. (18) тоже отмечали его отсутствие у нескольких локальных пород свиней и в популяциях кабана разного географического происхождения. Основываясь на результатах анализа распределения аллелей и генотипов IGF2 в различных породах свиней, можно сделать вывод о потенциальной значимости этого маркера в селекции свиней корня крупной белой породы, а также пород ландрас, белорусская мясная и эстонская беконная.
Сообщается, что животные с генотипом АА в позиции 3072 IGF2 выделяются наибольшей постностью, высоким среднесуточным приростом и массой окорока, меньшей толщиной шпика и лучшей конверсией корма (20, 21). На свиньях крупной белой породы мы выявили высокодостоверные тенденции к повышению живой массы по завершении выращивания, среднесуточных приростов живой массы и толщины шпика и к снижению возраста достижения массы 100 кг в ряду генотипов GG → AG → AA по IGF2, что согласуется с исследованиями других авторов. Онаружена достоверная разница между подсвинками разного пола по показателям скороспелости, затрат кормов и переваримого протеина на 1 кг прироста живой массы (p < 0,001) (22). Превосходство по показателям откормочной продуктивности мужских особей над женскими было установлено в группах свиней с различными генотипами по MC4R (23). При отсутствии достоверных различий в среднесуточных приростах между свинками и боровками M. Latorre с соавт. (24) выявили значимые различия в толщине шпика в пользу последних (p < 0,001).
Мы впервые исследовали влияние половой принадлежности на мясные и откормочные качества свиней в зависимости от генотипов по IGF2 . Установлено, что эффект замены аллелей IGF2 для хрячков был значительно выше, чем для свинок, в особенности по признакам среднесуточного прироста в ранний период выращивания (от рождения до 76,41±0,04 сут) и толщины шпика, приведенной к живой массе 100 кг. Как подтвердили результаты двухфакторного дисперсионного анализа, интенсивность возрастания в ряду генотипов GG → AG → AA по этим показателям у хрячков выше, чем у свинок. Нами впервые обнаружен различный характер влияния генотипа по IGF2 на показатели роста по периодам постнатального онтогенеза у свиней разного пола. Показано наличие двух главных компонент, одна из которых связана с показателями, характеризующими приросты живой массы свиней в ранний (от рождения до 76,41±0,04 сут), вторая — в более поздний период (от 76,41±0,04 до 170,23±0,05 сут). Параметры аддитивно-доминантной модели по главной компоненте, связанной с приростами живой массы в поздний период и за весь период выращивания, были сходными у свинок и хрячков. С другой стороны, для главной компоненты, характеризующей рост в ранний период, роль аддитивной и доминантной компонент различалась у свиней разного пола. Для хрячков достоверную оценку получили в отношении доминантной, для свинок — аддитивной компоненты.
Таким образом, нами изучен полиморфизм в гене IGF2 у свиней различных пород и кроссов. Полученные результаты показали наличие высокой частоты аллеля A и генотипа АА у свиней пород пьетрен и дюрок, а также терминального кросса и синтетической линии боди. У свиней породы ливенская аллель А не обнаруживался. Ассоциативные исследования, проведенные на молодняке свиней, полученном от отцов с известными генотипами по IGF2 , подтвердили статистически значимую зависимость продуктивности по различным хозяйственно полезным признакам от генотипа по IGF2 как среди свинок, так и среди хрячков. Полученные нами данные о количественном влиянии генотипа по IGF2 на показатели мясной и откормочной продуктивности свиней, а также выявленное влияние пола на проявление действия маркерных генотипов по периодам выращивания следует учитывать при разработке программ маркерной селекции с использованием IGF2 .
Список литературы Ассоциация гена IGF2 с продуктивными качествами свиней ( Sus scrofa) крупной белой породы с учетом половой дифференциации
- Марзанов Н.С., Девришов Д.А., Марзанова С.Н., Комкова Е.А., Озеров М.Ю., Кантанен Ю. Генетическое маркирование, сохранение биоразнообразия и проблемы разведения животных. Сельскохозяйственная биология, 2011, 2: 3-14.
- Canadian Centre for Swine Improvement. 2014 Annual Meeting, June 26, 2014: 27-28 (http://www.ccsi.ca/meetings/annual/Annualreport_2014_EN.pdf).
- Зиновьева Н.А., Костюнина О.В., Гладырь Е.А., Банникова А.Д., Харзинова В.Р., Ларионова П.В., Шавырина К.М., Эрнст Л.К. Роль ДНК-маркеров признаков продуктивности сельскохозяйственных животных. Зоотехния, 2010, 1: 8-10.
- Jeon J.T., Carlborg O., Törnsten A., Giuffra E., Amarger V., Chardon P., Andersson-Eklund L., Andersson K., Hansson I., Lundström K., Andersson L. A paternally expressed QTL affecting skeletal and cardiac muscle mass in pigs maps to the IGF2 locus. Nat. Genet., 1999, 21: 157-158 (doi: 10.1038/5938).
- Nezer C., Moreau L., Brouwers B. An imprinted QTL with major effect on muscle mass and fat deposition maps to the IGF2 locus in pigs. Nat. Genet., 1999, 21: 155-156 (doi: 10.1038/5938).
- Chang K.C. Key signalling factors and pathways in the molecular determination of skeletal muscle phenotype. Animal, 2007, 1(5): 681-698 ( ) DOI: 10.1017/S1751731107702070
- Van Laere A.-S. From QTL to QTN. Identification of a quantitative trait nucleotide influencing muscle development and fat deposition in pig. Doct. Thesis. Swedish University of Agricultural Sciences, Uppsala, 2005.
- Van Laere A.-S., Nguyen M., Braunschweig M., Nezer C., Collette C., Moreau L., Archibald A.L., Haley C.S., Buys N., Tally M., Andersson G., Georges M., Andersson L. A regulatory mutation in IGF2 causes a major QTL effect on muscle growth in the pig. Nature, 2003, 425(6960): 832-836 ( ) DOI: 10.1038/nature02064
- Jungerius B.J., Van Laere A.-S., Te Pas M.F., van Oost B.A., Andersson L., Groenen M.A. The IGF2-intron3-G3072A substitution explains a major imprinted QTL effect on backfat thickness in a Meishan ½ European white pig intercross. Genet. Res., 2004, 84(2): 95-101 ( ) DOI: 10.1017/S0016672304007098
- Estelle J., Mercade A., Noguera J.L., Pérez-Enciso M., Ovilo C., Sánchez A., Folch J.M. Effect of the porcine IGF2-intron3-G3072A substitution in an outbred Large White population and in an Iberian½Landrace cross. J. Anim. Sci., 2005, 83: 2723-2728.
- Heuven H.C.M., Bovenhuis H., Janss L.L.G., van Arendonk J.A.M. Efficiency of population structures for mapping of Mendelian and imprinted quantitative trait loci in outbred pigs using variance component methods. Genet. Sel. Evol., 2005, 37: 635-655 ( ) DOI: 10.1051/gse:2005019
- Oczkowicz M., Tyra M., Walinowicz K., Różycki M., Rejduch B. Known mutation (A3072G) in intron3 of the IGF2 gene is associated with growth and carcass composition in Polish pig breeds. J. Appl. Genet., 2009, 50(3): 257-259 ( ) DOI: 10.1007/BF03195681
- Yang G.-C., Ren J., Guo Y.-M., Ding N.-S., Chen C.-Y., Huang L.-S. Genetic evidence for the origin of an IGF2 quantitative trait nucleotide in Chinese pigs. Animal Genetics, 2006, 37: 179-188 ( ) DOI: 10.1111/j.1365-2052.2006.01416.x
- Gardan D., Gondret F., Van den Maagdenberg K., Buys N., De Smet S., Louveau I. Lipid metabolism and cellular features of skeletal muscle and subcutaneous adipose tissue in pigs differing in IGF-II genotype. Domest. Anim. Endocrinol., 2008, 34(1): 45-53 ( ) DOI: 10.1016/j.domaniend.2006.10.001
- Van den Maagdenberg K., Claeys E., Stinckens A., Buys N., De Smet S. Effect of age, muscle type, and insulin-like growth factor-II genotype on muscle proteolytic and lipolytic enzyme activities in boars. J. Anim. Sci., 2007, 85(4): 952-960 ( ) DOI: 10.2527/jas.2006-563
- Костюнина О.В., Свеженцева Н.А., Зиновьева Н.А., Доцев А.В., Шахин А.В., Сизарева Е.И., Гладырь Е.А. Влияние маркерного генотипа по ESR и IGF2 на племенную ценность хряков крупной белой породы. Сельскохозяйственная биология, 2011, 6: 54-59.
- Ли Ч. Введение в популяционную генетику. М., 1978.
- Ojeda A., Huang L.S., Ren J., Angiolillo A., Cho I.C., Soto H., Lemus-Flores C., Makuza S.M., Folch J.M., Perez-Enciso M. Selection in the making: a worldwide survey of haplotypic diversity around a causative mutation in porcine IGF2. Genetics 2008, 178: 1639-1652 ( ) DOI: 10.1534/genetics.107.084269
- Ruan G.R., Xing Y.Y., Fan Y., Qiao R.M., He X.F., Yang B., Ding N.S., Ren J., Huang L.S., Xiao S.J. Genetic variation at RYR1, IGF2, FUT1, MUC13, and KPL2 mutations affecting production traits in Chinese commercial pig breeds. Czech J. Anim. Sci., 2013, 58(2): 65-70.
- Fontanesi L., Speroni C., Buttazzoni L., Scotti E., Dall’Olio S., Nanni Costa L., Davoli R., Russo V. The insulin-like growth factor 2 (IGF2) gene intron3-g.3072G>A polymorphism is not the only Sus scrofa chromosome 2p mutation affecting meat production and carcass traits in pigs: Evidence from the effects of a cathepsin D (CTSD) gene polymorphism. J. Anim. Sci., 2010, 88: 2235-2245 ( ) DOI: 10.2527/jas.2009-2560
- Лобан Н.А., Костюнина О.В., Василюк О.Я., Банникова А.Д., Чернов А.С., Зиновьева Н.А., Эрнст Л.К. Полиморфизм гена IGF2 у свиней мясных пород в Республике Беларусь и его влияние на откормочные и мясные качества. Сельскохозяйственная биология, 2009, 2: 27-30.
- Герасимов В.И., Пронь Е.В., Данилова Т.Н., Донских Т.В. Пол и продуктивность свиней. Мат. Интернет-конф. «Научный прогресс на рубеже тысячелетий-2007», Секция Ветеринария (http://www.rusnauka.com/Page_ru.htm).
- Klimenko A., Usatov A., Getmantseva L., Kolosov Y., Tretyakova O., Bakoev S., Kostjunina O., Zinovieva N. Effects of melanocortin-4 receptor gene on growth and meat traits in pigs raised in Russia. Am. J. Agricult. Biol. Sci., 2014, 9(2): 232-237 ( ) DOI: 10.3844/ajabssp.2014.232.237
- Latorre M.A., García-Belenguer E., Ariño L. The effects of sex and slaughter weight on growth performance and carcass traits of pigs intended for dry-cured ham from Teruel (Spain). J. Anim. Sci., 2008, 86(8): 1933-1942 ( ) DOI: 10.2527/jas.2007-0764


