Ассоциация медиаторов жировой ткани с развитием злокачественных новообразований на фоне метаболического синдрома
Автор: Середа Е.Е., Чернышова А.Л., Мамонова Т.Ю., Какурина Г.В., Юнусова Н.В., Сиденко Е.А., Коршунов Д.А., Кондакова И.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 т.23, 2024 года.
Бесплатный доступ
Цель исследования - обобщение имеющихся данных о взаимосвязи медиаторов жировой ткани с течением злокачественных новообразований у больных с метаболическим синдромом. Материал и методы. Используя электронные ресурсы поисковых систем PubMed и eLIBRARY, проведен литературный обзор научных трудов за последние 20 лет, содержащих доказательную экспериментальную и клиническую базу по обсуждаемым вопросам. Из 400 найденных по ключевым словам публикаций в обзор включено 58 исследований.
Злокачественные новообразования, метаболический синдром, адипокины, специализированные проразрешающие медиаторы (спрм), метаболиты полиненасыщенных жирных кислот
Короткий адрес: https://sciup.org/140305900
IDR: 140305900 | УДК: 616-006.04-056.5:577.1 | DOI: 10.21294/1814-4861-2024-23-2-101-110
Текст обзорной статьи Ассоциация медиаторов жировой ткани с развитием злокачественных новообразований на фоне метаболического синдрома
Метаболический синдром и злокачественные новообразования
Понятие «метаболический синдром» (МС) охватывает такие клинические и метаболические характеристики, как абдоминальное ожирение, инсулинорезистентность, дислипидемия, повышенное артериальное давление, наличие про-тромботических и провоспалительных состояний. Абдоминальное ожирение является ключевым параметром, который активирует большую часть пути метаболического синдрома [1]. В связи с высокой социальной значимостью нарушений, сопровождающих МС и ухудшающих течение ряда патологических состояний, включая онкологическую и сердечно-сосудистую патологии, Российским медицинским обществом по артериальной гипертонии и профильной комиссией по кардиологии разработаны клинические рекомендации по ведению больных с МС, которые содержат критерии его диагностики [2].
Доказано, что наличие МС ассоциировано с развитием ряда злокачественных новообразований у лиц обоего пола. Для мужчин выявлены значимые ассоциации между метаболическим синдромом и раком печени, колоректальным раком (КРР), раком мочевого пузыря и предстательной железы. У женщин выявлена взаимосвязь с развитием рака эндометрия, колоректального рака, рака молочной железы (РМЖ) в постменопаузе [3–5]. Наличие МС существенно снижает показатели общей и безрецидивной выживаемости у больных раком эндометрия, а также ассоциировано с клиническими характеристиками опухолевого процесса (стадия FIGO, степень дифференцировки, сосудистая инвазия, размер опухоли и наличие метастазов в лимфоузлах) [6, 7]. При раннем РМЖ продемонстрирована взаимосвязь худших показателей общей и безрецидивной выживаемости с наличием отдельных компонентов МС [8]. При КРР на фоне метаболического синдрома показатели общей выживаемости были хуже по сравнению с больными без МС. Независимыми предикторами, ассоциированными с неблагоприятным прогнозом общей выживаемости, были признаки, характерные для метаболического синдрома, такие как наличие инсулинорезистентности, высокий индекс массы тела (ИМТ) и повышенное содержание триацил-глицеролов (ТАГ) в сыворотке крови [9–11].
Существуют общие пути патогенеза многих злокачественных новообразований (ЗНО) и МС. Доказаны целесообразность и необходимость коррекции метаболического синдрома при онкологическом процессе [1, 12]. Тем не менее до настоящего времени нет адекватных предиктивных маркеров для выбора наиболее эффективной медикаментозной стратегии коррекции МС, которую можно бы было применить у пациентов с онкологической патологией.
Среди предполагаемых механизмов, объясняющих вклад МС в формирование коморбидных состояний (включая ЗНО, сердечно-сосудистую патологию и сахарный диабет 2-го типа), можно выделить 3 основных пути: инсулинорезистентность, хроническое воспаление и нейрогормональная активация [13], которые вызывают дополнительное нарушение углеводного и липидного обменов. На этом фоне наблюдается угнетение иммунологической реактивности [14], постоянно присутствует провоспалительная среда, которая способствует развитию опухолевой трансформации [15] и оказывает влияние на процессы ангиогенеза и метастазирования [16]. При наличии инсулино-резистентности в жировой ткани активируются процессы спонтанного липолиза, что приводит к хроническому повышению уровня свободных жирных кислот в плазме крови, оказывая повреждающее действие на В-клетки островков Лангерганса поджелудочной железы, приводя к гиперинсули-немии [17]. Сопровождающие метаболический синдром гипергликемия, постоянно повышенный уровень инсулина, в сочетании с нарушенным балансом адипокинов (гиперлептинемия и снижение уровня адипонектина) в сыворотке крови способствуют развитию опухолевого процесса, оказывая влияние на процессы клеточной пролиферации, апоптоза, ангиогенеза, клеточной подвижности, а также вызывая повреждение ДНК активными формами кислорода. Кроме того, адипокины оказывают влияние на активацию транскрипционных факторов, факторов роста и их рецепторов, таких как AMPK, SREBP-1, PPARα, STAT3, NF-kappaB, HIFα-1 и ERα, фактор роста эндотелия сосудов и его рецепторы IGF-I, IGF-II, IGFBPs, а также рецептор инсулиноподобного фактора роста I типа (IGF-IR), что объединяет патогенетические пути ЗНО и МС [18].
Существует ряд исследований, свидетельствующих об участии низкоинтенсивных хронических воспалительных реакций, сопровождающих МС, в развитии опухолевой трансформации. В частности, при ожирении, сопровождающем МС, постоянное присутствие провоспалительных медиаторов, которые продуцирует жировая ткань (цитокины, адипо-кины, а также липидные медиаторы), не позволяет адекватно завершиться процессам воспаления и реализовать стадию разрешения воспалительного процесса. В то же время при опухолевом процессе постоянно присутствует провоспалительная среда, формирующая микроокружение опухоли и состоящая из сложной сети гетерогенных типов клеток. Микроокружение опухоли включает инфильтрирующие иммунные клетки, тучные клетки и антигенпрезентирующие клетки (макрофаги и дендритные клетки), гранулоциты, а также ассоциированные с раком фибробласты, эндотелиальные клетки, внеклеточный матрикс и другие компоненты стромы. Разрушение нормальных функций этой сложной сети может вызвать дисфункцию эпителия и, в конечном счете, канцерогенез, а также стимуляцию роста опухолей [19, 20].
Участие медиаторов жировой ткани, регулирующих течение воспаления, в патогенезе рака
В жировой ткани существует идеальный баланс между адипоцитами и иммунными клетками, который теряется при ожирении, приводя к локальному хроническому слабому воспалению, связанному с повышенным риском развития рака. Иммунные клетки, инфильтрируя жировую ткань пациентов с ожирением, регулируют местные иммунные реакции, увеличивая уровни провоспалительных цитокинов и адипокинов, тем самым поддерживая развитие опухоли [21]. Показано, что вырабатываемые жировой тканью цитокины (в частности, IL-6 и TNF-α) активируют пути STAT3 и NF-kβ и способствуют выживанию, пролиферации и метастазированию раковых клеток [22]. Важным медиатором, регулирующим воспалительные реакции, являются адипокины, продуцируемые жировой тканью. Наиболее изученный адипокин жировой ткани – адипонектин, проявляющий противовоспалительные свойства, а также снижающий пролиферативную активность клеток. Кроме того, адипонектин оказывает влияние на углеводный и липидный обмены – стимулирует окисление жирных кислот, повышая чувствительность тканей к инсулину [23]. Показано, что при раке эндометрия (РЭ) низкий уровень адипонекти-на в сыворотке крови (<8 мг/л) связан с большей агрессивностью опухолевого процесса, более частым лимфогенным метастазированием и низкой степенью дифференцировки. Высокий уровень адипонектина перед операцией при РЭ является благоприятным фактором прогноза отдаленной безрецидивной выживаемости [24]. Среди ади-покинов с провоспалительным действием можно выделить лептин, резистин и висфатин. Основная роль лептина – регулирование потребления и расхода энергии [25]. При абдоминальном ожирении уровень лептина резко возрастает, оказывая стимулирующее действие на клеточный иммунный ответ и усиливая выработку провоспалительных цитокинов (ФНОα, ИЛ-2, ИЛ-6), ослабляя активность противовоспалительного адипонектина [26]. В литературе имеются данные относительно ассоциации уровня лептина и рецептора к лептину при колоректальном раке. Показано, что в сыворотке крови пациентов с КРР наблюдалось значительное повышение уровня лептина. Кроме того, в опухолях, не экспрессирующих рецепторы к лептину, значительно снижена пролиферация, в то время как высокие уровни экспрессии рецептора к лептину были ассоциированы с интенсивными процессами неоангиогенеза и увеличением метастатического потенциала [27]. При РЭ выявлены увеличение уровня лептина и его способность активировать транскрипционный фактор STAT, повышая инвазивный потенциал опухоли. Кроме того, более высокая тканевая концентрация лептина положительно коррелирует со степенью инвазии миометрия и метастазами в лимфатические узлы, что в конечном итоге приводит к худшему прогнозу [24]. Резистин – «гормон инсулинорезистентности» и провоспалительный адипокин, угнетает адипогенез. Висфатин – провоспалительный адипокин, проявляющий инсулиноподобное действие, уровень которого повышается при ожирении [28]. Также он действует как фактор, который способствует экспрессии различных провоспалительных цитокинов, таких как TNF-α, IL-1B и IL-6, способствует дифференцировке B-клеток [22]. При РМЖ и РЭ наблюдается повышенная экспрессия резистина. При РЭ демонстрируются повышенные уровни висфатина по сравнению со здоровыми женщинами. Высокие уровни резистина и висфатина связаны с антиапоптотическим, пролиферативным и проангиогенным действием, создающим благоприятные условия для образования метастазов [29]. Также показано, что висфатин значительно влияет на прогрессирование рака эндометрия посредством активации рецептора инсулина (IR) и сигнальных путей PI3K/AKT и MAPK/ERK [30].
Основной путь биосинтеза СпРМ включает кооперативное действие между 5-липоксигеназой лейкоцитов и 12-липоксигеназой тромбоцитов. В полиморфноядерных лейкоцитах периферической крови ω-6 арахидоновая кислота (С 20:4) метаболизирует до образования лейкотриена (ЛТ) А4 (который обладает провоспалительным действием), а затем с помощью 12-липоксигеназы преобразуется в липоксины [34, 37]. Липоксины являются мощными противовоспалительными биорегуляторами, подавляющими воспаление и активирующими процессы разрешения и восстановления, в частности, при метаболическом синдроме [38]. Результатом действия липоксинов являются ингибирование хемотаксиса и миграции макрофагов и нейтрофилов в очаг воспаления, блокирование перекисного окисления липидов, активация NF-κB и подавление синтеза провоспалительных цитокинов. Показано, что при метаболическом синдроме снижены уровни и чувствительность жировой ткани к СпМВ [39].
Резольвины, протектины и марезины образуются из ω-3 полиненасыщенных жирных кислот: эйкозапентаеновой (С 20:5, ЭПК, или тимнодоно-вая кислота) и докозагексаеновой (С 22:6, ДГК, или цервоновая кислота). Основные эффекты резольвинов, протектинов и марезинов как противовоспалительных медиаторов связаны с тем, что они останавливают приток лейкоцитов в очаг воспаления, проводя своего рода «зачистку», и снижают высвобождение цитокинов [40]. Марезины, полученные из ДГК по 12-липоксигеназному пути, синтезируются макрофагами и, помимо участия в воспалительных реакциях в качестве противовоспалительного агента, обладают антиноцицептив-ным действием и участвуют в регенерации тканей [41]. Резольвины и марезины способны стимулировать поляризацию макрофагов М1 в М2, таким образом влияя на процессы репарации [42]. Кроме того, пластическая поляризация макрофагов участвует в онкогенезе. M1-поляризованные макрофаги опосредуют быстрое воспаление, а также могут вызывать мутагенез, индуцированный воспалением. М2-поляризованные макрофаги подавляют быстрое воспаление, но могут способствовать прогрессированию опухоли. В эксперименте показано, что при раке предстательной железы в системе совместного культивирования раковых клеток и макрофагов как с докозагексаеновой жирной кислотой, так и с резольвином Д, ее производным, наблюдалось значительное ингибирование пролиферации раковых клеток. Резольвин Д1 и резоль-вин Д2 ингибировали поляризацию макрофагов, ассоциированных с опухолью, а также проявляли противовоспалительные эффекты, ингибируя LPS-интерферон (IFN)-γ-индуцированную поляризацию M1, также стимулируя интерлейкин-4 (IL-4)-опосредованную поляризацию M2a. Эти результаты позволяют предположить, что регуляция поляризации макрофагов с помощью резольвинов может быть потенциальным терапевтическим подходом при лечении рака предстательной железы [43]. Помимо участия в разрешении воспаления, резольвины тоже способны проявлять обезболивающий эффект. В частности, в эксперименте на мышах показано снижение болевой реакции, вызванной воспалением, а также острой и хронической послеоперационной и нейропатической болевой реакции. На мышиной модели рака кости выявлена антиноцицептивная активность резоль-винов D1 и E1, которая проявляется в снижении теплового и механического воздействия [44].
Кроме того, обязательно следует учитывать, что хроническое низкоинтенсивное воспаление, сопровождающее как МС, так и опухолевый процесс, может быть обратимым состоянием. Для этого необходимо создать условия, способствующие адекватному завершению воспалительного процесса. На стадии разрешения воспалительного процесса поэтапно должно произойти снижение уровня провоспалительных цитокинов, которое приведет к изменению метаболизма полинена-сыщенных жирных кислот, и биосинтетические пути должны переключится от синтеза провоспа-лительных липидных медиаторов (лейкотриенов и простагландинов) на образование специализированных медиаторов, участвующих в разрешении воспаления с противовоспалительным действием (СпМВ – липоксинов, резольвинов, протектинов и марезинов) [45]. Следовательно, баланс цитокинов, адипокинов и СпРМ может быть значим как при воспалительных заболеваниях, так и при онкологической патологии.
Благодаря открытию СпРМ и их эффектов может быть реализован новый превентивный терапевтический подход для многих заболеваний человека, в основе патогенеза которого лежит низкоинтенсивное хроническое воспаление [46]. Эндогенное производство СпРМ, полученных из ω-3 жирных кислот, можно модулировать приемом добавок незаменимых жирных кислот. Было показано, что применение добавок ω-3 по-линенасыщенных жирных кислот увеличивало выработку резольвина Д5 как в группе здоровых добровольцев, так и у пациентов с заболеваниями периферических артерий. При этом в крови снижалась активация циркулирующих фагоцитов и подавлялось воспаление [47]. В то же время при ряде патологических состояний образование этих СпРМ может нарушаться. Так, при наличии ожирения, сопровождающего метаболический синдром, наблюдается дисбаланс выработки СпРМ, проявляющийся в снижении образования производных ω-3 полиненасыщенных жирных кислот. На мышиных моделях продемонстрировано, что диета с высоким содержанием жиров способствует блокировке выработки СпРМ [48]. Употребление добавок, содержащих ω-3 полиненасыщенные жирные кислоты, в течение 3 мес у пациенток с ожирением сопровождалось снижением уровня триацилглицеролов в сыворотке крови, снижением уровня инсулина сыворотки крови, а также выраженным противовоспалительным эффектом, который проявлялся в изменении концентрации цитокинов, молекул адгезии, концентрации белков острой фазы воспаления и липидных медиаторов (резольвин Д1, резольвин Д2), тогда как у пациенток, принимающих плацебо, подобные изменения не были выявлены [49]. Дальнейшее изучение эффектов и способов получения СпРМ может быть перспективным направлением для разработ- ки практических инструментов борьбы со ЗНО и кардиометаболическими расстройствами [50].
Обнаруженные биологические эффекты данных метаболитов полиненасыщенных жирных кислот обеспечивают как их противовоспалительную активность, так и действие, способствующее разрешению воспалительного процесса и адекватному его завершению. Выявленные эффекты могут играть роль в улучшении прогноза течения опухолевого процесса при эффективной коррекции МС. СпМВ могут смещать поляризацию макрофагов с M1 на M2, тем самым влияя на биологическое поведение опухоли, тем не менее этот вопрос нуждается в детальном изучении. Кроме того, возможны и другие механизмы влияния медиаторов жировой ткани на течение опухолевого процесса.
Ассоциации медиаторов, регулирующих интенсивность воспаления, с метаболическим синдромом и злокачественными новообразованиями
Хорошо изучены молекулярные аспекты участия МС в канцерогенезе, такие как гиперинсулинемия и резистентность к инсулину, гипергликемия, ги-перэстрогенемия, гиперлептинемия и снижение уровня адипонектина в сыворотке крови. Все эти факторы участвуют в клеточной пролиферации, апоптозе, ангиогенезе, клеточной подвижности, повреждении ДНК активными формами кислорода вследствие избытка глюкозы. Кроме того, показано влияние адипокинов на активацию транскрипционных факторов и факторов роста и их рецепторов, таких как AMPK, SREBP-1, PPARα, STAT3, NF-kappaB, HIFα-1 и ERα, фактор роста эндотелия сосудов и его рецепторы, IGF-I, IGF-II, IGFBPs, а также рецептор инсулиноподобного фактора роста I типа (IGF-IR), что объединяет патогенетические пути злокачественных новообразований и метаболического синдрома [18].
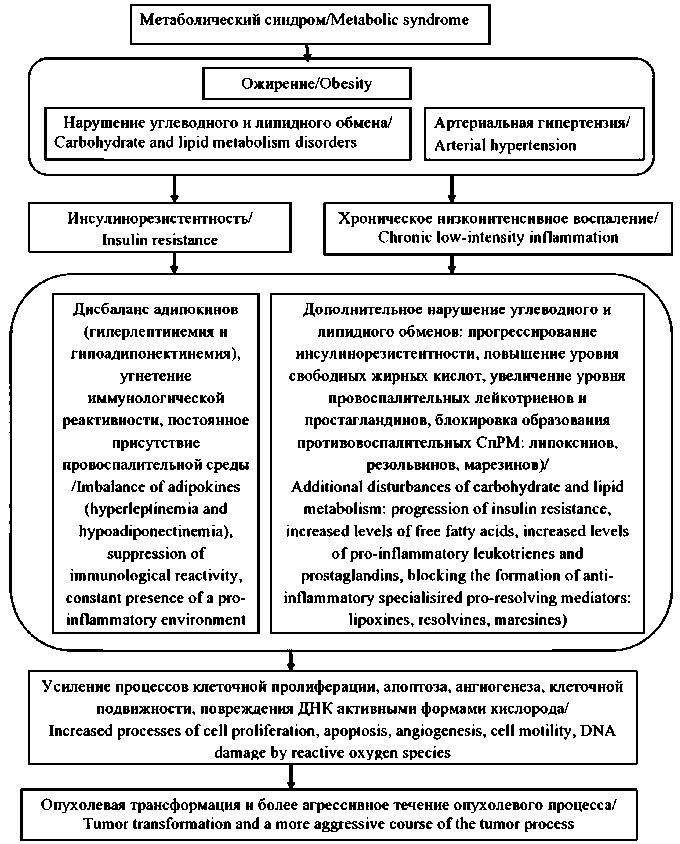
Рис. 1. Патогенез злокачественных новообразований на фоне метаболического синдрома.
Примечание: рисунок выполнен авторами
Fig.1. Pathogenesis of cancer in metabolic syndrome patients. Note: created by the authors
А4, В4 и резольвинов Д1, Д2 в плазме крови по сравнению со здоровыми добровольцами. Важно отметить, что в данном исследовании пациенты и здоровые добровольцы имели нормальную массу тела. Кроме того, с помощью метода ROC-aнализа показан высокий диагностический потенциал резольвина Д1 как маркера рака поджелудочной железы [56]. В эксперименте на MCF7 клеточных линиях РМЖ показано, что резольвин Д2 может синтезироваться как опухолевыми клетками, так и окружающими клетками стромы, а также присутствует в плазме в биологически активных концентрациях. Кроме того, резольвин Д2 (в концентрации от 10 до 1000 нМ) способствовал пролиферации экспрессирующих рецепторы эстрогена опухолевых клеток линии (MCF-7), не влияя на количество ER-отрицательных клеток линии рака молочной железы MDA-MB-231 [58].
Исходя из вышесказанного, патогенез злокачественных новообразований на фоне МС может быть представлен следующим образом: метаболический синдром, включающий в качестве основного компонента ожирение, а в качестве дополнительных компонентов – нарушения углеводного и липидного обменов, и/или артериальную гипертензию, сопровождается инсулинорезистентностью и присутствием постоянной провоспалительной среды. Эти два ведущих патогенетических факто- ра при метаболическом синдроме усугубляются и поддерживаются нарушением в метаболизме адипокинов, продуцируемых жировой тканью, а также блокировкой выработки СпРМ с противовоспалительным действием. На фоне этих метаболических нарушений, провоцируемых ожирением, возникают благоприятные условия для опухолевой трансформации и усугубляется течение опухолевого процесса (рис. 1).
Список литературы Ассоциация медиаторов жировой ткани с развитием злокачественных новообразований на фоне метаболического синдрома
- Mili N., Paschou S.A., Goulis D.G., Dimopoulos M.A., Lambrinoudaki I., Psaltopoulou T. Obesity, metabolic syndrome, and cancer: pathophysiological and therapeutic associations. Endocrine. 2021; 74(3):478-97. https://doi.org/10.1007/s12020-021-02884-x.
- Rekomendatsii po vedeniyu bol'nykh s metabolicheskim sindromom, razrabotannye po porucheniyu Minzdrava Rossii i utverzhdennye Rossiiskim meditsinskim obshchestvom po arterial'noi gipertonii i profil'noi komissiei po kardiologii. M., 2013.
- Chernyshova A.L., Kolomiets L.A., Yunusova N.V., Shanshashvili E.V. Osobennosti gormonal'no-energeticheskogo obmena u bol'nykh s giperplasticheskimi protsessami i rakom endometriya na fone metabolicheskogo sindroma. Sibirskii onkologicheskii zhurnal. 2015;1(1): 5-12.
- Yunusova N.V., Kondakova I.V., Kolomiets L.A., Afanas’ev S.G., Kishkina A.Y., Spirina L.V. The role of metabolic syndrome variant in the malignant tumors progression. Diabetes Metab Syndr. 2018; 12(5): 807-12. https://doi.org/10.1016/j.dsx.2018.04.028.
- Conteduca V., Caffo O., Galli L., Maugeri A., Scarpi E., Maines F., Chiuri V.E., Lolli C., Kinspergher S., Schepisi G., Santoni M., Santini D., Fratino L., Burgio S.L., Salvi S., Menna C., De Giorgi U. Association among metabolic syndrome, inflammation, and survival in prostate cancer. Urol Oncol. 2018; 36(5). https://doi.org/10.1016/j.urolonc.2018.01.007.
- Kokts-Porietis R.L., McNeil J., Nelson G., Courneya K.S., Cook L.S., Friedenreich C.M. Prospective cohort study of metabolic syndrome and endometrial cancer survival. Gynecol Oncol. 2020; 158(3): 727-33. https://doi.org/10.1016/j.ygyno.2020.06.488.
- Yang X., Li X., Dong Y., Fan Y., Cheng Y., Zhai L., Zhang S., Zhou J., Wang J. Effects of Metabolic Syndrome and Its Components on the Prognosis of Endometrial Cancer. Front Endocrinol (Lausanne). 2021; 12. https://doi.org/10.3389/fendo.2021.780769.
- Buono G., Crispo A., Giuliano M., De Angelis C., Schettini F., Forestieri V., Lauria R., De Laurentiis M., De Placido P., Rea C.G., Pacilio C., Esposito E., Grimaldi M., Nocerino F., Porciello G., Giudice A., Amore A., Minopoli A., Botti G., De Placido S., Trivedi M.V., Arpino G. Metabolic syndrome and early stage breast cancer outcome: results from a prospective observational study. Breast Cancer Res Treat. 2020; 182(2):401-9. https://doi.org/10.1007/s10549-020-05701-7.
- Li Y., Zhao J., Wu X., Zhang Y., Jin Y., Cai W. Clinical and genomic characteristics of metabolic syndrome in colorectal cancer. Aging (Albany NY). 2021; 13(4): 5442-60. https://doi.org/10.18632/aging.202474.
- Bhome R., Peppa N., Karar S., McDonnell D., Mirnezami A., Hamady Z. Metabolic syndrome is a predictor of all site and liver-specific recurrence following primary resection of colorectal cancer: Prospective cohort study of 1006 patients. Eur J Surg Oncol. 2021; 47(7): 1623-8. https://doi.org/10.1016/j.ejso.2020.12.016.
- Han F., Wu G., Zhang S., Zhang J., Zhao Y., Xu J. The association of metabolic syndrome and its components with the incidence and survival of colorectal cancer: a systematic review and meta-analysis. Int J Biol Sci. 2021; 17(2): 487-97. https://doi.org/10.7150/ijbs.52452.
- Zhou J., Massey S., Story D., Li L. Metformin: An Old Drug with New Applications. Int J Mol Sci. 2018; 19(10): 2863. https://doi.org/10.3390/ijms19102863.
- Fahed G., Aoun L., Bou Zerdan M., Allam S., Bou Zerdan M., Bouferraa Y., Assi H.I. Metabolic Syndrome: Updates on Pathophysiology and Management in 2021. Int J Mol Sci. 2022; 23(2): 786. https://doi.org/10.3390/ijms23020786.
- Gluvic Z., Zaric B., Resanovic I., Obradovic M., Mitrovic A., Radak D., Isenovic E.R. Link between Metabolic Syndrome and Insulin Resistance. Curr Vasc Pharmacol. 2017; 15(1): 30-9. https://doi.org/10.2174/1570161114666161007164510.
- McCracken E., Monaghan M., Sreenivasan S. Pathophysiology of the metabolic syndrome. Clin Dermatol. 2018; 36(1): 14-20. https://doi.org/10.1016/j.clindermatol.2017.09.004.
- Battelli M.G., Bortolotti M., Polito L., Bolognesi A. Metabolic syndrome and cancer risk: The role of xanthine oxidoreductase. Redox Biol. 2019; 21. https://doi.org/10.1016/j.redox.2018.101070.
- Ivanov V.V., Shakhristova E.V., Stepovaya E.A., Nosareva O.L., Fedorova T.S., Ryazantseva N.V., Novitskii V.V. Okislitel'nyi stress: vliyanie na sekretsiyu insulina, retseptsiyu gormona adipotsitami i lipoliz v zhirovoi tkani. Byulleten' sibirskoi meditsiny. 2014;13(3): 32-9. https://doi.org/10.20538/1682-0363-2014-3-32-39.
- Yunusova N.V., Kondakova I.V., Kolomiets L.A., Afanas’ev S.G., Chernyshova A.L., Kudryavtsev I.V., Tsydenova A.A. Molecular targets for the therapy of cancer associated with metabolic syndrome (transcription and growth factors). Asia Pac J Clin Oncol. 2018; 14(3): 134-40. https://doi.org/10.1111/ajco.12780.
- Zhang A.M.Y., Wellberg E.A., Kopp J.L., Johnson J.D. Hyperinsulinemia in Obesity, Inflammation, and Cancer. Diabetes Metab J. 2021;45(3): 285-311. https://doi.org/10.4093/dmj.2020.0250.
- Chen M., Linstra R., van Vugt M.A.T.M. Genomic instability, inflammatory signaling and response to cancer immunotherapy. Biochim Biophys Acta Rev Cancer. 2022; 1877(1). https://doi.org/10.1016/j.bbcan.2021.188661.
- Di Zazzo E., Polito R., Bartollino S., Nigro E., Porcile C., Bianco A., Daniele A., Moncharmont B. Adiponectin as Link Factor between Adipose Tissue and Cancer. Int J Mol Sci. 2019; 20(4): 839. https://doi.org/10.3390/ijms20040839.
- Garikapati K.K., Ammu V.V.V.R.K., Krishnamurthy P.T., Chintamaneni P.K., Pindiprolu S.K.S.S. Type-II endometrial cancer: role of adipokines. Arch Gynecol Obstet. 2019; 300(2): 239-49. https://doi.org/10.1007/s00404-019-05181-1.
- Kahn C.R., Wang G., Lee K.Y. Altered adipose tissue and adipocyte function in the pathogenesis of metabolic syndrome. J Clin Invest. 2019;129(10): 3990-4000. https://doi.org/10.1172/JCI129187.
- Słabuszewska-Jóźwiak A., Lukaszuk A., Janicka-Kośnik M., Wdowiak A., Jakiel G. Role of Leptin and Adiponectin in Endometrial Cancer. Int J Mol Sci. 2022; 23(10): 5307. https://doi.org/10.3390/ijms23105307.
- Daley-Brown D., Oprea-Ilies G.M., Lee R., Pattillo R., Gonzalez- Perez R.R. Molecular cues on obesity signals, tumor markers and endometrial cancer. Horm Mol Biol Clin Investig. 2015; 21(1): 89-106. https://doi.org/10.1515/hmbci-2014-0049.
- Vavilova T.P., Pleten’A.P., Mikheev R.K. [Biological role of adipokines and their association with morbid conditions]. Vopr Pitan. 2017;86(2): 5-13. Russian. https://doi.org/10.24411/0042-8833-2017-00028.
- Socol C.T., Chira A., Martinez-Sanchez M.A., Nuñez-Sanchez M.A., Maerescu C.M., Mierlita D., Rusu A.V., Ruiz-Alcaraz A.J., Trif M., Ramos-Molina B. Leptin Signaling in Obesity and Colorectal Cancer. Int J Mol Sci. 2022; 23(9): 4713. https://doi.org/10.3390/ijms23094713.
- Ilhan T.T., Kebapcilar A., Yilmaz S.A., Ilhan T., Kerimoglu O.S., Pekin A.T., Akyurek F., Unlu A., Celik C. Relations of Serum Visfatin and Resistin Levels with Endometrial Cancer and Factors Associated with its Prognosis. Asian Pac J Cancer Prev. 2015; 16(11): 4503-8. https://doi.org/10.7314/apjcp.2015.16.11.4503.
- Stępień S., Olczyk P., Gola J., Komosińska-Vassev K., Mielczarek-Palacz A. The Role of Selected Adipocytokines in Ovarian Cancer and Endometrial Cancer. Cells. 2023; 12(8): 1118. https://doi.org/10.3390/cells12081118.
- Michalczyk K., Niklas N., Rychlicka M., Cymbaluk-Płoska A. The Influence of Biologically Active Substances Secreted by the Adipose Tissue on Endometrial Cancer. Diagnostics (Basel). 2021; 11(3): 494. https://doi.org/10.3390/diagnostics11030494.
- VriensK.,ChristenS.,ParikS.,BroekaertD.,YoshinagaK.,TalebiA., Dehairs J., Escalona-Noguero C., Schmieder R., Cornfield T., Charlton C., Romero-Pérez L., Rossi M., Rinaldi G., Orth M.F., Boon R., Kerstens A., Kwan S.Y., Faubert B., Méndez-Lucas A., Kopitz C.C., Chen T., Fernandez-Garcia J., Duarte J.A.G., Schmitz A.A., Steigemann P., Najimi M., Hägebarth A., van Ginderachter J.A., Sokal E., Gotoh N., Wong K.K., Verfaillie C., Derua R., Munck S., Yuneva M., Beretta L., DeBerardinis R.J., Swinnen J.V., Hodson L., Cassiman D., Verslype C., Christian S., Grünewald S., Grünewald T.G.P., Fendt S.M. Evidence for an alternative fatty acid desaturation pathway increasing cancer plasticity. Nature. 2019;566(7744): 403-6. https://doi.org/10.1038/s41586-019-0904-1.
- Kulikov V.A., Grebennikov I.N. Rezolviny, protektiny, mareziny: novye mediatory vospaleniya. Vestnik Vitebskogo gosudarstvennogo meditsinskogo universiteta. 2012; 2: 25-30.
- Panigrahy D., Gilligan M.M., Serhan C.N., Kashfi K. Resolution of inflammation:An organizing principle in biology and medicine. Pharmacol Ther. 2021; 227. https://doi.org/10.1016/j.pharmthera.2021.107879.
- Tang S., Wan M., Huang W., Stanton R.C., Xu Y. Maresins: Specialized Proresolving Lipid Mediators and Their Potential Role in Inflammatory-Related Diseases. Mediators Inflamm. 2018. https://doi.org/10.1155/2018/2380319.
- Kelly A.G., Panigrahy D. TargetingAngiogenesis via Resolution of Inflammation. Cold Spring Harb Perspect Med. 2023; 13(3). https://doi.org/10.1101/cshperspect.a041172.
- Liotti F., Marotta M., Melillo R.M., Prevete N. The Impact of Resolution of Inflammation on Tumor Microenvironment: Exploring New Ways to Control Cancer Progression. Cancers (Basel). 2022; 14(14): 3333. https://doi.org/10.3390/cancers14143333.
- Dyall S.C., Balas L., Bazan N.G., Brenna J.T., Chiang N., da Costa Souza F., Dalli J., Durand T., Galano J.M., Lein P.J., Serhan C.N., Taha A.Y. Polyunsaturated fatty acids and fatty acid-derived lipid mediators: Recent advances in the understanding of their biosynthesis, structures, and functions. Prog Lipid Res. 2022; 86. https://doi.org/10.1016/j.plipres.2022.101165.
- Doğan E.S.K., Doğan B., Fentoğlu Ö., Kırzıoğlu F.Y. The role of serum lipoxin A4 levels in the association between periodontal disease and metabolic syndrome. J Periodontal Implant Sci. 2019; 49(2): 105-13. https://doi.org/10.5051/jpis.2019.49.2.105.
- Denisenko Y.K., Kytikova O.Y., Novgorodtseva T.P., Antonyuk M.V., Gvozdenko T.A., Kantur T.A. Lipid-Induced Mechanisms of Metabolic Syndrome. J Obes. 2020. https://doi.org/10.1155/2020/5762395.
- Börgeson E., Godson C. Resolution of inflammation: therapeutic potential of pro-resolving lipids in type 2 diabetes mellitus and associated renal complications. Front Immunol. 2012; 3: 318. https://doi.org/10.3389/fimmu.2012.00318.
- Kolawole O.R., Kashfi K. NSAIDs and Cancer Resolution: New Paradigms beyond Cyclooxygenase. Int J Mol Sci. 2022; 23(3): 1432. https://doi.org/10.3390/ijms23031432.
- Serhan C.N., Levy B.D. Resolvins in inflammation: emergence of the pro-resolving superfamily of mediators. J Clin Invest. 2018; 128(7):2657-69. https://doi.org/10.1172/JCI97943.
- Shan K., Feng N., Cui J., Wang S., Qu H., Fu G., Li J., Chen H., Wang X., Wang R., Qi Y., Gu Z., Chen Y.Q. Resolvin D1 and D2 inhibit tumour growth and inflammation via modulating macrophage polarization. J Cell Mol Med. 2020; 24(14): 8045-56. https://doi.org/10.1111/jcmm.15436.
- Ji R.R. Specialized Pro-Resolving Mediators as Resolution Pharmacology for the Control of Pain and Itch. Ann Rev Pharmacol Toxicol. 2023; 63: 273-93. https://doi.org/10.1146/annurev-pharmtox-051921-084047.
- Martínez-Fernández L., Laiglesia L.M., Huerta A.E., Martínez J.A., Moreno-Aliaga M.J. Omega-3 fatty acids and adipose tissue function in obesity and metabolic syndrome. Prostaglandins Other Lipid Mediat. 2015;121(Pt A): 24-41. https://doi.org/10.1016/j.prostaglandins.2015.07.003.
- Serhan C.N., Sulciner M.L. Resolution medicine in cancer, infection, pain and inflammation: are we on track to address the next Pandemic? Cancer Metastasis Rev. 2023; 42(1): 13-7. https://doi.org/10.1007/s10555-023-10091-5.
- Harwood J.L. Polyunsaturated Fatty Acids: Conversion to Lipid Mediators, Roles in Inflammatory Diseases and Dietary Sources. Int J Mol Sci. 2023; 24(10). https://doi.org/10.3390/ijms24108838.
- Al-Shaer A.E., Buddenbaum N., Shaikh S.R. Polyunsaturated fatty acids, specialized pro-resolving mediators, and targeting inflammation resolution in the age of precision nutrition. Biochim BiophysActa Mol Cell Biol Lipids. 2021; 1866(7). https://doi.org/10.1016/j.bbalip.2021.158936.
- Polus A., Zapala B., Razny U., Gielicz A., Kiec-Wilk B., Malczewska-Malec M., Sanak M., Childs C.E., Calder P.C., Dembinska-Kiec A. Omega-3 fatty acid supplementation influences the whole blood transcriptome in women with obesity, associated with pro-resolving lipid mediator production. Biochim Biophys Acta. 2016; 1861(11): 1746-55. https://doi.org/10.1016/j.bbalip.2016.08.005.
- Dubé L., Spahis S., Lachaîne K., Lemieux A., Monhem H., Poulin S.M., Randoll C., Travaillaud E., Ould-Chikh N.E., Marcil V., Delvin E., Levy E. Specialized Pro-Resolving Mediators Derived from N-3 Polyunsaturated Fatty Acids: Role in Metabolic Syndrome and Related Complications. Antioxid Redox Signal. 2022; 37(1-3): 54-83. https://doi.org/10.1089/ars.2021.0156.
- Sáinz N., Fernández-Galilea M., Costa AGV, Prieto-Hontoria P.L., Barraco G.M., Moreno-Aliaga M.J. n-3 polyunsaturated fatty acids regulate chemerin in cultured adipocytes: role of GPR120 and derived lipid mediators. Food Funct. 2020; 11(10): 9057-66. https://doi.org/10.1039/d0fo01445a.
- Martínez-Fernández L., González-Muniesa P., Laiglesia L.M., Sáinz N., Prieto-Hontoria P.L., Escoté X., Odriozola L., Corrales F.J., Arbones-Mainar J.M., Martínez J.A., Moreno-Aliaga M.J. Maresin 1 improves insulin sensitivity and attenuates adipose tissue inflammation in ob/ob and diet-induced obese mice. FASEB J. 2017; 31(5): 2135-45. https://doi.org/10.1096/fj.201600859R.
- Yunusova N.V., Kondakova I.V., Kolomiets L.A., Afanas'ev S.G., Chernyshova A.L., Shatokhina O.V., Frolova A.E., Zhiwei Zh., Wei W. Adipokiny i ikh retseptory u bol'nykh rakom endometriya i obodochnoi kishki: svyaz' s invaziei i metastazirovaniem. Voprosy onkologii. 2015; 61(4): 619-23.
- Barden A., Shinde S., Tsai I.J., Croft K.D., Beilin L.J., Puddey I.B., Mori T.A. Effect of weight loss on neutrophil resolvins in the metabolic syndrome. Prostaglandins Leukot Essent Fatty Acids. 2019; 148: 25-9. https://doi.org/10.1016/j.plefa.2019.07.001.
- Liu H., Zeng J., Huang W., Xu Q., Ye D., Sun R., Zhang D. Colorectal Cancer Is Associated with a Deficiency of Lipoxin A , an Endogenous Anti-inflammatory Mediator. J Cancer. 2019; 10(19): 4719-30. https://doi.org/10.7150/jca.32456.
- Blogowski W., Dolegowska K., Deskur A., Dolegowska B., Starzynska T. Lipoxins and Resolvins in Patients With Pancreatic Cancer: A Preliminary Report. Front Oncol. 2022; 11. https://doi.org/10.3389/fonc.2021.757073.
- Torres W., Pérez J.L., Díaz M.P., D’Marco L., Checa-Ros A., Carrasquero R., Angarita L., Gómez Y., Chacín M., Ramírez P., Villasmil N., Durán-Agüero S., Cano C., Bermúdez V. The Role of Specialized Pro-Resolving Lipid Mediators in Inflammation-Induced Carcinogenesis. Int J Mol Sci. 2023; 24(16). https://doi.org/10.3390/ijms241612623.
- Al-Zaubai N., Johnstone C.N., Leong M.M., Li J., Rizzacasa M., Stewart A.G. Resolvin D2 supports MCF-7 cell proliferation via activation of estrogen receptor. J Pharmacol Exp Ther. 2014; 351(1): 172-80. https://doi.org/10.1124/jpet.114.214403.


