Ассоциация полиморфных маркеров гена TCF7L2 с сахарным диабетом типа 2
Автор: Никитин Алексей Георгиевич, Потапов Виктор Андреевич, Бровкин Алексей Николаевич, Лаврикова Елена Юрьевна, Ходырев Дмитрий Сергеевич, Шамхалова Минара Шамхаловна, Сметанина Светлана Андреевна, Суплотова Людмила Александровна, Шестакова Марина Владимировна, Носиков Валерий Вячеславович, Аверьянов Александр Вячеславович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (17), 2014 года.
Бесплатный доступ
С целью изучения ассоциации с сахарным диабетом типа 2 гена TCF7L2 проанализировано распределение частот аллелей и генотипов полиморфных маркеров rs7903146 и rs12255372 этого гена. В исследование вошли группы больных сахарным диабетом типа 2 и здоровых индивидов без признаков заболевания. Сравнительный анализ распределения частот аллелей и генотипов указывает на ассоциацию с этим заболеванием полиморфного маркера rs7903146 гена TCF7L2, в то время как для маркера rs12255372 не было обнаружено статистически значимой ассоциации. На основании полученных данных можно сделать вывод о том, что в русской популяции ген TCF7L2 ассоциирован с развитием СД типа 2.
Сахарный диабет типа 2, полиморфный маркер, генетическая предрасположенность
Короткий адрес: https://sciup.org/14338481
IDR: 14338481
Текст научной статьи Ассоциация полиморфных маркеров гена TCF7L2 с сахарным диабетом типа 2
Сахарный диабет (СД) – это группа метаболических (обменных) заболеваний, характеризующихся хронической гипергликемией, которая является результатом нарушения секреции инсулина, действия инсулина или обоих этих факторов. Хроническая гипергликемия при СД сопровождается повреждением, дисфункцией и недостаточностью различных органов, особенно глаз, почек, нервов, сердца и кровеносных сосудов.
В настоящее время во всех странах мира, особенно в промышленно развитых, наблюдается пандемия СД типа 2, который является одним из наиболее распространенных заболеваний. Он распространён повсеместно, однако уровень заболеваемости в различных регионах мира варьирует в зависимости от многих факторов, в особенности от этнической принадлежности популяции. Сахарный диабет типа 2 встречается в 10 раз чаще, чем сахарный диабет типа 1. По данным Всемирной Организации Здравоохранения в европейских странах распространённость сахарного диабета 2-го типа составляет 3-6%, в странах Америки: 5% у европеоидов, 10% – у афроамериканцев, 24% – у американцев мексиканского происхождения, у жителей островов Микронезии и Полинезии – до 35%.
В настоящее время ключевыми звеньями патогенеза СД типа 2 считают инсулинорезис-тентность (ИР), нарушение секреции инсулина, повышение продукции глюкозы печенью, а также наследственную предрасположенность и особенности образа жизни и питания, ведущие к ожирению. Роль наследственности в развитии СД типа 2 не вызывает сомнения. Гиподинамия и избыточное питание приводят к развитию ожирения, усугубляя тем самым генетически детерминированную ИР и способствуя реализации генетических дефектов, непосредственно ответственных за развитие СД типа 2.
Для СД типа 2, так же как и для других многофакторных заболеваний, характерна полигения, то есть клинический фенотип является результатом действия нескольких генетических локусов [1]. Различают две основные наследственные причины в формировании гипергликемии – это генетические дефекты β -клеточной функции и генетические дефекты действия инсулина.
К настоящему времени известно около 30 генов, варианты которых предрасполагают к развитию СД типа 2, что подчеркивает поли-генный характер данного заболевания [2, 3]. Генетический вклад можно разделить на два типа: гены, влияющие на развитие инсулиноре-зистентности в периферических тканях (мышцы, печень) и гены, связанные с нарушением развития, роста, пролиферации и функции β-клеток поджелудочной железы.
Недавние исследования в области генетики СД типа 2 выявили несколько предрасполагающих генетических вариантов, которые влияют на функцию и выживание β -клеток поджелудочной железы [4]. Некоторые из них располагались в гене TCF7L2 (ранее известный как TCF4 ), играющего важную роль в развитии и функциональной активности β -клеток.
TCF7L2 расположен в области 10q25.3 и кодирует транскрипционный фактор, который является составной частью Wnt-сигнального пути. С помощью этого сигнального механизма регулируются механизмы роста и развития клеток [5] (рис. 1). Активация этого пути начинается с образования комплекса из белка Wnt, FZD-рецептора и ко-рецептора LRP-5/6.
Это приводит к активации белка Dvl, который фосфорилируется казеинкиназой I ε , после чего ингибирует казеинкиназу 1 и киназу
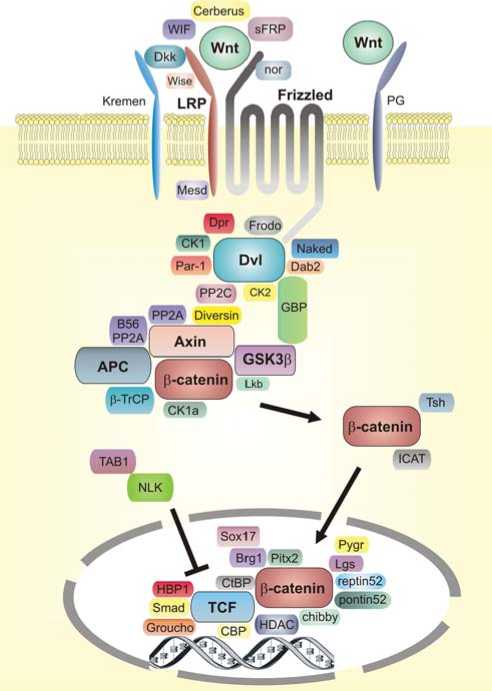
Рис. 1. Взаимодействие белков в Wnt-сигнальном пути.
Источник: гликогенсинтетазы (GSK3). Это приводит к прекращению деградации β-катенинов, которые проникают внутрь ядра, и связываются с транскрипционным фактором [6].
В гене TCF7L2 было найдено два одиночных нуклеотидных полиморфизма ( rs12255372 и rs7903146 ), показавших сильную ассоциацию с СД типа 2 [7]. Эти данные были подтверждены на множественных этнических исследованиях европейских [8-13], азиатских [14-16], афро-ка-рибской [17] и афро-американской [18] популяциях. Среди всех известных к данному времени генетических маркеров риска СД типа 2, маркеры rs12255372 и rs7903146 показали наиболее выраженную ассоциацию с высоким риском развития СД типа 2 (OR ≥ 1,40) в европейских популяциях [10, 19]. Также была обнаружена ассоциация данных маркеров с повышенным уровнем проинсулина при одновременном сокращении амплитуды инсулинового ответа в ответ на стимуляцию глюкозой [20], низкой секрецией инсулина [21, 22] и уменьшением скорости превращения проинсулина в инсулин [23].
В настоящей работе была поставлена задача изучить ассоциацию полиморфных маркеров rs7903146 и rs12255372 гена TCF7L2 с сахарным диабетом типа 2 у русских больных, проживающих в г. Москве.
Экспериментальная часть
В исследование было включено 440 пациентов с установленным диагнозом СД типа 2 («СД2+») на основании клинических и биохимических исследований. Контрольная группа («СД2-») представляла собой случайную выборку из 264 пациентов без признаков заболевания (табл. 1).
У всех пациентов были измерены следующие параметры: базальная концентрация глюкозы и инсулина в крови, концентрация глюкозы и инсулина в крови через 2 часа после ППГТ (пероральный глюкозо-толерантный тест), а также рассчитаны индексы HOMA-IR (Homeostasis model assessment-insulin resistance) и HOMA- β (homeostasis model assessment of β -cell function), необходимые соответственно для оценки функционирования β -клеток и оценки инсулинорезистентности тканей [24]. Исследуемые группы формировались из числа пациентов Эндокринологического Научного Центра (г. Москва) и Тюменской Государственной Медицинской Академии (г. Тюмень). Выборки были этнически однородны и составлены из русских (по данным анкетирования).
Геномную ДНК выделяли из цельной крови больных посредством экстракции фенолом-хлороформом после инкубации образцов крови с протеиназой К в присутствии 0,1% додецилсульфата натрия [25].
Амплификацию полиморфных участков исследуемых генов проводили с помощью ПЦР «в реальном времени» на термоциклере «ABI StepOnePlus» (Applied Biosystems) в 20 мкл реакционной смеси следующего состава: 70 мМ Трис-HCl, pH 8.8, 16.6 мМ сульфат аммония, 0.01%-ный Твин-20, 2 мМ хлорид магния, 200 нМ каждого dNTP, 500 нМ праймеров, 250 нМ флуоресцентных зондов, 1.5 ед. Taq ДНК-полимеразы (термостабильная ДНК-полимераза Taq производства ЗАО «Евроген», г. Москва, олигонуклеотидные праймеры синтезированы ЗАО «Евроген», г. Москва, флуоресцентные зонды синтезированы ООО «ДНК-Синтез», г. Москва), 50-100 нг геномной ДНК.
Таблица 1
Сравнительная характеристика больных в группе с установленным диагнозом СД типа 2 (СД2+) и контрольной группе и (СД2-)
|
Метаболические характеристики |
СД2+ (n = 440) |
СД2- (n = 264) |
|
Базальный уровень глюкозы (моль/л) |
9,9 ± 1,7 |
5,7 ± 0,5 |
|
Уровень глюкозы через 2 часа после ППГТ* (моль/л) |
12,4 ± 1,2 |
6,8 ± 0,7 |
|
Базальный уровень инсулина (мЕд/л) |
14,8 ± 7,7 |
10,2 ± 6,2 |
|
Уровень инсулина через 2 часа после ППГТ (мЕд/л) |
84,0 ± 32,1 |
48,2 ± 19,9 |
|
HOMA-b |
46,2 ± 22,4 |
92,7 ± 46,3 |
|
HOMA-IR |
6,5±1,6 |
2,6±0,6 |
* ПГТТ – пероральный глюкозо-толерантный тест
Условия амплификации фрагментов ДНК: 950C/2 мин – 1-й цикл; 940C/10 сек, 54-660C/60-40 циклов, условия ПЦР, последовательности праймеров, флуоресцентных зондов и метод детекции генотипов для исследо- ванных локусов приведены в табл. 2.
Используемые в зондах флуоресцентные красители – FAM (карбоксифлуоресцеин) и HEX (гексахлорофлуоресцеин), тушитель флуоресценции – BHQ-1.
Таблица 2
Последовательности праймеров, флуоресцентных зондов и особенности амплификации полиморфных участков гена TCF7L2
|
Ген |
Полиморфный маркер |
Метод генотипирования |
Последовательность праймеров, 5`-3` |
Последовательность зондов, 5`-3` |
Темпера тура отжига, °С |
|
TCF7L2 |
rs7903146 |
TaqMan |
ctctgcctcaaaaccta gccttccctgtaactg |
agcactttttagatactatataatttaatt agcactttttagatattatataatttaatt |
58 |
|
rs12255372 |
TaqMan |
gtccagtttacacataagg cactcagaagagagtcag |
caggcaagaatgaccatatt caggcaagaattaccatatt |
58 |
Обозначения полиморфных маркеров даны в соответствии с базой данных dbSNP .
Статистический анализ распределения частот генотипов проводили с использованием таблиц сопряженности и критерия хи-квадрат ( χ 2). Вычисления производили с помощью программы «Калькулятор для расчета статистики в исследованиях "случай-контроль"» [26] и пакета статистических программ SPSS версии 17. Достоверными считали различия при p < 0,05.
Результаты и обсуждение
Полиморфные маркеры rs12255372 и rs7903146 представляют собой замены G/T в интроне 4 и С/Т в интроне 3, соответственно. В различных исследованиях была установлена связь изменений в гене с нарушением инсули- нового ответа, секрецией инсулина и уменьшением конверсии проинсулина в инсулин [1922, 27]. Механизм этих изменений в настоящее время до конца не изучен, но, возможно, наличие данных полиморфных маркеров приводит к изменениям в процессе созревания РНК [28]. Нарушение работы β-клеток поджелудочной железы напрямую способствует развитию СД, поэтому было предпринято несколько попыток найти ассоциацию полиморфных маркеров rs12255372 и rs7903146 гена TCF7L2 с данным заболеванием [7-10, 29, 30].
При анализе распределения частот и аллелей и генотипов полиморфного маркера rs7903146 гена TCF7L2 в группах «СД2+» и «СД2-» были обнаружены статистически достоверные различия (табл. 3).
Наличие аллеля T и генотипа T/T повышало
Таблица 3
Сравнительный анализ распределения частот аллелей и генотипов полиморфного маркера rs7903146 гена TCF7L2 в группах «СД2+» и «СД2-»
При анализе ассоциации данного полиморфного маркера со значениями метаболических показателей глюкозотолерантности и функции β -клеток были обнаружены статистически достоверные различия (табл. 4).
Для носителей генотипов C/T и T/T в груп- пе «СД2+» и в группе «СД2-», наблюдалось снижение базального уровня инсулина и уровня инсулина через 2 часа после ППТГ, а также увеличение уровня глюкозы через 2 часа после ППТГ и уменьшение индекса HOMA-β.
При анализе распределения частот аллелей и генотипов полиморфного маркера rs12255372 гена TCF7L2 в группах «СД2+» и «СД2-» статистически достоверных различий найдено не было (табл. 5).
Таблица 4
Анализ ассоциация полиморфного маркера rs7903146 гена TCF7L2 с метаболическими показателями глюкозотолерантности и функции β -клеток
|
«СД2+» (п = 440) |
«СД2-»(п = 264) |
|||||||
|
Метаб. характеристики |
С/С |
С/Т |
Т/Т |
Р |
С/С |
С/Т |
Т/Т |
Р |
|
Уровень глюкозы через 2 часа после ППГТ(тто1/1) |
12,2±1,4 |
12,9±1,1 |
13,3±1,3 |
0,041 |
6,9±0,3 |
7,1±0,8 |
7,5±0,7 |
0,028 |
|
Базальный уровень инсулина (mU/1) |
15,1±4,5 |
14,2±4,7 |
13,1±3,4 |
0,043 |
10,9±5,8 |
10,4±4,6 |
ю,о±з,з |
0,046 |
|
Уровень инсулина через 2 часа после ППГТ (mU/1) |
81,7±30,5 |
79,6±32,3 |
77,8±34,1 |
0,028 |
54,6±20,1 |
49,2±19,4 |
45,7±21,1 |
0,040 |
|
НОМА-Ь |
52,9±14,5 |
43,6±21,0 |
34,9±21,9 |
0,019 |
99,2±21,2 |
94,5±43,1 |
90,4±43,8 |
0,021 |
Таблица 5
Сравнительный анализ распределения частот аллелей и генотипов полиморфного маркера rs12255372 гена TCF7L2 в группах «СД2+» и «СД2-»
|
Аллели и генотипы |
Частота аллелей и генотипов |
Значение /2 |
Уровень значимости р |
OR |
||
|
СД2+ |
СД2- |
|||||
|
п = 440 |
п = 264 |
значение |
CI95% |
|||
|
Аллель G |
590 / 0,670 |
372 / 0,705 |
1,77 |
0,18 |
0,85 |
0,68-1,08 |
|
Аллель Т |
290 / 0,330 |
156/0,295 |
1,17 |
0,93 -1,48 |
||
|
Генотип GG |
190/0,432 |
122 / 0,462 |
3,45 |
0,18 |
0,88 |
0,65-1,20 |
|
Генотип GT |
210/0,477 |
128/0,485 |
0,97 |
0,71 - 1,32 |
||
|
Генотип ТТ |
40/0,091 |
14/0,053 |
1,79 |
0,95-3,35 |
||
При анализе ассоциации данного полиморфного маркера со значениями метаболических показателей глюкозотолерантности и функции β -клеток были обнаружены статистически достоверные различия (табл. 6).
В группах «СД2+» и «СД2-» у носителей генотипов GT и TT по сравнению с носителями генотипа GG наблюдались снижение базального уровня инсулина и через 2 часа после ППГТ, повышение уровня глюкозы через 2 часа после
Таблица 6
Анализ ассоциация полиморфного маркера rs12255372 гена TCF7L2 с метаболическими показателями глюкозотолерантности и функции β -клеток
|
«СД2+» (п =440) |
«СД2-«(п = 264) |
|||||||
|
Метаб. характеристики |
G/G |
G/T |
Т/Т |
Р |
G/G |
G/T |
Т/Т |
Р |
|
Базальный уровень глюкозы (mmol/1) |
9,3±1,8 |
10,3±1,6 |
10,7±1,9 |
0,018 |
5,4±0,5 |
6,2±0,6 |
5,9±0,4 |
н/д |
|
Уровень глюкозы через 2 часа после ППГТ(тто1/1) |
12Д±1,1 |
12,7±1,4 |
13,3±1,3 |
0,035 |
6,4±0,7 |
7,5±0,9 |
7,8±0,8 |
0,017 |
|
Базальный уровень инсулина (mU/1) |
15,5±7,4 |
15,1±7,7 |
13,9±7,5 |
0,033 |
9,1±б,3 |
10,7±5,9 |
11,5±6,2 |
0,026 |
|
Уровень инсулина через 2 часа после ППГТ (mU/1) |
90,7±33,5 |
89,5±31,3 |
79,8±33,3 |
0,018 |
50,6±20,1 |
46,4±19,0 |
43,7±19,2 |
0,035 |
|
НОМА-Ь |
53,4±21,5 |
44,4±23,0 |
38,6±21,9 |
0,003 |
95,8±48,2 |
79,3±41,8 |
74,5±44,6 |
0,001 |
ППГТ, а также снижение индекса HOMA- β .
На основании полученных нами данных можно сделать вывод о том, что в русской популяции основную роль в развитии СД типа 2 играют гены, влияющие на уровень синтеза и секреции инсулина в β -клетках поджелудочной железы. В тоже время следует отметить, что один из полиморфных маркеров гена TCF7L2 не показал ассоциацию с развитием СД типа 2 в русской популяции, хотя в полногеномных поисках ассоциация этого гена с СД типа 2 была обнаружена.
Все эти данные говорят о важности исследования предрасполагающих генетических факторов, вклад которых в развитие заболевания существенно изменяется в зависимости от популяции. Выявление генетических маркеров риска СД типа 2 позволяет лучше понять основной патологический механизм развития этого заболевания и в соответствии с этим выбрать оптимальную терапию заболевания, а также использовать полученные данные для профилактики СД типа 2 у здоровых людей.
Список литературы Ассоциация полиморфных маркеров гена TCF7L2 с сахарным диабетом типа 2
- Пузырев Валерий Павлович. Патологическая анатомия генома человека. Новосибирск: Наука, Сибирское предприятие РАН. 1997.
- Grant Richard W, Moore Allan F, Florez Jose C. Genetic architecture of type 2 diabetes: recent progress and clinical implications. Diabetes Care. 2009. 32 (6), 1107-14.
- Parikh Hemang, Lyssenko Valeriya, Groop Leif C. Prioritizing genes for followup from genome wide association studies using information on gene expression in tissues relevant for type 2 diabetes mellitus. BMC Med Genomics. 2009; 2: 72.
- Florez J C. Newly identified loci highlight beta cell dysfunction as a key cause of type 2 diabetes: where are the insulin resistance genes? Diabetologia. 2008. 51 (7), 1100-10.
- Jin Tianru, Liu Ling. The Wntsignaling pathway effector TCF7L2 and type 2 diabetes mellitus. Mol. Endocrinol. 2008. 22 (11), 2383-92.
- Maiese Kenneth, Li Faqi, Chong Zhao Zhong, Shang Yan Chen. The Wnt signaling pathway: aging gracefully as a protectionist? Pharmacol. Ther. 2008. 118 (1), 58-81.
- Grant Struan FA, Thorleifsson Gudmar, Reynisdottir Inga, et al. Variant of transcription factor 7like 2 (TCF7L2) gene confers risk of type 2 diabetes. Nat. Genet. 2006. 38 (3), 320-323.
- Cauchi Stéphane, Meyre David, Dina Christian, et al. Transcription factor TCF7L2 genetic study in the French population: expression in human betacells and adipose tissue and strong association with type 2 diabetes. Diabetes. 2006. 55 (10), 2903-2908.
- Groves Christopher J, Zeggini Eleftheria, Minton Jayne, et al. Association analysis of 6,736 U.K. subjects provides replication and confirms TCF7L2 as a type 2 diabetes susceptibility gene with a substantial effect on individual risk. Diabetes. 2006. 55 (9), 2640-44.
- Saxena Richa, Gianniny Lauren, Burtt Noël P, et al. Common single nucleotide polymorphisms in TCF7L2 are reproducibly associated with type 2 diabetes and reduce the insulin response to glucose in nondiabetic individuals. Diabetes. 2006. 55 (10), 2890-95.
- Scott Laura J, Bonnycastle Lori L, Willer Cristen J, et al. Association of transcription factor 7like 2 (TCF7L2) variants with type 2 diabetes in a Finnish sample. Diabetes. 2006. 55 (9), 2649-53.
- Zhang Cuilin, Qi Lu, Hunter David J, et al. Variant of transcription factor 7like 2 (TCF7L2) gene and the risk of type 2 diabetes in large cohorts of U.S. women and men. Diabetes. 2006. 55 (9), 2645-48.
- Chandak G R, Janipalli C S, Bhaskar S, et al. Common variants in the TCF7L2 gene are strongly associated with type 2 diabetes mellitus in the Indian population. Diabetologia. 2007. 50 (1), 63-67.
- Marzi C, Huth C, Kolz M, et al. Variants of the transcription factor 7like 2 gene (TCF7L2) are strongly associated with type 2 diabetes but not with the metabolic syndrome in the MONICA/KORA surveys. Horm. Metab. Res. 2007. 39 (1), 46-52.
- Bodhini Dhanasekaran, Radha Venkatesan, Dhar Monalisa, Narayani Nagarajan, Mohan Viswanathan. The rs12255372(G/T) and rs7903146 (C/T) polymorphisms of the TCF7L2 gene are associated with type 2 diabetes mellitus in Asian Indians. Metab. Clin Exp. 2007; 56 (9): 1174-78.
- Horikoshi M, Hara K, Ito C, et al. A genetic variation of the transcription factor 7like 2 gene is associated with risk of type 2 diabetes in the Japanese population. Diabetologia. 2007. 50 (4), 747-51.
- Humphries Steve E, Gable David, Cooper Jackie A, et al. Common variants in the TCF7L2 gene and predisposition to type 2 diabetes in UK European Whites, Indian Asians and AfroCaribbean men and women. J. Mol. Med. 2006. 84 (12), 1005-1014.
- Lewis Joshua P, Palmer Nicholette D, Hicks Pamela J, et al. Association analysis in african ameri cans of Europeanderived type 2 diabetes single nucleotide polymorphisms from wholegenome association studies. Diabetes. 2008. 57 (8), 2220-2225.
- Helgason Agnar, P
- Schäfer S A, Tschritter O, Machicao F, et al. Impaired glucagonlike peptide1induced insulin secretion in carriers of transcription factor 7like 2 (TCF7L2) gene polymorphisms. Diabetologia 2007; 50 (12): 2443-2450.
- Kirchhoff K, Machicao F, Haupt A, et al. Polymorphisms in the TCF7L2, CDKAL1 and SLC30A8 genes are associated with impaired proinsulin conversion. Diabetologia. 2008. 51 (4), 597-601.
- Chimienti Fabrice, Devergnas Séverine, Pattou François, et al. In vivo expression and functional characterization of the zinc transporter ZnT8 in glucoseinduced insulin secretion. J Cell Sci. 2006;119:4199-4206.
- Dunn Michael F. Zincligand interactions modulate assembly and stability of the insulin hexamer a review. Biometals. 2005. 18 (4), 295-303.
- Matthews DR, Hosker JP, Rudenski A S, et al. Homeostasis model assessment: insulin resistance and betacell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28 (7):412-19.
- Johns MB, PaulusThomas JE. Purification of human genomic DNA from whole blood using sodium perchlorate in place of phenol. Anal Biochem 1989; 180 (2): 276-8.
- Калькулятор для расчета статистики в исследованиях «случай-контроль» [http://genexp.ru/calculator_or.php].
- Pearson Ewan R, Donnelly Louise A, Kimber Charlotte, et al. Variation in TCF7L2 influences therapeutic response to sulfonylureas: a GoDARTs study. Diabetes. 2007. 56 (8), 2178-2182.
- Lindi Virpi I, Uusitupa Matti I J, Lindström Jaana, et al. Association of the Pro12Ala polymorphism in the PPARgamma2 gene with 3year incidence of type 2 diabetes and body weight change in the Finnish Diabetes Prevention Study. Diabetes. 2002. 51 (8), 2581-86.
- Salonen Jukka T, Uimari Pekka, Aalto JuhaMatti, et al. Type 2 diabetes wholegenome association study in four populations: the DiaGen consortium. Am. J. Hum. Genet. 2007. 81 (2), 338-45.
- Freathy Rachel M, Timpson Nicholas J, Lawlor Debbie A, et al. Common variation in the FTO gene alters diabetesrelated metabolic traits to the extent expected given its effect on BMI. Diabetes. 2008. 57 (5), 1419-26.


