Ассоциация размеров фиброза левого предсердия со структурным ремоделированием левого желудочка у больных с фибрилляцией предсердий
Автор: Гизатулина Т.П., Павлов А.В., Мартьянова Л.У., Шорохова И.В., Колунин Г.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.34, 2019 года.
Бесплатный доступ
Цель исследования: изучение связи между выраженностью фиброза левого предсердия (ЛП) и структурно-функциональным состоянием левого желудочка (ЛЖ) у больных с неклапанной фибрилляцией предсердий (ФП).Материал и методы. В исследование включены 56 пациентов с ФП (средний возраст - 57,1±8,4 лет, из них 25 женщин), в том числе 47 с пароксизмальной и 9 с персистирующей ФП, госпитализированных в клинику с целью первичной катетерной аблации (КА). Для оценки структурно-функционального состояния сердца выполнялась трансторакальная эхокардиокардиография. На основании расчетов индекса массы миокарда ЛЖ (ИММЛЖ) и относительной толщины стенки (ОТС) ЛЖ все пациенты были разделены на группы по типу геометрии ЛЖ: 1) нормальная геометрия (n=27): нормальный ИММЛЖ (≤95 г/м2 для женщин и ≤115 г/м2 для мужчин) и ОТС≤0,42; 2) концентрическое ремоделирование (n=13): нормальный ИММЛЖ и ОТС>0,42; 3) концентрическая гипертрофия (n=6): увеличение ИММЛЖ и ОТС>0,42; 4) эксцентрическая гипертрофия (n=10): увеличение ИММЛЖ и ОТС≤0,42. Оценка размеров фиброза ЛП была основана на выделении низковольтажных зон ( function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Фибрилляция предсердий, фиброз левого предсердия, ремоделирование левого желудочка, диастолическая дисфункция левого желудочка
Короткий адрес: https://sciup.org/149125297
IDR: 149125297 | УДК: 616.12-008.313.2-06:616.124.2-092:616.125.2-006.327 | DOI: 10.29001/2073-8552-2019-34-2-39-46
Текст научной статьи Ассоциация размеров фиброза левого предсердия со структурным ремоделированием левого желудочка у больных с фибрилляцией предсердий
Гизатулина Т.П., Павлов А.В., Мартьянова Л.У., Шорохова И.В., Колунин Г.В. Ассоциация размеров фиброза левого предсердия со структурным ремоделированием левого желудочка у больных с фибрилляцией предсердий. Сибирский медицинский журнал. 2019;34(2):39–46. https://doi. org/10.29001/2073-8552-2019-34-2-39-46
Фибрилляция предсердий (ФП) – наиболее часто встречающаяся устойчивая аритмия [1], распространенность которой в популяции носит характер эпидемии [2]. У большой доли пациентов ФП развивается на фоне сохранной функции миокарда, что обусловливает необходимость ранней диагностики причин, предрасполагающих к ФП [3].
В патогенезе многих факторов риска развития ФП, включая возраст, артериальную гипертонию, ожирение, сахарный диабет, участвует нарушение диастолической функции левого желудочка (ЛЖ) [4]. Это объясняет параллельный рост диастолической дисфункции ЛЖ и заболеваемости ФП с увеличением возраста [5].
Обширная информация, основанная на клинических и экспериментальных исследованиях, подтверждает, что фиброз левого предсердия (ЛП) играет ключевую роль в появлении драйверов для поддержания и прогрессирования ФП [6, 7]. Ремоделируемая под влиянием патологических факторов ткань предсердий в результате фиброза, изменения толщины стенки и ориентации мышечных волокон, анизотропии и электрического ремоделирования приобретает уникальные характеристики, обусловливающие формирование драйвера ФП по принципу синергизма [8].
Установлено, что фиброз ЛП может быть визуализирован с помощью вольтажного электроанатомического картирования (ВЭК) в процессе электрофизиологического исследования перед катетерной аблацией (КА), так как зоны низкого вольтажа, электрически немые, с фракционированными потенциалами, хорошо коррелируют с наличием предсердного фиброза или рубцов после хирургического вмешательства [6, 9].
Является доказанным тот факт, что эффективность КА при ФП зависит от выраженности фиброза ЛП [10], поэтому попытка предсказать размеры фиброза ЛП с помощью неинвазивных методов исследования перед КА является чрезвычайно актуальной [11], поскольку позволяет выбрать пациента с предполагаемой высокой эффективностью КА или, наоборот, решить вопрос в пользу консервативной терапии при ожидаемой низкой эффективности КА.
В последнее время все большее значение придается поиску предикторов фиброза ЛП c помощью эхокардиографии (ЭхоКГ), при этом основное внимание уделяется структурному ремоделированию ЛП [12]. Принимая во внимание тот факт, что в патогенезе ФП влияние факторов риска в первую очередь реализуется через диастолическую дисфункцию с последующим структурным ремоделированием ЛЖ, представилось целесообразным изучить корреляцию между выраженностью фиброза ЛП и показателями, характеризующими структурно-функциональное состояние ЛЖ.
Цель исследования: изучить ассоциацию размеров фиброза ЛП по данным ВЭК со структурным ремоделированием сердца у пациентов с неклапанной ФП.
Материал и методы
Данное пилотное исследование представляет собой часть проспективного исследования, целью которого является поиск предикторов эффективности первичной КА при неклапанной ФП у пациентов с сохранной фракцией выброса ЛЖ (ФВЛЖ). В анализ включены данные 56 пациентов с неклапанной ФП в возрасте от 32 до 69 лет (средний возраст 57,1±8,4 лет), в том числе 25 женщин, госпитализированных в Тюменский кардиологический научный центр для проведения первичной КА по поводу ФП.
Исходно всем пациентам выполнялась трансторакальная эхокардиография (ЭхоКГ) в соответствии с рекомендациями по количественной оценке структуры и функции камер сердца с помощью ЭхоКГ [13], а также диастолической функции ЛЖ, одобренными ASE и ЕАС1 [14]. Исследования выполнены с применением ультразвукового сканера Vivid E9 (General Electric Medical Systems, США) с последующим сохранением данных и расчетом показателей, усредненных за три последовательных сердечных цикла. Тип геометрии ЛЖ определялся на основании расчетов индекса массы миокарда ЛЖ (ИММЛЖ) и относительной толщины стенок ЛЖ (ОТС). Расчет ОТС ЛЖ производили по формуле: 2 х толщину задней стенки ЛЖ ^ конечно-диастолический диаметр ЛЖ. Выделяли следующие типы геометрии ЛЖ: 1) тип 1 (нормальная геометрия сердца): нормальный ИММЛЖ (<95 г/м2 для женщин и <115 г/м2 для мужчин) и ОТС≤0,42; 2) тип 2 (концентрическое ремоделирование): нормальный ИММЛЖ и ОТС>0,42; 3) тип 3 (концентрическая гипертрофия): увеличение ИММЛЖ и ОТС>0,42; 4) тип 4 (эксцентрическая гипертрофия): увеличение ИММЛЖ и ОТС<0,42.
Диастолическая функция ЛЖ оценивалась только на синусовом ритме. Для определения диастолической функции ЛЖ из многочисленных исследуемых показателей [14] в данной работе представлены только те, в отношении которых получены статистически значимые результаты: максимальные скорости раннего наполнения ЛЖ (Е) и позднего наполнения ЛЖ (А), отношение Е/А, скорости пика е′ в области латерального (е′ lateral) и медиального (е′ septal) отделов фиброзного кольца митрального клапана, отношение Е/е‘.
Всем пациентам в процессе первичной КА первым этапом выполнялось эндокардиальное биполярное ВЭК ЛП, после чего осуществлялась радиочастотная изоляция устьев легочных вен. Для проведения ВЭК использовались: 3-D навигационная система Carto 3 (Biosense Webster), картирующий аблационный электрод Thermocool Smart Touch или/и многополюсный циркулярный картирующий электрод Lasso NAV (Biosense Webster). Построение биполярной карты осуществлялось преимущественно в автоматизированном режиме с применением картирующего модуля Confidence или в мануальном режиме мето- дом point by point. Анализ вольтажной карты ЛП проводился в послеоперационном периоде опытным электрофизиологом, не осведомлённым о результатах ЭхоКГ. Область митрального клапана и устьев легочных вен не включались в расчет. Зоны низкого вольтажа определялись при амплитуде биполярного сигнала <0,5 мВ, как было предложено M.K. Stiles и соавт. [15]. Выделенные контрастным цветом (отличным от розового), они обводились по периметру с помощью модуля Area Measurement с последующим автоматическим расчетом площади фиброза ЛП (рис. 1). Рассчитывались следующие показатели: общая площадь фиброза (Sф) в см2 (путем суммирования отдельных зон Sф (%) – доля фиброза в %) от общей площади ЛП, степень фиброза по аналогии со шкалой UTAH [11]: степень I – <5%, II – ≥5% ≤ 19%, III – ≥20% ≤35%, IV – >35%. Кроме того, учитывали количество зон фиброза как показатель распространенности и неоднородности аритмогенного субстрата.
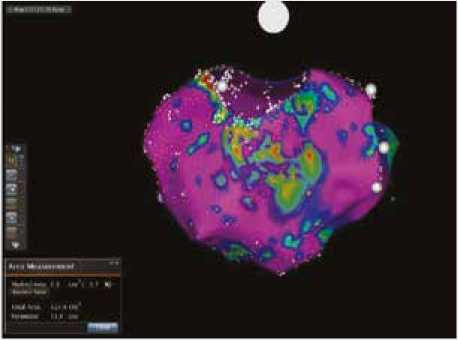
Рис. 1. Биполярная карта с выделением низковольтажной зоны (выделено цветом, отличным от розового), соответствующей области фиброза
Fig. 1. Bipolar map showing low voltage zones (highlighted in a color other than pink), corresponding to left atrial fibrosis
Лабораторные исследования, выполненные всем пациентам до КА, кроме общеклинических, включали определение уровня N-концевого мозгового натрийуретического пропепти-да (NT-proBNP).
Статистическую обработку данных проводили с помощью программного пакета STATISTICA 6.0 for Windows. Ввиду малой численности выборки количественные показатели представлены в виде медианы и интерквартильного размаха Me [ Q 25; Q 75]. При сравнении количественных показателей в двух независимых группах использовали U-критерий Манна–Уитни, при сравнении трех и более независимых групп - критерий Кра-скела–Уоллиса с процедурой множественных сравнений. При сравнении качественных показателей применяли критерий х2 Пирсона и точный критерий Фишера. Оценку корреляционных связей между парами количественных признаков осуществляли с использованием непараметрического рангового коэффициента Спирмена. Результаты считались статистически значимыми при p <0,05.
Результаты
Клиническая характеристика больных представлена в таблице 1.
Таблица 1. Клиническая характеристика больных
Table 1. Clinical characteristics of patients
|
Характеристики |
Показатели |
|
Возраст (лет) |
57,1±8,4 |
|
Женский пол, n (%) |
25 (44,6) |
|
Форма ФП: пароксизмальная, п (%) |
47 (83,9) |
|
персистирующая, п (%) |
9 (16,1) |
|
АГ, п (%): |
28 (50) |
|
Стадия: 1 (п ) |
3 |
|
2 ( п ) |
22 |
|
3 (п ) |
3 |
|
Степень: 1 (п ) |
5 |
|
2 ( п ) |
8 |
|
3 ( п ) |
15 |
|
ИБС в сочетании с АГ, п (%), в том числе |
20 (35,7) |
|
перенесенный инфаркт миокарда |
1 (1,8) |
|
Изолированная ФП, п (%) |
8 (14,3) |
|
Длительность анамнеза ФП: |
|
|
менее 1 года (п ) |
5 |
|
от 1 года до 3 лет (п ) |
17 |
|
более 3 лет (п) |
34 |
|
ХСН, п (%): |
44 (78,6) |
|
ФК I (п ) |
23 |
|
ФК II (п ) |
17 |
|
ФК III (п) |
4 |
|
Нарушения углеводного обмена, п (%): |
9 (16,1) |
|
сахарный диабет ( п) |
3 |
|
нарушение толерантности к глюкозе (п) |
5 |
|
нарушение гликемии натощак ( п ) |
1 |
|
Хроническая болезнь почек, n (%) |
5 (8,9) |
|
CHA2DS2-VASc (средний балл), в том |
|
|
числе: |
1,9 |
|
0 баллов( п ) |
4 |
|
1 балл (п) |
16 |
|
2 балла (п ) |
20 |
|
3 балла (п) |
12 |
|
4 балла (п) |
3 |
|
5 баллов ( п) |
1 |
|
Число пациентов с классом симптомов |
|
|
ФП, EHRA (п ): |
18 |
|
11а ( п ) |
34 |
|
IIB ( п ) |
4 |
|
III ( п ) |
|
|
NT-proBNP (пг/мл): ( Me [25; 75]) |
91,00 (33,20; 154,00) |
|
<125 пг/мл, п (%) |
35 (62) |
|
>125 пг/мл, п (%) |
21 (38) |
Примечание: АГ – артериальная гипертония, ИБС – ишемическая болезнь сердца, ХСН – хроническая сердечная недостаточность, ФК – функциональный класс ХСН.
Note: AH – arterial hypertension; IHD – ischemic heart disease; CHF – chronic heart failure; f.c. – functional class of CHF.
Несмотря на то, что статистически значимая связь между размерами фиброза и ФК ХСН отсутствовала, отмечена прямая связь Sф и Sф (%) с уровнем Nt-proBNP: R =0,31 и R =0,30 соответ-ст^енно ( p <0,05).
Наиболее выраженная, IV степень фиброза по шкале, аналогичной UTAH, регистрировалась чаще у пациентов с персистирующей формой ФП по сравнению с пациентами с пароксизмальной формой ФП: 55,6 и 17,0% соответственно ( p =0,017).
Для оценки ассоциации фиброза ЛП со структурно-функциональными особенностями сердца проведен корреляционный анализ между параметрами ЭхоКГ и показателями фиброза ЛП. Коэффициенты корреляции наиболее значимых связей представлены в таблице 2 (статистически значимые показатели выделены жирным шрифтом).
Была выявлена прямая связь размеров фиброза ЛП с диаметром правого предсердия (ПП) и ЛП, массой миокарда ЛЖ (ММЛЖ) и систолическим давлением в легочной артерии и обратная связь между фиброзом ЛП и ФВЛЖ.
Таблица 2. Корреляционные связи показателей фиброза ЛП с данными ЭхоКГ
Table 2. Correlation of left atrial fibrosis extent with echocardiographic parameters
|
Показатели ЭхоКГ |
Sф (см2) |
Sф (% ) |
Степень фиброза (UTAH) |
|
Диаметр ЛП |
0,38 |
0,36 |
0,35 |
|
Индекс диаметра ЛП |
0,44 |
0,44 |
0,40 |
|
Объем ЛП |
0,38 |
0,36 |
0,28 |
|
Индекс объема ЛП |
0,42 |
0,41 |
0,29 |
|
Индекс объема ПП |
0,29 |
0,33 |
0,26 |
|
СДЛА |
0,29 |
0,29 |
0,23 |
|
ФВЛЖ |
– 0,29 |
– 0,28 |
– 0,30 |
|
ММЛЖ |
0,18 |
0,15 |
0,12 |
|
ИММЛЖ |
0,30 |
0,27 |
0,23 |
|
Регургитация на ТК |
0,29 |
0,30 |
0,28 |
Примечание: ЛП – левое предсердие; ПП – правое предсердие;
СДЛА – систолическое давление в легочной артерии; ФВЛЖ – фракция выброса левого желудочка; ММЛЖ – масса миокарда левого желудочка; ИММЛЖ – индекс массы миокарда левого желудочка; ТК рег. – степень регургитации на трикуспидальном клапане. Жирным шрифтом выделены статистически значимые связи ( p <0,05).
Note: LA – left atrium; RA – right atrium; SPPA – systolic pressure in the pulmonary artery; LVE – left ventricular ejection fraction;
LVMM – left ventricular myocardium mass; TV reg – degree of regurgitation on tricuspid valve. Significant values ( p <0.05) are shown in bold.
С помощью сравнительного анализа в независимых выборках, а также корреляционного анализа Спирмена были исследованы связи между размером фиброза ЛП и клиническими данными. Не было получено статистически значимых различий показателей фиброза ЛП в зависимости от пола, наличия сахарного диабета и других нарушений углеводного обмена, наличия анемии в анамнезе, присутствия хронической болезни почек. Отсутствовала связь показателей фиброза ЛП с возрастом, индексом массы тела, степенью ожирения, а также количеством баллов по шкале CHA2DS2-VASc.
Структурно-функциональные показатели сердца в зависимости от типов геометрии сердца представлены в таблице 3. Показатели пациентов с нормальной геометрией ЛЖ (тип 1) рассматривались в качестве референсных. Пациенты с концентрической (тип 3) и эксцентрической гипертрофией (тип 4) отличались от типа 1 увеличением диаметра ЛП и наличием признаков гипертрофии ЛЖ. При этом пациенты с эксцентрической гипертрофией имели дополнительные отличия в виде увеличения размера и объемов ЛЖ, а также значимого тренда к более низкой ФВЛЖ.
Таблица 3. Структурно-функциональные показатели сердца и типы геометрии ЛЖ
Table 3. Structural and functional parameters of the heart and types of left ventricular geometry
|
Данные ЭхоКГ |
Типы геометрии ЛЖ |
|||
|
Тип 1 (п =27) |
Тип 2 ( п =13) |
Тип 3 ( п =6) |
Тип 4 ( п =10) |
|
|
ЛП, мм |
39,0 (37,0; 44,0) |
40,0 (38,0; 43,0) |
46,0 (40,0; 47,0)* |
43,5 (41,0; 46,0)* |
|
КДО ЛП, мл |
52,5 (40,5; 67,5) |
61,7 (51,5; 73,0)# |
70,2 (60,5; 85,0)# |
76,0 (54,0; 80,0)# |
|
Индекс объема ЛП, мл/м2 |
28,3 (22,2; 34,9) |
30,8 (26,6; 37,8) |
35,3 (32,0; 38,7)# |
37,4 (22,4; 39,7) |
|
КСР ЛЖ, мм |
31,0 (28,0; 34,0) |
28,0 (26,0; 29,0)** |
33,0 (29,0; 36,0) |
33,0 (31,5; 35,5)# |
|
КДР ЛЖ, мм |
49,3 (48,0; 51,0) |
45,0 (42,0; 48,0)** |
52,0 (49,0; 53,0)# |
51,5 (49,0; 56,0)* |
|
КДО ЛЖ, мл |
114,0 (105,0; 124,0) |
91,0 (79,0; 105,0)** |
111,0 (102,0; 128,0) |
128,0 (116,5; 143,5)* |
|
КСО ЛЖ, мл |
36,0 (29,0; 42,0) |
29,5 (24,5; 32,5)* |
41,0 (33,0; 42,0) |
47,0 (39,0; 52,5)* |
|
МЖП, мм |
10,0 (9,0; 11,0) |
10,5 (10,0; 13,0)* |
14,5 (12,0; 15,0)*** |
12,0 (12,0; 13,0)*** |
|
ЗСЛЖ мм |
9,0 (8,0; 9,0) |
11,0 (10,0; 11,0)*** |
12,0 (12,0; 13,0)*** |
10,0 (9,0; 11,0)** |
|
ММЛЖ, г |
158,0 (146,0; 174,0) |
173,4 (146,0; 193,0)# |
287,0 (234,0; 330,0)*** |
228,5 (198,0; 254,9)*** |
|
ИММЛЖ, г/м2 |
83,0 (74,0; 92,0) |
87,0 (77,8; 90,4) |
135,5 (117,0; 150,5)*** |
101,9 (100,5; 121,0)*** |
|
ФВЛЖ, % |
68,0 (63,0; 72,0) |
69,0 (38,0; 43,0) |
65,5 (63,0; 70,0) |
61,0 (59,0; 69,0)# |
Примечание: ЛЖ - левый желудочек, ЛП - левое предсердие, КСР - конечно-систолический размер, КДР - конечно-диастолический размер, КСО – конечно-систолический объем, КДО – конечно-диастолический объем, МЖП – межжелудочковая перегородка, ЗСЛЖ – задняя стенка левого желудочка, ММЛЖ – масса миокарда левого желудочка, ИММЛЖ – индекс массы миокарда левого желудочка; ФВЛЖ – фракция выброса левого желудочка. Статистическая значимость различий в сравнении с типом 1: * p <0,05; ** p <0,01; *** p <0,001; # p <0,1.
Note: LV – left ventricle; LA – left atrium; LV EDV – left ventricular end-diastolic volume; LV ESD – left ventricular end-systolic diameter; LV EDD – left ventricular end-diastolic diameter; LV ESV – left ventricular end-systolic volume; IVS – interventricular septum; LV PW – left ventricular posterior wall; LVMM – left ventricular myocardium mass; LVEF – left ventricular ejection fraction. Significance of differences in comparison with type 1: * p <0.05; ** p <0.01; *** p <0.001; # p <0.1.
При сравнении размеров фиброза ЛП у пациентов с различными типами ремоделирования не было выявлено статистически значимых различий показателей фиброза ЛП, характеризующих площадь фиброза (табл. 4). Но при этом количество зон фиброза у пациентов с эксцентрической гипертрофией ЛЖ было статистически значимо выше, чем у пациентов с нормальной ге ометрией сердца. Поскольку по данным анализа Спирмена имелась сильная прямая связь количества зон фиброза с Sф (R=0,88, p<0,05), а также с Sф (%) (R=0,81; p<0,05), можно сделать вывод о том, что эксцентрическая гипертрофия ЛЖ ассоциируется с большей распространенностью и, вероятно, неоднородностью фиброза ЛП по сравнению с нормальной геометрией сердца.
Таблица 4. Показатели фиброза ЛП в зависимости от типов геометрии ЛЖ
Table 4. Indicators of left atrial fibrosis depending on the type of left ventricular geometry
|
Типы геометрии ЛЖ |
5ф (см2) |
p |
Sф (%) |
p |
Количество зон фиброза |
p |
|
Тип 1 |
9,1 (3,4; 16,9) |
14,0 (4,86; 29,2) |
4,0 (2,0; 4,0) |
|||
|
Тип 2 |
9,0 (6,9; 28,0) |
р1-2=0,5902 |
15,2 (8,3; 36,6) |
p 1-2 = 0,7324 |
4,0 (3,0; 5,0) |
p 1-2 =0,6333 |
|
Тип 3 |
9,0 (3,5; 23,0) |
p 1. 3=0,4113 |
13,6 (4,9; 34,3) |
p 1-3 = 0,4113 |
3,5 (2,0; 5,0) |
p 1-3=0,9591 |
|
Тип 4 |
19,9 (7,1; 4,5) |
p 1-4 =0,1164 |
27,8 (10,0; 37,8) |
p 1-4 = 0,1544 |
5,0 (4,0; 5,0) |
p 1-4 =0,0427 |
Примечание: Sф – общая площадь фиброза левого предсердия (ЛП), Sф (%) – доля фиброза от общей площади ЛП.
Notes: Sf – total square of left atrium fibrosis; Sf (%) – % of fibrosis in relation to the total square of the left atrium.
Не было отмечено статистически значимой связи между показателями диастолической функции и размерами фиброза, тем не менее, выявлены различия показателей диастолической функции е‘ septal и е‘ lateral у больных с различными типами ремоделирования ЛЖ: у пациентов с типами ремоделирования 3 и 4 е‘ septal (см/с) и е‘ lateral (см/с) были ниже, чем у лиц с типом геометрии 1: е‘ septal соответственно 5,5±24,0; 6,3±1,9
и 8,5±2,2 ( p <0,01), е′ lateral соответственно 8,0±3,8; 8,2±2,7 и 11,3±2,9 ( p <0,01), при этом E/e` только у пациентов с типом ЛЖ 3 был выше, чем при типе геометрии 1:10,4±2,8 и 7,2±1,6 соответственно ( p <0,001).
Таким образом, максимальная степень фиброза ЛП (>35%) чаще встречалась при персистирующей форме ФП, чем при пароксизмальной. Результаты исследования продемонстриро- вали, что структурно-функциональное ремоделирование ЛЖ связано как с размером и объемом ЛП, так и выраженностью фиброза в нем. Эксцентрическая гипертрофия ЛЖ ассоциируется с наиболее выраженным фиброзом ЛП, хотя нарушения диастолической функции ЛЖ отмечаются как при эксцентрической, так и концентрической гипертрофии ЛЖ.
Обсуждение
Полученные результаты исследования позволяют утверждать, что у большинства пациентов с ФП структурное и электрофизиологическое ремоделирование ЛП, обусловливающее развитие ФП, является следствием структурно-функциональных изменений ЛЖ, возникающих под действием таких факторов риска ФП, как артериальная гипертония, ишемическая болезнь сердца (ИБС), нарушения углеводного обмена, повышение массы тела, возраст и др., приводящих к диастолической дисфункции ЛЖ и связанному с ней структурному ремоделированию ЛЖ, что в последующем вызывает ухудшение систолической функции ЛЖ. Это подтверждается тем, что в нашем исследовании выраженность фиброза ЛП увеличивается не только с нарастанием размера и объема ЛП, но и с увеличением ММЛЖ, систолического давления в легочной артерии, степени регургитации на трехстворчатом клапане, а также со снижением ФВЛЖ. В большинстве случаев эти нарушения длительное время остаются бессимптомными и манифестируют только с появлением ФП. Наши рассуждения согласуются с выводами других авторов, указывающих на то, что фиброз миокарда ответственен за снижение эластических свойств миокарда с развитием диастолической дисфункции ЛЖ, ухудшением сократимости и формированием систолической дисфункции, развитием нарушений ритма сердца и ухудшением коронарного кровотока у пациентов с сердечной недостаточностью различной этиологии [16, 17].
Таким образом, структурное ремоделирование ЛП является вторичным по отношению к патологическим изменениям в ЛЖ, проявляющимся изменением геометрии ЛЖ и последующим развитием сердечной недостаточности. М.А. Rosenberg и соавт. [4] объясняют это тем, что ЛП является тонкостенной структурой, и фиброз в нем развивается быстрее при повышении диастолического давления в ответ на повышение жесткости и снижение комплайен-са ЛЖ. Наличие таких изменений подтверждает выявленная нами прямая связь между размером фиброза ЛП и уровнем NT-proBNP.
Представленные в исследовании особенности выраженности фиброза ЛП в зависимости от типов геометрии ЛЖ можно объяснить тем, что типы ремоделирования соответствуют различным стадиям развивающейся диастолической дисфункции и отражают длительность и тяжесть патологического процесса в ЛЖ, приводящего к фиброзу ЛП. Начальные признаки фиброза ЛП возникают уже на стадии концентрического ремоделирования, хотя современные ЭхоКГ-критерии оценки диастолической функции ЛЖ не всегда позволяют выявить признаки диастолической дисфункции ЛЖ на этом этапе [18], поэтому, вероятно, мы не обнаружили признаков диастолической дисфункции ЛЖ у пациентов этой группы. У пациентов с концентрической гипертрофией ЛЖ, наряду с увеличением ММЛЖ и признаками диа- столической дисфункции ЛЖ, выявлено статистически значимое увеличение диаметра ЛП; тем не менее, по нашим данным, по размерам фиброза ЛП они не отличаются от пациентов с нормальной геометрией ЛЖ. Это может быть связано с наличием компенсаторных механизмов, препятствующих развитию систолической дисфункции ЛЖ. Другим объяснением может быть малая численность пациентов данной подгруппы. При эксцентрической гипертрофии ЛЖ к диастолической дисфункции присоединяются начальные проявления снижения систолической функции, что вызывает увеличение постнагрузки на ЛП и, соответственно, повышение конечно-диастолического давления в ЛП, приводящего к увеличению распространенности фиброза, в том числе и за счет прогрессирования ФП. Это подтверждается тем, что у пациентов с эксцентрической гипертрофией выявлено статистически значимо большее количество зон фиброза, которое коррелировало с площадью фиброза. При этом ФВЛЖ не выходила за пределы нормального уровня, но была ниже, чем у пациентов с нормальной геометрией сердца. Правомочность этих рассуждений подтверждает прямая связь Sф с уровнем систолического давления в легочной артерии, NT-proBNP и обратная связь с ФВЛЖ. Наши данные согласуются с результатами исследования Yuta Seko и соавт., которые обнаружили в крупной популяции госпитальных больных ассоциацию эксцентрической гипертрофии ЛЖ с более частым развитием ФП [19].
Список литературы Ассоциация размеров фиброза левого предсердия со структурным ремоделированием левого желудочка у больных с фибрилляцией предсердий
- Majeed A., Moser K., Carroll K. Trends in the prevalence and management of atrial fibrillation in general practice in England and Wales. 1994-1998: analysis of data from the general practice research database. Heart. 2001;86:284-288. DOI: 10.1136/heart.86.3.284
- Chugh S.S., Blackshear J.L., Shen W.K., Hammill S.C., Gersh B.J. Epide-39-46 miology and natural history of atrial fibrillation: Clinical implications. J.Am. Coll. Cardiol. 2001;37:371-378.
- Wyse D.G., Van Gelder I.C., Ellinor P.T., Go A.S., Kalman J.M., Narayan S.M., et al. Lone atrial fibrillation: does it exist? J. Am. Coll. Cardiol. 2014;63:1715-1723. DOI: 10.1016/j.jacc.2014.01.023
- Rosenberg М.А., Manning W.J. Diastolic dysfunction and risk of atrial fibrillation: a mechanistic appraisal. Circulation. 2012;126:2353-2362. DOI: 10.1161/CIRCULATIONAHA.112.113233
- Chen H.H., Lainchbury J.G., Senni M., Bailey K.R., Redfield M.M. Diastolic heart failure in the community: clinical profile, natural history, therapy, and impact of proposed diagnostic criteria. J. Card. Fail. 2002;8:279-287.
- Kottkamp H. Fibrotic atrial cardiomyopathy: a specific disease/syndrome supplying substrates for atrial fibrillation, atrial tachycardia, sinus node disease, AV node disease, and thromboembolic complications. J. Cardiovasc. Electrophysiol. 2012;23(7):797-799.
- DOI: 10.1111/j.1540-8167.2012.02341.x
- Gal P., Marrouche N.F. Magnetic resonance imaging of atrial fibrosis: redefining atrial fibrillation to a syndrome. Eur. Heart J. 2017;38:14-19.
- DOI: 10.1093/eurheartj/ehv514
- Hansen B.J., Zhao J., Csepe T.A., Moor B.T., Li N., Jayne L.A., et al. Atrial fibrillation driven by micro-anatomic intramural re-entry revealed by simultaneous sub-epicardial and sub-endocardial optical mapping in explanted human hearts. Eur. Heart J. 2015;36:2390-2401.
- Piorkowski C., Hindricks G., Schreiber D., Tanner H., Weise W., Koch A., et al. Electroanatomic reconstruction of the left atrium, pulmonary veins, and esophagus compared with the "true anatomy" on multislice computed tomography in patients undergoing catheter ablation of atrial fibrillation. Heart Rhythm. 2006;3:317-327.
- Akoum N., Morris A., Perry D., Cates J., Burgon N., Kholmovski E., et al. Substrate modification is a better predictor of catheter ablation success in atrial fibrillation than pulmonary vein isolation: An LGE-MRI Study. Clin. Med. Insights Cardiol. 2015;27(9):25-31.
- DOI: 10.4137/CMC.S22100
- Mahnkopf C., Badger T.J., Burgon N.S., Daccarett M., Haslam T.S., Badger C.T., et al. Evaluation of the left atrial substrate in patients with lone atrial fibrillation using delayed-enhanced MRI: implications for disease progression and response to catheter ablation. Heart Rhythm. 2010;7:1475-1481. 10/1016/j.hrthm.2010.06.030.
- DOI: 10.1016/j.hrthm.2010.06.030
- Pilichowska-Paszkiet Е., Baran J., Sygitowicz G., Sikorska A., Stec S., Kułakowski P., et al. Noninvasive assessment of left atrial fibrosis. Correlation between Echocardiography, biomarkers, and electroanatomical mapping. Echocardiography. 2018;35(9):1326-1334.
- DOI: 10.1111/echo.14043
- Lang R.M., Badano L.P., Mor-Avi V., Afilalo J., Armstrong A., Ernande L., et al. Recommendations for cardiac chamber quantification by echocar diography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2015;16(3):233-270.
- DOI: 10.1093/ehjci/jev014
- Nagueh S.F., Smiseth O.A., Appleton C.P., Byrd B.F., Dokainish H., Edvardsen T., et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2016;29(4):277-314.
- DOI: 10.1016/j.echo.2016.01.011
- Stiles M.K., John B., Wong C.X., Kuklik P., Brooks A.G., Lau D.H., et al. Paroxysmal lone atrial fibrillation is associated with an abnormal atrial substrate: Characterizing the "second factor". J. Am. Coll. Cardiol. 2009;53(14):1182-1191.
- DOI: 10.1016/j.jacc.2008.11.054
- Zile M.R., Baicu C.F., Ikonomidis J., Stroud R.E., Nietert P.J., Bradshaw A.D., et al. Myocardial stiffness in patients with heart failure and a preserved ejection fraction: contributions of collagen and titin. Circulation. 2015;131:1247-1259.
- DOI: 10.1161/circulationaha.114.013215
- Каретникова В.Н., Каштанова В.В., Косарева С.Н., Барбараш О.Л. Фиброз миокарда: современные аспекты проблемы. Терапевтический архив. 2017;89(1):88-93.
- DOI: 10.17116/terarkh201789188-93
- Алехин М.Н., Гришин А.М., Петрова О.А. Эхокардиографическая оценка диастолической функции левого желудочка сердца у пациентов с сохранной фракцией выброса. Кардиология. 2017;57(2):40-45.
- DOI: 10.18565/cardio.2017.2.40-45
- Seko Y., Kato T., Haruna T., Izumi T., Miyamoto S., Nakane E., et al. Association between atrial fibrillation, atrial enlargement, and left ventricular geometric remodeling. Scientific Reports. 2018;8:63-66.
- DOI: 10.1038/s41598-018-24875-1
- Hudsmith L.E., Tyler D.J., Emmanuel Y., Petersen S.E., Francis J.M., Watkins H., et al. 31P cardiac magnetic resonance spectroscopy during leg exercise at 3 Tesla. Int. J. Cardiovasc. Imaging. 2009;25:819-826.
- DOI: 10.1007/s10554-009-9492-8
- Мазаев В.В., Стукалова О.В., Терновой С.К., Чазова И.Е. Оценка энергетического метаболизма миокарда у больных с гипертрофией левого желудочка на фоне артериальной гипертонии методом фосфорной магнитно-резонансной спектроскопии. Российский электронный журнал лучевой диагностики. 2013;3(1):36-42.


