Атеротромботический и лакунарный инсульты у пациентов пожилого возраста: особенности клинических проявлений и тромбоцитарного гемостаза
Автор: Голдобин Виталий Витальевич, Клочева Елена Георгиевна, Сироткина Ольга Васильевна, Вавилова Татьяна Владимировна, Ласковец Анастасия Борисовна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 6 (135), 2013 года.
Бесплатный доступ
Ишемический инсульт чаще возникает у лиц пожилого и старческого возраста. Патогенез атеротромботического и лакунарного инсультов определяется взаимодействием тромбоцита с эндотелиоцитом сосуда, что объясняет назначение антиагрегантных препаратов для вторичной профилактики. Цель исследования - изучение клинических данных и показателей тромбоцитарного гемостаза у пациентов пожилого возраста, перенесших атеротромботический и лакунарный инсульты. Обследованы 35 больных с инсультом (66,3 ± 3,9 года) и 13 лиц без инсульта (63,6 ± 5,2 года). Всем обследуемым выполнено стандартное клинико-лабораторное обследование, позволяющее верифицировать патогенетический вариант инсульта, исследование тромбоцитарного гемостаза: аденозиндифосфат-индуцированная агрегометрия и проточная цитометрия экспрессии рецепторов к фибриногену, фактору Виллебранда и Р-селектина, а также молекулярно-генетическое исследование. Данные агрегометрии при стимуляции 2,5 и 5 мкмоль аденозиндифосфата свидетельствовали о более высокой активности тромбоцитов у здоровых лиц (85,3 ± 28,1 и 54,1 ± 20,0 %, р
Ишемический инсульт, тромбоциты, агрегация, р-селектин, рецепторы к фибриногену, тромбоцитарный гликопротеин 1ba
Короткий адрес: https://sciup.org/14750477
IDR: 14750477 | УДК: 616.831-005.4:616-005
Текст научной статьи Атеротромботический и лакунарный инсульты у пациентов пожилого возраста: особенности клинических проявлений и тромбоцитарного гемостаза
Медико-социальная значимость церебрального ишемического инсульта связана с высокими показателями инвалидизации и летальности пациентов [1]. Частота развития первичного ишемического инсульта (ИИ) увеличивается в пожилом возрасте: в когортных исследованиях показано развитие инсульта у 2 % лиц в возрасте 45–64 лет, у 8 % лиц 64–74 лет и у 11 % лиц возраста 75 лет и более [13]. До настоящего времени механизмы развития ИИ окончательно не ясны. Определяющую роль в патогенезе атеротром-ботического и лакунарного инсультов играет взаимодействие тромбоцитов с эндотелиоци-тами сосудистой стенки [3]. Важной составляющей вторичной профилактики атеротромбо-тического и лакунарного инсультов является назначение антитромбоцитарных препаратов. Однако на современном этапе профилактики эффективность антиагрегантной терапии составляет 25 % [6], а повторный ИИ развивается в течение 5 лет у 16–42 % больных [2], [6], что указывает на необходимость определения особенностей терапии для пациентов c различными патогенетическими вариантами ИИ. Выделение классификационных подгрупп атеротромботи-ческого инсульта (АТИ) и лакунарного инсульта (ЛИ) связано с нарушением кровоcнабжения мозга на различных уровнях: атеротромбозом магистральных артерий при АТИ и поражением мелких пенетрирующих артерий при ЛИ, чаще вследствие липогиалиноза.
Целью данного исследования являлось изучение клинических данных и показателей тромбоцитарного гемостаза у пациентов пожилого возраста, перенесших атеротромботический и лакунарный инсульты.
МАТЕРИАЛЫ И МЕТОДЫ
Были обследованы 35 пациентов в возрасте 66,3 ± 3,9 года (основная группа) и 13 здоровых лиц в возрасте 63,6 ± 5,2 года (контрольная группа). Набор пациентов проводился в клинике неврологии СЗГМУ им. И. И. Мечникова и в ан-гионеврологическом отделении ГУЗ «Городская больница святой преподобномученицы Елизаветы» (Санкт-Петербург).
Критериями включения в исследование являлись наличие АТИ или ЛИ в остром периоде, подтвержденное компьютерной томографией (КТ) или магнитно-резонансной томографией (МРТ) головного мозга.
Диагноз АТИ устанавливали при обнаружении стеноза соответствующей очагу артерии (> 50 % по данным дуплексного сканирования), отсутствии признаков кардиогенной эмболии и при размере очага поражения головного мозга > 20 мм при КТ или МРТ [5]. Критериями ЛИ были наличие лакунарного синдрома в клинической картине; отсутствие признаков кардиогенной эмболии, стеноза ипсилатеральной моз- говой артерии > 50 %; размер очага поражения головного мозга < 20 мм при КТ или МРТ [5].
Критериями невключения были: постоянный прием антикоагулянтных препаратов, наличие острого инфаркта миокарда, нестабильной стенокардии, фибрилляции предсердий, острой сердечной недостаточности, хронической сердечной недостаточности выше 2-й стадии по классификации Нью-Йоркской кардиологической ассоциации, пороков клапанов сердца, анамнестические данные о проведении коронарной ангиопластики или аортокоронарного шунтирования, ангиопластики брахиоцефальных артерий, каротидной эндартерэктомии, протезирования клапанов сердца. В исследование не включали пациентов с сопутствующими хроническими заболеваниями головного мозга (рассеянный склероз, болезнь Паркинсона, опухоли); заболеваниями системы крови; наличием хронической почечной недостаточности с проведением гемодиализа; лиц, постоянно принимающих антидепрессанты из группы селективных ингибиторов обратного захвата серотонина.
Для сравнения клинических и гемореологических показателей были выделены 2 группы в соответствии с вариантом ишемического инсульта: 1-ю группу составили 20 больных с АТИ в возрасте 66,5 ± 4,4 года, 2-ю группу – 15 пациентов с ЛИ в возрасте 65,9 ± 3,1 года.
Комплексное обследование включало: клинико-неврологическое, инструментальное и лабораторное исследования. На каждого больного заполнялась специально разработанная карта.
Неврологический осмотр выполняли по стандартной методике. Проводилась оценка состояния пациентов на момент поступления и при выписке по общепринятым шкалам в баллах: по шкале инсульта Американского национального института здоровья (NIHSS), которая характеризует основные нарушения при церебральном инсульте [7], [9], и по шкале Ранкина, которая позволяет оценить степень инвалидизации в повседневной жизни [8].
КТ или МРТ головного мозга выполняли всем больным на 2–5-й день от развития заболевания для верификации очага ишемии в веществе мозга, оценки его локализации и размеров.
Лабораторное исследование включало клинический анализ крови при поступлении и на 10-й день от развития ИИ, а также аденозиндифосфат (АДФ) индуцированную агрегатоме-трию и проточную цитометрию на 10-й день от развития инсульта. Венозную кровь забирали в утреннее время, натощак. В условиях процедурного кабинета под венозным жгутом проводилась венепункция локтевой вены иглой 21G со свободным током крови через вакутейнер в вакуумные полипропиленовые пробирки, содержащие в качестве антикоагулянта К2 и К3 соль этинилдиаминтетрауксусной кислоты (для гема- тологического анализа) или 3,8 % цитрат натрия (для агрегометрии и проточной цитометрии). Выполнение клинического анализа крови с подсчетом количества тромбоцитов осуществляли кондуктометрическим методом на автоматических гематологических анализаторах «Beckman Coulter LH 500» и «MaxM» (США). Показатель среднего объема тромбоцитов (MPV) рассчитывался прибором автоматически из гистограммы тромбоцитов.
АДФ-индуцированную агрегацию тромбоцитов исследовали фотометрическим методом на агрегометре «SOLAR» (Беларусь). Концентрация индуктора составляла 2,5 мкМ, 5 мкМ (АДФ производства «Sigma-Aldrich», США). Результат оценивали по изменению степени светопропу-скания в точке максимума, а также по скорости агрегации через 30 с после добавления АДФ. Перед исследованием на проточном цитометре проводили центрифугирование полученной крови при 1500 об./мин в течение 5 мин при комнатной температуре для получения богатой тромбоцитами плазмы (БТП). Обедненную тромбоцитами плазму (ОТП) получали путем центрифугирования БТП при 3000 об./мин в течение 15 мин. ОТП использовали для разведения БТП до 300 тыс. кл/мкл, если это было необходимо, а также для калибровки агрегометра на уровень Т = 100 %. Содержание гликопротеидов IIb/IIIa и Ibα на поверхности тромбоцитов, а также число клеток, экспрессирующих Р-селектин, определяли на проточном цитометре «CYTOMICS FC 500» («Beckman Coulter», США). Использовались меченые моноклональные антитела CD61-FITC, CD62P-PE (Beckman Coulter, США) и VM16d-FITC (Российский кардиологический научнопроизводственный комплекс Росмедтехнологий, РФ). Количество рецепторов IIb/IIIa и Ibα на поверхности тромбоцитов до и после индукции 10 мкМ АДФ оценивали по показателю средней интенсивности флуоресценции. Экспрессию Р-селектина на поверхности тромбоцитов оценивали как процент клеток, меченных CD62P-PE до и после индукции 10 мкМ АДФ. Математически рассчитывались параметры:
-
1) ΔIIb/IIIa, который показывает увеличение в процентах количества рецепторов IIb/IIIa на поверхности тромбоцитов после индукции АДФ;
-
2) ΔР-селектина, показывающий увеличение процента тромбоцитов, экспрессирующих Р-се-лектин после индукции АДФ.
Молекулярно-генетическое исследование включало выявление точечной мутации гена тромбоцитарного гликопротеида 1bα, локали-зованого в 13-м локусе короткого плеча 17-й хромосомы (с.3550С>T – замена С на Т в 3550-й позиции). Наличие данной миссенс-мутации приводит к замене триптофана на метионин в 145-м положении аминокислотной последова- тельности белка (Thr145Met), в результате чего изменяется функциональная активность рецептора к фактору Виллебранда, что предрасполагает к тромбообразованию и увеличивает риск развития сердечно-сосудистых заболеваний почти в 3 раза [10].
Дезоксирибонуклеиновую кислоту (ДНК) выделяли из лейкоцитов крови стандартным фенол-хлороформным методом. Лизис клеток проводили по методу Канкеля с использованием реактивов фирмы «Хеликон» (РФ). Выход ДНК составлял 40–50 мкг ДНК из 500 мкл цельной крови. Для идентификации однонуклеотидных замен использовали амплификацию соответствующего участка гена методом полимеразной цепной реакции (ПЦР) с последующим рестрикционным анализом. Амплификацию проводили на амплификаторе «Терцик» (термостат программируемый четырехканальный для проведения ПЦР анализа ТП4-ПЦР-01 – «Терцик» ТУ 9452–001–46482062–98, НПФ «ДНК-Технология», РФ) при помощи термостабильной вы-сокопроцессивной рекомбинантной Taq ДНК полимеразы фирмы «Fermentas» (Литва). В результате реакции получали фрагмент 587 полинуклеотидов, который подвергался ферментативному расщеплению с помощью рестриктазы Hin 1I (1 ед.) в рестрикционном буфере. Продукт рестрикционного анализа электрофоретически разделяли при 30 мА (150 В) в полиакриламидном геле в трис-боратном буфере. Результаты визуализировали в ультрафиолетовом свете после окрашивания бромистым этидием. В случае нормального аллельного варианта (Thr) определялись фрагменты 270 полинуклеотидов, 201 полинуклеотид и 1163 полинуклеотида, при мутации образуются фрагменты 386 полинуклеотидов и 201 полинуклеотид (Met).
Статистическую обработку результатов выполняли с использованием пакета программ Statistica 6,0 for Windows (StatSoft Inc.). Изучаемые количественные признаки представлены в виде М ± σ, где М – среднее, σ – одно стандартное отклонение. Проверка нормальности распределения проводилась по критерию Шапиро – Уилкса. Для проверки гипотезы о равенстве средних для двух групп использовались параметрические (t-Стьюдента для независимых выборок; t-Стьюдента для связанных выборок) или непараметрические (χ2, Манна – Уитни, Вилкок-сона) критерии. Различия считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основные клинические проявления ИИ у обследованных пациентов представлены на рисунке. У больных с АТИ выявлялись афазия, гемианопсия, нехарактерные для ЛИ.
Значения NIHSS и шкалы Ранкина в 1-й и 2-й группах при поступлении и при выписке
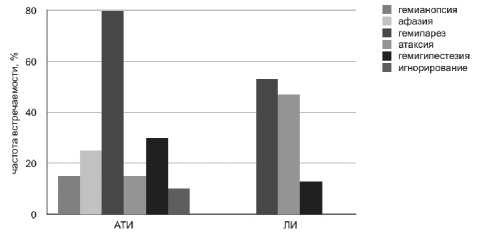
Клинические проявления инсульта у пациентов 1-й и 2-й групп представлены в табл. 1. Наблюдалось достоверно (р < 0,05) более высокое значение NIHSS при поступлении у больных с АТИ, что свидетельствовало о более тяжелом состоянии указанных пациентов. Также у пациентов с АТИ был выявлен значимо (р < 0,05) более высокий балл по шкале Ранкина при выписке, что указывало на выраженное нарушение функциональной независимости. Полученные различия могут быть объяснены большим размером очага при АТИ по сравнению с ЛИ, что предполагает более тяжелое течение заболевания [5].
Таблица 1
Значения клинических шкал у пациентов с различными вариантами ИИ
|
Группа пациентов |
NIHSS, балл |
Шкала Ранкина, балл |
||
|
при поступлении |
при выписке |
при поступлении |
при выписке |
|
|
1-я |
7,6 ± 3,1* |
3,4 ± 2,0 |
2,7 ± 0,7 |
1,8 ± 0,7* |
|
2-я |
4,8 ± 2,6* |
2,3 ± 1,7 |
2,3 ± 0,6 |
1,3 ± 0,5* |
Примечание. * – p < 0,05.
Наблюдалось достоверное уменьшение показателей клинических шкал при выписке по сравнению со значениями при поступлении в обеих группах (р < 0,05), что указывало на благоприятное течение ИИ у обследованных пациентов.
Количество тромбоцитов у пациентов 1-й группы при поступлении составило 233,7 ± 60,6 × 109 / л, MPV – 10,0 ± 1,0 фл, на 10-й день соответственно 225,2 ± 40,0 × 109 / л и 10,4 ± 1,0 фл. У больных 2-й группы указанные показатели были 244,7 ± 59,1 × 109 / л, 8,7 ± 0,9 фл, 217,7 ± 39,8 × 109 / л и 9,0 ± 1,1 фл. Достоверного различия тромбоцитарных показателей гемограммы при поступлении и при выписке у пациентов 1-й и 2-й групп не наблюдалось (р > 0,05). В течение первых 10 суток заболевания было выявлено снижение MPV в обеих группах (р < 0,05), что свидетельствовало об уменьшении размеров тромбоцитов. MPV рассматривают как один из маркеров функционального исхода ишемического инсульта. Снижение значений данного показателя в динамике заболевания может указывать на благоприятный прогноз инсульта у обследованных пациентов [12].
Исследование агрегации тромбоцитов показало более (р < 0,05) высокие значения степени агрегации при стимуляции 2,5 и 5 мкмоль АДФ у здоровых лиц по сравнению с основной группой (табл. 2). Полученные данные могут быть связаны с влиянием постоянно проводимой антиагрегантной терапии в основной группе, изменяющим взаимодействие тромбоцита с индуктором агрегации.
Таблица 2
Агрегометрические показатели у обследуемых с ишемическим инсультом и лиц контрольной группы
|
Индуктор агрегации |
Пациенты с инсультом |
Контрольная группа |
||
|
Степень,% |
Скорость, % / мин |
Степень, % |
Скорость, % / мин |
|
|
2,5 мкмоль АДФ |
54,1 ± 20,0* |
23,7 ± 9,1 |
85,3 ± 28,1* |
29,8 ± 14,1 |
|
5 мкмоль АДФ |
64,9 ± 19,6* |
26,7 ± 10,0 |
83,8 ± 23,7* |
32,8 ± 14,9 |
Примечание. * – p < 0,05.
Степень агрегации тромбоцитов при стимуляции 2,5 мкмоль АДФ в 1-й группе составила 54,4 ± 18,1 %, во 2-й – 53,8 ± 23,0 %; скорость агрегации была соответственно 24,7 ± 9,1 % / мин и 22,3 ± 9,3 % / мин. При стимуляции 5 мкмоль АДФ степень агрегации в 1-й группе была равна 65,6 ± 21,2 %, во 2-й – 64,0 ± 17,8 %; скорость агрегации составила соответственно 26,9 ± 10,3 % / мин и 26,5 ± 9,8 % / мин. Достоверных различий агрегометрических данных у пациентов 1-й и 2-й групп выявлено не было (р > 0,05).
Показатели экспрессии тромбоцитами Р-се-лектина приведены в табл. 3. Наблюдалось достоверно (р < 0,05) более высокое количество тромбоцитов, экспрессирующих Р-селектин после стимуляции АДФ в основной группе по сравнению с контрольной. Экспрессия Р-селектина является специфическим маркером активации тромбоцита, отражающим его конформационные изменения, поскольку в неактивированном состоянии Р-селектин депонирован в α-гранулах тромбоцита [11]. Выявление активации тромбоцитов у пациентов с ИИ по сравнению с контрольной группой при проточной цитометрии может свидетельствовать о предпочтительности данного метода по сравнению со стандартной аг-регометрией. Достоверного различия показателей экспрессии Р-селектина у больных 1-й и 2-й групп выявлено не было (р > 0,05).
Таблица 3
Экспрессия Р-селектина на тромбоцитах в обследуемых группах
|
Группа |
Тромбоциты, экспрессирующие Р-селектин, % |
||
|
базальный уровень |
стимулированный АДФ |
∆ |
|
|
Основная |
6,0 ± 5,7 |
36,1 ± 17,9* |
82,4 ± 14,3 |
|
Контрольная |
4,4 ± 4,5 |
24,1 ± 12,8* |
77,6 ± 18,6 |
Примечание. * – p < 0,05.
В табл. 4 представлены результаты проточной цитометрии (в единицах интенсивности флуоресценции) с определением экспрессии рецепторов IIb/IIIа на поверхности тромбоцита. У пациентов с ИИ наблюдалось более высокое значение D, чем в контрольной группе. До 80 % рецепторов IIb/ IIIa равномерно распределены на мембране тромбоцитов, остальные 20 % находятся в канальцевой системе «внутри тромбоцита» [4]. Таким образом, можно предположить, что полученное высокое значение Δ для пациентов с инсультом связано с наличием у них большей пластичности мембраны активированных тромбоцитов.
|
Таблица 4 Количество рецепторов IIb/IIIa на тромбоцитах в сравниваемых группах |
|||
|
Группа |
Интенсивность флюоресценции |
||
|
базальная |
стимулированная АДФ |
∆, % |
|
|
Основная |
7,4 ± 1,4 |
8,2 ± 1,9 |
12,4 ± 5,0* |
|
Контрольная |
7,5 ± 1,5 |
8,3 ± 2,3 |
8,4 ± 6,9* |
Примечание. * – p < 0,05.
Сравнение уровней экспрессии рецепторов IIb/IIIа на поверхности тромбоцита у пациентов 1-й и 2-й групп значимых различий не выявило (р > 0,05).
Экспрессия рецепторов к фактору Виллебранда на тромбоците (в единицах интенсивности флуоресценции) в основной группе составила 4,3 ± 2,5, в контрольной – 4,9 ± 1,2, достоверного различия выявлено не было (р > 0,05). Экспрессия рецепторов к фактору Виллебранда на тромбоците в 1-й группе была 3,8 ± 1,4, во 2-й – 4,9 ± 3,4, значимого различия не выявлено (р > 0,05).
Гетерозиготное носительство мутантной аллели с.3550С>T наблюдалось у 9 (аллельная частота 12,9 %) пациентов с инсультом и у одного (3,8 %) обследуемого контрольной группы, достоверного различия не было (р > 0,05). В 1-й группе мутантную аллель выявили у 8 (20,0 %) пациентов, что значимо (р < 0,05) больше, чем во 2-й – один больной (6,7 %).
В 1-й группе наблюдалась прямая достоверная корреляция (r = 0,608; p = 0,012) балла NIHSS при выписке с экспрессией рецепторов Ibα на тромбоците, что указывало на худшее восстановление пациентов с более высокой экспрессией рецепторов к фактору Виллебранда на тромбоците. Тромбо-образование определяется взаимодействием фактора Виллебранда со специфическими рецепторами клеток крови, в первую очередь тромбоцитов, и образованием комплекса фактор Виллебранда – рецептор к фактору Виллебранда – IX–V. В доступной нам литературе нет данных об экспрессии рецепторов к фактору Виллебранда на тромбоците у пациентов с АТИ. Перспективным направлением терапии у данных пациентов могут стать препараты, направленные на блокаду рецептора к фактору Виллебранда или комплекса фактор Виллебранда – рецептор к фактору Виллебранда.
Во 2-й группе наблюдалась прямая достоверная корреляция балла по шкале Ранкина при выписке с показателями агрегации тромбоцитов: скоростью агрегации тромбоцитов при индукции 2,5 мкмоль АДФ (r = 0,800; p = 0,005), значением D P-селектина (r = 0,722; p = 0,018). Полученная корреляционная связь указывала на худшее восстановление функциональной независимости больных ЛИ с повышенной агрегацией и активацией тромбоцитов.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что у пациентов пожилого возраста с атеротромбо-тическим и лакунарным инсультами наблюдается активация тромбоцитарного звена гемостаза. Стандартная агрегометрия недостаточно информативна для оценки активации тромбоцитов у данных больных. Прогностическое значение для течения острого периода инсульта у пациентов пожилого возраста с атеротромботическим ишемическим инсультом может иметь экспрессия рецептора к фактору Виллебранда на тромбоците. У больных с лакунарным инсультом на восстановление могут оказывать влияние показатели, характеризующие агрегацию и активацию тромбоцитов.
ATHEROTHROMBOTIC AND LACUNAR STROKES IN ELDERLY PATIENTS:
CLINICAL MANIFESTATIONS AND PLATELET HAEMOSTASIS
Список литературы Атеротромботический и лакунарный инсульты у пациентов пожилого возраста: особенности клинических проявлений и тромбоцитарного гемостаза
- Гусев Е. И., Скворцова В. И., Стаховская Л. В. Эпидемиология инсультав России//Журнал неврологиии психиатрии (Приложение «Инсульт»). 2003. С. 4-9.
- Сус лина З. А., Пир адов М. А. Инсульт: диагностика, лечение, профилактика. М.: МЕДпресс-информ, 2009. 288 с.
- Суслина З. А., Танашян М. М., Ионова В. Г. Ишемический инсульт: кровь, сосудистая стенка, антитромботическая терапия. М.: Медицинская книга, 2005. 248 с.
- Шитикова А. С. Тромбоцитарный гемостаз. СПб.: Изд-во СПб ГМУ, 2000. 227 с.
- Adams H. P. Jr., Bendixen B. H., Kappelle L. J. et al. Classification of sup-type of acute ischemic Stroke. Definition for use ina multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke treatment//Stroke. 1993. Vol. 24. № 1. P. 35-41.
- Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patient//BMJ. 2002. Vol. 324. № 7329. P. 71-86.
- Biller J., Love B., Marsh III Е. et al. Spontaneous improvement after acute ischemic stroke//Stroke. 1990. Vol. 21. № 7. P. 1008-1012.
- Bonita R., Beaglehole R. Modification ofRankin Scale: recovery ofmotor function after stroke//Stroke. 1988. Vol. 19. № 12. P. 1497-1500.
- Bгott T., Adams H. P., Olinger C. P. et al. Measurement of acute cerebral infarction:a clinical examination scale//Stroke. 1989. Vol. 20. № 7. P. 864-870.
- Gonzalez-Conejero R., Lozano M. L.,Rivera J. et al. Polymorphisms of platelet membrane glycoprotein Ib associated with arterial thrombotic disease//Blood. 1998. Vol. 92. № 8. P. 2771-2776.
- Harrison P., Cramer E. M. Platelet a-granules//Blood Rev. 1993. Vol. 7. № 1. P. 52-62.
- Mayda-Domac F., Misirli H., Yilmaz M. Prognostic role of mean platelet volume and platelet count in ischemic and hemorrhagic stroke//J. Stroke Cerebrovasc. Dis. 2010. Vol. 19. № 1. Р. 66-72.
- Pleis J. R., Lethbridge-Cejku M. Summary health statistics for US adults: National Health Interview Survey, 2006. National Center for Health Statistics//Vital Health Stat. 2007. № 235. P. 1-153.


