Атипическая гиперплазия эндометрия в концепции опухолевой прогрессии (обзор литературы)
Автор: Дамиров М.М., Титова Г.П., Иерусалимский А.П.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 2 т.15, 2025 года.
Бесплатный доступ
Введение. В последние годы отмечается возрастание частоты разных нозологических форм гиперплазии эндометрия в структуре гинекологической заболеваемости. Атипическая гиперплазия эндометрия, как основа прогрессирования в рак эндометрия, имеет важное клиническое значение. Существуют большие противоречия в трактовке гиперплазии эндометрия в современных классификациях, которые отличаются от данных, приведённых в МКБ-10. Целью исследования явился анализ современной трактовки гиперплазии эндометрия в концепции опухолевой прогрессии. Материалы и методы. Проведён анализ баз данных PubMed, Embase, Cochrain а также, изучены последние публикации по проблеме ГЭ с акцентом на АГЭ по ключевому слову «atypical endometrial hyperplasia». Результаты. Приведена морфологическая классификация гиперплазии эндометрия и показано современное представление о прогрессии разных нозологических форм данной патологии. Отмечено, что гиперплазия эндометрия является клинико-морфологическим диагнозом, который базируется на результатах анамнестических данных, комплексного клинико-инструментального обследования и грамотной интерпретации морфологических данных. Заключение. Морфологическое исследование является наиболее точным методом диагностики разных видов эндометриальной гиперплазии при условии правильного забора операционного материала. На клеточном уровне оценивается гистологическая структура подлежащих исследованию тканей изменения. Только на основании комплексной оценки выносится окончательное морфологическое заключение о характере диагностируемого патологического процесса. Для правильной интерпретации гистологического материала необходима высокая квалификация врача-морфолога, а также наличие современного лабораторного оборудования.
Атипическая гиперплазия эндометрия, Опухолевая прогрессия, Рак эндометрия, Морфологическая диагностика, Классификация гиперплазии эндометрия, Гинекологическая заболеваемость
Короткий адрес: https://sciup.org/143184248
IDR: 143184248 | УДК: 618.141.63+576.31 | DOI: 10.20340/vmi-rvz.2025.2.MORPH.4
Текст научной статьи Атипическая гиперплазия эндометрия в концепции опухолевой прогрессии (обзор литературы)
MORPH.4
Гиперплазия эндометрия (ГЭ) представляет чрезвычайно важную и многогранную проблему практической гинекологии [1-5]. В нашей стране ежегодно диагностируют более 200 тыс. новых случаев ГЭ [6, 7]. Неослабевающий интерес к этому заболеванию определяется отсутствием патогномоничных симптомов, большими трудностями в клинической диагностике, разноречивыми данными об информативности применяемых инструментальных методов обследования, сложностью разработки персонифицированного лечения, тенденцией к длительному, рецидивирующему течению [8-10]. ГЭ относится к числу пролиферативных процессов, и при неадекватном выбранном методе лечения, особенно на фоне метаболических нарушений (ожирение, сахарный диабет) и другой коморбид-ной патологии, может приводить к развитию рака эндометрия (РЭ) [1, 2, 11, 12].
Гиперплазия эндометрия - это патологический процесс, затрагивающий эпителиальный и стромальный компоненты эндометрия, проявляющийся увеличением общего числа желёз, а также различными изменениями фенотипических характеристик клеток [13-16]. Термин «эндометриальная гиперплазия» охватывает состояния, варьирующие от доброкачественных пролиферативных изменений желёз и стромы до моноклонального роста генетически измененных атипичных желёз [7, 17, 18].
Под ГЭ понимают избыточное увеличение объёма и толщины пролиферирующего эндометрия с различной степенью выраженности нарушений архитектоники желёз, стратификации эпителия и его атипии [13, 15, 19]. В основе развития ГЭ важное значение имеет нарушение эпителиальномезенхимальных взаимоотношений в связи с изменением механизма действия стероидов на клеточные элементы слизистой тела матки, неадекватной реакцией клеток железистого эпителия на медиаторы, прежде всего эстрогены [20, 21].
ГЭ включает в себя спектр различных морфологических повреждений: от нормального поликлонального эндометрия, отвечающего на аномальные гормональные воздействия, до пролиферативных моноклональных повреждений, сопровождающихся высоким риском развития РЭ [1, 6, 13].
Особую роль в развитии РЭ занимают предраковые гиперпластические процессы, среди которых центральное место занимает атипическая гиперплазия эндометрия (АГЭ) [1, 2, 13, 22, 23]. Данную патологию диагностируют у 5,8-10,1% пациенток с ГЭ [9, 24, 25, 26].
Для диагностики разных видов эндометриальной гиперплазии в клинической практике применяют инструментальные методы обследования (ультразвуковое исследование, гистероскопию, магнитно- резонансную томографию, компьютерную томографию и др.) [1, 7]. Применяемые дополнительные инструментальные методы позволяют диагностировать патологию эндометрия только на тканевом уровне, они являются операторзависимыми, и получаемые при обследовании этими методами данные во многом зависят от квалификации врача, методики применения и использованной аппаратуры. Следует отметить разноречивость данных об информативности этих методов в диагностике у пациенток с разными формами ГЭ [6, 20, 24, 25].
Наиболее достоверным методом диагностики ГЭ является гистологическое исследование [13, 15, 16, 18]. ГЭ характеризуется разнообразием морфологической картины, что связано с разной выраженностью соотношения между эпителиальным и стромальным компонентами, различной формой и величиной желёз, интенсивностью пролиферации железистого эпителия, наличием или отсутствием в последнем клеток с атипией [19, 27]. Большинство морфологов полагают, что АГЭ занимает промежуточное положение между ГЭ без атипии и РЭ, в связи с чем её относят к морфологически доказуемой форме предрака эндометрия [13, 15].
Таким образом, высокая частота разных видов эндометриальной гиперплазии, трудности диагностики, возможность злокачественного перерождения, известные сложности в лечении позволяют относить эту патологию к числу важнейших проблем современной гинекологии.
Целью исследования явился анализ современной трактовки ГЭ в концепции опухолевой прогрессии.
Материалы и методы
Проведён анализ баз данных PubMed, Embase, Cochrain а также, изучены последние публикации по проблеме ГЭ с акцентом на АГЭ. Так, анализ поисковой базы PubMed по ключевому слову «atypical endometrial hyperplasia» показал 1162 публикации за период с 2020 по 2025 год, что свидетельствует о клинической значимости данной патологии.
Результаты
Диагноз «гиперплазия эндометрия» - это клинико-морфологический диагноз с использованием диагностических критериев, в основе которых лежит оценка баланса железистого и стромального компонентов эндометрия, а также отсутствие или наличие атипических эпителиальных клеток [7, 13, 28]. При ГЭ нарушается соотношение процессов пролиферации и апоптоза [15, 20, 29]. Обилие различных терминов и многочисленные классификации ГЭ сделали данную группу поражений запутанной и трудной для понимания врачами-клиницистами и морфологами.
Следует остановиться на основных классификациях, применяемых для диагностики разных видов эндометриальной гиперплазии. Важность этого вопроса определяется адекватной трактовкой изменений, происходящих при развитии ГЭ врачами акушерами-гинекологами, специалистами, применяющими дополнительные инструментальные методы исследований, и морфологами. Кроме того, следует учитывать противоречия по диагностике этой патологии, возникающие при постановке диагноза в соответствии с современной морфологической классификацией, а также согласно МКБ-10.
В течение длительного времени для интерпретации разных видов эндометриальной гиперплазии наибольшее распространение получила классификация, предложенная ISGP (International Society of Gynaecological Pathologists) и принятая ВОЗ в 1994 году [6, 11, 13]. Было отмечено, что чрезвычайно важное отличие АГЭ от эндометриальной гиперплазии заключается в нарушении тканевой дифференцировки. Было показано, что АГЭ, в отличие от высокодифференцированной аденокарциномы, не имеет признаков стромальной инвазии [13, 14, 15, 30].
В целях совершенствования диагностики предраковых заболеваний эндометрия, была разработана классификационная система EIN (Endometrial Intraepithelial Neoplasia, «эндометриальная интраэпителиальная неоплазия») [1, 15, 31]. Термин EIN был предложен в 1997 году на основании доказательств того, что предраки эндометрия являются моноклональными и, следовательно, неопластическими [20, 23]. Показано, что развитие аденокарциномы эндометрия начинается со спорадического приобретения редкой мутации гена супрессора опухоли PTEN, приводящей к прогрессии железистого компонента [19]. Клинические исследования течения и исхода заболеваний у женщин с ГЭ установили пороговые диагностические особенности, которые позволяют сформировать группу повышенного риска развития РЭ. Этот класс поражений высокого риска был обозначен как EIN [15, 23, 28].
Согласно клональной модели эндометриоидной аденокарциномы эндометрия (рис. 1), её появлению нередко предшествует поражение предшественника (EIN), который имеет повышенный риск неопластической трансформации эндометрия [21]. Эти предраки развиваются из участков нормальной поликлональной ткани посредством мутаций, вызывающих резкое увеличение потенций к росту, которые под митогенным стимулом эстрогена, не встретившего сопротивления, успешно пролиферируют как клон (обозначен широкими стрелками) [29]. Моноклональный предрак посредством мутаций и серии событий, обусловленных местными условиями, даёт начало внутренней гетерогенности клеток и приводит к развитию иерархии субклонов (слева направо) с переменным успехом [17]. Некоторые предраковые клоны подвергаются инволюции, тогда как другие прогрессируют благодаря дополнительным мутациям и отбору, в конечном счёте достигая стадии, когда для их выживания гормональная поддержка больше не требуется. Злокачественная трансформация в карциному (клоны неправильной формы) характеризуется накоплением генетических повреждений, достаточных для начала инвазии прилежащих стромальных тканей [19].
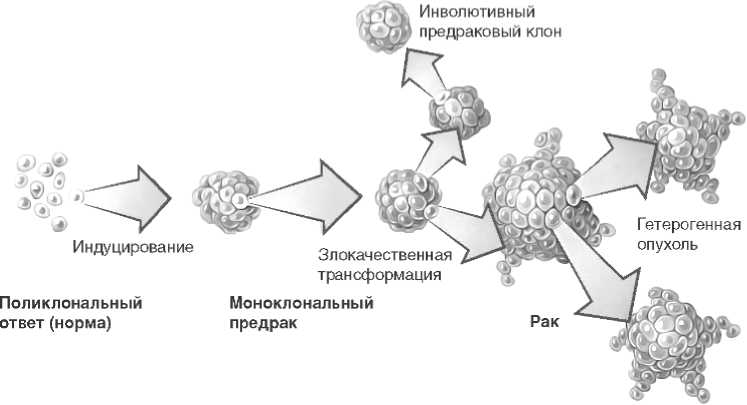
Рисунок 1. Этапы развития эндометриоидной аденокарциномы эндометрия
Figure 1. Stages of development of endometrioid adenocarcinoma of the endometrium
Гистологическая классификация гиперпластических процессов эндометрия (ВОЗ, 2003), одобренная как врачами акушерами-гинекологами, так и морфологами, выделила два вида гиперпластических процессов: 1) эндометриальная гиперплазия; 2) атипичная гиперплазия эндометрия. Каждую разновидность эндометриальной гиперплазии разделяли на простую и сложную формы [9, 15]. В данной классификации впервые были разделены АГЭ и аденоматоз, которые раньше были синонимами. В состав данной классификации вошли также полипы эндометрия (ПЭ).
В 2014 году ВОЗ приняла Бинарную классификацию ГЭ, которая нашла своё отражение в гистологической классификации опухолей женской половой системы (World Health Organization (WHO) Classification of Tumours of Female Reproductive Organs, 2014) [1, 7, 32, 33] . Бинарная классификация ВОЗ была одобрена и рекомендована к применению ведущими экспертными организациями мира: Королевской коллегией акушеров и гинекологов (RCOG) в 2016 г. и Международной ассоциацией акушеров и гинекологов (FIGO) в 2018 г. [25, 20, 31].
Согласно данной классификации выделяют гиперплазию эндометрия без атипии и АГЭ. Принятые две формы ГЭ отражают два возможных пути развития заболевания - путь гиперплазии с низкой вероятностью исхода в рак эндометрия (РЭ), а также путь гиперплазии с высоким риском малигнизации. Отмечено, что относительный риск прогрессирования ГЭ без атипии в РЭ составляет 1,01-1,03%, тогда как при диагностике АГЭ он значительно возрастает и колеблется от 14 до 45% [7, 31].
Вместе с тем, в данную классификацию не вошли полипы эндометрия (ПЭ). Это было связано с тем, что в большинстве наблюдений ПЭ диагностировали на фоне неизмененного эндометрия, что свидетельствовало об их автономности и отсутствии прямой связи с нарушениями в системе «гипоталамус -гипофиз - яичники». Следует отметить изменение структуры внутриматочной патологии в последние годы, с которой пациенты были госпитализированы в стационар нашего института. Так, в 2021 году у женщин репродуктивного возраста с различной внутриматочной патологией ГЭ без атипии была диагностирована в 63% случаев, тогда как ПЭ определяли у 27% женщин. Несколько иные данные были получены при анализе заболеваемости в 2022 и 2023 годах: ПЭ диагностировали у 71,5% пациенток, а ГЭ без атипии выявляли только в 28,5%случаев.
С учётом принятой бинарной классификации ГЭ, ВОЗ во время пересмотра в 2020 году подтвердила её значимость [22].
Эндометрий является наиболее чувствительной гормональнозависимой структурой репродуктивной системы, поэтому одной из ведущих причин разви- тия ГЭ является абсолютная или относительная ги-перэстрогения, возникающая на фоне отсутствия или недостаточного антиэстрогенного влияния прогестерона [6]. Следствием гиперэстрогении является развитие сочетанных пролиферативных заболеваний в органах репродуктивной системы, частота которых значительно возросла в последние годы [10]. Установлено два основных клиникопатогенетических варианта развития сочетанной гиперпластической патологии эндо- и миометрия у женщин, находящихся в репродуктивном возрасте [6]. У большинства лиц (73%) она возникает на фоне неизмененных гормональных соотношений, но при нарушенном взаимодействии стероидов с рецепторами клеток эндометрия («автономный» вариант); в значительно меньшем числе случаев (27%) - на фоне дисбаланса гонадотропных гормонов, выраженного дефицита прогестероновых влияний и прочих обменно-эндокринных нарушений («нейроэндокринный» вариант) [6].
Молекулярно-генетические аспекты развития ГЭ Отмечено, что количество гормонов, действию которых подвергаются ткани-мишени, находятся под строгим генетическим контролем (гены, кодирующие белки, обеспечивающие биосинтез, метаболизм и транспорт гормонов). Обязательным условием появления опухолевого фенотипа является серия соматических мутаций, которым подвергается клетка в процессе своего деления, однако полная последовательность генов, вовлечённых в прогрессию рака пока неизвестна [34]. Мутация PTEN-гена, который участвует в регуляции клеточной пролиферации и апоптоза, приводит к повышенной пролиферации желёз эндометрия, что способствует развитию ГЭ с последующей трансформацией в АГЭ и далее в РЭ [12]. Нарушение функции гена супрессора опухоли PTEN - самое частое генетическое поражение, выявленное у пациентов с аденокарциномой эндометрия. Ген PTEN - гормонально чувствительный ген-супрессор опухоли, мутирующий во время инициации роста многих опухолей, может служить информативным биомаркером предраковых и злокачественных клонов.
Показано, что существенным фактором риска развития ГЭ является наличие у женщины метаболических нарушений. Была сформулирована концепция «метаболического синдрома», согласно которой ожирение, преимущественно андроидного типа, артериальная гипертензия, дислипидемия, нарушение толерантности к глюкозе, а также активация свертывающей системы крови являются звеньями единой цепи обменных расстройств [6, 7, 20, 35]. ГЭ является следствием возникающих дисгор-мональных нарушений в организме женщины, реализующих эти изменения в органах репродуктивной системы, клинически проявляющихся развитием различных пролиферативных заболеваний. Нозологическими формами этих нарушений являются ГЭ, АГЭ, лейомиома матки, генитальный эндометриоз.
Показно, что различные формы ГЭ и РЭ являются взаимосвязанным проявлением единого патогенетического процесса, поскольку отмечена единая последовательность событий в развитии этих заболеваний, согласующаяся с открытыми закономерностями опухолевой прогрессии [34, 36, 37]. Учение о прогрессии опухолей, сформулированное J. Foulds в 1962-1964 гг., оказалось одной из наиболее глубоких концепций, развиваемых современной гинекологией [37]. Прогрессия - это качественные изменения свойств опухоли, приводящие к увеличению различий между ней и исходной нормальной тканью. Иными словами, под прогрессией или развитием опухоли понимают её биологическую трансформацию, основным признаком которой является возрастание автономности, то есть нерегулируемо-сти опухолевого роста. Показано, что возникновение опухоли - это многостадийный процесс, включающий три этапа [5, 34, 35]: I этап - инициация (трансформация) - приобретение исходной нормальной клеткой способности беспредельно размножаться; II этап - промоция, или активизация опухолевых клеток; III этап - опухолевая прогрессия, или стойкие качественные изменения свойств опухоли в сторону малигнизации, возникающие по мере её роста. Согласно учению L. Foulds, в ходе прогрессии уменьшается морфологическое, биохимическое, генетическое и антигенное сходство между опухолью и исходной нормальной клеткой [37]. Трансформации нормальных клеток в опухолевые, промоции и опухолевой прогрессии способствует ряд факторов: снижение антибластомной резистентности и противоопухолевого иммунитета (иммунодепрессия, иммунодефицит), ослабление «кейлонного надзора» за опухолью, эндокринный дисбаланс, гормонально-метаболические нарушения и др. [5, 34].
Говоря о трансформации неопухолевых клеток в опухолевые, следует остановиться на гипотезе Хьюгса, которая в известной степени отвечает на вопрос, каким образом опухолевая клетка становится «бессмертной», т.е. утрачивает лимит Хейфли-ка и приобретает способность к постоянному делению [35]. Хейфлик установил, что в ядре каждой клетки заложен генетический механизм, ограничивающий количество митозов клетки (например, фибробласт даёт 50 митозов, а затем погибает; другие клетки дают ещё меньше делений и гибнут) [35]. Опухолевые же клетки утрачивают лимит Хейфлика, в результате чего они становятся «бессмертными» (то есть делятся тысячи и миллионы раз).
Существуют две точки зрения о происхождении онкологических заболеваний. Преобладающей точкой зрения среди клиницистов является понимание того, что предраковые изменения являются неизбежной стадией в процессе малигнизации (гипотеза «критической точки») [17, 21, 35]. Этому соответствует и концепция, выдвинутая проф. Л.М. Шаба-дом: «Всякий рак имеет свой предрак, но не каждый предрак переходит в рак» [38] . В связи с этим очевиден интерес к диагностике и лечению ГЭ, поскольку своевременная диагностика и адекватная терапия - реальный путь к снижению частоты заболеваемостью РЭ. Установлено, что различные формы ГЭ и РЭ являются, по сути дела, взаимосвязанным проявлением единого патогенетического процесса, поскольку установлена единая последовательность событий в их развитии, согласующаяся с открытыми закономерностями опухолевой прогрессии [5, 35].
Вместе с тем, некоторые учёные, относящиеся к группе так называемых «биологических детерминистов», ставят под сомнение независимое существование предраковых состояний как самостоятельных нозологических форм и рассматривают рак de novo (без предшествующих изменений в виде доброкачественных опухолей или диспластических очагов) [34]. Однако данное положение не характерно для пролиферативных гормонообусловленных заболеваний матки.
Возникновение в организме как доброкачественных, так и злокачественных заболеваний происходит под действием многих причинных факторов. Образование и прогрессирование эндометриальной гиперплазии является следствием дизрегу-ляторных изменений в организме женщины, связанных с воздействием различных экзо- и эндогенных факторов [39]. Применительно к эндометриальной гиперплазии, нами было решено представить схему происходящих изменений (рис. 2).
В патогенезе возникновения и развития ГЭ важная роль отводится нарушениям тканевой рецепции. Установлено, что чувствительность слизистой оболочки матки к стероидам регулируют специфические цитоплазматические и ядерные рецепторы [5]. Отмечено повышенное содержание эстрогенных рецепторов при ГЭ без атипии, их уменьшение при АГЭ и низкое содержание при РЭ [12]. Изменения рецепторного аппарата клеток эндометрия могут быть также обусловлены травматическими повреждениями слизистой оболочки матки при многократных абортах и диагностических выскабливаниях, а также при воспалительных процессах матки, которые определяют у 46-59% женщин с ГЭ [6, 20].
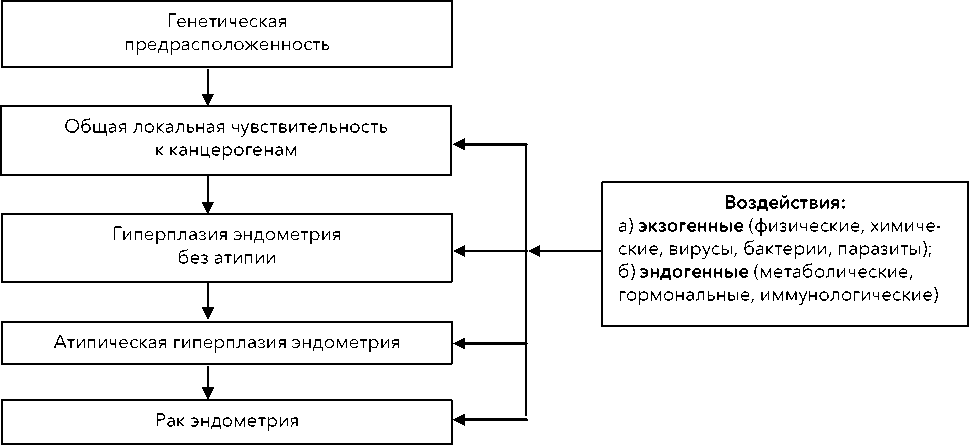
Рисунок 2. Взаимоотношение различных факторов, приводящих к возникновению гиперплазии эндометрия и ее прогрессирования до рака эндометрия
Figure 2. The relationship between various factors leading to the development of endometrial hyperplasia and its progression to endometrial cancer
Не следует забыть и о «воспалительном» генезе возникновения разных видов ГЭ [6]. О.К. Хмельницкий показал, что в воспалительно-измененной слизистой оболочке матки нарушена рецепция даже при сохранённом гормональном гемостазе [16]. Это позволило разработать концепцию о «воспалительном» генезе ГЭ, основанной на снижении биологических факторов защиты, препятствующих проникновению инфекционных агентов в полость матки [6, 24]. Причиной возникновения ГЭ могут быть как острый, но особенно длительно текущий хронический эндометрит. Показано, что в развитии ГЭ участвуют инфекционные агенты, включая бактерии, патогенны, аэробные и анаэробные микроорганизмы, а также вирусы и грибы [9]. Воспалительные заболевания ингибируют апоптоз и ускоряют трансформацию повреждённых клеток в патологические формы. Хронический эндометрит активирует иммунные механизмы в эндометрии, нарушая клеточный баланс, играя особую роль в развитии патологии эндометрия [16].
Большую помощь клиницистам в интерпретации получаемых данных принесла разработанная академиками РАН Г.М. Савельевой и В.Н. Серовым клинико-морфологическая классификация предрака эндометрия [40]. Согласно данной классификации выделяют: 1) аденоматоз и аденоматозные полипы в любом возрасте; 2) железистую ГП в сочетании с гипоталамическими и нейрообменно-эндокринными нарушениями в любом возрасте; 3) рецидивирующую железистую ГПЭ, особенно в пери- и постменопаузальный периоды. Было показано, что необходимо интерпретировать морфологические данные, ориентируясь на клиническую картину заболевания.
Рецидивирующая ГЭ определяется как «клинический предрак», особенно на фоне различных мета- болических нарушений, поскольку возникновение РЭ у женщин с данной патологией отмечено в 20-30% случаев [1, 7, 9, 11].
Применяемые в клинической практике для диагностики разных форм ГЭ инструментальные методы обследования значительно повысили частоту выявления данной патологии, однако их информативность, в зависимости от нозологической формы, колеблется от 58 до 89% [ 1,6].
Наиболее достоверным методом диагностики разных нозологических форм ГЭ является гистологическое исследование [13, 15, 41]. При морфологическом исследовании производится оценка характера патологического процесса на основании детального изучения структуры и клеточного состава материала. Гистологическая характеристика ГЭ основывается на оценке таких критериев, как структурные нарушения формы и плотности расположения желёз, соотношение железистого и стромального компонентов эндометрия, а также цитологических изменениях его железистого эпителия [5, 13]. При этом оцениваются объёмная плотность железистых структур и наличие ядерной и клеточной ати-пии. Основной отличительной чертой ГЭ служит увеличение количества желёз по отношению к строме с соответствующими структурными и иногда цитологическими аномалиями.
Разная выраженность соотношения между эпителиальным и стромальным компонентами, различная форма и величина желёз, различная выраженность пролиферации железистого эпителия, наличие или отсутствие в ткани клеток с атипией приводят к различной морфологической картине (рис. 3).
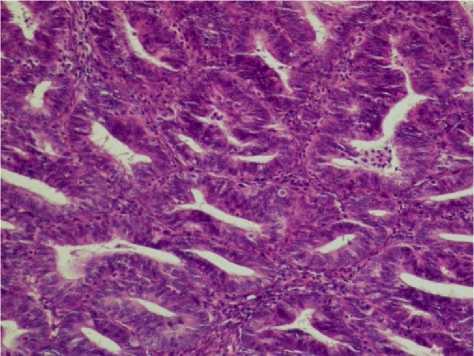
А
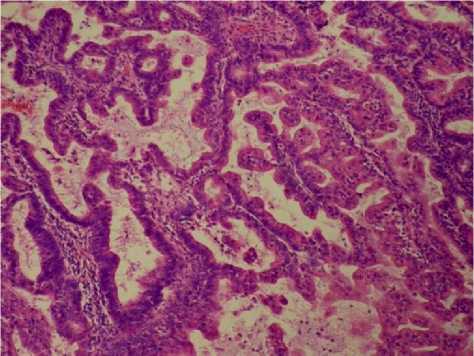
Б
Рисунок 3. Атипическая гиперплазия эндометрия: А - плотно прилежащие друг к другу железы с эозинофильной цитоплазмой и увеличенными ядрами клеток, потерей полярности и выраженными ядрышками; Б - извилистые железы с эпителиальными завитками и сосочками, выступающими в просветы (эозинофильная, синцитиальная метаплазия) и демонстрирующими цитологическую атипию. Окраска гематоксилином и эозином. Ув. ×200 Figure 3. Atypical endometrial hyperplasia: A - densely packed glands with eosinophilic cytoplasm and enlarged cell nuclei, loss of polarity and prominent nucleoli; Б - convoluted glands with epithelial whorls and papillae protruding into the lumens (eosinophilic, syncytial metaplasia) and demonstrating cytological atypia. Hematoxylin and eosin staining. Magnification ×200
Следствием этого являются разноречивые трактовки морфологических заключений, которые во многом зависят от квалификации врача-морфолога. Расхождения мнений морфологов при оценке одних и тех же микропрепаратов, особенно в случаях с АГЭ, составляет 65-72% [12, 41]. Общеизвестно, что доброкачественные пролиферативные заболевания эндометрия значительно лучше диагностируют врачи-морфологи, работающие в стационарах общей практики, тогда как предраковые и онкологические заболевания эндометрия более квалифицированно определяют врачи-морфологи, работающие в онкологических учреждениях. В связи с чем, для точности постановки диагноза АГЭ врачам, работающим в стационарах общей практики, целесообразно проводить экспертную оценку препаратов консилиумом врачей.
Морфологическая пластичность тканей эндометрия является важным фактором, затрудняющим точную диагностику разных форм эндометриальной гиперплазии. Высокая степень морфологической вариабельности пролиферативных изменений эндометрия, даже в пределах одного препарата, создаёт значительные трудности в определении значимых диагностических критериев [34, 41]. Тем не менее, гистологическое исследование соскоба эндометрия является «золотым стандартом» дифференциальной диагностики разных нозологических форм эндометриальной гиперплазии.
Высокая информативность морфологического метода является основной причиной того, что он является референтным методом, в сравнении с которым оценивают информативность других методов, применяемых для его диагностики. Только на основании результатов комплексного подхода, включающего в себя полную клиническую информацию о пациентке, выносится окончательное морфологическое заключение о характере диагностируемого патологического процесса.
Заключение
Таким образом, приведённые данные свидетельствуют о больших сложностях в диагностике разных видов эндометриальной гиперплазии. Применение инструментальных методов повышает точность диагностики разных нозологических форм ГЭ. Для формирования квалифицированного морфологического заключения необходимо следующее: детальная информация об анамнестических данных пациентки, проведённых методах обследования и лечения, получение адекватного материала для гистологического исследования, оснащённость лаборатории современным оборудованием и, самое главное, высокая квалификация врача-морфолога для грамотной интерпретации исследуемого материала. Комплексная оценка результатов клинического обследования, данных применения инструментальных методов, результатов морфологического обследования способствует постановке правильного клинического диагноза, выбору оптимальной тактики ведения с целью снижения гинекологической и онкологической заболеваемости, а также повышению репродуктивного потенциала пациенток.


