Атипичные клинические проявления тиреотоксикоза. Случай из практики
Автор: Союстова Елена Леонидовна
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 3 (15), 2013 года.
Бесплатный доступ
Проведен разбор случая развития тяжелой сердечной недостаточности у больной с диффузным токсическим зобом. Его особенностью являлось доминирование в клинической картине заболевания явлений декомпенсации кровообращения.
Диффузный токсический зоб, сердечная недостаточность
Короткий адрес: https://sciup.org/14338464
IDR: 14338464
Текст научной статьи Атипичные клинические проявления тиреотоксикоза. Случай из практики
Актуальность проблемы
Пациент с заболеванием щитовидной железы – это больной с не всегда традиционной клинической картиной, он может встретиться в практике врача любого профиля.
В последние несколько десятилетий увеличилось количество сообщений об атипичных или необычных проявлениях болезни Грейвса (БГ), относящихся к различным системам организма. Нередко один из этих признаков является ведущим проявлением БГ. Недостаток знаний относительно связи подобных находок и БГ приводит к поздней диагностике, ошибочному диагнозу или излишним исследованиям.
К атипичным симптомам БГ относится сердечная недостаточность с легочной гипертензией, которая иногда доминирует в клинической картине заболевания.
Диффузный токсический зоб (болезнь Грейвса, болезнь Базедова) – это системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреотропного гормона, клинически проявляющееся поражением щитовидной железы (ЩЖ) с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией: эндокринной офтальмопатией, претибиальной микседемой, нарушением функционального состояния органов и систем, в первую очередь – сердечно-сосудистой системы и центральной нервной системы. Во всем мире традиционно используется термин болезнь Грейвса, в немецко-говорящих странах – болезнь Базедова, в России – диффузный токсический зоб.
Этиология и патогенез
Заболевание развивается у лиц с генетической предрасположенностью. О наследственном характере заболевания свидетельствует изучение системы НLA. Чаще БГ ассоциируется с носительством аллелей HLA B8, DR3 или их сочетанием. Наследуется дефект в иммунной системе, проявляющийся снижением числа Т-супрессоров. В результате при действии провоцирующих факторов (психические травмы, хронический стресс, инфекции, курение) в организме больного появляются «запрещенные клоны» лимфоцитов, направленных против собственной ЩЖ. Эти клетки действуют на железу либо непосредственно, либо через систему В-лимфоцитов, продуцирующих аутоантитела. Развитие аутоиммунного процесса приводит к появлению антител к рецептору тиреотропного гормона гипофиза (АТ-рТТГ), которые обладают уникальной способностью стимулировать функцию ЩЖ, имитируя связывание ТТГ с рецептором (тиреостимулирующие иммуноглобулины), вызывая гипертиреоз. В активной фазе заболевания АТ-рТТГ определяются у 90% больных БГ. Иммуноглобулины активируют аденилатциклазу и увеличивают синтез тиреоидных гормонов (ТГ), при этом одновременно происходит гиперплазия. Избыток ТГ разобщает процессы тканевого дыхания и окислительного фосфорилирования, что ведет к избыточному образованию тепла, снижению энергетических запасов организма в макроэргических связях АТФ. Энергетический дефицит восполняется за счет ускорения всех метаболических процессов и увеличения потребности в кислороде, что определяет клиническую картину тиреотоксикоза [1, 2].
Эпидемиология
Женщины болеют в 10 раз чаще мужчин, в большинстве случаев – между 20-50 годами. У молодых пациентов БГ является одним из самых частых диагнозов. Распространенность в регионе с нормальным потреблением йода достигает 2% среди женщин, частота новых случаев составляет 3 на 1000 женщин в год [3].
Клинические проявления
Для БГ, в большинстве случаев, характерен относительно короткий анамнез: первые жалобы обычно появляются за 4-6 месяцев до обращения к врачу.
Основным симптомом со стороны сердечнососудистой системы является тахикардия и достаточно выраженное ощущение сердцебиений. Пациенты могут ощущать сердцебиения не только в грудной клетке, но и в голове, руках, животе. ЧСС в покое при синусовой тахикардии, обусловленной тиреотоксикозом, может достигать 120-130 ударов в минуту.
При длительно существующем тиреотоксикозе, особенно у пожилых пациентов, развиваются выраженные дистрофические изменения в миокарде, частым проявлением которых являются суправентрикулярные нарушения ритма, а именно – фибрилляция (мерцание) предсердий. Это осложнение тиреотоксикоза достаточно редко развивается у пациентов моложе 50 лет. Дальнейшее прогрессирование миокардиодистрофии (тиреотоксического сердца) приводит к развитию изменений миокарда желудочков и застойной сердечной недостаточности. Происходят глубокие биохимические изменения в сердечной мышце: гипоксия, уменьшение содержания гликогена, белка,
АТФ, снижается содержание калия и увеличивается – натрия. При аускультации обычно выслушиваются громкие тоны и систолический шум на верхушке. Нарушения на ЭКГ зависят от длительности и тяжести заболевания. Характерно изменение зубца Р, признаки гипертрофии левого желудочка, деформация QRS-комплекса и зубца Т в левых грудных отведениях. Нередко у молодых больных отмечаются коронароподобные зубцы (отрицательный зубец Т, удлинение QRS-комплекса, смещение интервала ST вниз) из-за метаболических нарушений в миокарде.
Диагностика
К диагностическим критериям диффузного токсического зоба относят [3, 4]:
-
- лабораторно подтвержденный тиреотоксикоз (уменьшение ТТГ, увеличение Т4 и/или ТЗ);
-
- эндокринную офтальмопатию (60-80 % случаев);
-
- диффузное увеличение объема щитовидной железы (60-70 % пациентов);
-
- диффузное усиление захвата радиофармпрепарата (РФП) по данным сцинтиграфии щитовидной железы;
-
- Повышенный уровень антител к рецептору ТТГ.
Клинический случай
В качестве примера доминирования кардиальной симптоматики у пациентки с болезнью Грейвса приводим собственное наблюдение из практики.
Больная Б., 43 лет, поступила в отделение торакальной хирургии ФНКЦ ФМБА России 16.01.2012 г. с жалобами на одышку при незначительной физической нагрузке, отеки ног, сердцебиение, периодически подъем температуры тела до субфебрильных цифр, озноб, приступы сухого кашля, похудание, нервозность, экзофтальм, общую слабость, учащенный оформленный стул.
Из анамнеза: с 2003 года диагностирован ДТЗ, больная длительное время принимала мерказолил, однако в течение последних 2-х лет тиреостатическая терапия не проводилась. С 2006 г. присоединилась фибрилляция предсердий, с 2009 г. – отеки ног. Ухудшение состояния с сентября 2011 г. после отдыха на Кипре, когда появилась прогрессирующая одышка, увеличились отеки нижних конечностей. В ноябре 2011 г. при рентгенологическом обследовании легких выявлен двусторонний плеврит, позже, в декабре 2011 г. был проведен онкопоиск на догоспитальном этапе (УЗИ органов брюшной полости, надпочечников, почек, щитовидной железы, органов малого таза, молочных желез). Данных за онкологическую патологию не было получено, по данным КТ органов грудной клетки диагностирован двусторонний плеврит и перикардит. Больная консультирована торакальным хирургом и была госпитализирована в отделение торакальной хирургии ФНКЦ ФМБА России для уточнения диагноза и лечения.
При поступлении: состояние средней тяжести. Индекс массы тела – 26 кг/м2. Отеки нижних конечностей доходят до уровня средней трети бедра. Пастозность мягких тканей туловища и молочных желез. Пальпируется диффузно увеличенная щитовидная железа с изменением конфигурации шеи, безболезненная. Двусторонний экзофтальм. Кожные покровы нормальной окраски, повышенной влажности, ладони влажные, теплые. Легкий мелкий тремор пальцев рук.
В легких везикулярное дыхание, в нижних отделах ниже угла лопаток дыхание ослабленное. Границы сердца расширены влево, фибрилляция предсердий до 120 в мин. Шум трения перикарда. АД – 140/70 мм рт.ст. Печень не пальпируется.
В анализах выявлена гипоальбуминемия 39,10% (при норме 48,00-61,00).
Mозговой натрийуретический пептид – маркер сердечной недостаточности: 238,60 пг/мл – норма. D-димер – положительный
Гормоны щитовидной железы: от 17.01.2012 ТТГ – 0,001 мкМЕд/мл (норма: 0,350-4,940), Т4св. – 37,33 пмоль/л (норма: 10,30-24,50), антитела к тиреопероксидазе (АТ к ТПО) – 2000,000 IU/ mL (норма: 0,000-12,000)
Гормоны щитовидной железы: от 31.01.2012 ТТГ – 0,001мкМЕд/мл, Т4св. – 21,4 пмоль/л, (АТ к ТПО) – 1872,150 IU/ mL.
УЗИ щитовидной железы от 18.01.2012: картина диффузного зоба, структура гипоэхогенная. Объем увеличен до 55,0 см3 (норма: 6-19 см3).
Сцинтиграфия щитовидной железы с Тс 99м - пертехнетатом: Щитовидная железа визуализируется в типичном месте, изображение увеличено в размерах, правая доля больше левой, контуры ровные. Накопление РФП в тиреоидной ткани высокое. Распределение РФП в тиреоидной ткани диффузное. Сцинтиграфическая картина ДТЗ (рис. 1).
ЭХО-КГ от 17.01.2012: фибрилляция предсердий, тахисистолическая форма с ЧЖС 94124 в мин. Уплотнение стенок аорты и створок аортального клапана. Увеличение объемов обоих предсердий (Vлп=88 мл; Vпп=69 мл). Легочная гипертензия 1-й степени, систолическое давление в легочной артерии повышено до 38 мм рт.ст. Четких данных за наличие зон нарушения локальной сократимости не получено. Глобальная сократимость миокарда в норме. Фракция выброса 58%. Отмечается расхождение листков перикарда с образованием эхонегативного пространства в диастолу: за задне- боковой стенкой левого желудочка – до 3,6 см, за боковой стенкой левого желудочка – до 3,1см, на уровне верхушки сердца – до 0,5см, по переднее-латеральному краю правого желудочка – до 1,2 см, со стороны правого предсердия – до 0,8 см, что соответствует значительному количеству жидкости в полости перикарда, преимущественно со стороны левых отделов. Обращает внимание коллабирова-ние нижней полой вены менее 50% и зависимость трансмитрального и транстрикуспидального диастолических потоков от фаз дыхания – эхокардиографические признаки повышения внутриперикардиального давления.
ЭКГ от 19.01.2012: вольтаж зубцов низкий. Фибрилляция предсердий: тахисистолическая форма с ЧСС = 125 в 1 мин. Вертикальное положение ЭОС. Нарушена линия зубца "r" V1-4. Изменения миокарда левого желудочка диффузного характера.
УЗИ плевральных полостей от 27.01.2012 (после дренирования): в левом плевральном
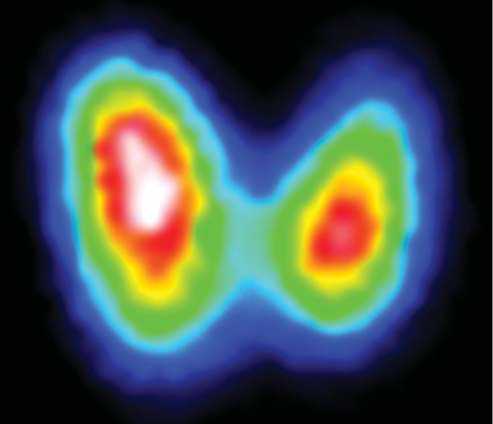
Рис. 1. Сцинтиграфия ЩЖ (интенсивное накопление радиофармпрепарата, увеличение размеров ЩЖ, больше справа)
синусе определяется свободная жидкость, толщина слоя – 3,7 см; в правом плевральном синусе – толщина до 4,2 см. Заключение: УЗИ признаки двустороннего гидроторакса.
В отделение торакальной хирургии с 16.01 по 23.01.2012 г. проведено дренирование плевральных полостей и полости перикарда. Из правой плевральной полости выделено 4860 мл, из левой – 3650 мл, из полости перикарда – 1620 мл прозрачной жидкости.
Цитологическое исследование плевральной и перикардиальной жидкости: реактивный выпот с пролиферацией мезотелия и лимфоидной инфильтрацией. При окраске по Цилю-Ниль-сену ВК не найдено.
17.01.2012 г. больная консультирована заведующей эндокринологическим отделением, был поставлен диагноз: Основной : Диффузный токсический зоб. Диффузное увеличение щитовидной железы 4 степени с частичным смещением трахеи. Рецидив тиреотоксикоза тяжелой степени тяжести, декомпенсация. Осложнение основного: Тиреотоксическое сердце. Постоянная форма фибрилляции предсердий. НК II степени. Хроническая сердечная недостаточность. Анасарка. Двусторонний плеврит, перикардит. Эндокринная офтальмопатия.
Рекомендована консультация офтальмолога, хирурга-эндокринолога с целью определения дальнейшей тактики – тиреоидэктомии после компенсации тиреотоксикоза, так как терапия радиоактивным йодом является выбором при объеме щитовидной железы не более 43 см3.
23.01.2012 в отделении торакальной хирургии был проведен консилиум совместно с заместителем главного врача по хирургии, заведующими кардиологическим и эндокринологическим отделениями. Сделано следующее заключение: диагноз ДТЗ и тиреотоксического сердца не вызывает сомнений, однако отечный синдром – анасарка, положительный Д-димер, шум трения перикарда не исключает смешанный генез заболевания. Следует провести дифференциальный диагноз между полисерозитом и ТЭЛА мелких ветвей предположительно из полостей сердца у больной с длительно существующей фибрилляцией предсердий НК 2б ст. По решению консилиума больная 24.01.2012 была переведена в кардиологическое отделение, где находилась до 07.02.2012г.
Проведена терапия: тирозол 30 мг/сутки, ко-ронал 5 мг/сутки, верошпирон 25 мг, диувер, тромбоАСС 100 мг, лазикс в/м, затем фуросе- мид, преднизолон 30 мг/сутки с положительным клиническим эффектом: купировались отеки, анасарка, одышка, шум трения перикарда, явления тиреотоксикоза до субклинического, нормосистолическая форма фибрилляции предсердий.
06.02.2012 был проведен повторный консилиум на базе кардиологического отделения с присутствием хирурга-эндокринолога. Резюме: пациентка поступила с явлениями декомпенсации рецидива тиреотоксикоза, полисерозитом, анасаркой. На фоне проводимой терапии явления анасарки купировались. Генез полисерозита остается неуточненным. Учитывая нормальные показатели СОЭ, СРБ, отсутствие суставного синдрома представляется сомнительным наличие системного заболевания. Выраженный отечный синдром расценивался как проявление в структуре тиретоксического сердца с постоянной формой фибрилляции предсердий. Учитывая малые сроки компенсации явлений недостаточности кровообращения, неуточнен-ный генез полисерозита рекомендовано продолжить терапию в течение месяца с контрольным обследованием, и, при стабилизации процесса, провести оперативное лечение.
В динамике при повторной консультации через месяц у больной достигнута компенсация тиреотоксикоза, восстановился синусовый ритм. 18.05.2012 года выполнена операция тиреоидэктомия. Течение послеоперационного периода без осложнений, рана зажила первичным натяжением.
Таким образом, анасарка явилась проявлением сердечной недостаточности, доминируя в клинической картине, что потребовало исключения других возможных причин – системного заболевания соединительной ткани, ТЭЛА. Данный случай демонстрирует сложности в установлении этиологии тяжелой сердечной недостаточности у пациентки с тиреотоксикозом, необходимости коллегиального подхода в ведении таких пациентов.
За 2012-2013 гг. в отделении эндокринологии наблюдались еще два случая БГ с клинической картиной тяжелой сердечной недостаточности, анасаркой, повышением давления в легочной артерии: больной Ю.,53 лет с систолическим давлением в легочной артерии 57 мм рт.ст. и больная Ш., 75 лет с систолическим давлением в легочной артерии 56 мм рт.ст., которые изначально были расцены как больные с сердечной (ИБС) и легочной (пневмония) патологией.
Выводы и практические рекомендации:
-
1. Диффузным токсическим зобом чаще болеют молодые люди в возрасте от 20 до 40 лет; тем не менее, 15% составляют пациенты старшего возраста.
-
2. Диагностика и лечение тиреоидных нарушений у пожилых затруднены в связи с атипичными клиническими проявлениями и наличием тяжелых сопутствующих заболеваний.
-
3. Так как у пожилых пациентов чаще более выраженно проявляется кардиальная симптоматика, то неэффективность антиаритмичес-
- кой терапии должна нацеливать на исключение у данной категории тиреотоксикоза как причины расстройства сердечного ритма.
-
4. В медикаментозной терапии следует сочетать антиаритмические и тиреостатичес-кие препараты с целью компенсации тиреотоксикоза.
-
5. При неэффективности консервативной терапии, наиболее обоснована терапия радиоактивным йодом, так как хирургическое лечение часто невозможно из-за тяжелой сопутствующей соматической патологии.
Список литературы Атипичные клинические проявления тиреотоксикоза. Случай из практики
- Аметов А.С. Избранные лекции по эндокринологии. М.: МИА, 2009
- Старкова Н.Т. Руководство по клинической эндокринологии. М.: Питер-Пресс,1996.
- Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. Учебник для вузов. М.: ГЭОТАР -Медиа, 2012.
- Кеннеди Ли, Басу Ансу. Диагностика и лечение в эндокринологии. Проблемный подход. Пер. с англ. под ред. проф. В.В. Фадеева. М.: ГЭОТАР-Медиа, 2010.


