Аутологичная трансплантация гемопоэтических стволовых клеток у больных с впервые диагностированной множественной миеломой
Автор: Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 1 т.19, 2023 года.
Бесплатный доступ
Множественная миелома (ММ) - это гетерогенное заболевание, определяемое клональной пролиферацией плазматических клеток, гематологическая опухоль, которая составляет 1,0-1,8% среди всех видов онкологических заболеваний. В последние десятилетия в результате широкого применения аутологичной трансплантации гемопоэтических стволовых клеток (АутоТГСК) и новых, весьма эффективных лекарственных средств, существенно улучшились показатели выживаемости пациентов с множественной миеломой. Для пациентов
Множественная миелома, бортезомиб, леналидомид, моноклональные антитела, аутологичная трансплантация гемопоэтических стволовых клеток, полный ответ, общая выживаемость
Короткий адрес: https://sciup.org/170199720
IDR: 170199720
Текст научной статьи Аутологичная трансплантация гемопоэтических стволовых клеток у больных с впервые диагностированной множественной миеломой
Как известно, опухолевые плазматические клетки обладают крайне низкой скоростью пролиферации и не способны поддерживать свою популяцию ex vivo, что объясняется возникновением первичных онкогенных событий на этапе герминативного центра и высокой зависимостью клональных плазматических клеток от микроокружения [6]. В патогенезе множественной миеломы можно выделить два основных первичных онкогенных события: ги-пердиплоидия и транслокации генов тяжелых цепей иммуноглобулинов. В меньшем проценте случаев первичным механизмом может быть комбинация гипердиплоидии и транслокации генов тяжелых цепей иммуноглобулинов, моносомия 14 хромосомы и другие редкие цитогенетические аномалии. Оба механизма различными путями осуществляют гиперэкспрессию генов одного из циклинов D1, D2 или D3. Вторичными онкогенными событиями могут являться дополнительные транслокации генов IgH, Igk, IgL, myc, делеция 13q, моносомия 13 хромосомы, дупликация длинного плеча 1 хромосомы, делеции 1p, 6q, 8p, 12p, 14q, 16q, 17p, 20p.
Течение ММ характеризуется серией ремиссий и рецидивов, с развитием в итоге рефрактерного рецидива, то есть заболевание на сегодняшний день остается неизлечимым. Однако с введением в практику новых лекарственных препаратов (ингибиторы протеасомы, иммуномодулирующие агенты, моноклональные антитела), подходы к лечению ММ претерпели существенные изменения, что привело к увеличению медианы общей выживаемости с 2-х до 8-10 лет, а показатель 5-летней выживаемости достиг 56% [7-10]. Но не менее важная причина успехов – включение в алгоритм лечения больных ММ этапа высокодозной химиотерапии (ВДХТ) с аутологичной трансплантации гемопоэтических стволовых клеток (АутоТГСК) [1,10].
Целью настоящего обзора является представление результатов основных клинических исследований, оценивающих эффективность аутологичной трансплантации гемопоэтических стволовых клеток при впервые диагностированной/выявленной ММ (ВДММ).
Согласно рекомендациям EHA-ESMO-21, NCCN-21 и NCCN-22, АутоТГСК является стандартной терапевтической опцией для пациентов с ВДММ в возрасте до 70 лет, без сопутствующих заболеваний [10-14]. В качестве индукционной терапии перед АутоТГСК рекомендуются 2 режима: DaraVTD (дара-тумумаб / бортезомиб / талидомид / дексаметазон)
или VRd (бортезомиб / леналидомид / дексаметазон). При невозможности использования одного из этих режимов, можно ограничится двумя другими – VTD (бортезомиб / талидомид / дексаметазон) или VCD (бортезомиб / циклофосфамид / дексаметазон), но их эффективность ниже. Как правило, пациенты лечатся примерно 3-4 циклами индукционной терапии перед сбором гемопоэтических стволовых клеток (ГСК). После сбора ГСК пациенты могут либо получить АутоТГСК, либо продолжить терапию той же схемой, которая использовалась в индукции, откладывая АутоТГСК до первого рецидива. Существует много вариантов первичной терапии, и наиболее распространенные схемы лечения обсуждаются ниже.
Для «молодых пациентов» вопрос об оптимальных стратегиях лечения особенно актуален, с целью улучшения долгосрочных результатов при минимизации воздействия токсичности, связанной с лечением. Между тем, традиционное представление о том, что пациенты старше 65 лет не имеют права на АутоТГСК, больше не уместно, так как ясно, что пожилые пациенты, которые сохранны и не имеют тяжелой сопутствующей патологии, выигрывают от интенсивного лечения [10,15]. Применимые в клинике системы стадирования и стратификации риска основаны главным образом на оценке болезнь-свя-занных факторов. Все предлагаемые шкалы (Durie-Salmon, ISS, R-ISS, mSMART и другие) нацелены на определение прогноза пациента, на персонифицированный подход к лечению. Ясно, что пациенты в возрасте до 70 лет требуют индивидуальной оценки, учитывающей конкретный возраст, сопутствующие заболевания, выносливость, физическую активность и наличие инвалидности (физические или психические нарушения). Поэтому при оценке пригодности к АутоТГСК все большее значение приобретают индексы коморбидности [16,17].
При аутологичной трансплантации реинфузи-руемые стволовые клетки действуют как поддержка пациента, но не оказывают дополнительного противоопухолевого эффекта. Поэтому АутоТГСК не является методом излечения больных от ММ, но существенно продлевает их общую выживаемость. Смертность, связанная с АутоТГСК, составляет 1-2%. На современном этапе алгоритм лечения пациентов с ВДММ включает индукционную терапию, режимы, используемые для мобилизации ГСК из костного мозга в периферическую кровь, режимы кондиционирования (мелфалан в дозе 200 мг/ м2, при выраженном нарушении функции почек, но не требующем гемодиализа и больным 65-70 лет, целесообразно снижение дозы до 140 мг/м2), выполнение АутоТГСК, консолидирующие циклы с последующей поддерживающей терапией или только поддерживающая терапия до прогрессирования. Среди режимов мобилизации ГСК можно выделить следующие: гранулоцитарный колониестимулиру- ющий фактор (Г-КСФ), назначаемый в монорежиме; Г-КСФ совместно с плериксафором; комбинация одного или нескольких химиопрепаратов с Г-КСФ. Наибольшее распространение получили комбинированные режимы мобилизации, в частности, циклофосфамид+Г-КСФ [18,19]. Но применяют и другие цитостатические препараты (например, ви-норелбин или используют агрессивные схемы химиотерапии).
В настоящее время одним из наиболее перспективных способов повышения мобилизационного потенциала ГСК считается назначение ингибитора CXCR4 плериксафора. Сочетание Г-КСФ с плерикса-фором предоставляет возможность полностью отказаться от химиопрепаратов в составе режима мобилизации, что снижает цитостатическую нагрузку на кроветворные клетки и клетки гемопоэтической ниши, а кроме того, снижает риск развития вторичных неоплазий. Плериксафор чаще назначается при низком количестве CD34+ клеток, циркулирующих в периферической крови в предаферезном периоде [20]. Установлено, что при введении Г-КСФ в монорежиме, потребность в дополнительном назначении плериксафора значимо выше у больных ММ, предварительно получивших более 4 циклов леналидомида (отмечено негативное влияние леналидомида на мобилизационный потенциал) по сравнению с меньшим количеством циклов или не получавших леналидомид (р = 0,01) [21]. Что касается режима кондиционирования, то следует отметить, что несмотря на приоритет мелфалана, вводимого в дозе 200 мг/м2, продолжаются многочисленные попытки усиления предтрансплантационной подготовки (режима кондиционирования) посредством добавления второго препарата, в частности, циклофосфамида, этопозида, бусульфана бендамустина, тиоте-пы [22,23] или используют препараты, обладающие непосредственным противомиеломным действием – ингибиторы протеасомы (бортезомиб, карфилзо-миб) [24,25]. Хотя некоторые авторы указывают на отсутствии улучшения выживаемости, например, при дополнительном введении бортезомиба по 1 мг/м2 [24].
Рекомендуемый алгоритм лечения больных с ВДММ приведен на рисунке 1.
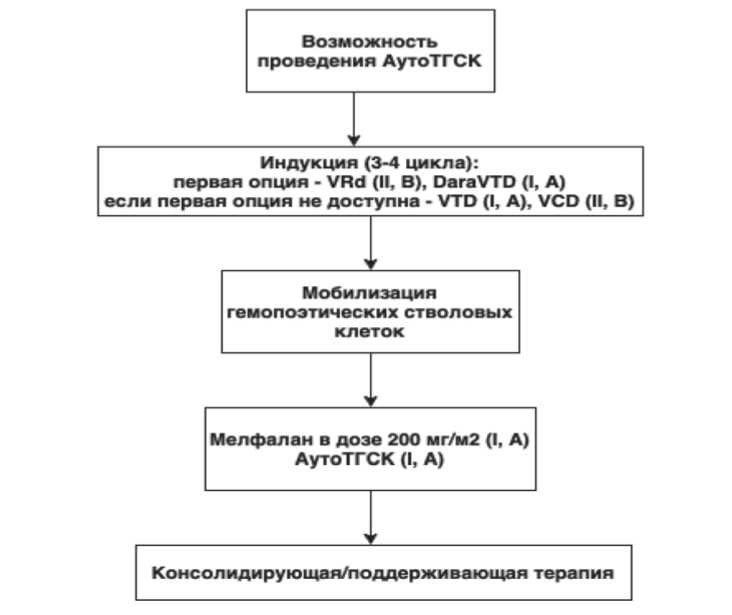
Рис . 1. Алгоритм лечения больных с впервые диагностированной множественной миеломой (EHA-ESMO, 2021)
В 1996 году были сообщены результаты первого рандомизированного исследования, показавшего, что выполнение АутоТГСК приводит к более высоким показателям ответа и увеличивает общую выживаемости и выживаемость без событий по сравнению с таковыми показателями аналогичных пациентов, получавших стандартное лечение [26].
В 2003 году опубликованы результаты второго исследования, сравнивающего ВДХТ со стандартной терапией. В этом исследовании было рандомизировано 407 пациентов с ВДММ, которые были моложе 65 лет, и получали либо стандартную комбинированную химиотерапию, либо высокодозную химиотерапию и АутоТГСК. Установлено, что показатели полного ответа были выше в группе интенсивной терапии, чем в группе стандартной терапии (44% против 8,0%, P<0,001), но показатели частичного ответа – аналогичными (42% и 40% соответственно; P=0,72). В то же время по сравнению со стандартной терапией интенсивное лечение увеличило медиану выживаемости почти на 1 год (54,1 мес. [95 % доверительный интервал – CI колебался от 44,9 до 65,2] по сравнению с 42,3 мес. [95%CI от 33,1 до 51,6]) [27]. Между тем, в 2006 г. Barlogie B. с соавторами сообщили о результатах американского исследования, которое включило 510 пациентов для получения высокодозной терапии с АутоТГСК или стандартной терапией [28]. При периоде наблюдении в 76 месяцев не было найдено различий в частоте ответов, беспрогрессивной (PFS) или общей выживаемости (OS) между двумя группами больных; 7-летняя PFS составила 17% и 16%, а OS - 37% и 42% соответственно. Причина результатов, несоответствующих предыдущему, не ясна, но может быть связана с различиями в конкретных режимах высокодозной терапии и стандартных режимов терапии между исследованиями. Например, исследование Barlogie B. et al. [28] включало полное облучение тела (12 Гр), как часть режима высоко-дозной химиотерапии. Между тем, еще в 2002 г. были опубликованы заключительные результаты рандомизированного исследования Intergroupe Francophone du Myelome 9502, согласно которым полное облучение существенно уступает высоко-дозному мелфалану [29].
Превосходство АутоТГСК (при использовании в рамках начальной терапии) над не трансплантирующим подходом подтверждено результатами крупных многоцентровых исследований GIMEMA MM-RV-209 и EMN MM-RV-441. В оба исследования были включены пациенты в возрасте <65 лет, которые получали индукцию по схеме леналидомид+дексаметазон до сбора стволовых клеток, а затем были рандомизированы на 2 группы: в 1-й группе выполняли АутоТГСК, а во 2-й – проводили 6 циклов MPR (мелфалан, преднизолон, леналидомид; исследование GIMEMA) или 6 циклов CRD (циклофосфамид, леналидомид, дексаметазон; исследование EMN). Продемонстрированы очевидные преимущества АутоТГСК как в отношении PFS, так и общей выживаемости. Для убедительности подробнее рассмотрим исследование GIMEMA [30], в котором участвовали 273 пациента. Одна группа больных получила трансплантацию гемопоэтических стволовых клеток, вторая – консолидирующую терапию по схеме MPR после индукции и достижения ответа. В последующем пациенты были разделены на 2 подгруппы, в одной из которых была назначена поддерживающая терапия леналидомидом, в другой – поддерживающая терапия отсутствовала. По результатам исследования, при медиане периода наблюдения 51,2 месяца, как PFS, так и OS были значительно длительнее в группе пациентов, получивших трансплантацию стволовых клеток, чем схему терапии MPR (медиана PFS (mPFS) составила 43,0 мес. против 22,4 мес. (95%CI= 0,32-0,61; P<0,001); 4-летняя общая выживаемость - 81,6% против 65,3% (95% CI= 0,32-0,93; P = 0,02). Но в этом исследовании, безусловно, не последнюю роль сыграла поддерживающая терапия. Так, медиана выживаемости без прогрессирования была значительно больше в группе больных ММ с поддерживающей терапией леналидомидом, чем при его отсутствии (41,9 мес. против 21,6 мес.; 95% CI= 0,33-0,65; P<0,001). Однако 3-летняя общая выживаемость оказалась сходной (88,0% против 79,2%; 95% CI= 0,36-1,15; P=0,14). Авторы заключают, что высокие дозы мелфалана плюс трансплантация стволовых клеток, по сравнению с режимом MPR, значительно увеличили выживаемость без прогрессирования и общую выживаемость среди пациентов с множественной миеломой в возрасте 65 лет и моложе. В то же время, поддерживающая терапия леналидомидом, по сравнению с отсутствием поддерживающей терапии, продлевает выживаемость без прогрессирования, но не оказывает влияния на общую выживаемость.
В последние годы, в индукционной терапии при ВДММ хорошо зарекомендовал себя триплет VRd (бортезомиб / леналидомид / дексаметазон), что подтверждают результаты многочисленных клинических исследований. Так, в исследовании I/II фазы проспективного исследования, триплет VRd, назначался больным с впервые выявленной ММ. Согласно опубликованным результатам, показатель частичного ответа (ЧО) составил 100%, при этом в 74% случаев был достигнут очень хороший частичный ответ (охЧО) или лучше, а в 52% - полный ответ или лучше [31]. Преимущества триплета – бортезомиб / леналидомид / дексаметазон в первичной терапии были отмечены в исследованиях II фазы IFM 2008 и II фазы EVOLUTION [32,33]. В исследовании IFM 2008 [32] 58% пациентов с ММ, получивших VRd в качестве индукционной терапии, достигли ≥ охЧО. При выполнении в последующем аутоТГСК и консолидирующей терапии наблюдался существенный прирост количества охЧО или выше – до 70% и 87% соответственно.
На сегодняшний день принципиальной целью лечения больных множественной миеломой является достижение устойчивого негативного статуса минимальной остаточной болезни (МОБ) [31,32]. Выполняемая преимущественно в 1 линии терапии, между индукционной и консолидирующей/ поддерживающей терапией, АутоТГСК позволяет решить несколько задач. Во-первых, ожидается нарастающее улучшение качества ответа, во-вторых – снижение объема остаточных опухолевых плазматических клеток до минимального уровня, что приводит к улучшению беспрогрессивной и общей выживаемости [34,35].
В исследовании III фазы IFM 2009 года, проведенном французской группой по изучению миеломы, были выделены больные, которые после 3 индукционных циклов VRd переводились на вы-сокодозный мелфалан с последующей АутоТГСК, усиленной в дальнейшем 2-я консолидирующими циклами VRd (1 группа) и больные, которым после 3 индукционных циклов VRd, не выполняли Ау-тоТГСК, а назначали еще 5 циклов VRd, рассматривая их как консолидирующую терапию (2 группа) [36]. После пациенты обеих групп получали поддерживающую терапию леналидомидом в течение 1 года. По результатам проведенного исследования, у пациентов, получивших АутоТГСК, mPFS составила 50 мес., в то время как у больных – только терапию VRd – 36 мес. (P < 0,001). Причем это преимущество наблюдалось во всех анализируемых подгруппах пациентов, включая стадии по шкале R-ISS и высокий цитогенетический риск. Процент пациентов с полным ответом (ПО) был выше в 1 группе больных, чем во второй (59% против 48%, P=0,03), как и процент пациентов с МОБ-негативным статусом (79% по сравнению с 65%, P<0,001). Правда, общая выживаемость между группами больных не различалась. 4-летняя OS в группе применения VRd + АутоТГСК составила 81%, а в группе применения только VRd — 82% (HR=1,16; 95%CI=0,80–1,68). Тем не менее, согласно большинству исследований, VRd обеспечивает наилучший профиль соотношения риска и пользы и поэтому рекомендуется ESMO и NCCN в качестве первой лечебной опции [II, B].
Наряду с применением в индукционной терапии VRd, возможно использование другого триплета – VCD (бортезомид, циклофосфамид и дексаметазон), что подтверждено рандомизированным исследованием Европейской группы (EMN02/HO95). 1503 пациента в возрасте ≤65 лет получили индукционную терапию 3-4 циклами VCD, после чего была проведена первая рандомизация на 2 подгруппы: больные 1 подгруппы переведены на лечение VMP (бортезомиб / мелфалан / преднизолон; четыре 42-дневных цикла), а пациентам 2 подгруппы выполнена одиночная (n=208) или двойная/ тандемная (n=207) аутологичная трансплантация гемопоэтических стволовых клеток (АутоТГСК-1 или АутоТГСК-2). После этого предусмотрена вторая рандомизация: подгруппа пациентов, которым после АутоТГСК-1 провели 2 консолидирующих цикла VRd и подгруппа больных без консолидации. После чего все больные, участвующие в исследовании, переведены на поддерживающую терапию леналидомидом до прогрессирования или непереносимой токсичности. При медиане наблюдения от первой рандомизации, равной 60,3 месяца, mPFS была гораздо больше у пациентов, получивших АутоТГСК по сравнению с больными, получившими VMP (56,7 против 41,9 мес.; P = 0,0001) [37,38]. Обращало на себя внимание преимущество в подгруппах пациентов с неблагоприятным прогнозом, включая пациентов ММ R-ISS II+III стадиями (HR=0,48; 95%CI=0,27-0,86; Р=0,013) и высоким цитогенетическим риском (HR=0,52; 95%CI=0,28-0,98; Р=0,042). Важно отметить, что в подгруппе больных, получивших 2 консолидирующих цикла VRd после АутоТГСК, при медиане наблюдения 42,1 мес., mPFS составила 58,9 мес., а у больных без консолидации – 45,5 мес. (HR=0,77; 95%CI=0,63-0,95; p=0,014). Причем у 41% больных после консолидации удалось достичь МОБ-негативного (МОБ [-]) статуса.
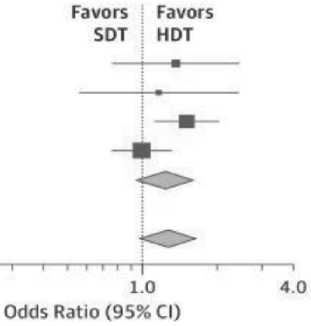
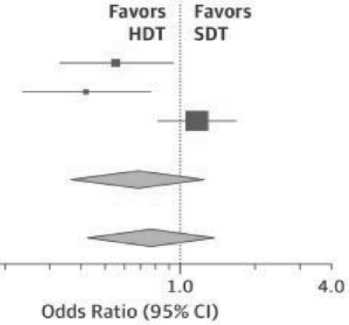
Мета-анализ основных исследований, опубликованный в 2018 г., действительно подтвердил более высокий показатель PFS, среди больных, получивших в качестве первоначального лечения АутоТГСК [39]. В общей сложности в мета-анализ были отобраны результаты 4 клинических исследований (2421 пациент) для однофакторного метаанализа и 5 исследований (3171 пациент) для многофакторного метаанализа.
Как видно из рисунка 2, суммирующее соотношение шансов при верификации полного ответа составило 1,27 (95%CI=0,98-1,65; P=0,07) среди пациентов, получавших ВДХТ и АутоТГСК в сравнении со стандартной терапией. Совокупное значение HR для PFS составило 0,55 (95%CI=0,41-0,74; P < 0,001) в пользу АутоТГСК, но результаты оказались хуже для общей выживаемости. Возможно, это было связано с тем, что только 3 клинических исследования, включенных в мета-анализ, сообщили об общей выживаемости. Причем используемые показатели для ее оценки в исследованиях, характеризовались значительной неоднородностью (на рисунке 2 – Heterogeneity). Совокупный HR для всех 3 исследований составил 0,76 (95%CI= 0,42-1,37; P=0,20). В то же время, мета-регрессионный анализ показал, что при более длительном наблюдении преимущества были более очевидными, как по PFS (HR/мес.= 0,98; 95% CI= 0,96-0,99; P = 0,03), так и по OS (HR/мес.= 0,90; 95% CI= 0,84-0,96; P = 0,02). Летальность при использовании ВДХТ и АутоТГСК была минимальной (<1%).
В исследовании FORTE, с целью улучшения результативности лечения больных ВДММ, предпринята попытка замены бортезомиба на карфилзо-миб (ингибитора протеасомы второго поколения) [40].
|
Полный ответ |
Odds Ratio |
|
Study |
(95% Cl) |
|
Palumbo et al, 2014 |
1.37 (0.76-2.45) |
|
Gayetal, 2015 |
1.17 (0.56-2.47) |
|
Attaletal, 2015 |
1.51 (1.12-2.04) |
|
Cavoetal, 2016 |
1.00 (0.76-1.32) |
|
Univariate summary, P = .ll |
1.24 (0.95-1.61) |
|
Heterogeneity (Q = 4.16, P=.24; / 2 = 38.1% ) |
|
Multivariate summary, P=.O7 1.27 (0.98-1.65)
Г" 0.1
_L Беспрогрессивная выживаемость
|
В Общая выживаемость |
|
|
Study |
Odds Ratio (95% Cl) |
|
Palumbo et al, 2014 |
0.55 (0.32-0.94) |
|
Gayetal, 2015 |
0.42 (0.23-0.76) |
|
Attaletal, 2015 |
1.16(0.80-1.68) |
|
Cavoetal, 2016 |
|
|
Univariate summary, P=,20 |
0.67 (0.36-1.24) |
|
Heterogeneity (Q=10.24, P=.01; /2 = 78.7%) |
|
|
Multivariate summary, P=.36 |
0.76(0.42-1.37) |
|
Г0.1 |
|
|
Study |
Odds Ratio (95% Cl) |
Favors HOT |
Favors SDT |
|
Palumbo et al, 2014 |
0.44 (0.32-0.61) |
-■— |
|
|
Gayetal, 2015 |
0.40 (0 25-0.63) |
--- |
|
|
Attaletal, 2015 |
0.65 (0.53-0.80) |
||
|
Cavoetal, 2016 |
0.73 (0.61-0.88) |
||
|
Univariate summary, P<.001 |
0.56(0.43-0.74) |
||
|
Heterogeneity (Q= 11.28, P=.01; /2 = 77.2%) |
|||
|
Multivariate summary, P<.001 |
0.55 (0.41-0.74) |
О |
|
|
0Л |
1.0 4.0 |
||
Odds Ratio (95% Cl)
Рис. 2. Частота ответа и показатели выживаемости gov/30098154/).
Примечание. Представленные графики иллюстрируют: A – полный ответ, B – выживаемость без прогрессирования, C – общую выживаемость среди пациентов, получавших высокодозную химиотерапию и аутологичную трансплантацию гемопоэтических стволовых клеток (HDT) при множественной миеломе в сравнении со стандартной терапией (SDT) по результатам однофакторного (univariate) и многофакторного (multivariate) мета-анализа.
Были сопоставлены 2 лечебных подхода: 1) четыре 28-дневных индукционных цикла KRd (карфилзо-миб / леналидомид / дексаметазон), с последующим проведением AутоТГСК и далее 4 цикла консолидации KRd (группа KRd – AутоТГСК - KRd); 2) только 12 циклов KRd (группа KRd12). Как выяснилось, число ≥ охЧО, ≥ПО, сПО и МОБ [-] ответов было сопоставимым между группами KRd – AутоТГСК - KRd и KRd12 у больных ММ стадиями R-ISS I и R-ISS II/III. Значительно более низкой была частота раннего рецидива на стадии R-ISS II/III в группе больных, получивших KRd – AутоТГСК – KRd, чем только KRd12 (12% и 23%; P=0,05), но разница не наблюдалась на стадии R-ISS I. В многофакторном регрессионном анализе применение KRd – AутоТГСК - KRd существенно снизило риск раннего прогрессирования (HR= 0,42; P=0,021) [40]. В целом, по мнению авторов, оба режима высоко эффективны, 50% пациентов с высоким риском, независимо от лечебного подхода, достигли МОБ [-] ответа. Кроме того, выяснилось, что комбинация карфилзомиба с леналидомидом обладает более выраженной противоопухолевой активностью, чем комбинация карфилзомиба с циклофосфамидом. В исследованиях оба режима (KRd – AутоТГСК - KRd и KRd12) продемонстрировали превосходство над индукцией KCd (карфилзомиб + циклофосфамид + дексаметазон – 4 цикла) – AутоТГСК – консолидация KCd (4 цикла) [41].
Одним из наиболее интересных направлений в терапии множественной миеломы является разработка моноклональных антител к антигенам клеток множественной миеломы. Моноклональные антитела (mAbs) — это новый класс лекарственных препаратов, которые интегрируются в существующие схемы лечения миеломы из-за более высокой скорости ответа и лучшего показателя PFS, наблюдаемого при их использовании, в первую очередь, в комбинированных схемах терапии [42,43]. Включение mAbs, в частности, даратумумаба, в первую линию изменило прогноз ММ. Одна из характерных особенностей опухолевых плазматических клеток – высокая экспрессия на их поверхности CD38. Экспрессия CD38 на плазматических клетках в сочетании со своей ролью клеточного рецептора и эктоэнзима, послужила основанием для использования CD38 в качестве потенциальной терапевтической мишени [44,45]. Даратумумаб является человеческим IgG1 моноклональным антителом против белка CD38. Этот препарат входит в состав ряда четырехкомпонентных режимов индукционной терапии. Более того, начались исследования по оценке пятикомпонентных схем, содержащих даратумумаб. Например, в текущем исследовании OPTIMUM схема индукции состоит из пяти лекарственных препаратов – даратумумаб-циклофосфосфамид-борте-зомиб-леналидомид-дексаметазон (DCVRd). После индукции больным выполняется АутоТГСК и две схемы консолидации даратумумаб-бортезомиб-ле-налидомид-дексаметазон (DVRd) и даратумумаб-бортезомиб-леналидомид (DVR) и далее поддерживающая терапия DR (даратумумаб-леналидомид). В исследование включаются пациенты сверхвысокого риска: две или более цитогенетических аномалий t(4;14), t(14;16), t(14;20), gain(1q), del(1p), del(17p); профилирование экспрессии генов высокого риска (SKY92); плазмоклеточный лейкоз (циркулирующие плазматические клетки >20%). Согласно первым опубликованным данным, общий ответ после индукции составил 94% (41% больных достигли МОБ негативного статуса (чувствительность 10-5), а после АутоТГСК - 83% (64% достигли МОБ негативного статуса).
Однако в данном обзоре мы сделаем акцент на четырехкомпонентные схемы, большинство исследований по которым завершены или завершаются. В настоящее время даратумумаб в комбинированных схемах, включающих 4 препарата (квадриплеты), разрешен для применения в первой линии терапии ВДММ.
Интересно, действительно это изменило прогноз множественной миеломы, привели ли 4-х компонентные комбинации к улучшению результатов лечения ММ?
Как уже указывалось выше, наряду с триплетом VRd, в первой линии терапии пациентов с ММ, планируемых на аутоТГСК, рекомендуется квадри-плет DaraVTD (даратумумаб / бортезомиб / талидомид / дексаметазон) (ESMO 21). Эффективность DaraVTD хорошо документирована в исследовании CASSIOPEIA (III фаза) [46], в которое вошло более 1000 пациентов с ВДММ. Выделено 2 группы. В 1 группу включены 542 больных с ВДММ, которым назначена индукционная терапия триплетом VTD (бортезомиб / талидомид / дексаметазон). Во 2 группу вошли 543 больных, которые получали протокол DaraVTD. После завершения индукционной терапии пациентам обеих групп была выполнена АутоТГСК с последующей консолидацией (по 2 цикла VTD или DaraVTD соответственно) и переводом их на поддерживающую терапию даратумумабом 1 раз в 8 недель максимально до 2 лет, а затем наблюдение, или больные сразу переводились под наблюдение до 2 лет.
Через 100 дней после выполнения АутоТГСК число строгих полных ответов (сПО), в том числе с МОБ-негативным статусом, было значительно выше среди больных из 2 группы (сПО: 28,9% против 20,3%, P<0,001; МОБ [-]: 63,7% против 43,5%, <0,0001). Оценка PFS на 18 месяцев наблюдения показала преобладание DaraVTD над VTD (92,7% против 84,6%, P < 0,0001). Существенные различия наблюдались при сравнении показателей PFS, особенно при достижении МОБ [-] статуса. Риск прогрессирования или смерти в DaraVTD группе был на 53% ниже, чем в VTD группе [46].
Исследование CASSIOPEIA было первым исследованием, которое продемонстрировало возможность использования в первой линии терапии больных ММ четверных комбинаций. Результаты исследования показали, что больные, получившие консолидацию, с большей вероятностью будут в строгом полном ответе, если они получили четыре препарата (DaraVTD); они с большей вероятностью достигнут МОБ [-] статуса, а это основа более пролонгированной выживаемости. Таким образом, четырехкомпонентная схема лечения, содержащая анти-CD38 моноклональное антитело даратумумаб, оказалась гораздо эффективнее триплета VTD в индукционной терапии больных ММ, с последующей АутоТГСК и консолидацией (2 цикла DaraVTD). Согласно существующим рекомендациям, режим терапии DaraVTD является новым стандартом лечения больных с ВДММ [I, A] (см. Рис. 1).
Однако к таким результатам некоторые исследователи отнеслись с критикой. Она заключается в том, что в исследовании CASSIOPEIA во время поддерживающей терапии была вторая рандомизация – пациенты либо не получали поддерживающую терапию, а находились под наблюдением, либо получали поддерживающую терапию даратумумабом один раз в 8 недель в течение 2 лет. Вопрос заключался в том, можно ли сравнивать такие группы больных и как это повлияло на выживание без прогрессирования в этом испытании?
Поэтому началось рандомизированное исследование фазы II GRIFFIN, которое было построено аналогично исследованию CASSIOPEIA. Проведена оценка 4-х компонентной комбинации DaraVRd (даратумумуба+VRd)+аутоТГСК и триплета VRd [47]. В исследовании участвовали 207 пациентов. Медиана возраста составила 60 лет (диапазон 29-70). По критериям Международной системы стадирования (ISS), I стадия выявлена у 48%, II стадия – у 37% и III стадия – у 15% больных ММ. Тридцать пациентов (15%) имели высокий цитогенетический риск – делеция 17p, транслокация t(4;14) или транслокация t(14;16). Методом случайной выборки все пациенты разделены на 2 группы (1:1): 1 группа -DaraVRd (4 цикла индукции), АутоТГСК, консолидация DaraVRd (2 цикла) и поддерживающая терапия – леналидомид±Dara (26 циклов); 2 группа – VRd (4 цикла индукции), АутоТГСК, консолидация VRd (2 цикла), поддерживающая терапия леналидомидом, также 26 циклов. Во время поддерживающей терапии — вводимой в 28-дневных циклах — пациенты получали 10 мг леналидомида с 1-го по 21-й день. При удовлетворительной переносимости в первые 3 месяца дозу увеличивали до 15 мг (с 4 по 24 мес.). Те, кому был назначен даратумумаб, получали 16 мг/ кг в/в каждые 8 недель во время поддерживающего периода или каждые 4 недели. То есть пациенты после посттрансплантационной консолидации были переведены на поддерживающую терапию дарату-мумабом или леналидомидом. Таким образом, одно из основных отличий от исследования CASSIOPEIA заключается в том, что во время поддерживающей терапии не было второй рандомизации. Все получали поддерживающую терапию. Группа контроля получала поддерживающую терапию леналидомида, а экспериментальная группа получала леналидомид и даратумумаб в течение первых 2 лет, а затем пациентам было предложено продолжать монотерапию леналидомидом.
Согласно опубликованным данным, количество сПО (первичная конечная точка) к концу консолидации после АутоТГСК было больше в группе пациентов, получивших DaraVRd, чем в группе пациентов, получивших VRd (42,4% против 32,0%; HR=1,57; 95%CI=0,87-2,82; P = 0,068) и эта разница становилась все более очевидной с увеличением срока наблюдения [47]. При медиане наблюдения 22,1 месяца, показатель сПО повысился еще более отчетливо в DaraVRd группе – 62,6%, чем в VRd – 45,4% (P = 0,0177), число пациентов с МОБ негативным статусом (секвенирование 10-5) составило 51,0% против 20,4%; P < 0,0001). Прирост сПО, как установили исследователи, был связан с использованием да-ратумумаба. Так, в конце индукции частота сПО составила 12,1% против 7,2%, после трансплантации аутологичных стволовых клеток – 21,2% против 14,4%. К концу консолидации число ответивших пациентов, получавших даратумумаб, достигло 99% против 92% в группе без даратумумаба. Очень хороший частичный ответ или лучше зарегистрирован в 91% против 73% случаев и полный ответ или лучшего – в 52% против 42%. 24-месячная PFS составила 95,8% для группы DaraVRd и 89,8% - для группы VRd [47].
Как и в исследовании CASSIOPEIA, показатели строгого полного ответа были лучше к концу консолидирующей терапии, одновременно улучшились показатели отрицательного МОБ-статуса. Обновленные результаты исследования GRIFFIN были представлены на заседании Американского общества гематологии в декабре 2022 г. К этому времени все пациенты прошли как минимум 2 года поддерживающей терапии. Показатель полного ответа составил 80% в группе DaraVRd по сравнению с 60% в группе VRd, а МОБ [-] статус был зарегистрирован у 64% и 30% больных соответственно (больше, чем удвоение; чувствительность 10-5). Четырёхкомпонентная схема DaraVRd в первой линии терапии, последующая аутоТГСК и консолидация, использованная в исследовании GRIFFIN, подтвердила преимущество аутоТГСК в сравнении с консервативной терапией у пациентов с ВДММ. Добавляя, анти-CD38 антитела к иммуномодулирующим препаратам и ингибиторам протеасом мы получаем более высокие значения МОБ [-] статуса, что приводит к улучшению выживаемости без прогрессии (HR=0,46; 95%CI=1,0). Весьма привлекательны результаты подгруппового анализа, что наглядно представлено на рисунке 3. Именно D-VRd в большинстве подгрупп существенно повысила частоту сПО и МОБ [-].
Что касается безопасности, то в исследованиях CASSIOPEIA и GRIFFIN, единственное на что обращают внимание авторы – более высокий уровень нейтропении 3 степени при использовании 4-х компонентных схем терапии, содержащих антитела против CD38. Так, в исследовании CASSIOPEIA частота нейтропении 3 ст. и выше составила 28% в группе пациентов, получавших даратумумаб плюс VTd по сравнению с 15% пациентов, получавших только VTd, т.е в 2 раза меньше. В исследовании GRIFFIN результаты аналогичные: DaraVRd - 41%, VRd - 22%. Более часто в группе больных, получавших DaraVRd, наблюдались инфекционные осложнения, но частота 3 и 4 ст. тяжести была сходной с таковой в группе больных, получавших триплет VRd. 42% пациентов, получавших даратумумаб, испытывали реакции, связанные с инфузией, но большинство из них были 1 или 2 степени и не требовали прекращения терапии или снижения дозы.
RVd D-RVd RVd D-RVd cIIO (%; n)_____________Отношение шансов (95% ДИ) _______________Отсутствие МОБ, п (%) Отношение шансов (95% Д11)
|
Пол Мужской Женский Возраст Сталия болезни по 1 П ш Tini ММ IgG Не IgG |
25/55 (45,5) 21/42 (50,0) 35/70 (50,0) 11/27 (40.7) 1SS 18/48 (37,5) 19/35 (54,3) 8/13 (61,5) 17/51 (33,3) 29/46 (63,0) |
33/55 (60.0) 30/44 (68,2) 46/72 (63,9) 17/27 (63,0) 29/48 (60.4) 26/37 (70,3) 8/14(57,1) 31/51 (60,8) 29/45 (64.4) |
*4 ■ч |
1,80 (0,84-3,84) 2,14 (0,89-5,15) 1,77 (0,90 3,46) 2,47 (0,83-7,39) 2,54(1.12-5.79) 1.99 (0.76-5,25) 0,83 (0,18-3,88) 3,10(1,38-6,96) 1,06 (0.45-2,50) |
Пол Мужской 14/60 (23,3) 33/58 (56.9) Женский 14/43 (32,6) 32/46 (69.6) Возраст < 65 лет 23/75 (30,7) 46/76 (60,5) >65 лет 5/28 (17.9) 19/28 (67.9) Стадия болезни по ISS I 10/50(20,0) 32/49(65,3) II 13/37 (35,1) 23/40(57,5) III 5/14(35,7) 10/14(71,4) Тип ММ IgG 13/52 (25,0) 35/55 (63,6) Не IgG 15/51 (29,4) 28/46 (60,9) |
нч и |
4.34(1,96-9.58) 4.73 (1,93-11.59) 3,47 (1,77-6,79) 9,71 (2,78-33,92) 7,53 (3,03-18,69) 2,50 (0.99-6,27) 4,50 (0,91-22,15) 5,25 (2,28-12,09) 3,73 (1,60-8,69) |
|
|
Цитогенетичекий риск Высокий риск 5/13 (38,5) Стандартный риск 40/80 (50,0) ФС по ECOG 0 15/39(38,5) 1-2 31/58(53,4) |
7/16 (43,8) 55/79 (69,6) 22/38 (57,9) 40/60 (66,7) |
НИ ч |
1,24 (0,28-5,53) 2,29 (1,20 4,39) 2,20 (0,88-5,47) 1,74 (0,83-3,67) |
Цитогенетический риск Высокий риск 4/14(28,6) 7/16(43,8) Н Стандартный риск 24/83 (28,9) 56/82 (68,3) ФС по ECOG 0 8/40(20,0) 25/39(64,1) 1-2 20/62 (32.3) 40/62 (64.5) |
и нч"1 |
1,94 (0,42-8,92) 5,29 (2,72-10.29) 7,14 (2,59 19,69) 3,82 (1.81-8,04) |
||
|
%!— |
10 |
100 |
||||||
|
RVd >фф |
мсти внес |
D-RVd >ффск1ивнее |
„___ RVd >ф фок tn внес |
D-RVd »ф ф ект и внес |
||||
Рис . 3. Анализ достижения сПО и отсутствия МОБ в подгруппах к моменту завершения 12- месячной поддерживающей терапии по результатам исследования GRIFFIN
Примечание. RVd – леналидомид, бортезомиб, дексаметазон; D-RVd – даратумумаб, леналидомид, бортезомиб, дексаметазон; сПО – строгий полный ответ; МОБ [-] – негативный статус по минимальной остаточной болезни. Медиана наблюдения - 27,4 мес.
Еще одно обстоятельство, требующее внимания, анти-CD38 моноклональные антитела могут влиять на сбор гемопоэтических стволовых клеток. Например, в исследовании GRIFFIN, в котором сравнивалась эффективность схем DaraVRd и VRd в индукционном периоде, выявлена большая потребность в плериксафоре при мобилизации стволовых клеток у больных, которым назначался даратумумаб: 69,5% против 56,3% соответственно.
Таким образом, плериксафор может быть составляющим компонентов режимов мобилизации исходно или назначаться при низком количестве CD34+ клеток в предаферезном периоде. И, действительно, результаты исследований CASSIOPEIA и GRIFFIN показали, что мобилизация стволовых клеток и аутологичная трансплантация стволовых клеток возможны после индукции, содержащей да-ратумумаб, причем без существенного влияния на восстановление кроветворения. Исследователи не сообщили о существенной разнице в группах больных, получавшим даратумумаб-содержащие режимом и VRd в отношении среднего выхода стволовых клеток (8,1 x 106 клеток / кг против 9,4 x 106 клеток / кг), среднего времени до приживления тромбоцитов (13 дней против 12 дней) или среднего времени до приживления нейтрофилов (12 дней против 12 дней) [46,47].
Польза от добавления даратумумаба к бортезо-мибу, леналидомиду и дексаметазону не вызывает сомнений. Четырехкомпонентные комбинации, содержащие даратумумаб, имеют более высокую скорость достижения качественного ответа по сравнению с тройными комбинациями. Уровень достигнутого МОБ [-] статуса является беспрецедентным. Поэтому NCCN рекомендует DaraVRd в качестве одной из опций у больных с ВДММ, планируемых на АутоТГСК.
Между тем, как выяснилось, возможна замена бортезомиба на ингибитор протеасомы второго поколения карфилзомиб, что подтверждает пилотное исследовании MANHATTAN [48], которое проходило с 1 октября 2018 года по 15 ноября 2019 года. В исследование вошли больные с ВДММ, которым назначены восемь 28-дневных циклов лечения по схеме wKRd-D: внутривенно карфилзомиб, 20/56 мг/ м2 (дни 1, 8 и 15-й); перорально леналидомид, 25 мг (дни 1-21-й); дексаметазон, 40 мг 1 раз в неделю, перорально или внутривенно (циклы 1-4-й) и 20 мг после 4 цикла; внутривенно даратумумаб, 16 мг/кг дни 1, 8, 15 и 22-й (циклы 1-2), дни 1 и 15 (циклы 3-6) и день 1-й (циклы 7 и 8). Медиана наблюдения с начала лечения составило 20,3 месяца. В исследование включены 41 пациент (медиана возраста 59 лет; диапазон 30-70 лет); 20 (49%) имели множественную миелому высокого риска. Первичной конечной точкой была частота минимальной остаточной болезни при отсутствии высокодозной химиотерапии мелфаланом и аутологичной трансплантации гемопоэтических клеток. Вторичные конечные точки включали определение безопасности и переносимости, оценку показателей клинического ответа в соответствии с Международной рабочей группой по изучению миеломы и оценку показателей выживаемости без прогрессирования (PFS) и общей выживаемости (OS).
Первичная конечная точка МОБ [-], при чувстви- тельности 10-5, была достигнута у 29 из 41 пациента (71%; 95%CI=54%-83%) после 8 циклов wKRd-D. Анализ, с учетом стандартных клинических факторов, показал аналогичное преимущество wKRd-D во всех подгруппах. В частности, частота МОБ [-] в подгруппах высокого и стандартного риска была сходной (HR=1,7; 95%CI= 0,36-0,86; P = 0,50). Аналогичная связь выявлена между статусом МОБ и возрастом (<60 лет против ≥60; (HR=0,48; 95%CI=0,08-2,3; P = 0,32). Медиана циклов до достижения МОБ [-] статуса составила 6 (диапазон 1-8 циклов). Среди 29 пациентов, у которых был обнаружен отрицательный МОБ статус после завершения комбинированной терапии wKRd-D, был только 1 пациент, который спустя 9 месяцев прогрессировал. 8 пациентов были оценены на МОБ при 1-летнем наблюдении, при этом 7 (88%) показали 1-летний устойчивый отрицательный МОБ статус. Пациент, который перешел из МОБ [-] в МОБ [+] при 1-летнем наблюдении, сохранил полный ответ и продолжал получать поддерживающую терапию. Вторичные конечные точки: общая частота ответа и очень хороший частичный ответ или полный ответ составили 100% (41 из 41 пациента) и 95% (39 из 41 пациента) соответственно. При медиане наблюдения 11 месяцев 1-летняя PFS составила 98% (95%CI=93%-100%) (Рис. 4), а OS - 100% соответственно.
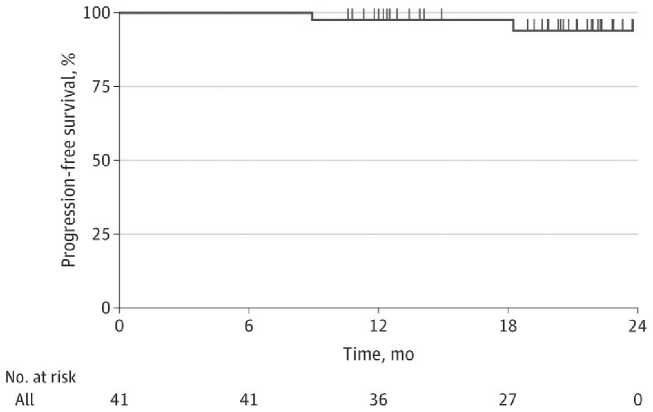
Рис . 4. Беспрогрессивная выживаемость больных с ВДММ , получивших wKRd-D.
Наиболее распространенными (≥2 пациентов) неблагоприятными событиями 3 или 4 степени тяжести были нейтропения (12 пациентов [27%]), сыпь (4 пациента [9%]), легочная инфекция (3 пациента [7%]) и повышенный уровень аланинаминотрансферазы (2 пациента [4%]). Смертей не было.
В этом клиническом исследовании привлекает эффективность комбинированной терапии (кар-филзомиб-леналидомид-дексаметазон-даратуму-маб), которая привела к высоким показателям МОБ- негативного статуса у пациентов с ВДММ и высоким показателям PFS.
Довольно впечатляющие результаты продемонстрированы в клиническом исследовании MASTER, в котором также применялась схема Dara-KRd в качестве индукционной терапии с последующей АутоТГСК [49]. Оценивалась частота достижения МОБ [-] статуса с учетом цитогенетических факторов риска среди пациентов с ВДММ. В исследовании участвовали 123 пациента, 43% из которых не име- ли ни одного цитогенетического фактора высокого риска, у 37% больных обнаружен 1 и у 20% - > 2 факторов высокого риска. Больным была назначена индукционная терапия четырехкомпонентной схемой – Dara-KRd (даратумумаб + карфилзомиб + леналидомид + дексаметазон) с последующей Ау-тоТГСК и консолидацией Dara-KRd (4-8 циклов) [49]. Медиана наблюдения составила 25,1 мес. В целом 80% больных достигли МОБ негативного статуса (78%, 82% и 79% для больных с 0, 1 и 2+ факторов риска соответственно). При этом 66% достигли МОБ [-] при уровне чувствительности < 10–6. 2-летняя PFS составила 87% (91%, 97% и 58% больных с 0, 1 и 2+ факторами высокого цитогенетического риска соответственно). По мнению авторов, именно проведение консолидации по схеме Dara-KRd позволило получить такие высокие значения МОБ негативного статуса в прогностически неблагоприятной группе больных ММ.
Таким образом, индукционная терапия трех- и, особенно четырехкомпонентными схемам, содержащими анти-CD38 моноклональные антитела, с последующей АутоТГСК, оказывая мощное цитостатическое и иммуноопосредованное воздействия на костный мозг, обеспечивает максимальную эрадика-цию опухолевого клона, отражением чего является достижение устойчивого МОБ-негативного статуса, трансформирующегося в длительную бессобытий-ную и общую выживаемость. Данные, которые были представлены и опубликованы по результатам оценки эффективности Dara-KRd, действительно заставляют обратит на себя внимание. Хотя никаких прямых сравнений Dara-RVd и Dara-KRd не было, но глубина ответа и быстрота, с которой пациенты достигали МОБ [-], впечатляют.
Рассматривая важность проведения больным ММ АутоТГСК, нельзя обойти стороной двойную/ тандемную АутоТГСК (АутоТГСК-2). До эпохи иммуномодуляторов, ингибиторов протеасомы, моноклональных антител, тандемная АутоТГСК (обычно планируется после первой через 3-6 месяцев) явно приносила пользу, по крайней мере, тем пациентам, которые после первой АутоТГСК (АутоТГСК-1) не достигали очень хорошего частичного ответа [50,51]. В частности, согласно результатам исследования IFM94 [50], вероятность достижения 7-летней бес-событийной выживаемости составила 10% в группе больных, получивших одну трансплантацию, и 20% в группе больных с двойной трансплантацией. В подгрупповом анализе выяснилось, что выиграли от второй трансплантации пациенты, которые не достигли полного или охЧО в течение 3 месяцев после первой трансплантации. Между тем различий в показателях OS между одиночной и двойной трансплантацией в целом не обнаружено. Сделано предположение, что улучшение прогнозируемой выживаемости, связанной с тандемной трансплантацией, обусловлено не с ростом показателей ответа, а с более длительной продолжительностью ответа. О сходных данных сообщили Cavo М. et al [51]. Правда, по их данным наибольшую выгоду от двойной трансплантации получают пациенты, не достигшие именно ПО после первой трансплантации.
В 2009 г. опубликованы результаты мета-анализа 6 рандомизированных контролируемых исследований [52]. Проанализированы материалы конференций и статей. Кроме того, авторы связались с экспертами в этой области знаний и обсудили с ними результаты. Конечными точками были общая выживаемость (OS), выживаемость без событий, частота ответов и смертность, связанная с лечением. Анализ показал, что общая частота ответов при использовании АутоТГСК-2, действительно, выше (HR= 0,79, 95%CI = 0,67-0,93), но при статистически значимом увеличении смертности, связанной с лечением (HR = 1,71, 95%CI = 1,05-2,79). Не выявлено улучшения OS (HR= 0,94; 95%CI = 0,77-1,14) или бессобытийной выживаемости (HR = 0,86; 95%CI = 0,70-1,05) в сравнении с АутоТГСК-1. Тем не менее, авторы обращают внимание на то, что исследования, включенные в мета-анализ, были неоднородными, что, безусловно, повлияло на общую выживаемость, выживаемость без событий. Прямого сравнения АутоТГСК-1 и Ау-тоТГСК-2 не предполагалось. В одном из исследований, в первую очередь, оценивалась эффективность поддерживающей терапии талидомидом после одиночной трансплантации, что и улучшило бессобы-тийную выживаемость. Таким образом, результаты сопоставления в группах АутоТГСК-1 и АутоТГСК-2 были не достоверны. Тогда исследователи для более точной интерпретации имеющихся данных, из мета-анализа эту работу исключили [53]. Повторно проведенный анализ, выявил улучшение и общей, и бессобытийной выживаемости больных, получивших АутоТГСК-2.
Иное мнение еще в 2010 г. было высказано Barlogie B. et al. после анализа долгосрочных исходов – тандемные АутоТГСК превосходят по эффективности как одиночные трансплантации, так и стандартные методы лечения [54]. Это подтверждалось более длительной безрецидивной выживаемостью, но, как оказалось, только в том случае, когда бессо-бытийная выживаемость поддерживалась в течение не менее 3,5 лет после тандемной трансплантации.
В 2016 г. опубликованы первые результаты исследовании фазы III BMT CTN 0702 – StaMINA [55]. Это клиническое исследование, в которое были включены 758 пациентов с симптоматической ММ в возрасте <71 года (медиана 57 лет), имеющие показания для АутоТГСК в течение 12 месяцев после начала терапии. Пациенты методом случайной выборки распределены в соотношении 1:1:1. В 1 группу (ACM) были включены больные, получившие мелфалан 200 мг/м2 с АутоТГСК и 4 цикла консолидации RVD (леналидомид 15 мг в день 1-14, дексаметазон 40 мг в день 1,8 и 15 и бортезомиб 1,3 мг/м2 1,4,8 и 11-й дни каждые 21 день; во 2 группе (TAM) выполнялась повторная трансплантация (АутоТГСК-2); больные 3 группы получали только АутоТГСК-1 (АМ). В последующем все больные, не зависимо от лечебного подхода, переводились на поддержку леналидомидом (от 5 мг до 15 мг/день) до прогрессирования заболевания. Больные стратифицированы с целью выявления высокого риска заболевания - цитогенетические аномалии - del13q, del17p, t(4;14), t(14;16), t(14;20) и гиподиплоидия; или высокий уровень бета-2 микроглобулина). Из тех, кто был включен в исследование, 24% имели высокий риск. Медиана доступного наблюдения от рандомизации составила 38 месяцев. Первые результаты этого крупнейшего рандомизированного испытания аутологичной трансплантации при ММ в США показали следующее. 38-месячная PFS составила 57% (95%CI= 5063%), 56% (95%CI= 49-63%) и 52% (95%CI= 45-59%) для ACM, TAM и AM соответственно (ACM против TAM p=0,75, ACM против AM p=0,21, TAM против АМ p=0,37). Соответствующие показатели OS составили 86% (95%CI= 80-90%), 82% (95%CI= 76-87%) и 83% (95%CI= 78-88%). Медиана общей выживаемости в группах больных не достигнута. Добавление консолидации RVD или выполнение второй АутоТГСК не превосходило результаты АутоТГСК-1 с последующей поддерживающей терапией леналидомидом. Случаи прогрессирования заболевания в течение 38 месяцев составили 42% (95%CI= 36-48%), 42% (95%CI= 35-48%) и 47% (95%CI=40-54%) для групп ACM, TAM и AM соответственно. Было зарегистрировано 39 случаев вторых первичных злокачественных новообразований (SPM). Совокупные случаи SPM составили 6,0% (95%CI= 3,4-9,6%), 5,9% (95%CI= 3,39,6%) и 4,0% (95%CI= 1,9-7,2%) для ACM, TAM и AM соответственно.
Три года спустя Stadtmauer E.A. et al. [56] снова подтвердили, что различий действительно нет. 38-месячный показатель PFS составил 58,5% (95%CI от 51,7% до 64,6%) для АутоТГСК-1/АутоТГСК-2 + леналидомид, 57,8% (95%CI от 51,4% до 63,7%) для АутоТГСК-1 + RVD + леналидомид и 53,9% (95%CI от 47,4% до 60%) для АутоТГСК-1 + леналидомид. Общая выживаемость составила 81,8% (95%CI от 76,2% до 86,2%), 85,4% (95%CI от 80,4% до 89,3%) и 83,7% (95%CI, 78,4% до 87,8%) соответственно, а показатели полного ответа через 1 год – 50,5% (n = 192), 58,4% (n = 209) и 47,1% (n = 208) соответственно. Профили токсичности и развитие вторичных первичных злокачественных новообразований были одинаковыми во всех группах лечения. Такие результаты позволили авторам заключить – одиночная АутоТГСК и леналидомид в поддерживающей терапии должны оставаться стандартным подходом для больных с ВДММ.
И, наконец в 2020 г. представлены результаты долгосрочного наблюдения за больными ММ, вошедшими в исследование BMT CTN 0702
(STaMINA). 6-летняя PFS и OS среди больных, получивших АутоТГСК-1+АутоТГСК-2 составили 43,9% и 73,1%, АутоТГСК-1+4 цикла VRd - 39,7% и 74,9% и АутоТГСК-1 с переходом на леналидомид в поддерживающей терапии - 40,9% и 76,4%. То есть, ни консолидирующая терапия, ни АутоТГСК-2 не улучшили результаты лечения в сравнении с АутоТГСК-1+поддерживающая терапия леналидомидом. Однако различия были обнаружены при высоком цитогенетическом риске: 6-летняя PFS после АутоТГСК-2 составила 43,6%, а АутоТГСК-1 – 26% (P=0,03). Преимущества двойной АутоТГСК были очевидны и среди пациентов, которые не смогли достичь по крайней мере почти полного ответа после первой аутотрансплантации [57].
Между тем в недавнем анализе данных долгосрочного наблюдения (медиана 117 месяцев), объединенном из трех европейских исследований фазы 3 (GIMEMA MMY -3006, PETHEMA/GEM и HONVON65MM/GMMG-HD41), тандемная АутоТГСК привела к улучшению PFS (HR= 0,76 (р= 0,001) и OS (HR= 0,69 (р<0,001) по сравнению с одиночной. То есть роль тандемной АутоТГСК остается предметом споров. Однако применение этого лечебного подхода имеет более сильное обоснование для пациентов с ММ высокого риска.
Эксперты NCCN-21, NCCN-22 считают, что тандемная трансплантация с поддерживающей терапией или без нее может быть рассмотрена для всех пациентов, которые являются кандидатами на ТГСК, и, кроме того, является эффективной опцией для пациентов, не достигших очень хорошего частичного ответа после первой АутоТГСК, а также для пациентов с высоким цитогенетическим риском [13, 58]. Рекомендуется собирать гемопоэтические стволовые клетки у всех, подходящих для трансплантации пациентов, в количестве достаточном для проведения двух трансплантаций.
Высказанная рекомендация базируется на результатах крупных рандомизированных исследованиях. В исследовании фазы II IFM 2018-04 продемонстрирована эффективность, тандемной трансплантации при высоком цитогенетическом риске. Но следует обратить внимание, что в данном исследовании на каждом этапе, начиная с индукции и завершая поддерживающей терапией, использовались моноклональные антитела – даратумумаб [59].
В это исследование вошли 50 больных с ВДММ в возрасте < 65 лет (медиана 57 лет), с высоким цитогенетическим риском - t(4;14), del 17p и/или t(14;16)). 3-я стадия ISS выявлена у 12 (24%) пациентов. Основываясь на критериях включения, все пациенты имели высокий цитогенетический риск, включая del 17p (n=20, 40%), t(4;14) (n=26, 52%) или t(14;16) (n=10, 20%). Всем пациентам в качестве индукции проведено 6 циклов Dara-KRd (даратуму-маб / карфилзомиб / леналидомид / дексаметазон), далее сбор гемопоэтических стволовых клеток, Ау- тоТГСК-1, консолидация 4 циклами Dara-KRd, Ау-тоТГСК-2, поддерживающая терапия даратумума-бом (каждые 8 недель) или леналидомидом (по 10 мг 28-дневные циклы) в течение 2 лет. Исследование проходило с июля 2019 г. по март 2021 г. в 11 центрах. Сорок шесть пациентов полностью завершили индукцию Dara-KRd. Два пациента прекратили лечение из-за тяжелых нежелательных явлений (инфекция COVID-19, n=1; медикаментозный гепатит, n=1), а 2 пациента прекратили лечение из-за прогрессирования заболевания. Неблагоприятными событиями, связанными с лечением 3-4 степени (>5% пациентов), были нейтропения (38%), анемия (14%), тромбоцитопения (8%), инфекция (6%), почечная недостаточность (6%) и тромбоз глубоких вен (6%). У двух пациентов (6%) неудачный сбор стволовых клеток. Результаты исследования: общий ответ составил 96%, из них сПО - 10%, ПО - 21%, > охЧО – 92%. МОБ негативный статус (NGS, 10-5) зарегистрирован у 37 (62%) из 46 больных [59]. Таким образом, лечебная стратегия, включающая Dara-KRd в индукции до АутоТГСК, и в консолидации дополненный АутоТГСК-2 с последующей поддерживающей терапией даратумумабом или леналидомидом, безопасна и обеспечивает глубокие ответы у пациентов с ВДММ с цитогенетическим профилем высокого риска.
По данным EMN02/HO95 [37,38], беспрогрессив-ная и общая выживаемость в подгруппе больных получивших АутоТГСК-2, были выше, чем после завершения АутоТГСК-1 (36-месячная PFS в подгруппе АутоТГСК-1 составила 64%, а в подгруппе АутоТГСК-2 – 73%, OS – 82 и 89% соответственно). Причем, выполнение АутоТГСК-2 более отчетливо, чем АутоТГСК-1, преодолевало неблагоприятный прогноз, связанный с высоким цитогенетическим риском (3-летняя PFS - 69% против 44%, 3-летняя OS – 85% против 73%). Значимые различия наблюдалось среди пациентов с R-ISS II+III (HR= 0,48; P=0,013), а также у пациентов, не достигших ПО [60]. Причем преимущество АутоТГСК-2 при высоком риске было подтверждено результатами 10-летнего периода наблюдения в трех исследованиях -GIMEMA MMY-3006, PETHEMA/GEM и HOVON65MM/ GMMG-HD41(R-ISS II+III, и неспособность достичь ПО): низкий риск (20%) - медиана PFS = 87 месяцев; 10-летняя OS = 78%; промежуточный риск (42%) - медиана PFS = 53 месяца; 10-летняя OS = 53%; высокий риск (38%) - медиана PFS = 27 месяцев; 10-летняя OS = 32%. В подгруппе с низким риском: группа АутоТГСК-2 против группы АутоТГСК-1 показала тенденцию к улучшению PFS, но не OS (HR= 0,66; 95%CI = 0,41-1,07, P = 0,093) В промежуточной подгруппе: не наблюдалось никакой разницы между группами АутоТГСК-2 и АутоТГСК-1 при оценке PFS и OS. В подгруппе высокого риска: АутоТГСК-2 значительно продлила как mPFS (32 против 20 месяцев; HR= 0,71; 95%CI=0,54–0,93, P = 0,012), так и OS (80
против 48 месяцев; HR= 0,58; 95%CI= 0,42–0,80, P = 0,001) против ASCT-1. При сверхвысоком риске (пациенты со всеми тремя неблагоприятными цитогенетическими факторами): выполнение АутоТГСК-2 в сравнении с АутоТГСК-1 привело к двукратному увеличению медианы PFS (35 против 14 месяцев; HR= 0,40; 95%CI= 0,21–0,79, P = 0,008) и 56% снижению риска смерти (26% против 6% предполагаемой 10-летней OS; HR= 0,44; 95%CI= 0,21–0,90, P = 0,025) [61].
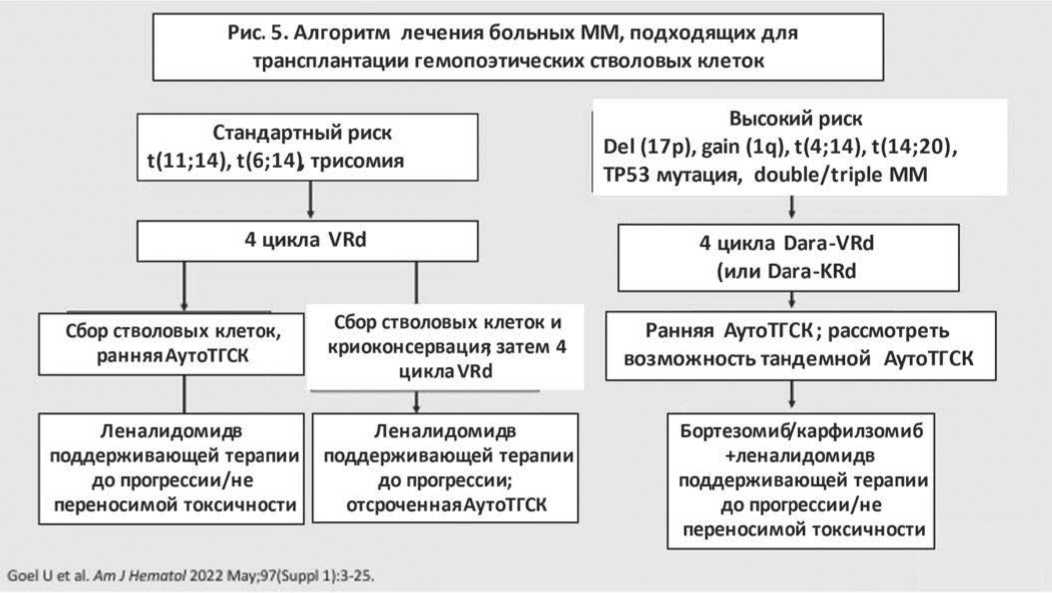
Следует констатировать, что на сегодняшний день, АутоТГСК является предпочтительным методом лечения больных с ВДММ. Однако у некоторых больных со стандартным риском ММ и негативном отношении пациента, АутоТГСК может быть отложена до первого рецидива. Существует несколько исследований, проведенных до введения режима VRd, показавших, что выполнение АутоТГСК у больных с ВДММ (после 3-4 циклов инициальной терапии) или на момент рецидива (в качестве терапии спасения), не имеет различий в общей выживаемости [62,63]. Cook G. et al. в 2011 г. опубликовали результаты ретроспективного анализа эффективности второй АутоТГСК и обычной химиотерапии при рецидиве MM [64]. Показано, что вторая АутоТГСК связана с высокой смертностью, обусловленной рецидивом заболевания, по сравнению с обычной химиотерапией (68% против 78%) и ухудшением OS (22% против 32%) через 4 года наблюдения за больными. Однако авторы указали на необходимость тщательной предварительной стратификации больных, что определяет эффективность того или иного лечебного подхода. В частности, молодой возраст (<55 лет), уровень бета-2 микроглобулина <2,5 мг/л при постановке диагноза, продолжительность ремиссии > 9 месяцев и >ЧО, достигнутый после АутоТГСК-1. Именно эти факторы, связанные с улучшением OS и PFS больных с рецидивом ММ, подходящих для ТГСК. То есть, вторая аутологичная трансплантация, при 1 рецидиве или прогрессии ММ, может быть вариантом для тщательно отобранных пациентов. В то же время, исследование с использованием VRd в качестве начальной терапии продемонстрировало улучшение беспрогрессивной выживаемости, но разницы в общей выживаемости по сравнению с отложенной АутоТГСК до первого рецидива, получено не было [65]. Поэтому необходим не только анализ факторов, связанных с заболевание, но и с пациентом, то есть, важное значение приобретает мнение пациента при определении сроков проведения АутоТГСК, особенно при стандартном риске. На наш взгляд, практическую значимость имеет предложенный Goel U. et al., алгоритм лечения больных ММ, подходящих для АутоТГСК с учетом цитогенетического риска (Рис. 5).
Как уже указывалось выше, алгоритм лечения пациентов с ВДММ включает индукционную терапию, режим кондиционирования с выполнением
АутоТГСК, консолидирующие циклы с последующей поддерживающей терапией или только поддерживающей терапии до прогрессирования. Поддерживающая терапия леналидомидом в дозе 10-15 мг/ сут считается стандартом для всех пациентов с MM, достигших ответа. Бортезомиб в дозе 1,3 мг/м2 каждые 2 недели в течение 2-х лет также рекомендуется в качестве поддерживающей терапии, но, главным образом, для пациентов с ММ высокого риска. Проводятся исследования по оценке эффективности перорального ингибитора протеасомы иксазомиба в поддерживающей терапии и уже сообщается о преимуществе подобного подхода (улучшение PFS) по сравнению с плацебо.
Кроме того, как представлено в данном обзоре, в клинических исследованиях все больше используется и в консолидирующей, и в поддерживающей терапии анти-CD38 моноклональное антитело дара-тумумаб. В частности, это хорошо документировано исследованиями GRIFFIN и IFM 2018-04, в которых пациенты получали даратумумаб 16 мг/кг в/в каждые 8 недель во время поддерживающего периода.
Заключение
Современные тенденции в лечении больных ММ характеризуются использованием комбинированных программ, содержащих новые препараты уже на этапе индукционной терапии с последующей ВДХТ и аутоТГСК. Более половины пациентов с впервые диагностированной ММ считаются пожилыми, и эта популяция чрезвычайно неоднородна, с сопутствующими заболеваниями и слабостью увеличивающимися с возрастом. Однако необходимо подчеркнуть, что все больные в возрасте до 65 лет, а также пациенты 65-70 лет с хорошим соматическим статусом без тяжелых сопутствующих заболеваний с вновь диагностиро- ванной ММ, должны рассматриваться в качестве кандидатов на проведение ТГСК. Применение иммуномодулирующих средств, ингибиторов проте-асомы и моноклональных антител в индукционной терапии и выполнение АутоТГСК, позволили значительно повысить эффективность лечения пациентов с ММ.
В данном обзоре представлены подходы к лечению пациентов с ММ, подходящих для аутологичной трансплантации гемопоэтических стволовых клеток, которые основаны на результатах проводимых рандомизированных многоцентровых клинических исследований и нашли свое приложение в рекомендациях ESMO, NCCN, Национальных клинических рекомендациях. Для получения качественного ответа и увеличения его продолжительности, необходима индукция с использованием триплетов (предпочтительно VRd, но, если эта комбинация не доступна, могут использоваться и другие триплеты – VCD, VTD) или квадрипле-та (DaraVTD) с последующей АутоТГСК, консолидацией и длительной поддерживающей терапией. На комбинацию VCD следует обратить внимание у больных с острой почечной недостаточностью, у больных с подозрением на нефропатию. Выбор начальной терапии для больных ММ требует тщательного анализа рисков и пользы. Следует помнить о необходимости тщательного наблюдения за больными, мониторировать ранние проявления токсичности.
У молодых пациентов с впервые диагностированным ММ активное лечение следует начинать как можно раньше. При планировании стратегии лечения необходимо учитывать несколько факторов, включая логистику, расходы, доступность лекарств, социальные соображения, сопутствующие заболевания и предпочтения пациентов. Ранее никогда не имела значения следовавшая за терапией индукции глубина ответа, но теперь, как было показано рядом исследовательских групп, глубокие ответы и их удержание сказываются на посттрансплантационной выживаемости. Глубина и продолжительность ответа, достигнутые с помощью триплетов, не всегда соответствуют ожиданиям лечащего врача и пациента. Поэтому в настоящее время возникают новые парадигмы лечении больных ММ.
Важно рассмотреть альтернативные режимы, которые более эффективны и в скором времени найдут применение в практической деятельности врача. Во время начала лечения у пациента уже имеются как доминантный клон, так и минорные клоны, поэтому не вызывает сомнений тот факт, что более предпочтительной тактикой является использование даже не триплетов, а четырехкомпонентных режимов терапии, так как цель – эра-дикация как доминантного клона, так и как можно больше минорных клонов, которые являются резервуаром будущего рецидива.
Моноклональные антитела, в частности, дара-тумумаб – моноклональное антитело, ориентированное на CD38 – это препарат, совершивший прорыв в лечении больных ММ. У этого препарата, как показали многочисленные исследования, выраженная эффективность при резистентной миеломе, что позволило в последние годы включить его в начальное лечение при множественной миеломе.
Четырехкомпонентные схемы, содержащие даратумумаб, показывают многообещающие результаты. Хорошо зарекомендовал себя квадри-плет DaraVTD, что послужило основанием для его включения в последние рекомендации ESMO. Режим DaraVTd показал превосходные результаты, более высокие показатели ответа, выживаемость без прогрессирования (PFS) и тенденцию к лучшей OS по сравнению с VTd. Но талидомид, входящий в схему DaraVTD, не зарегистрирован в РФ, поэтому применение данной комбинации крайне ограничено.
Появились и прошли апробацию в клиниче- ских исследованиях четырехкомпонентные схемы - DaraVRd (даратумумуба+VRd) и DaraКRd (даратумумуба+КRd). Их применение, по результатам клинических исследований, в индукционной и консолидирующей терапии с последующей трансплантацией и далее – в поддерживающей терапии, превысили эффективность при аналогичном использовании триплетов VRd или КRd. Наблюдается существенный прирост как общего ответа, так и его глубины и продолжительности. В настоящее время измерение минимальной остаточной болезни (МОБ) с помощью многоцветной иммунофлуоресцентной проточной цитометрии и секвенирования генов с чувствительностью до 10-5, становится обязательным критерием ответа MM [34,35]. Мета-анализы подтвердили, что достижение МОБ-отрицательного статуса после лечения пациентов с впервые диагностированной ММ значительно улучшает выживаемость. Причем несмотря на то, что, примерно, 25% пациентов с МОБ [-] рецидивируют, кривые PFS и OS гораздо выше и длительнее, чем у пациентов с МОБ-положительным статусом. Четырехкомпонентные комбинации привели к быстрому достижению качественного ответа и беспрецедентному уровню МОБ [-] статуса по сравнению с тройными комбинациями, что позитивно отразилось на показателях выживаемости. Причем весьма примечательный факт – аналогичные данные получены у пациентов с высоким цитогенетическим риском.
Общая выживаемость пациентов с множественной миеломой значительно улучшилась за последнее десятилетие и в настоящее время близка к медиане 10 лет для недавно диагностированных пациентов. Однако 15-20% всех пациентов с ММ имеют прогнозируемую OS менее трех лет. Эта подгруппа идентифицирована как имеющая ММ высокого риска и представляет собой проблему для диагностики и лечения с неудовлетворительным контролем заболевания и ранним рецидивом, несмотря на использование новейших методов лечения. Пациенты с признаков высокого риска, особенно цитогенетических /геномных аномалий, или ранним рецидивом (<1 год) после аутологичной трансплантации гемопоэтических клеток включаются в категорию сверхвысокого риска с ожидаемой медианой OS менее двух лет. Для этих пациентов необходимы инновационные стратегии лечения.
Многоцентровые исследования показывают, что применение четырехкомпонентных комбинаций, в первой линии терапии с последующей АутоТГСК, консолидацией и поддерживающей терапией – лучший способ преодоления высокого риска и поддержания негативности МОБ [10]. Негативность МОБ является сильным прогностическим фактором, который может преодолеть многие первоначальные факторы, связанные с плохим прогнозом. Доступные в настоящее время методы исследования очень чувствительны и недавние исследования продемонстрировали важность достижения МОБ [-] уже на уровне 106, а также важность устойчивого МОБ [-] статуса. Прогноз пациентов с высоким риском, достигающих устойчивого негативного МОБ статуса, очень близок к прогнозу пациентов со стандартным риском. Комбинации DaraVRd и DaraКRd с успехом могут быть применены у пациентов с Double Hit или Triple Hit миеломой в качестве начальной терапии (3-4 цикла) с последующей АутоТГСК, консолидацией и переходом на поддерживающую терапию бортезомибом, но возможен и режим VRd или даратумумаб.
Что касается тандемной АутоТГСК, которая была предложена как способ преодоления неполного ответа на одну трансплантацию. Однако выполнение тандемной АутоТГСК связано с более выраженной токсичностью и высокой смертностью. Поэтому следует помнить о предварительной стратификации больных, что во многом определяет эффективность лечения. В частности, важны такие факторы, как возраст, цитогенетический риск, уровень бета-2 микроглобулина, глубина и длительность достигнутого после АутоТГСК-1 ответа. Пациенты со сверхвысоким риском, с общей выживаемостью менее двух лет, имеют признаки высокого риска, такие как цито-генетические/генетические аномалии или рецидив в течение одного года после АутоТГСК. Среди факторов риска ММ генетически-молекулярные изменения и ответ на лечение являются наиболее надежными предикторами исходов. Тандемная АутоТГСК рекомендуется для пациентов с высоким цитогенетическим риском и у пациентов, не достигших после первой трансплантации очень хорошего частичного или полного ответа. Рандомизированные клинические испытания показали превосходные показатели ответа, увеличение выживаемости при правильном использовании тандемной АутоТГСК. В то же время, существуют опасения по поводу кумулятивной долгосрочной токсичности костного мозга от двойного высоко-дозного алкилирования. Учитывая быстро меняющуюся парадигму лечения и эффективность новых комбинаций агентов, вторую АутоТГСК можно разумно сохранить в резерве для пациентов в 1 рецидиве. Считается, что проведение АутоТГСК во второй линии является логическим подходом для пациентов, которые рецидивируют после первичной терапии, включающей в себя АутоТГСК, с продолжительностью ремиссии 36 месяцев [66].
Консолидация после АутоТГСК состоит из 2-4 циклов, обычно той же схемой терапии, используемой в индукции. Такая терапия проводится с целью улучшения глубины ответа и продления выживаемости. В нескольких рандомизированных исследованиях оценивались различные циклы консолидации после АутоТГСК, и все они показали нарастание глубины ответов, но не все обеспечили преимущества OS. В текущих испытаниях, например, в исследовании BMT-CTN 0702, оценивалась консолидация по протоколу RVD или выполнялась вторая АутоТГСК, проводилось сравнение с одиночной АутоТГСК или с последующей поддержкой леналидомидом. Показано преимущество выживаемости без прогрессирования после посттрансплантационной консолидации. Поэтому одним из вариантов лечения пациентов с высоким риском и тех, кто не достиг полного ответа после АутоТГСК, может быть применение от двух до четырех циклов консолидации триплетом RVD или квадриплетом DaraRVD, что более доступно и выгодно.
Подводя итог, мы с уверенностью может констатировать, что будущее лечения ММ обнадеживает и обещает лучшие показатели ответа и улучшенную выживаемость за счет внедрения новых и рационально разработанных методов лечения.
Список литературы Аутологичная трансплантация гемопоэтических стволовых клеток у больных с впервые диагностированной множественной миеломой
- Бессмельцев С.С., Абдулкадыров К.М. Множественная миелома: рук. для врачей. – М.: МК. 2016. – 504.
- Moreau P., San Miguel J., Sonneveld P. et al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann Oncol. – 2017. – Vol. 28, Suppl 4. – P. iv52–61.
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2020 // Cancer J Clin. – 2020. – Vol. 70. – P. 7–30.
- Jaffe E.S., Harris N.L., Stein H., Vardiman J.W. World Health Organization Classification of Tumors. Pathology and Genetics of Tumors of Haematopoietic Lymphoid Tissues. Lyon: IARC Press, 2001.
- Злокачественные новообразования в России в 2017 году (заболеваемость и смертность)./ под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018.
- Tricot G. New insights into role of microenvironment in multiple myeloma // Lancet. – 2000. – Vol. 355, N 9200. – P. 248-50
- SEER Cancer Stat Facts: Myeloma. Bethesda: National Cancer Institute. https://seer.cancer.gov/statfacts/html/mulmy.html. Accessed 24 Feb 2020.
- Fonseca R., Usmani S.Z., Mehra M. et al. Frontline treatment patterns and attrition rates by subsequent lines of therapy in patients with newly diagnosed multiple myeloma. - BMC Cancer. – 2020. – Vol. 20. – P. 1087-1098.
- Kumar S.K., Callander N.S., Alsina M. et al. NCCN guidelines insights: multiple myeloma, version 3.2018// J Natl Compr Canc Netw. – 2018. – Vol. 16. – P. 11–20.
- Бессмельцев С.С. Множественная миелома: диагностика и терапия (часть 1)//Вестник гематологии. - 2022. - Т. 18, №2. - С. 4-26.
- Dimopoulos M. A., Moreau P., Terpo E. et al. Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Annals Oncology. – 2021. – Vol. 32. – P. 309-322.
- Shaji K. Kumar, Natalie S. et al. Multiple Myeloma, Version 3.2021. NCCN Clinical Practice Guidelines in Oncology // J Natl Compr Canc Netw . – 2020. – Vol. 18, N 12. – P. 1685–1717.
- NCCN Clinical Practice Guidelines in Oncology. Multiple Myeloma. Version 4.2022 — December 14, 2021/ Shaji K. Kumar, Natalie S. et al.
- Михайлов Е.С., Салогуб Г.Н., Бессмельцев С.С. Влияние возраста на результаты аутологичной трансплантации гемопоэтических стволовых клеток у пациентов с множественной миеломой // Биомедицинскийжурнал Medline.ru. – 2021. – Т. 22, СТ. 36. – С. 527-539.
- Muchtar E., Dingli D., Kumar S. et al., Autologous stem cell transplant for multiple myeloma patients 70 years or older // Bone Marrow Transplant. – 2016. – Vol. 51, N 11. – P. 1449-1455.
- Charlson M. Szatrowski T.P., Peterson J., Gold J. Validation of a combined comorbidity index // J Clin Epidemiol. - 1994. – Vol. 47, N 11. – P. 1245-1251.
- Saad A., Mahindra A., Zhang M.-J. et al., Hematopoietic cell transplant comorbidity index is predictive of survival after autologous hematopoietic cell transplantation in multiple myeloma // Biol Blood Marrow Transplant. - 2014. – Vol. 20, N 3. – P. 402-408 e1.
- Грицаев С.В., Кузяева А.А., Бессмельцев С.С. Отдельные аспекты трансплантации аутологичных гемопоэтических стволовых клеток больным множественной миеломой // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. – 2017. – № 1. – С. 7–12.
- Gertz M.A. Current status of stem cell mobilization // Br. J. Haematol. – 2010. – 150. – P. 647–662.
- Milone G., Martino M., Spadaro A. et al. Plerixafor on-demand combined with chemotherapy and granulocyte colony-stimulating factor: significant improvement in peripheral blood stem cells mobilization and harvest with no increase in costs // Br. J. Haematol. – 2014. – Vol. 164. – P. 113–123.
- Costa L., Abbas J., Hogan K. et al. Growth factor plus preemptive (‘just-in-time’) plerixafor successfully mobilizes hematopoietic stem cells in multiple myeloma patients despite prior lenalidomide exposure // Bone. Marrow. Transplant. – 2012. – Vol. 47. – P. 1403–1408.
- Martino M., Tripepi G., Messina G. et al. A phase II, single-arm, prospective study of bendamustine plus melphalan conditioning for second autologous stem cell transplantation in de novo multiple myeloma patients through a tandem transplant strategy // Bone Marrow Transplant. – 2016. – Vol. 51, N 9. – P. 1197-11203.
- Saini N., Bashir O., Milton D. et al. Busulfan and melphalan conditioning is superior to melphalan alone in autologous stem cell transplantation for high-risk MM // Blood. Adv. – 2020. – Vol. 4. – P. 4834–4837.
- Roussel M., Lauwers-Cances V., Macro M. et al. Bortezomib and high-dose melphalan conditioning regimen in frontline multiple myeloma: an IFM randomized phase 3 study // Blood. 2022. – Vol. 139. – P. 2747–2757.
- Costa L., Landau H., Chhabra S. et al. Phase 1/2 trial of carfilzomib plus high-dose melphalan preparative regimen for salvage autologous hematopoietic cell transplantation followed by maintenance carfilzomib in patients with relapsed/refractory multiple myeloma // Biol. Blood. Marrow. Transplant. – 2018. – Vol. 24. – P. 1379–1385.
- Attal M., Harousseau J.L., Stoppa A.M. et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Francais du Myelome // N Engl J Med. – 1996. – Vol. 335. – P. 91-97.
- Child J.A., Morgan G.J., Davies F.E. et al. High-dose chemotherapy with hematopoietic stem-cell rescue for multiple myeloma. // N Engl J Med. – 2003. – Vol. 348. – P. 1875-1883.
- Barlogie B., Kyle R.A., Anderson K.C. et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma: final results of phase III US Intergroup Trial S9321 // J Clin Oncol. – 2006. – Vol. 24. – P. 929- 936.
- Moreau P., Facon T., Attal M. et al. Comparison of 200 mg/m(2) melphalan and 8 Gy total body irradiation plus 140 mg/m(2) melphalan as conditioning regimens for peripheral blood stem cell transplantation in patients with newly diagnosed multiple myeloma: final analysis of the Intergroupe Francophone du Myelome 9502 randomized trial //. Blood. – 2002. – Vol. 99. – P. 731-735.
- Palumbo A., Cavallo F., Gay F. et al., Autologous transplantation and maintenance therapy in multiple myeloma // N Engl J Med. - 2014. Vol. 371, N 10. – P. 895-905.
- Richardson P.G., Weller E., Lonial S. et al. Lenalidomide, bortezomib, and dexamethasone combination therapy in patients with newly diagnosed multiple myeloma// Blood. – 2010. – Vol. 116. – P. 679-686
- Roussel M., Lauwers-Cances V., Robillard N. et al. Front-line transplantation program with lenalidomide, bortezomib, and dexamethasone combination as induction and consolidation followed by lenalidomide maintenance in patients with multiple myeloma: a phase II study by the Intergroupe Francophone du Myelome // J Clin Oncol. – 2014. – Vol. 32. – P. 2712-2717.
- Kumar S., Flinn I., Richardson P.G. et al. Randomized, multicenter, phase 2 study (EVOLUTION) of combinations of bortezomib, dexamethasone, cyclophosphamide, and lenalidomide in previously untreated multiple myeloma // Blood. – 2012. – Vol. 119. – P. 4375-4382.
- Goicoechea E., Puig N., Cedenae M. et al. Deep MRD profiling defines outcome and unveils different modes of treatment resistance in standard- and high-risk myeloma // Blood. 2021. – Vol. 137. – P. 49-60.
- Чубукина Ж.В., Глазанова Т.В., Кострома И.И., Бубнова Л.Н., Грицаев С.В., Волошин С.В., Бессмельцев С.С. Динамика минимальной остаточной болезни у больных множественной миеломой до и после трансплантации аутологичных гемопоэтических стволовых клеток // Вестник гематологии. – 2019. – Т. 15, №3. – С. 71.
- Attal M., Lauwers-Cances V., Hulin C. et al. Lenalidomide, bortezomib, and dexamethasone with transplantation for myeloma // N Engl J Med. – 2017. – Vol. 76. – P. 1311-1320.
- Cavo M., Gay F., Patriarca F. et al. Double autologous stem cell trans- plantation significantly prolongs progressionfree survival and overall survival in comparison with single autotransplantation in newly diagnosed multiple myeloma: an analysis of phase 3 EMN02/HO95 study // Blood. – 2017. – Vol. 130, Suppl 1. – P. 401.
- Cavo M., Gay F., Beksac M. et al. Autologous haematopoietic stem-cell transplantation versus bortezomib-melphalanprednisone, with or without bortezomib-lenalidomide-dexamethasone consolidation therapy, and lenalidomide maintenance for newly diagnosed multiple myeloma (EMN02/HO95): a multicentre, randomised, open-label, phase 3 study // Lancet Haematol. – 2020. – Vol. 7. – P. e456-e468.
- Dhakal B., Szabo A., Chhabra S. et al. Autologous Transplantation for Newly Diagnosed Multiple Myeloma in the Era of Novel Agent Induction: A Systematic Review and Meta-analysis // JAMA Oncol. – 2018. – Vol. 4, N3. – P. 343-350.
- Gay F., Cerrato C., Petrucci M. et al. Efficacy of carfilzomib lenalidomide dexamethasone (KRd) with or without transplantation in newly diagnosed myeloma according to risk status: results from the FORTE trial // J Clin Oncol. – 2019. – Vol. 37, Suppl 15. – P. 8002.
- Gay F., Musto P., Rota-Scalabrini D. et al. Carfilzomib with cyclophosphamide and dexamethasone or lenalidomide and dexamethasone plus autologous transplantation or carfilzomib plus lenalidomide and dexamethasone, followed by maintenance with carfilzomib plus lenalidomide or lenalidomide alone for patients with newly diagnosed multiple myeloma (FORTE): a randomised, open-label, phase 2 trial // Lancet Oncol. – 2021. – Vol. 22. – P. 1705–1720.
- Rajkumar S.V. Myeloma today: Disease definitions and treatment advances // Am J Hematol. – 2016. – Vol. 91, N 1. – P. 90-100.
- Бессмельцев С.С. Анти-CD38 моноклональные антитела в лечении рецидивов/рефрактерных форм множественной миеломы // Вестник гематологии. -2018. – Т. XIV, № 3. – C. 5-18.
- Deckert J., Wetzel M.C., Bartle L.M. et al. SAR650984, a novel humanized CD38-targeting antibody, demonstrates potent antitumor activity in models of multiple myeloma and other CD38 hematologic malignancies // Clin Cancer Res. - 2014. – Vol. 20, N17. – P. 4574–4583.
- van de Donk W.C.J., Richardson P., Malavasi F. CD38 antibodies in multiple myeloma: back to the future // Blood. - 2018. – Vol. 131, N1. – P. 13–29.
- Moreau P., Attal M., Hulin C. et al. Bortezomib, thalidomide, and dexamethasone with or without daratumumab before and after autologous stem-cell transplantation for newly diagnosed multiple myeloma (CASSIOPEIA): a randomised, open-label, phase 3 study // Lancet. – 2019. – Vol. 394. – P. 29-38.
- Voorhees P.M., Kaufman J.L., Laubach J. et al. Daratumumab, lenalido- mide, bortezomib, and dexamethasone for transplant-eligible newly diagnosed multiple myeloma: the GRIFFIN trial // Blood. – 2020. – Vol. 136. – P. 936–945.
- Landgren O., Hultcrantz M., Diamond B. et al. Safety and Effectiveness of Weekly Carfilzomib, Lenalidomide, Dexamethasone, and Daratumumab Combination Therapy for Patients with Newly Diagnosed Multiple Myeloma. The MANHATTAN Nonrandomized Clinical Trial // JAMA Oncol. - 2021. – Vol. 7, N 6. – P. 862-868.
- Costa L.J., Chhabra S., Medvedova E. et al. Daratumumab, Carfilzomib, Lenalidomide, and Dexamethasone with Minimal Residual Disease Response-Adapted Therapy in Newly Diagnosed Multiple Myeloma // Journal of Clinical Oncology. - Published online December 13, 2021.DOI: 10.1200/JCO.21.01935.
- Attal M., Harousseau J-L., Facon Th. et al. Single versus double autologous stem-cell transplantation for multiplemyeloma // N Engl J Med. – 2003. – Vol. 349, N 26. – P. 2495-2502.
- Cavo M. Tosi P., Zamagni E. et al., Prospective, randomized study of single compared with double autologous stemcell transplantation for multiple myeloma: Bologna 96 clinical study // J Clin Oncol. - 2007. – 25, N 17. – P. 2434-2441.
- Kumar A. Kharfan-Dabaja M.A., Glasmacher A., Djulbegovic B. Tandem versus single autologous hematopoietic cell transplantation for the treatment of multiple myeloma: a systematic review and meta-analysis // J Natl Cancer Inst. - 2009. – Vol. 101, N 2. – P. 100-106.
- Giralt S. Vesole D.H., George Somlo G. et al., Re: Tandem vs single autologous hematopoietic cell transplantation for the treatment of multiple myeloma: a systematic review and meta-analysis // J Natl Cancer Inst. - 2009. – Vol. 101, N 13. – P. 964; author reply 966-967.
- Barlogie B., Attal M., Crowley J. et al. Long-term follow-up of autotransplantation trials for multiple myeloma: update of protocols conducted by the intergroupe francophone du myelome, southwest oncology group, and university of Arkansas for medical sciences // J Clin Oncol. – 2010. – Vol. 28. – P. 1209-1214.
- Stadtmauer A., Pasquini M., Blackwell B. et al. Comparison of autologous hematopoietic cell transplant (autoHCT), bortezomib, lenalidomide (Len) and dexamethasone (RVD) consolidation with Len maintenance (ACM), tandem auto-HCT with Len maintenance (TAM) and AutoHCT with Len maintenance (AM) for up-front treatment of patients with Multiple Myeloma (MM): Primary results from the randomized phase III trial of the Blood and Marrow Transplant Clinical Trials Network (BMT CTN 0702 – StaMINA Trial) // ASH Annual meeting 2016 ; Late breaking Abstract.
- Stadtmauer E.A., Pasquini M.C., Blackwell B. et al. Autologous Transplantation, Consolidation, and Maintenance Therapy in Multiple Myeloma: Results of the BMT CTN 0702 Trial // J Clin Oncol. – 2019. – Vol. 37. – P. 589-597.
- Hari P., Pasquini M., Stadtmauer E. et al. Long-term follow-up of BMT CTN 0702 (STaMINA) of post autologous hematopoietic cell transplantation (autoHCT) strategies in the upfront treatment of multiple myeloma (MM) // J Clin Oncol. – 2020. – Vol. 38, Suppl 15. – P. 8506.
- NCCN Clinical practice guidelines in oncology. Multiple Myeloma, Version 3.2021/ Kumar S.K., Callander N.S., Adekola K. et al.
- Touzeau C., Perrot A., Hulin C. et al Daratumumab, carfilxomib, lenalidomide and dexamethasone as induction therapy in high-risk transplantat eligible newly diagnosed myeloma patients: results of the phase 2 study IFM 2018-04// ASCO 2022, Abstract 8002
- Cavo M., et al., Double vs single autologous stem cell transplantation for newly diagnosed multiple myeloma. 60th ASH Annual Meeting & Exposition, 2018: p. abstract 124.
- Fotaki V. ASH 2018 | Long-term follow-up of double vs single ASCT in patients with newly diagnosed multiple myeloma/ The 60th American Society of Hematology (ASH) Annual Meeting was held in San Diego, California, from 1–4 December 2018. On Saturday 1 December 2018, an oral abstract session was held entitled: Clinical Autologous Transplantation: Results: Multiple Myeloma: Upfront Autologous Transplantation, which focused on updates of advanced clinical trials for newly diagnosed multiple myeloma (NDMM).
- Fermand J. P., Ravaud P., Chevret S. et al. High-dose therapy and autologous peripheral blood stem cell transplantation in multiple myeloma: up-front or rescue treatment? Results of a multicenter sequential randomized clinical trial // Blood. – 1998. – Vol. 92, N 9. – P. 3131–3136.
- Barlogie B., Kyle R.A., Anderson K.C. et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma: final results of phase III US Intergroup Trial S9321 //J. Clin. Oncol. – 2006. – Vol. 24, N 6. – P. 929–936.
- Cook G., Liakopoulou E., Pearce R. et al. Factors influencing the outcome of a second autologous stem cell transplant (ASCT) in relapsed multiple myeloma: a study from the British Society of Blood and Marrow Transplantation Registry // Biol Blood Marrow Transplant. – 2011. – Vol. 17. – P. 1638- 1645.
- Attal M., Lauwers-Cances V., Hulin C. et al. Autologous transplantation for multiple myeloma in the era of new drugs: a phase III study of the Intergroupe Francophone Du Myeloma (IFM/DFCI 2009 Trial) // Blood. – 2015. – Vol. 126. – P. 391.
- Rajkumar S.V., Kumar S. Multiple myeloma current treatment algorithms // Blood Cancer Journal. – 2020. – Vol. 94. – P. 2-10.


