Авелумаб в лечении пациентов с карциномой Меркеля: первые результаты программы раннего доступа в России
Автор: Орлова К.В., Назарова В.В., Петенко Н.Н., Демидов Л.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 1 т.9, 2019 года.
Бесплатный доступ
Карцинома Меркеля (КМ) - это редкая и агрессивная опухоль кожи с ограниченными возможностями терапии на поздних стадиях, когда летальность, обусловленная заболеванием, достигает 46 % . Ранее было показано, что КМ является иммуногенной опухолью, поэтому появление ингибиторов контрольных точек иммунного ответа изменило лечебные принципы больных распространенной КМ. В данной статье мы представляем первые результаты применения в России анти-PD-L1 антитела авелумаб в лечении больных метастатической и / и ли местно-распространенной КМ в рамках программы раннего доступа.
Карцинома меркеля, авелумаб, анти-pd-l1, полиомавирус, анти-pd-1
Короткий адрес: https://sciup.org/140243815
IDR: 140243815
Текст научной статьи Авелумаб в лечении пациентов с карциномой Меркеля: первые результаты программы раннего доступа в России
Карцинома Меркеля (КМ) — редкая агрессивная опухоль кожи с эпителиальной и нейроэндокринной дифференцировкой, в большинстве случаев ассоциированная с полиомавирусом клеток Меркеля. Уровень заболеваемости КМ варьирует в зависимости от географического региона. Так, в странах Европейского Союза на основании данных регистра редких опухолей (RARECARE) заболеваемость КМ составила 0,13 на 100 000 населения в период c 1995 по 2002 год [1]. В США по данным SEER (База данных по наблюдению, распространенности и исходам злокачественных новообразований) заболеваемость КМ в 2013 году составила 0,7 на 100 000 населения, что соответствует 2488 случаям за год [2]. Самые высокие показатели заболеваемости отмечены в Австралии: 1,6 на 100 000 населения [3]. По разным оценкам смертность от КМ составляет от 33% до 46%, это существенно выше, чем при меланоме кожи, что еще раз подчеркивает агрессивное течение этого заболевания [4]. Несмотря на чувствительность КМ к химиотерапии, долговременные ответы можно наблюдать нечасто. Медиана выживаемости без прогрессирования (ВБП) на фоне химиотерапии по данным ретроспективных исследований варьирует от 3,1 до 4,6 мес., что свидетельствует о необходимости поиска новых более эффективных вариантов терапии [5–7].
Лиганд программированной гибели-1 (PD–L1) экспрессируется на поверхности опухолевых клеток КМ, а также на клетках микроокружения опухоли, предполагая возможность применения ингибиторов PD-1 и PD–L1 в лечении данной патологии [8, 9], что было подтверждено данными нескольких клинических исследований [10–13]. Частота объективных ответов анти-PD-1 и ан-ти-PD–L1 антител варьировала от 32%, при использовании во вторую и последующие линии, до 71,4%, при использовании в первую линию терапии, с показателями 6-месячной ВБП 40% [12] и 67% [10], соответственно, и ожидаемой 1-летней ВБП 30%, при использовании во вторую и последующие линии. На основании этих данных впервые в 2017 году было зарегистрировано анти-PD–L1 антитело (авелумаб) для лечения пациентов с метастатической и/или неоперабельной КМ. В данной статье мы представляем первые результаты применения авелумаба в России в рамках программы раннего доступа для лечения больных распространенной КМ.
Материалы и методы
В программу раннего доступа было включено 9 пациентов: в возрасте от 31 до 67 лет, мужчины/женщины = 5/4, с морфологически подтвержденным диагнозом метастатической или неоперабельной КМ, ранее получившие одну или более линий химиотерапии по поводу распространенной формы болезни [1 линия (n = 2), 2 линии (n = 6), 3 линии (n = 1)], ECOG статусом 0–2, наличием измеряемых очагов по критериям оценки RECIST 1.1, наличием подписанного информированного согласия на лечение препаратом авелумаб, который не зарегистрирован в РФ. Основные критерии исключения: неконтролируемые метастазы в головной мозг, ВИЧ инфекция, гепатит В или С, прием системных кортикостероидов в дозе более 10 мг/сут из расчета по преднизолону.
Режим терапии
Авелумаб в дозе 10 мг/кг вводился внутривенно в течение 60 минут после премедикации (димедрол 50 мг в/в, парацетамол 500–1000 мг внутрь) каждые 2 недели до прогрессирования заболевания или непереносимой токсичности. Для инфузии использовался фильтр 0,2 мкм. В случае достижения полного ответа (ПО) пациенты должны были получать терапию в течении 12 месяцев после подтверждения ответа, до прогрессирования заболевания или непереносимой токсичности. Максимальная длительность лечения могла составлять 24 месяца. Если у пациента с полным ответом регистрировалось прогрессирование заболевания после прекращения терапии авелумабом, допускалось возобновление терапии по усмотрению врача.
Результаты
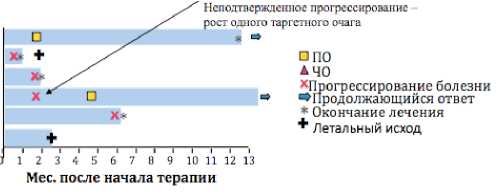
В период с октября 2017 по декабрь 2018 года в программу было включено 9 пациентов. Основные данные по больным приведены в таблице 1. На момент первичного анализа (январь 2019 года) 6 пациентов получили хотя бы одно введение аве-лумаба (рис.1), 3 больных не получали терапию (из них: 1 отзыв согласия, 1 летальный исход от ТЭЛА до начала терапии, 1 пациент ожидает ввоз препарата, включен в программу в декабре 2018 года). В настоящее время 1 пациент из 6 продолжает терапию авелумабом (рисунок 1). Эффективность терапии (при помощи КТ/ПЭТ-КТ всего тела каждые 2–3 месяца) была оценена у 4 пациентов из 6, и в результате достигнуто следующее: 2 — полных ответа (50%), 1 — стабилизация болезни (25%), 1 — прогрессирование болезни (25%). Таким образом, частота объективных ответов составила 50%, стабилизация болезни — 25% и прогрессирование — 25%. У пациентки № 4 полный ответ был достигнут после неподтвержденного прогрессирования болезни при первичной оценке (несмотря на увеличение одного таргет-ного очага, терапия была продолжена до последующей оценки, проведенной через 8 недель, при которой был зарегистрирован полный ответ). У пациентки № 6 со стабилизацией заболевания при продолжении терапии через 3 месяца было зарегистрировано прогрессирование болезни. Таким образом, прогрессирование заболевания наступило у 2 больных, один из которых в последующем получил одновременную химиолучевую терапию (иринотекан + цисплатин и лучевая терапия на область конгломерата паховых лимфоузлов, эффект — уменьшение опухолевого конгломерата при стабилизации заболевания), а другая пациентка получила последовательную химиолучевую терапию (6 курсов химиотерапии по схеме этопозид + карбоплатин с частичным ответом; в настоящее время продолжает лучевую терапию на область подвздошных лимфоузлов).
У 5 пациентов была произведена иммуногистохимическая оценка наличия или отсутствия полиомавируса в клетках Меркеля, а также рецепторов соматостатина 2 типа. На момент публикации оценка уровня экспрессии PD–L1 на опухолевых клетках находится в работе. Важно отметить, что по данным литературы полиомави-рус-негативные опухоли не экспрессируют PD–L1, однако это не всегда коррелировало с отсутствием ответа на терапию анти-PD1 и анти-PD–L1 антителами. Этот же факт мы отмечаем и среди наших клинических наблюдений: один полный ответ зарегистрирован у пациента с MCPyV-отрицательной опухолью, а стабилизация болезни, перешедшая в прогрессирование заболевания при последующей оценке на фоне терапии авелумабом, была зарегистрирована у пациентки с MCPyV-позитивной опухолью.
Безопасность
Оценка безопасности терапии проведена у всех 6 пациентов, получивших хотя бы одно введение авелумаба. В рамках программы раннего доступа не было зарегистрировано ни одно из ранее не описанных нежелательных явлений (НЯ). В процессе терапии наблюдались следующие НЯ, предположительно связанные с авелумабом: инфузионная реакция 1 степени (n = 1), кожная токсичность (эритематозная сыпь) 2 степени (n = 1), сухость кожи волосистой части головы 1 степени (n = 1), утомляемость 1 степени (n =1), повышение печеночных ферментов 1 степени (n = 1), повышение общего билирубина 2 степени (за счет непрямой фракции), нейропатическая боль в конечностях 1 степени (n = 2). Все нежелательные явления купировались в течение 2–4 недель от момента выявления. Отмены терапии в связи с непереносимостью не было.
Рисунок 1. Продолжительность терапии и ответа у пациентов, включенных в исследование.
Усиление интенсивности сыпи до 2 степени (см. рис. 3–5): эритематозная сыпь склонная к слиянию и шелушению на коже конечностей, главным образом, в области левой нижней конечности на фоне лимфостаза (после 9-и введений авелумаба).
Заключение
Терапия авелумабом представляет собой высокоэффективный вариант лечения больных неоперабельной и/или метастатической КМ при удовлетворительной переносимости терапии. Эффективность и безопасность этого препарата была продемонстрирована в крупных (для такой редкой орфанной болезни, как КМ) многоцентровых клинических исследованиях (см. табл. 2).
При этом другие варианты иммунотерапии (анти-PD1 антитела), согласно предварительным данным, могут быть не менее эффективны. В таблице 2 представлены сравнительные показатели эффективности анти-PD-1 и анти-PD–L1 антител в первую и последующие линии терапии распространенной КМ.
Дата 02.08.2018
Усиление интенсивности сыпи до 2 степени (см. рис. 3–5): эритематозная сыпь, склонная к слиянию и шелушению на коже конечностей, главным образом, в области левой нижней конечности на фоне лимфостаза (после 9-и введений авелумаба).
Дата 19.07.2018
Пример кожной токсичности 2 степени (см. рис.2).
Пациентка № 6, терапия авелумабом 10 мг/кг с марта 2018 по август 2018, эффект лечения — прогрессирование заболевания.
Рисунок 2.
Элемент сыпи на коже.
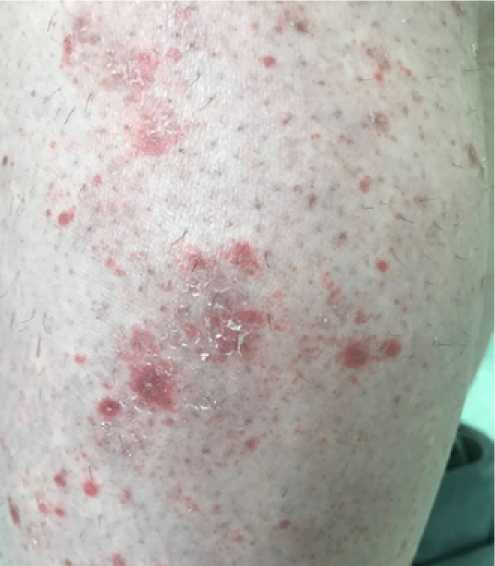
Рисунок 3.
Нижние конечности, вид сзади.
Рисунок 4.
Кисти, тыльная поверхность.
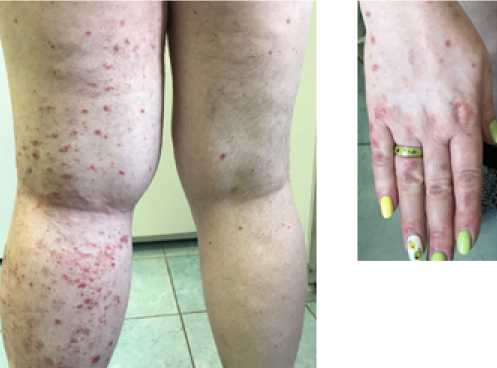
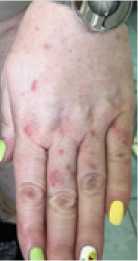
Рисунок 5.
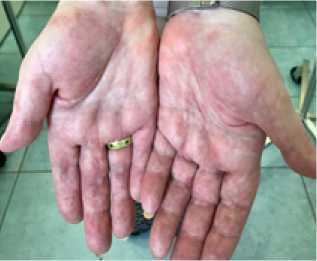
Эритема на коже ладоней.
В настоящей статье представлены первые результаты применения в России анти-PD–L1 антитела авелумаб в лечении пациентов с метастатической и/или местно-распространенной неоперабельной КМ.
Согласно литературе и нашим данным, во вторую и последующие линии терапии авелумаб менее эффективен, чем в первую линию, однако достигнутые ответы на лечение продолжительные, что впервые позволило контролировать это агрессивное заболевание в течение длительного времени.
Полученные результаты согласуются с ранее опубликованными данными. Большая часть пациентов получают пользу от применения иммунотерапии как в первую, так и в последующие линии лечения с очевидным преимуществом у тех больных, которые ранее не получали системную терапию. Поиск причин первичной и приобретенной резистентности к терапии, а также предиктивных критериев и факторов, предсказывающих успех терапии, требует дополнительных исследований.
Таблица 1. Характеристика пациентов, включенных в программу раннего доступа
|
Пациент |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Возраст, годы* |
63 |
31 |
57 |
56 |
54 |
50 |
59 |
67 |
62 |
|
Пол |
Мужчина |
Женщина |
Мужчина |
Женщина |
Мужчина |
Женщина |
Мужчина |
Мужчина |
Женщина |
|
Локализация первичного очага |
Голова и шея |
Голова и шея |
Лимфоузлы без ВПО |
Верхняя конечность |
Нижняя конечность |
Нижняя конечность |
Лимфоузлы без ВПО |
Голова и шея |
Нижняя конечность |
|
Дата установления диагноза мКМ |
Май 2017 |
Апрель 2017 |
Июнь 2017 |
Сентябрь 2017 |
Декабрь 2016 |
Июль 2015 |
Май 2018 |
Февраль 2018 |
Ноябрь 2017 |
|
Количество линий предшествующей терапии по поводу КМ |
2 |
2 |
2 |
2 |
2 |
1 |
1 |
3 |
2 |
|
Наличие висцеральных метастазов |
Есть |
Есть |
Нет |
Нет |
Есть |
Нет |
Есть |
Есть |
Нет |
|
ECOG статус |
0 |
1 |
2 |
0 |
Летальный исход от ТЭЛА до начала терапии |
0 |
1 |
2 |
1 |
|
ki67 |
80% |
70% |
НД |
60% |
95% |
Отзыв согласия |
Ожидает ввоз препарата |
||
|
SSTR2 |
0 |
0 |
НД |
2+ |
2+ |
2+ |
|||
|
MCPyV |
0 |
0 |
НД |
1+ |
3+ |
0 |
|||
|
Дата начала терапии авелумабом |
Декабрь 2017 |
Декабрь 2017 |
Декабрь 2017 |
Декабрь 2017 |
Март 2018 |
Октябрь 2018 |
|||
|
Наилучший ответ и его продолжительность, мес. |
ПО, 12+ мес. |
НО |
ПБ |
ПО, 9+ мес. |
СБ |
НО |
|||
|
Время до развития ответа |
3 мес. |
НД |
2,5 мес. |
5 мес. |
2 мес. |
НД |
|||
|
Продолжительность терапии |
12 мес. |
1 мес. |
2,5 мес. |
14+ мес. |
4 мес. |
2 мес. |
|||
|
Статус в настоящий момент |
В январе 2019 закончена терапия авелума-бом, наблюдение |
В феврале 2018, летальный исход, клинически прогрессирование |
В апреле 2018, летальный исход от прогрессирования заболевания |
В процессе терапии (2-й год) |
В августе 2018 закончена терапия авелу-мабом, переход на ХТ |
В январе 2019 летальный исход от ТЭЛА |
ВПО — выявленный первичный очаг; ПО — полный ответ; НО — не оценено; НД — нет данных; ПБ — прогрессирование болезни; СБ — стабилизация болезни; ТЭЛА — тромбоэмболия легочной артерии; SSTR2 — рецепторы соматостатина 2 типа; ki67 — индекс пролиферативной активности; MCPyV — полиомавирус клеток Меркеля; * — на момент установления диагноза.
Таблица 2. Данные непрямого сравнения анти-PD1 и анти-PD–L1 моноклональных антител в лечении метастатической и/или местно-распространенной неоперабельной КМ
|
Препарат |
Авелумаб [14] |
Авелумаб [13] |
Пембролизумаб [15] |
Ниволумаб [16] |
Ниволумаб [16] |
|
Фаза исследования |
II |
II |
II |
I/II |
I/II |
|
Линия терапии |
1 |
≥ 2 |
1 |
1 |
≥ 2 |
|
Количество пациентов |
39 включено, у 29 произведена оценка эффективности |
88 |
50 |
14 |
8 |
|
Период наблюдения |
≥3 мес. |
29,2 мес. |
14,9 мес. |
26 нед. |
|
|
ЧОО, n (%) |
18 (62,1%) (42,3–79,3) |
29 (33%) (23,3–43,8) |
28 (56%) |
10 (71%) (42–92) |
63% (25–92) |
|
ПО, n (%) |
4 (13,8%) |
10 (11,4%) |
12 (24%) |
3 (21%) |
0 |
|
ЧО, n (%) |
14 (48,3%) |
19 (21,6%) |
16 (32%) |
7 (50%) |
5 (63%) |
|
СБ, n (%) |
3 (10,3%) |
9 (10,2%) |
3 (21%) |
1 (13%) |
|
|
ПБ, n (%) |
7 (24,1%) |
32 (36,4%) |
1 (7%) |
2 (25%) |
|
|
НО, n (%) |
1 (3,4%) |
18 (20,5%) |
|
Препарат |
Авелумаб [14] |
Авелумаб [13] |
Пембролизумаб [15] |
Ниволумаб [16] |
Ниволумаб [16] |
|
Медиана продолжительности ответа (95 % ДИ), мес. |
НД (4,0–НД) |
НД (2,8–31,8 мес.; 95%ДИ 18,0–НД) |
НД (5,9–34,5+) |
НД (0,0–5,6) |
|
|
Медиана ВБП, мес. |
9,1 (1,9–НД) |
2,7 (1,4–6,9) 24 мес. ВБП 26% |
16,8 (4,6–НД) |
НД 3 мес. ВБП 82% |
|
|
Медиана ОВ, мес. |
12,6 мес. |
НД, 24 мес. ОВ — 68,7% |
НД 3 мес. ОВ 92% |
||
НД — не достигнута. Авелумаб — разработан Merck KGaA, США; ниволумаб — разработан Bristol-Myers Squibb, США; пембролизумаб — разработан Merck, США.
Список литературы Авелумаб в лечении пациентов с карциномой Меркеля: первые результаты программы раннего доступа в России
- van der Zwan JM, Trama A, Otter R, Larranaga N, Tavilla A, Marcos-Gragera R, et al. Rare neuroendocrine tumours: results of the surveillance of rare cancers in Europe project. Eur J Cancer 2013 Jul;49 (11):2565e78.
- Paulson, K. G., Park, S. Y., Vandeven, N. A., Lachance, K., Thomas, H., Chapuis, A. G., … Nghiem, P. (2018). Merkel cell carcinoma: Current US incidence and projected increases based on changing demographics. Journal of the American Academy of Dermatology, 78 (3), 457-463.e2. doi:10.1016/j.jaad.2017.10.028
- Youlden DR, Soyer HP, Youl PH, Fritschi L, Baade PD. Incidence and survival for Merkel cell carcinoma in Queensland, Australia, 1993e2010. JAMA Dermatol 2014 Aug;150 (8): 864e72.
- Schadendorf D, Lebbe C, Zur Hausen A, Avril MF, Hariharan S, Bharmal M, Becker JC. Merkel cell carcinoma: epidemiology, prognosis, therapy and unmet medical needs. Eur J Cancer. 2017;71:53-69. doi: 10.1016/j.ejca.2016.10.022.
- Nghiem P, Kaufman HL, Bharmal M, Mahnke L, Phatak H, Becker JC. Systematic literature review of efficacy, safety and tolerability outcomes of chemotherapy regimens in patients with metastatic Merkel cell carcinoma. Future Oncol. 2017;13 (14): 1263-1279.
- Cowey CL, Mahnke L, Espirito J, Helwig C, Oksen D, Bharmal M. Real-world treatment outcomes in patients with metastatic Merkel cell carcinoma treated with chemotherapy in the USA. Future Oncol. 2017;13 (19):1699-1710.
- Iyer JG, Blom A, Doumani R, et al. Response rates and durability of chemotherapy among 62 patients with metastatic Merkel cell carcinoma. Cancer Med. 2016;5 (9):2294-2301.
- Lipson EJ, Vincent JG, Loyo M, et al. PD-L1 expression in the Merkel cell carcinoma microenvironment: association with inflammation, Merkel cell polyomavirus and overall survival. Cancer Immunol Res. 2013;1 (1):54-63.
- Schadendorf D, Nghiem P, Bhatia S, et al. Immune evasion mechanisms and immune checkpoint inhibition in advanced Merkel cell carcinoma. Oncoimmunology.2017;6 (10):e1 338 237.
- Nghiem PT, Bhatia S, Lipson EJ, et al. PD-1 blockade with pembrolizumab in advanced Merkel-cell carcinoma. N Engl J Med. 2016;374 (26): 2542-2552.
- Topalian SL, Bhatia S, Hollebecque A, et al. Non-comparative, open-label, multiple cohort, phase 1/2 study to evaluate nivolumab (NIVO) in patients with virus-associated tumors (CheckMate 358): efficacy and safety in Merkel cell carcinoma (MCC). Cancer Res. 2017;77 (13 suppl): Abstract CT074.
- Kaufman HL, Russell J, Hamid O, et al. Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial. Lancet Oncol. 2016;17 (10):1374-1385.
- Kaufman HL, Russell JS, Hamid O, et al. Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after_1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer. 2018;6:7.
- D'Angelo SP, Russell J, Lebbé C, et al. Efficacy and safety of first-line avelumab treatment in patients with stage IV metastatic Merkel cell carcinoma: a preplanned interim analysis of a clinical trial. JAMA Oncol. 2018;4 (9):e180 077. 10.1001/jamaoncol.2018.0077
- DOI: :10.1001/jamaoncol.2018.0077
- Nghiem PT, Bhatia S, Lipson EJ, et al. et al. Durable Tumor Regression and Overall Survival in Patients With Advanced Merkel Cell Carcinoma Receiving Pembrolizumab as First-Line Therapy. J Clin Oncol. 2019 Feb 6: JCO1 801 896. 10.1200/JCO.18.01 896
- DOI: :10.1200/JCO.18.01896
- Topalian SL, et al. CT074: non-comparative, open-label, multiple cohort, phase 1/2 study to evaluate nivolumab (NIVO) in patients with virus-associated tumors (CheckMate 358): Efficacy and safety in Merkel cell carcinoma (MCC). Presented at: Annual Meeting of American Association for Cancer Research; April 1-5, 2017; Washington, DC.


