B-эндорфин и селективные агонисты опиатных рецепторов в регуляции пролиферативного ответа лимфоцитов. Роль блокады опиатных рецепторов
Автор: Гейн С.В., Баева Т.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 5, 2007 года.
Бесплатный доступ
Установлено, что опиоидный пептид B-эндорфин, неселективный лиганд ¥-, ¥-опиатных рецепторов, а также синтетические аналоги энкефалинов DAGO (селективный лиганд ¥- опиатных рецепторов) и DADLE (селективный ¥-лиганд) в системе in vitro оказывали стимулирующее влияние на функциональную активность лимфоцитов в присутствии 2,5 мкг/мл фигогемагглютинина (ФГА). Их эффект усиливался при внесении в культуры неселективного антагониста ¥-, ¥-опиатных рецепторов налоксона гидрохлорида. Селективный ¥-блокатор налтриндола гидрохлорид отменял эффекты ??-эндорфина и селективного ¥-агониста DAGO.
Короткий адрес: https://sciup.org/147204406
IDR: 147204406 | УДК: 612-017.1.018
Текст научной статьи B-эндорфин и селективные агонисты опиатных рецепторов в регуляции пролиферативного ответа лимфоцитов. Роль блокады опиатных рецепторов
Опиоидные пептиды являются одними из важнейших посредников во взаимодействии нервной и иммунной систем и играют ключевую роль в процессах адаптации организмов к меняющимся условиям окружающей среды (Корнева и др., 1988; Madden et al., 1995; Bidlack, 2000; Voccarino et al., 2000). Ведущая роль в процессе формирования адаптации со стороны иммунной системы принадлежит факторам, участвующим в запуске процессов пролиферации и дифференцировки лимфоцитов, непосредственно выполняющих эффекторные функции. Несмотря на то, что изучению влияния опиоидных пептидов на пролиферативный ответ уделено достаточно много внимания (Зозуля и др., 1990; Panerai et al., 1997; Sacerdote, 2003), ряд аспектов данной проблемы остается нерешенным. В частности, остается открытым вопрос о механизмах реализации эффектов β-эндорфина, наиболее активного представителя данной группы соединений, способного связываться одновременно с несколькими типами опиатных рецепторов. Предполагается возможность кооперации опиатных рецепторов в проведении сигналов внутрь клетки (Усенко и др., 2002; Sharp et al., 1998). Цель работы – оценить в системе in vitro влияние в -эндорфина на пролиферативный ответ лимфоцитов в условиях блокады опиатных рецепторов неселективным и селективным антагонистами, сравнить эффекты в -эндорфина с эффектами селективных ц - и 5 -агонистов DAGO и DADLE соответственно.
Материалы и методы
Лейкоциты периферической крови 10 здоровых мужчин-добровольцев в возрасте от 20 до 33 лет культивировали с фитогемагглютинином Р (ФГА «Sigma», США; 2.5 мкг/мл) в 96-луночных круглодонных планшетах. Каждая культура содержала 2*105 клеток в 0.2 мл полной питательной среды, которую готовили на основе среды 199 с добавлением HEPES 10 mM («Sigma», США), L-глутамина 2 mM («Sigma», США), 100 мкг/мл гентамицина и 10% аутоплазмы. Культивирование осуществляли во влажной атмосфере с 5% СО 2 при 37˚С в течение 72 ч. За 18 ч до окончания культивирования в каждую лунку вносили по 2 мкКи 3H-тимидина («Изотоп», Санкт-Петербург) в объеме 10 мкл. Содержимое каждой лунки последовательно осаждали на фильтровальную бумагу (Фриммель, 1987) при давлении вакуумного насоса 0.5–1.0 атм. Затем фильтры промывали последовательно 5 мл 0.85% NaCl, 5 мл охлажденной до 4˚С 5% трихлоруксусной кислотой и 5 мл 0.85% NaCl. Радиоактивность проб определяли на жидкостном сцинтилляционном счетчике «Guardian» (Wallac, Финляндия). в -эндорфин («Sigma», США) использовали в концентрации 10 -7 М; [ d-Ala2,N-Me-Phe4,Gly5-ol ] -энкефалин (DAGO) («Sigma», США) - 10 -8 М; [ d -Ala 2 ,d-Leu5 ] -энкефалин (DADLE) («Sigma», США) – 10-7 М; неселективный антагонист опиатных рецепторов налоксона гидрохлорид («DuPont», США) – 10-6, 10-8, 10-10М; селективный антагонист δ-опиатных рецепторов налтриндола гидрохлорид («ISN», США)-10-6,
10-8, 10-10М. Выбор концентраций β -эндорфина, DAGO, DADLE и ФГА основывался на исследованиях, проведенных ранее (Гейн и др., 2003; Гейн и др. 2006).
Статистический анализ результатов проводили с помощью парного t-критерия Стьюдента.
Результаты и их обсуждение
Как представлено на рис. 1, в присутствии ФГА 2,5 мкг/мл β -эндорфин в концентрации 10-7М статистически значимо усиливал пролиферативный ответ по сравнению с контролем. При совместном внесении в клеточные культуры β -эндорфина и неселективного блокатора δ-, μ-опиатных рецепторов налоксона гидрохлорида наблюдалось усиле-
Значения, полученные при совместном внесении в культуры селективного δ -антагониста на-лтриндола и β-эндорфина, статистически значимо не отличались от контрольных цифр, что может свидетельствовать об отмене стимулирующего эффекта опиоида δ-блокатором. Сам налтриндол не оказывал влияния на пролиферативную активность лимфоцитов ни в одной из исследуемых концентраций.
Данные о влиянии DAGO в условиях блокады опиатных рецепторов на выраженность РБТЛ представлены на рис. 2. В культурах с ФГА 2,5 мкг/мл DAGO оказывал самостоятельный статистически значимый стимулирующий эффект на пролиферативный ответ по сравнению с контролем. Как и в случае с β -эндорфином, на фоне бло-
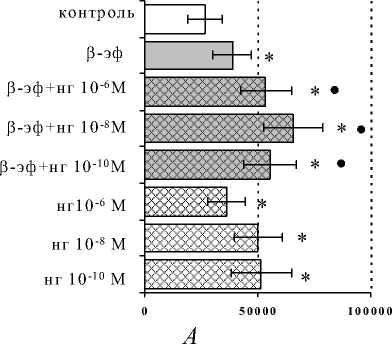
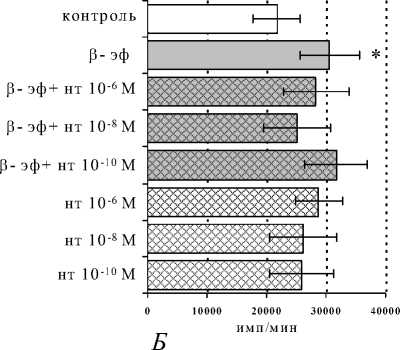
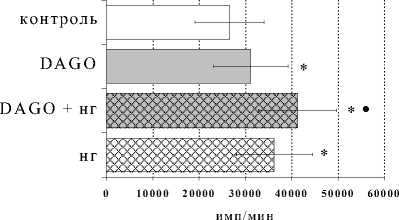
Рис. 1. Влияние β -эндорфина ( β -эф) на пролиферативный ответ лимфоцитов в присутствии ФГА 2.5 мкг/мл в условиях блокады опиатных рецепторов налоксона гидрохлоридом (НГ) ( А ) и на-лтриндола гидрохлоридом (НТ) ( Б ). Здесь и на рис. 2, 3: по оси абсцисс – интенсивность пролиферации (имп/мин); * – р<0,05 по сравнению с контролем; • – р<0.05 по сравнению с пептидом
А
Б
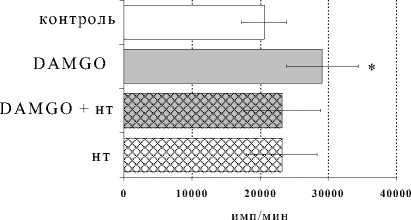
Рис. 2. Влияние DAGO на пролиферативный ответ лимфоцитов в культурах с ФГА 2.5 мкг/мл в условиях блокады опиатных рецепторов налоксона гидрохлоридом (НГ) ( А ) и налтриндола гидрохлоридом (НТ) ( Б )
ние пролиферации как по сравнению с контролем, так и по сравнению с эффектом изолированного внесения β -эндорфина. Этот феномен имел место при всех используемых нами концентрациях налоксона. Неожиданным оказалось наличие у налоксона самостоятельного стимулирующего влияния на пролиферативную реакцию, чего не наблюдалось у контрольных культур.
кады опиатных рецепторов налоксоном наблюдалось усиление пролиферативной активности лимфоцитов как по сравнению с таковой у контрольных культур, так и у культур при изолированном внесении DAGO. В данной серии экспериментов мы подтвердили самостоятельный стимулирующий эффект налоксона в концентрации 10-6М на пролиферативный ответ лимфоцитов.
В присутствии налтриндола была получена картина, аналогичная таковой в культурах с β-эндорфином. Внесение δ-селективного антагониста в культуры с DAGO отменяло стимулирующий эффект опиоидного пептида. Таким образом, селективный агонист µ-рецепторов оказывал эффект, схожий по своему характеру с эффектом β-эндорфина, при этом для проявления эффектов как β-эндорфина, так и селективного μ-агониста оказалось необходимым присутствие на клетках δ- опиатных рецепторов.
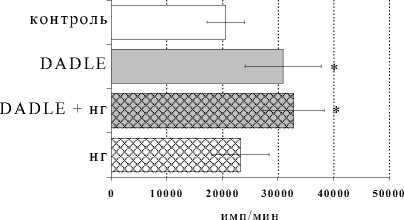
Сходное по характеру, но более слабое по силе воздействие на пролиферативную реакцию было выявлено у синтетического δ-агониста DADLE. Как показано на рис. 3, блокада опиатных рецепторов налоксоном совместно с δ-агонистом в культурах с ФГА 2.5 мкг/мл также значимо усиливала эффект самого агониста. В то же время внесение в культуры с DADLE δ-антагониста не изменяло выраженности пролиферативного ответа лимфоцитов по сравнению с таковой у культур, в которые вносился лишь DADLE, что еще раз подтверждает способ- ность антагонистов опиатных рецепторов при опре-
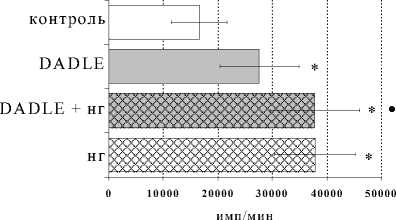
Оценка зависимости влияния β -эндорфина, DAGO и DADLE от блокады опиатных рецепторов показала усиление стимулирующих эффектов исследуемых опиоидных пептидов в присутствии налоксона гидрохлорида. С одной стороны, данный феномен может быть связан с наличием у налоксона самостоятельного стимулирующего эффекта на процесс пролиферации лимфоцитов. В работах некоторых авторов ранее уже были отмечены самостоятельные стимулирующие эффекты блокаторов опиатных рeцепторов в системе in vivo, однако авторы связывали их с отменой угнетающих эффектов эндогенной опиоидной системы (Manfredi et al., 1993). В нашем случае, вероятнее всего, имеет место суммация эффектов β-эндорфина и налоксона, возможная благодаря наличию в пределах µ -опиатных рецепторов различных доменов связывания для опиатных алкалоидов, β-эндорфина и других опиоидных пептидов, в частности, энкефалинов и их аналогов (Law, 1999). По данным литературы, наибольшая аффинность (специфичность) наблюдается у налоксона именно по отношению к μ-опиатному рецептору (Сергеев
А
Б
Рис. 3. Влияние DADLE на пролиферативный ответ лимфоцитов в культурах с ФГА 2.5 мкг/мл в условиях блокады опиатных рецепторов налоксона гидрохлоридом (НГ) ( А ) и налтриндола гидрохлоридом (НТ) ( Б )
деленных условиях выступать в роли агонистов.
Ранее в литературе неоднократно описывалась возможность как супрессивного, так и активирующего влияния β -эндорфина на выраженность пролиферативного ответа лимфоцитов (Зозуля и др., 1986, 1987, 1990; Manfredi et al., 1993; Гейн и др., 2003). На наш взгляд, стимулирующая направленность эффекта β -эндорфина определяется прежде всего его способностью оказывать как прямое (через стимуляцию µ -, δ -, ε -опиатных рецепторов), так и опосредованное воздействие. Последнее может включать в себя активацию синтеза отдельных цитокинов: интерлейкина 1 (ИЛ-1), интерферона γ (ИФН-γ), интерлейкина 2 (ИЛ-2) (Brown et al., 1986; Bessler et al., 1990; Shahabi et al., 1995), возможное взаимодействие с рецептором к ИЛ-2 (Carr D.J. et al., 1991; Jiang et al., 2000). Определенную роль в воздействии β -эндорфина на клетки иммунной системы могут играть продукты его протеолиза, каждый из которых может обладать собственной иммуномодулирующей активностью (Захарова и др., 2001).
и др., 1987; Sacerdote, 2003). По другим данным, его аффинность приблизительно одинакова в отношении как µ -, так и δ -опиатных рецепторов (Law, 1999). Аналогичными свойствами обладает β -эндорфин (Зозуля и др., 1990).
В последние годы появилось предположение, что подтипов опиатных рецепторов с физикохимической точки зрения не существует, а есть явления гомо-, гетеро- и олигомеризации δ- и μ-опиатных рецепторов (Law, 1999). В пользу этой гипотезы свидетельствуют данные, полученные нами при совместном внесении в культуры β-эндорфина и налтриндола гидрохлорида.
Несмотря на сходство эффектов DAGO и β-эндорфина, действие последнего было выражено значительно сильнее. Различие в выраженности эффектов, на наш взгляд, может быть связано с наличием разных сайтов связывания этих пептидов в пределах μ-опиатного рецептора, а также со способностью β -эндорфина взаимодействовать дополнительно с δ - и ε -рецепторами.
Таким образом, полученные в настоящей работе данные указывают на то, что опиоидергическая регуляция пролиферативной активности является сложным многофакторным процессом, в котором как агонисты, так и антагонисты опиатных рецепторов способны проявлять самостоятельные, независимые друг от друга эффекты.
Работа выполнена при поддержке программы Президиума РАН № 10 «Физико-химическая биология» (академик Г.П. Георгиев) – Грант «Молекулярные и клеточные механизмы нейроэндокринной регуляции функций иммунной системы при стрессе».
Список литературы B-эндорфин и селективные агонисты опиатных рецепторов в регуляции пролиферативного ответа лимфоцитов. Роль блокады опиатных рецепторов
- Гейн С.В., Баева Т.А., Гейн О.Н. и др. Роль моноцитов в реализации эффектов ??-эндорфина и селективных агонистов ??-и ??-опиатных рецепторов на пролиферативную активность лимфоцитов периферической крови//Физиология человека. 2006. Т. 32. ¢ 3. С. 111-116.
- Гейн С.В., Симоненко Т.А., Черешнев В.А. Влияние ??-эндорфина и селективного агониста ??-опиатных рецепторов DAGO на пролиферативную активность лимфоцитов//Докл. АН. 2003. Т. 391. ¢ 1. С. 1-3.
- Захарова Л.А., Василенко А.М. Опиоидная система в сочетанной регуляции боли и иммунитета//Изв. АН. Сер. биол. 2001. ¢ 3. 339 с.
- Зозуля А.А., Воронкова Т.Л., Пацакова Э. и др. Значение лигандов опиатных рецепторов в регуляции пролиферативной активности лимфоцитов//Фармакол. токсикол. 1987. ¢ 3. С. 58-59.
- Зозуля А.А., Пацакова Э., Кост Н.В. и др. Исследование влияния ??-эндорфина и миелопептидов на уровень цАМФ и пролиферацию лимфоцитов in vitro//Бюл. эксперим. биол. и мед. 1986. Т. 102, ¢ 12. С. 731-733.
- Зозуля А.А., Пшеничкин С.Ф. Опиоидные рецепторы и их лиганды//Итоги науки и техн. ВИНИТИ. Сер. Иммунология. 1990. ¢ 25. С. 48-120.
- Корнева Е.А., Шхинек Э.К. Гормоны и иммунная система. М., 1988. 251 с.
- Сергеев П.В., Шимановский Н.Л. Рецепторы физиологически активных веществ. М.: Медицина, 1987. 400 с.
- Усенко А.Б., Емельянова Т.Г., Мясоедов Н.Ф. Дерморфины -природные опиоиды с уникальной первичной структурой, определяющей специфику их биологической активности//Физиология животных. 2002. ¢ 2. С. 192-204.
- Фриммель Г. Иммунологические методы. М.: Медицина, 1987. 472 с.
- Bessler H., Sztein M.B., Serrate S.A. Beta-endorphin modulation of IL-1-induced IL-2 production//Immunopharmacol. 1990. Vol. 19. ¢ 1. P. 5-14.
- Bidlack J.M. Detection and function of opioid receptors on cells from the immune system//Clin. Diagnos. Lab. Immunol. 2000. Vol. 7, ¢ 5. P. 719-723.
- Brown S.L., Van Epps D.E. Opioid peptides modulate production of interferon gamma by human mononuclear cells//Cell Immunol. 1986. Vol. 103, ¢ 1. P. 19-26.
- Carr D.J. The role of endogenous opioids and their receptors in the immune system//Proc. Soc. Exp. Biol. Med. 1991. Vol. 198, ¢ 2. P. 710-720.
- Jiang C.L., Xu D., Lu C.L. et al. Interleukin-2: structural and biological relatedness to opioid peptides//Neuroimmunomodul. 2000. Vol. 8, ¢ 1. P. 20-24.
- Law P.Y., Loh H.H. Regulation of opioid receptor activities//J. Pharmacol. Experim. Therap. 1999. Vol. 289. ¢ 2. P. 607-624.
- Madden K.S., Felten D.L. Experimental basis for neural-immune interactions//Physiological Rev. 1995. Vol. 75, ¢ 1. С. 77-106.
- Manfredi B., Sacerdote P., Bianchi M. et al. Evidence for an opioid inhibitory effect on T cell proliferation//J. Neuroimmunol. 1993. Vol. 44, ¢ 1. P. 43-48.
- Panerai A.E., Sacerdote P. Beta-endorphin in the immune system: A role at last//Trends Immunol. Today. 1997. Vol. 18, ¢ 7. P. 317-319.
- Sacerdote P. Effect of in vitro and in vivo opioids on the production of IL-12 and IL-10 by murine macrophages//Ann. N.Y. Acad. Sci. 2003. Vol. 992. P. 129-140.
- Shahabi N.A., Sharp B.M. Antiproliferative effects of delta opioids on highly purified CD4+ and CD8+ murine T cells//J. Pharmacol. Exp. Ther. 1995. Vol. 273. ¢ 3. P. 1105-1113.
- Sharp B.M., Roy S., Bidlack J.M. Evidence for opioid receptors on cells involved in host defense and the immune system//J. Neuroimmunol. 1998. Vol. 83. P. 45-56.
- Voccarino A.L., Kastin A.J. Endogenous opiates: 1998//Peptides. 2000. Vol. 21. P. 1975-2034.


