b-казеин Bos taurus: структура белка, полиморфизм гена, влияние на желудочно-кишечный тракт человека (обзор)
Автор: Токарчук Т.А., Кожевникова И.С., Кудрина М.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 4 т.58, 2023 года.
Бесплатный доступ
В современном мире высококачественные продукты питания играют важную роль в здоровом образе жизни человека. Коровье молоко и производимые из него продукты содержат все необходимые питательные вещества. Основные компоненты молока - это вода, жир, белок, лактоза, минеральные вещества, витамины (P.C. Wynn с соавт., 2013). С появлением на рынке молока А2, которое обеспечивает снижение симптомов непереносимости лактозы и обладает хорошей усвояемостью, спрос населения на этот продукт начал расти. Молоко А2 получают от коров - носителей генотипа А2 по β-казеину. В коровьем молоке в среднем содержится 3,5 % белка (P. Feng с соавт., 2020). Казеин - наиболее важный белковый компонент молока, который составляет в нем около 80 % от общего количества белка. Существует четыре основных казеиновых фракции - as1, as2, β и κ. Большую часть (35 %) от всего казеина составляет β-казеин. β-Казеин представляет собой цепочку из 209 аминокислотных остатков, из которых 16,7 % приходится на пролин, равномерно распределенный по полипептиду, что ограничивает образование a-спирали (S. Pattanayak, 2013). Более 95 % казеина в молоке находится в мицеллярной форме. Ген β-казеина имеет 13 аллельных вариантов, среди которых наиболее изучены типы А1 и А2, различающиеся последовательностью аминокислот в первичной структуре β-казеина. При употреблении в пищу коровьего молока А1 и А2 β-казеины расщепляются в желудочно-кишечном тракте человека с образованием разных биоактивных пептидов. В случае аллеля А1 образуется пептид, состоящий из семи аминокислотных остатков - β-казоморфин-7. Содержание этого пептида в 4 раза выше в молоке А1, чем в молоке А2. При употреблении молока, содержащего β-казеин типа А1, через 12 ч может наблюдаться вздутие живота, боли, метеоризм, тяжесть в желудке, изменение частоты и консистенции стула, в некоторых случаях - симптомы целиакии. Потребление молока, содержащего А1 тип β-казеина, ассоциируется со значительно более длительным временем транзита через желудочно-кишечный тракт (на 6,3 ч дольше), воспалением тонкой кишки и слизистой оболочки желудка по сравнению с потреблением молока, содержащего А1 тип β-казеина. У людей с непереносимостью лактозы наблюдаются неблагоприятные желудочно-кишечные симптомы после употребления молока, которые могут быть связаны с присутствием именно β-казеина A1, а не с самой лактозой (H. Brüssow, 2013; D. Hu с соавт., 2014). В отличие от варианта А1, бета-казеин А2 в 2 раза увеличивает естественную выработку одного из самых важных антиоксидантов организма человека - глутатиона.
Казеин, β-казеин, молоко а1, молоко а2, коровье молоко, белки молока
Короткий адрес: https://sciup.org/142239840
IDR: 142239840 | УДК: 636.2.034:637.045:577.112 | DOI: 10.15389/agrobiology.2023.4.598rus
Текст обзорной статьи b-казеин Bos taurus: структура белка, полиморфизм гена, влияние на желудочно-кишечный тракт человека (обзор)
Коровье молоко и молочные продукты — важная часть традиционного рациона питания людей во многих странах мира. Разнообразие молочных продуктов обусловлено химическим составом молока, основными компонентами которого служат вода, жир, белок, лактоза, минеральные вещества, витамины (1).
В современном мире важную роль играют профилактика заболеваний и здоровый образ жизни, в связи с чем сельскохозяйственные производители заинтересованы в выпуске высококачественной продукции (2-4). С появлением в 2015 году на рынке США молока А2, которое обеспечивает снижение симптомов непереносимости лактозы и обладает хорошей усвояемостью, спрос населения на этот продукт начал расти. Молоко А2 получают от коров — носителей генотипа А2 по β -казеину (5, 6).
В настоящее время методы молекулярной генетики позволяют выявлять гены, которые контролируют те или иные полезные признаки сельскохозяйственных животных (7-9). Значительный интерес для популяци- онно-генетических исследований представляет изучение полиморфизма генов белков молока, в частности β-казеина.
Целью представленного обзора было обобщение новых данных о β -казеине, содержащемся в коровьем молоке, которые были получены за последние несколько лет с появлением возможностей более глубокого изучения как биохимических свойств молока и молочных продуктов, так и генетических особенностей животных.
Усвояемость молока зависит от его белкового состава. Коровье молоко содержит в среднем 3,5 % белка (10, 11). Белковый состав молока в значительной степени влияет на пищевую ценность и в комплексе со всеми составными компонентами определяет его технологические свойства (10). Белки, входящие в состав молока, имеют сложный состав, разнообразны по строению, физико-химическим свойствам и биологическим функциям. Выделяют три группы белков: казеины, сывороточные белки и белки оболочек жировых шариков (11).
Казеин представляет собой группу фосфопротеинов и составляет примерно 80 % белка в коровьем молоке. Молекулярная масса фракции казеина — 19000-25000 Да (12-14). Гены казеина крупного рогатого скота расположены на хромосоме 6q31-33 (15-17). Существует четыре основных казеиновых фракции: α s1, α s2, β и κ , из которых 15-18 % приходится на α s1, 8-11 % — на α s2, 25-35 % — на β , 18-15 % — на κ (18-20). То есть наиболее распространен β -казеин (21).
β -Казеин и его структура. Бета-казеин — это белок, на долю которого приходится от 30 до 35 % всех молочных белков (15). Его молекулы наиболее гидрофобны, они содержат большое количество пролина. В молекуле β -казеина имеется отрицательно заряженная гидрофильная область на участке от 1 до 43 а.о. и гидрофобный сегмент с высоким содержанием пролина на участке от 44 до 209 а.о. Это обусловливает сходство β -казеина со строением поверхностно-активных веществ. Растворимость β -казеина в воде лучше, чем у остальных казеинов, особенно при низких температурах (22-24).
β -Казеин — амфифильный фосфопротеин с изоэлектрической точкой рН 4,8-5,1. Он имеет сильно гидрофильный отрицательно заряженный N-концевой участок и гидрофобный С-концевой участок (25-27). От α -ка-зеина он отличается выраженной зависимостью от температуры, а также температурной зависимостью его растворимости в присутствии ионов кальция. β -Казеин более гидрофобен, чем α - или κ -казеин. Он содержит пять остатков фосфосерина в гидрофильной области, что придает ему суммарный отрицательный заряд при нейтральном pH молока (26, 28).
β -Казеин составляет цепочка из 209 аминокислотных остатков, из которых 16,7 % приходится на пролин, равномерно распределенный по полипептиду, что ограничивает образование α -спирали.
Более 95 % казеина в молоке находится в мицеллярной форме. Мицеллы казеина — близкие к сферической форме частицы размером от 30 до 300 нм. Каждая мицелла содержит от нескольких тысяч до сотен тысяч молекул всех типов казеинов. Свойства и химический состав мицелл обеспечивают их высокую устойчивость и стабильность в условиях отсутствия третичной структуры белка (29, 30).
Структура мицеллы казеина окончательно не установлена. Предложены два типа модели мицеллы: каркасная и субмицеллярная. Каркасная модель представляет непрерывную трехмерную сетку свернутых полипеп-тидных цепей αs1-казеина, с которыми посредством мицеллярного фосфата кальция связывается æ-казеин; β-казеин удерживается на каркасе слабыми гидрофобными связями, может легко покидать мицеллу и снова в нее входить. Согласно субмицеллярной модели, мицеллы составлены из сотен дискретных частиц — субмицелл диаметром 10-20 нм, в которых молекулы казеинов гидрофобно связаны друг с другом. Существуют два типа субмицелл — F2 и F3. Субмицеллы F2 состоят из αs1- и æ-казеина, субмицеллы F3 — из а- и в-казеинов. Субмицеллы удерживаются в составе мицелл главным образом при участии коллоидного фосфата кальция (рис. 1).
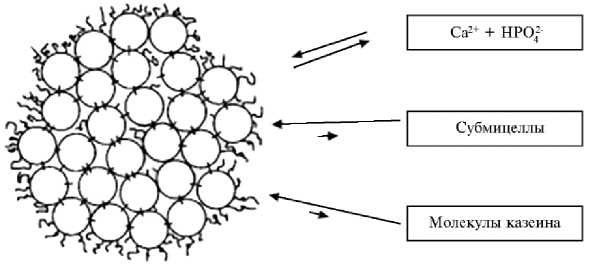
Рис. 1. Модель мицеллы в-казеина, содержащегося в коровьем молоке. Состоит из сферических субмицелл, связанных друг с другом фосфатом кальция (29, 30) .
Образование субмицелл в -казеина носит обратимый характер, на их стабильность влияют температура, концентрация соли и рН. Субмицеллы в -казеина более стабильны, чем мицеллы низкомолекулярных поверхностноактивных веществ, аналогичные мицеллам диблок-сополимеров (29-31).
Молекулы в -казеина склонны к самоассоциации в растворе из-за большой гидрофобной части в их структуре. Они остаются в виде мономеров при низких температурах (до 5 ° C) при концентрациях выше критической концентрации мицеллообразования, а при повышении температуры самоассоциируются за счет гидрофобных взаимодействий в ядре сферического агрегата, оставляя гидрофильное внешнее покрытие (32). Степень полимеризации молекулы в -казеина напрямую зависит от температуры (28, 33). Что касается гидрофильной области, которая дает высокую плотность отрицательного заряда, то в -казеины способны прочно связываться с двухвалентными ионами, особенно с Ca 2+ , через фосфосерин, аспарагиновую кислоту, глутаминовую кислоту и свободные карбоксильные группы посредством ионных взаимодействий. Добавление CaCl 2 и повышение температуры приводят к образованию крупных агрегатов в -казеина, связанных двухвалентными мостиками, установленными с остаточными группами фосфосерина, что является обратимой реакцией при снижении температуры (31, 34).
Исследования, проведенные различными методами (спектроскопия кругового дихроизма и инфракрасная спектроскопия с преобразованием Фурье) показали конформационное изменение в структуре в -казеина, которое создает более гидрофобное окружение. Показано, что аминокислоты, расположенные на конце С-концевого участка, обеспечивают гидрофобную среду, необходимую для самоассоциации белка и образования мицеллярных агрегатов (30-32).
Самоассоциация в-казеина мицеллоподобная. Как ионная сила, так и температура увеличивают количество присутствующего полимера, то есть повышают константу ассоциации и степень ассоциации (31). Число мономерных составляющих белков в этих мицеллоподобных структурах — почти сферических полимерах колеблется от 15 при ионной силе 0,1 моль/л-1 (pH 7 и 20 °C) до 52 при 0,110 моль/л-1 (pH 6,7 и 37 °C). При этом структуры, содержащие непосредственно β-казеин, находятся в расплавленном глобулообразном состоянии (29, 32). Субмицеллы с этими свойствами использовались для получения инкапсулятов терапевтических гидрофобных молекул. β-Казеин — наиболее активный из всех молочных белков, он первым из казеинов позиционируется на поверхности раздела масло—вода, присутствие фосфосерина в структуре придает толщину и стерическую стабильность адсорбированному слою, окружающему молочный белок. β-Казеин служит предшественником пептидов с различной биологической активностью, малых пептидов с антигипертензивными свойствами (31, 35).
Полиморфизм в - казеина. Выявлено 13 различных вариантов в -казеина в коровьем молоке, известен перечень генетических вариантов этого белка — А1, А2, А3, В, С, D, E, F, H1, H2, I и G (36, 37). Генетические варианты в -казеина определяют с помощью электрофореза, используя для разделения кислые или щелочные условия (38-40). Вариант А можно отличить от В, С и D с помощью электрофореза в щелочных условиях, варианты А между собой различимы только в кислых условиях (34, 41, 42). В селекции важное значение имеет выявление связей между генотипами генов белков молока и признаками продуктивности коров. Так, генетический вариант в -казеина В ассоциирован с повышенным содержанием жира и казеина в молоке, вариант А — с повышенным удоем (43-45).
1 1020
H-Arg-Glu-Leu-Glu-Glu-Leu-Asn-Val-Pro-Gly-Glu-Ile-Val-Glu-SeP-Leu-SeP-SeP-SeP-Glu-
21 | 3040
GLu-Ser-Ile-Thr-Arg-Ile-Asn-Lys-Lys-Ile-Glu-Lys-Phe-Gln-SeP-Glu-Glu-Gln-Gln-Gln-41 $060
Thr-61 u-Asp -G1 u- Leu -Gin-Asp-Ly s -He -Hi s -Fr о - Phe -Ala -G1 n-Thr- Gln-Se r-Leu-Vai- Tyr -61 7080
Pro-Phe-Pro-Gly-Pro-Ile-Pro-Asn-Ser-Leu-Pro-Gln-Asn-Ile-Pro-Pro-Leu-Thr -Gln-Thr-81 90100
Pro-Vai-Vai-Vai-Pro-Pro-Phe-Leu -Gin-Pro -Glu-Val-Met-Gly-Vai-Ser-Lys-Vai-Lys-Glu-101 | I 110120
ALa-Met-Ala-Pro-Lys-His-Lys-Glu-Met-Pro-Phe-Pro-Lys-Tyr-Pro-Val-Glu-Pro-Phe-Thr-121 130140
Glu-Ser-Gin-Ser-Leu-Thr-Leu-Thr-Asp-Val-Glu-Asn-Leu-His-Leu-Pro-Leu-Pro-Leu-Leu-141 150160
Gin-Ser-Trp-Met-His-Gin-Pro-His-Gln-Pro-Leu-Pro-Pro-Thr-Vai-Het-Phe-Pro-Pro-Gln-161 170180
Ser-Val-Leu-Ser-Leu-Ser-Gln-Ser-Lys-Val-Leu-Pro-Val-Pro-Gln-Lys-Ala-Val-Pro-Tyr-181 190200
Pro-Gln-Arg-Asp-Met-Pro-Ile-Gln-Ala-Phe-Leu-Leu-Tyr-Gln-Glu-Pro-Val-Leu-Gly-Pro-201209
Val-Arg-Gly-Pro-Phe-Pro-Ile-Ile-Val-OH
Рис. 2. Первичная последовательность для наиболее распространенного генетического варианта р-казеина A2 — β -CN A2-5P (35, 61, 62) . Остатки SeP, идентифицированные как фосфорилированные, выделены курсивом и жирным шрифтом.
Среди генетических вариантов в-казеина наиболее изучены А1 и А2 (46-48). Вариант А1 отличается от А2 лишь одной аминокислотой: в 67-й позиции замена цитозина на аденин привела к замещению пролина на гистидин (49-51). Выявление и количественный анализ в-казеина А2 обязателен для молочных продуктов А2 (14, 25, 52). Считается, что в-казеин А2 — это исходный в-казеиновый белок, поскольку несколько тысяч лет назад точечная мутация вызвала появление в-казеина А1 у европейского крупного рогатого скота (53-55). β-Казеин А1 — наиболее распространенный тип, характерный для коровьего молока, производимого в Европе (кроме Франции), США, Австралии и Новой Зеландии (56-58). Первичная последова- тельность для наиболее распространенного варианта A2 — β-CN A2-5P (34, 59, 60) представлена на рисунке 2.
Казеины и сывороточные белки ( β -лактоглобулин и α -лактальбу-мин) — это две основные группы молочных белков (61-63). Гены казеинов являются генами-кандидатами для биосинтеза молочного белка (41, 64, 65). Распространенным источником биоактивных пептидов выступают белки, содержащиеся в коровьем молоке. Биоактивные пептиды высвобождаются посредством ферментативного гидролиза казеинов и сывороточных белков желудочно-кишечными ферментами. In vitro биоактивный пептид β -казо-морфин-7 образуется в результате переваривания β -казеина A1, но при переваривании β -казеина A2 этого не наблюдается (66-68).
Влияние β -казоморфина-7 на функцию желудочнокишечного тракта. Поскольку β -казоморфин-7 обладает морфиноподобной активностью и, предположительно, вызывает такие заболевания как сахарный диабет 2 типа (69), синдром внезапной смерти новорожденных (70), ишемическую болезнь сердца и сердечно-сосудистые заболевания (71, 72), увеличивает риск онкологических заболеваний (73), может способствовать развитию аутизма у детей (74), изучение частоты генетических вариантов A1 и A2 вызывает интерес.
Молоко, содержащее β -казеин А1, вызывает более выраженное ухудшение желудочно-кишечных симптомов и увеличение времени транзита через желудочно-кишечный тракт у людей с непереносимостью лактозы, чем у толерантных к лактозе, тогда как молоко, содержащее β -казеин А2, не усугубляет симптомы при непереносимости лактозы (82-84). Это свидетельствует о том, что у некоторых людей с непереносимостью лактозы неблагоприятные желудочно-кишечные симптомы после употребления молока могут быть связаны с присутствием в нем β -казеина A1, а не с самой лактозой (76, 85, 86).
Потребление молока, содержащего β -казеин А2, ослабляет острые желудочно-кишечные симптомы по сравнению с молоком, содержащим β -казеин А1 (76, 87). β -Казеин А2 примерно в 2 раза увеличивает естественную выработку в организме человека глутатиона — антиоксиданта, который участвует в процессах детоксификации (88-90).
В β -казеине А2 присутствие пролина вместо гистидина предотвращает гидролиз пептидной связи между 66-м и 67-м аминокислотными остатками и ингибирует выработку β -казоморфина-7 (91, 92). При последовательном желудочно-кишечном переваривании молока, содержащего β -ка-зеин А1, количество образующегося β -казоморфина-7 в 4 раза выше, чем при переваривании молока, содержащего β -казеин А2 (93-95). В отличие от аллеля А1 , который может быть фактором риска для здоровья человека, аллель А2 имеет селекционную ценность (96-98).
Таким образом, коровье молоко содержит все необходимые для человека питательные вещества, в том числе в среднем 3,5 % белка, большую часть которого составляют казеины. При этом наиболее распространен β-казеин. Более 95 % казеина в молоке находится в мицеллярной форме. В литературе описывается по меньшей мере 13 генетических вариантов β-ка-зеина. Типы А1 и А2 наиболее изучены и отличаются друг от друга одной аминокислотой в 67-м положении аминокислотной цепи: в А1 — гистидин, в А2 — пролин. Присутствие гистидина вызывает высвобождение биоактивного пептида β-казоморфина-7 в процессе протеолиза β-казеина A1 в кишечнике, в то время как присутствие пролина в белке A2 предотвращает разрыв полипептидной последовательности в этом критическом месте. Биоактивный пептид β-казоморфин-7 обладает морфиноподобной активностью и воздействует на желудочно-кишечный тракт и центральную нервную систему человека. Предполагают, что существует корреляция между потреблением молока, содержащего β-казеин А1, и частотой развития заболеваний человека, таких как сахарный диабет 1 типа, ишемическая болезнь сердца и желудочно-кишечный дискомфорт при пищеварении. Дальнейшее изучение гена β-казеина и синтезируемых на его основе белков, а также накопление новых данных позволит получить более полное представление о метаболизме белков коровьего молока и молочных продуктов, содержащих β-казеин А1 и А2, и их влиянии на здоровье человека.
Список литературы b-казеин Bos taurus: структура белка, полиморфизм гена, влияние на желудочно-кишечный тракт человека (обзор)
- Wynn P.C., Sheehy P.A. Minor proteins, including growth factors. In: Advanced Dairy Chemistry /P. McSweeney, P. Fox (eds.). Springer, Boston, MA, 2013, 1A: 317-335 (doi: 10.1007/978-1-4614-4714-6).
- Ковалюк Н.В., Сацук В.Ф., Мачульская Е.В., Шахназарова Ю.Ю. Производство молока А2 — перспективное направление повышения рентабельности отрасли молочного скотоводства. Эффективное животноводство, 2018, 5(144): 22-23.
- Чаицкий А.А., Баранова Н.С. Оценка реализации биологического потенциала у крупного рогатого скота костромской породы с различными аллельными вариантами гена бета-казеина. Вестник АПК Верхневолжья, 2021, 2(54): 22-28 (doi: 10.35694/YARCX.2021.54.2.004).
- Валитов Ф.Р. Ассоциация полиморфизма гена бета-казеина с молочной продуктивность коров плановых пород Республики Башкортостан. Известия Оренбургского государственного аграрного университета, 2017, 1(63): 207-209.
- Шейко И.П., Климец Н.В., Песоцкий Н.И., Шеметовец Ж.И. Оценка племенных быков и быкопроизводящих коров голштинской породы молочного скота отечественной селекции с учетом генотипов по -казеину молока. Актуальные проблемы интенсивного развития животноводства, 2022, 25-1: 40-46.
- Парамонова М.А., Валитов Ф.Р., Ганиева И.Н. Частота встречаемости аллельных вариантов гена бета-казеина коров черно-пестрой породы. Сб. научных статей по итогам международной научно-практической конференции «Современные научные гипотезы и прогнозы: от теории к практике». СПб, 2021: 84-86.
- Епишко О.А., Пешко В.В., Танана Л.А., Пешко Н.Н., Мазурек Б.Г. Генетическая структура крупного рогатого скота белорусской черно-пестрой породы по генам CSN2 и CSN3. Мат. Межд. науч.-практ. конф. «Вклад науки и практики в обеспечение продовольственной безопасности страны при техногенном ее развитии». Брянск, 2021: 114-117.
- Тюлькин С.В. Влияние генотипа коров на их продуктивность и качество молока. Пищевые системы, 2018, 1(3): 38-43.
- Giglioti R., Gutmanis G., Katiki L.M., Okino C.H., de Sena Oliveira M.C., Vercesi Filho A.E. New high-sensitive rhAmp method for A1 allele detection in A2 milk samples. Food Chemistry, 2020, 313: 126167 (doi: 10.1016/j.foodchem.2020.126167).
- Fox P.F., Uniacke-Lowe T., McSweeney P.L.H., O'Mahony J.A. Milk Proteins. In: Dairy chem-istry and biochemistry. Springer, Cham, 2015: 145-239 (doi: 10.1007/978-3-319-14892-2_4).
- Горбатова К.К., Гунькова П.И. Биохимия молока и молочных продуктов. СПб, 2010.
- Ristanic M., Glavinic U., Vejnovic B., Maletic M., Kirovski D., Teodorovic V., Stanimirovic Z. Beta-casein gene polymorphism in Serbian holstein-friesian cows and its relationship with milk production traits. Acta Veterinaria, 2021, 70(4): 497-510 (doi: 10.2478/acve-2020-0037).
- Sarode A.R., Sawale P.D., Khedkar C.D., Kalyankar S.D., Pawshe R.D. Casein and caseinate: methods of manufacture. In: Encyclopedia of food and health /A.R. Sarode (ed.). Academic Press, 2016: 676-682 (doi: 10.1016/B978-0-12-384947-2.00122-7).
- Jaiswal K., De S., Sarsavan A. Detection of single nucleotide polymorphism by T-ARMS PCR of cross bred cattle Karan Fries for A1, A2 beta casein types. International Journal of Scientific Research in Biological Science, 2014, vol. 1: 18-22.
- Haq M.R.U., Kaplia R., Sharma R., Saliganti V., Kapila S. Comparative evaluation of cow β-casein variants (A1/A2) consumption on Th2-mediated inflammatory response in mouse gut. European Journal of Nutrition, 2013, 53(4): 1039-1049 (doi: 10.1007/s00394-013-0606-7).
- Bhat M.Y., Dar T.A., Singh L.R. Casein proteins: structural and functional aspects. In:Gigli I, ed. Milk Proteins – From Structure to Biological Properties and Health Aspects. InTechOpen, UK, 2016: 1-18 (doi: 10.5772/64187).
- Pattanayak S. Human health impact of bovine betacasomorphin-7 of milk – a question for milk products or our breeding policy? Exploratory Animal and Medical Research, 2013, 3(2): 93-94.
- Rangel A.H.N., Zaros L.G., Lima T.C., Borba L.H.F., Novaes L.P., Mota L.F.M., Silva M.S. Polymorphism in the Beta Casein Gene and analysis of milk characteristicsin Gir and Guzerà dairy cattle. Genetics and Molecular Research, 2017, 16(2): 16029592 (doi: 10.4238/gmr16029592).
- de Vitte K., Kerziene S., Klementavičiūtė J., de Vitte M., Mišeikienė R., Kudlinskienė I., Čepaitė J., Dilbiene V., Stankevičius R. Relationship of β-casein genotypes (A1A1, A1A2 and A2A2) to the physicochemical composition and sensory characteristics of cows’ milk. Journal of Applied Animal Research, 2022, 50(1): 161-166 (doi: 10.1080/09712119.2022.2046005).
- Andiç S., Ayaz R.M., Oğuz Ş. A1 milk and beta-casomorphin-7. Food Health, 2021, 7(2): 128-137 (doi: 10.3153/FH21014).
- Miluchová M., Gábor M., Trakovická A. Analysis of beta-casein gene (CSN2) polymorphism in different breeds of cattle. Scientific Papers Animal Science and Biotechnologies, 2014, 47: 56-59.
- Тёпел А. Химия и физика молока. СПб, 2021.
- Singh L.V., Jayakumar S., Sharma A., Gupta S.K., Dixit S.P., Gupta N., Gupta S.C. Compara-tive screening of single nucleotide polymorphisms in β-casein and κ-casein gene in different live-stock breeds of India. Meta Gene, 2015, 4: 85-91 (doi: 10.1016/j.mgene.2015.03.005).
- Feng P., Ding X., Gao T., Du R., Chen H. Determination of A2 β-casein and total β-casein in cow milk and milk powder by capillary zone electrophoresis. Chinese Journal of Chromatography (Se Pu), 2020, 38(6): 722-729.
- Kay S.-I.S., Delgado S., Mittal J., Eshraghi R.S., Mittal R., Eshraghi A.A. Beneficial Effects of Milk Having A2 β-Casein Protein: Myth or Reality? The Journal of Nutrition, 2021, 151(5): 1061-1072 (doi: 10.1093/jn/nxaa454).
- Ковалюк Н.В., Сацук В.Ф., Ковалюк М.А., Мачульская Е.В. Селекция крупного рогатого скота по полиморфному гену бета-казеина в Краснодарском Крае. Генетика и разведение животных, 2019, 1: 22-26.
- Mayer H.K., Lenz K., Halbauer E.-M. “A2 milk” authentication using isoelectric focusing and different PCR techniques. Food Research International, 2021, 147: 110523 (doi: 10.1016/j.food-res.2021.110523).
- Roin N.R., Larsen L.B., Comi I., Devold T.G., Eliassen T.I., Inglingstad R.A., Vegarud G.E., Poulsen N.A. Identification of rare genetic variants of the αS-caseins in milk from native Norwe-gian dairy breeds and comparison of protein composition with milk from high-yielding Norwegian Red cows. Journal of Dairy Science, 2022, 105(2): 1014-1027 (doi: 10.3168/jds.2021-20455).
- Bielecka M., Cichosz G., Czeczot H. Antioxidant, antimicrobial and anticarcinogenic activities of bovine milk proteins and their hydrolysates. International Dairy Journal, 2022, 127: 105208 (doi: 10.1016/j.idairyj.2021.105208).
- Хиценко А.В., Рогозинникова И.В. Использование молочных белков в пищевой промыш-ленности. Молодежь и наука, 2019, 3: 96-101.
- Rocha-Mendoza D., Jiménez-Flores R. Casein nomenclature, structure, and association. In: En-cyclopedia of dairy sciences (Third Edition) /P.L.H. McSweeney, J.P. McNamara (eds.). Academic Press, 2022 (doi: 10.1016/B978-0-12-818766-1.00277-4).
- Faĭzullin D.A., Konnova T.A., Haertle T., Zuev I. Self-association and secondary structure of beta-casein. Russian Journal of Bioorganic Chemistry, 2013, 39(4): 366-372 (doi: 10.1134/s1068162013040067).
- Yang T., Liu D., Zhou P. Temperature-dependent dissociation of human micellar β-casein: Im-plications of its phosphorylation degrees and casein micelle structures. Food Chemistry, 2022, 376: 131935 (doi: 10.1016/j.foodchem.2021.131935).
- Hernell O. Human milk vs. cow’s milk and the evolution of infant formulas. Nestlé Nutrition Institute Workshop Series: Pediatric Program, 2011, 67: 17-28 (doi: 10.1159/000325572).
- Gallinat J.L., Qanbari S., Drögemüller C., Pimentel E.C.G., Thaller G., Tetens J. DNA-based identification of novel bovine casein gene variants. Journal of Dairy Science, 2013, 96(1): 699-709 (doi: 10.3168/jds.2012-5908).
- Massella E., Piva S., Giacometti F., Liuzzo G., Zambrini A.V., Serraino A. Evaluation of bovine beta casein polymorphism in two dairy farms located in northern Italy. Italian Journal of Food Safety, 2017, 6(3): 131-133 (doi: 10.4081/ijfs.2017.6904).
- Sodhi M., Kataria R.S., Niranjan S.K., Parvesh K., Verma P., Swami S.K., Sharma A., Bharti V.K., Kumar B., Iqbal M., Rabgais S., Kumar P., Giri A., Kalia S., Gagoi D., Sa-rangi P.P., Mukesh M. Sequence characterisation and genotyping of allelic variants of beta casein gene establishes native cattle of Ladakh to be a natural resource for A2 milk. Life Science Journal, 2018, 3(2): 177-181.
- Ильина А.В., Абрамова М.В., Зырянова С.В. Аллельный полиморфизм крупного рогато-госкота ярославской породы по генам молочной продуктивности. Вестник Бурятской гос-ударственной сельскохозяйственной академии им. В.Р. Филиппова, 2018, 4(53): 55-62.
- Ganguly I., Kumar S., Gaur G., Singh U., Kumar A., Kumar S., Mann S., Sharma A. Status of β-casein, CSN2, polymorphism in frieswal, HF X Sahiwal cross bred cattle. Int. J. Biotechnol. Bioeng. Res., 2013, 4: 249-256.
- Валитов Ф.Р. Полиморфизм гена бета-казеина коров плановых пород Республики Башкортостан. Аграрная наука в инновационном развитии АПК. Мат. Межд. науч.-практ. конф. в рамках XXVI Международной специализированной выставки «Агроком-плекс-2016». Уфа, 2016, ч. II: 2730.
- Amalfitano N., Macedo Mota L.F., Rosa G.J.M., Cecchinato A., Bittante G. Role of CSN2, CSN3, and BLG genes and the polygenic background in the cattle milk protein profile. Journal of Dairy Science, 2022, 105(7): 6001-6020 (doi: 10.3168/jds.2021-21421).
- Марзанов Н.С., Абылкасымов Д.А., Девришов Д.А., Марзанова С.Н., Либет И.С. Харак-теристика аллелотипа у коров черно-пестрой породы по локусам бета- и каппа-казеина и качественные показатели молока. Актуальные вопросы молочной промышленности, межот-раслевые технологии и системы управления качеством, 2020, 1, 1(1): 368-376.
- Костюнина О.В., Коновалова Е.Н., Долматова И.Ю., Ракина Ю.А., Гладырь Е.А. Харак-теристика аллелофонда башкирских популяций крупного рогатого скота по генам CSN2 и CSN3. Достижения науки и техники АПК, 2013, 3: 64-67.
- Pandey A., Thakur M.S., Pandey Y. Association study of polymorphic varients of beta (b) casein gene with milk production traits (lactose, snf and density) in Malvi, Nimari, Sahiwal and H.F. cross breeds cow. Indian Journal of Animal Research, 2021, 55(1): 1-5 (doi: 10.18805/IJAR.B-3896).
- Парамонова М.А., Валитов Ф.Р., Кононенко Т.В. Влияние полиморфизма гена бета-казе-ина на молочную продуктивность коров черно-пестрой породы республики Башкортостан. Мат. Межд. науч.-практ. конф., посвященной 120-летию со дня рождения профессора О.А. Ивановой «Достижения и актуальные проблемы генетики, биотехнологии и селекции животных». Витебск, 2021: 38-42.
- Pal S., Woodford K., Kukuljan S., Ho S. Milk intolerance, beta-casein and lactose. Nutrients, 2015, 7(9): 7285-7297 (doi: 10.3390/nu7095339).
- ul Haq M.R., Kapila R., Shandilya U.K., Kapila S. Impact of milk derived β-casomorphins on physiological functions and trends in research: a review. International Journal of Food Properties, 2014, 17(8): 1726-1741 (doi: 10.1080/10942912.2012.712077).
- Khalid R.B., Nadeem A., Javed M., Shabbir M.Z., Babar M.E. Characterization of β-casein gene sequence variants in cholistani cattle. Pakistan Journal of Zoology, 2021, 53(5): 1929-1937 (doi: 10.17582/journal.pjz/20200610120622).
- Poulsen N.A., Glantz M., Rosengaard A.K., Paulsson M., Larsen L.B. Comparison of milk pro-tein composition and rennet coagulation properties in native Swedish dairy cow breeds and high-yielding Swedish Red cows. Journal of Dairy Science, 2017, 100(11): 8722-8734 (doi: 10.3168/jds.2017-12920).
- Li X., Spencer G.W.K., Ong L., Gras S.L. Beta casein proteins — a comparison between caprine and bovine milk. Trends in Food Science and Technology, 2022, 121: 30-43 (doi: 10.1016/j.tifs.2022.01.023).
- Geeta Chauhan L.G., Kumar K. -Glucosidase and -amylase inhibitory properties of A1 and A2 cow milk casein hydrolysate. International Journal of Current Microbiology and Applied Sciences, 2021, 10(2): 2210-2217 (doi: 10.20546/ijcmas.2021.1002.263).
- Kumar A., Kumar S., Singh R.V., Chauhan A., Kumar A., Sonwane A., Ilayakumar K., Singh R. Investigation of genetic polymorphism at β-casein A1/A2 loci and association analysis with pro-duction & reproduction traits in Vrindavani crossbred cows. Animal Biotechnology, 2021: 33(7): 1562-1570 (doi: 10.1080/10495398.2021.1917423).
- Malarmathi M., Senthil K. T., Parthiban M., Muthuramalingam T., Palanisammi A. Analysis of -casein gene for A1 and A2 genotype using allele specifi c PCR in Kangeyam and Holstein Friesian crossbred cattle in Tamil Nadu. Indian Journal of Veterinary and Animal Sciences and Research, 2014, 43: 310-315.
- Hockey M., Aslam H., Berk M., Pasco J.A., Ruusunen A., Mohebbi M., Macpherson H., Chat-terton M.L., Marx W., O’Neil A., Rocks T., McGuinness A.J., Young L.M., Jacka F.N. The Moo’D Study: protocol for a randomised controlled trial of A2 beta-casein only versus conven-tional dairy products in women with low mood. Trials, 2021, 22(1): 899 (doi: 10.1186/s13063-021-05812-6).
- Mumtaz S. β Casein polymorphism in indigenous and exotic cattle breeds of Pakistan. Pakistan Journal of Zoology, 2022, 54(3): 1451-1454 (doi: 10.17582/jornal.pjz/20190307030303).
- Горлов И.Ф., Сычева О.В., Кононова Л.В. Бета-казеин: известный, но не познанный. Мо-лочное и мясное скотоводство, 2016, 6: 18-19.
- Марзанов Н.С. Абылкасымов Д.А., Либет И.С., Девришов Д.А. Характеристика аллело-типа у коров черно-пестрой породы по локусам бета- и каппа-казеина и качественные показатели молока. В сб.: Актуальные вопросы молочной промышленности, межотраслевые технологии и системы управления качеством. М., 2020: 368-376 (doi: 10.37442/978-5-6043854-1-8-2020-1-368-376).
- Хавкин А.И., Васиа М.Н., Новикова В.П. Биологическая роль казоморфинов (часть 1). Экспериментальная и клиническая гастроэнтерология, 2021, 196(12): 102-109. (doi: 10.31146/1682-8658-ecg-196-12-102-109).
- Хавкин А.И., Васиа М.Н., Новикова В.П. Биологическая роль казоморфинов (часть 2): роль в патологии человека. Экспериментальная и клиническая гастроэнтерология, 2021, 12: 110-118 (doi: 10.31146/1682-8658-ecg-196-12-110-118).
- Huppertz T., Fox P.F., Kelly A.L. The caseins: structure, stability, and functionality. In: Proteins in food processing: Second Edition. Woodhead Publishing, 2018: 49-92 (doi: 10.1016/B978-0-08-100722-8.00004-8).
- Sharma V., Sharma N., Jawed B. Nautiyal S., Singh R. High resolution melts curve analysis for the detection of A1, A2 β-casein variants in Indian cows. Journal of Microbiology and Biotechnology Research, 2013, 3: 144-148.
- De Gaudry D.K., Lohner S., Schmucker C., Kapp P., Motschall E., Horrlein S., Roger C., Meerpohl J.J. Milk A1 p-casein and health-related outcomes in humans: a systematic review. Nutrition Reviews, 2019, 77(5): 278-306 (doi: 10.1093/nutrit/nuy063).
- Daniloski D., McCarthy N.A., Markoska T., Auldist M.J., Vasiljevic T. Conformational and physicochemical characteristics of bovine skim milk obtained from cows with different genetic variants of β-casein. Food Hydrocolloids, 2022, 124(Part A): 107186 (doi: 10.1016/j.foodhyd.2021.107186).
- Yudin N.S., Voevoda M.I. Molecular genetic markers of economically important traits in dairy cattle, Russ. Genetika, 2015, 51(5): 506-517 (doi: 10.1134/S1022795415050087).
- Duarte-Vázquez M.Á., García-Ugalde C., Villegas-Gutiérrez L.M., García-Almendárez B.E., Ro-sado J.L. Production of cow's milk free from beta-casein A1 and its application in the manufac-turing of specialized foods for early infant nutrition. Foods, 2017, 6(7): 50 (doi: 10.3390/foods6070050).
- Bodnár Á., Hajzser A., Egerszegi I., Póti P., Kuchtík J., Pajor F. A2 milk and its importance in dairy production and global market. Animal Welfare, Ethology and Housing Systems, 2018, 14(1): 1-7 (doi: 10.17205/SZIE.AWETH.2018.1.001).
- Ho S., Woodford K., Kukuljan S., Pal S. Comparative effects of A1 versus A2 beta-casein on gastrointestinal measures: a blinded randomised cross-over pilot study. European Journal of Clin-ical Nutrition, 2014, 68(9): 994-1000 (doi: 10.1038/ejcn.2014.127).
- Auestad N., Layman D.K. Dairy bioactive proteins and peptides: a narrative review. Nutrition Reviews, 2021, 79(supp_2): 36-47 (doi: 10.1093/nutrit/nuab097).
- Aune D., Norat T., Romundstad P., Vatten L.J. Dairy products and the risk of type 2 diabetes: A systematic review and dose-response meta-analysis of cohort studies. American Journal of Clin-ical Nutrition, 2013, 98(4): 1066-1083 (doi: 10.3945/ajcn.113.059030).
- Hu D., Huang J., Wang Y., Zhang D., Qu Y. Dairy foods and risk of stroke: A meta-analysis of prospective cohort studies. Nutrition, Metabolism and Cardiovascular Diseases, 2014, 24(5): 460-469 (doi: 10.1016/j.numecd.2013.12.006).
- Kuellenberg de Gaudry D., Lohner S., Bischoff K., Schmucker C., Hoerrlein S., Roeger C., Schwingshackl L., Meerpohl J.J. A1- and A2 beta-casein on health-related outcomes: a scoping review of animal studies. European Journal of Nutrition, 2022, 61: 1-21 (doi: 10.1007/s00394-021-02551-x).
- Patterson E., Larsson S.C., Wolk A., Åkesson A. Association between dairy food consumption and risk of myocardial infarction in women differs by type of dairy food. Journal of Nutrition, 2013, 143(1): 74-79 (doi: 10.3945/jn.112.166330).
- Aune D., Navarro Rosenblatt D.A., Chan D.S.M., Vieira A.R., Vieira R., Greenwood D.C., Vatten L.J., Norat T. Dairy products, calcium, and prostate cancer risk: A systematic review and meta-analysis of cohort studies. The American Journal of Clinical Nutrition, 2015, 101(1): 87-117 (doi: 10.3945/ajcn.113.067157).
- Cies̈lińska A., Sienkiewicz-Szłapka E., Wasilewska J., Fiedorowicz E., Chwała B., Moszyńska-Dumara M., Cies̈liński T., Bukało M., Kostyra E. Influence of candidate polymorphisms on the dipeptidyl peptidase IV and μ-opioid receptor genes expression in aspect of the β-casomorphin-7 modulation functions in autism. Peptides, 2015, 65: 6-11 (doi: 10.1016/j.peptides.2014.11.012).
- Ramakrishnan M., Eaton T., Sermet O., Savaiano D. A single meal of milk containing A2 -casein causes fewer symptoms and lower gas production than milk containing both A1 and A2 -casein among lactose intolerant individuals. Current Developments in Nutrition, 2020, 4(suppl 2): 772 (doi: 10.1093/cdn/nzaa052_041).
- He M., Sun J., Jiang Z.Q., Yang Y.X. Effects of cow's milk beta-casein variants on symptoms of milk intolerance in Chinese adults: a multicentre, randomised controlled study. Nutrition Journal, 2017, 16(1): 72 (doi: 10.1186/s12937-017-0275-0).
- Trivedi M.S., Shah J.S., Al-Mughairy S., Malav S., Hodgson N.W., Simms B., Trooskens G.A., Criekinge W.V., Deth R.C. Food-derived opioid peptides inhibit cysteine uptake with redox and epigenetic consequences. The Journal of Nutritional Biochemistry, 2014, 25(10): 1011-1018 (doi: 10.1016/j.jnutbio.2014.05.004).
- Vivanco-Maroto S.M., Santos-Hernández M., Sanchón J., Picariello G., Recio I., Miralles B. In vitro digestion of milk proteins including intestinal brush border membrane peptidases. Transep-ithelial transport of resistant casein domains. Food Research International, 2022, 157: 111238 (doi: 10.1016/j.foodres.2022.111238).
- Brooke-Taylor S., Dwyer K., Woodford K., Kost N. Systematic review of the gastrointestinal effects of A1 compared with A2 β-casein. Advances in Nutrition, 2017, 8(5): 739-748 (doi: 10.3945/an.116.013953).
- Jianqin S., Leiming X., Lu X., Yelland G.W., Ni J., Clarke A.J. Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta-casein proteins on gastrointestinal physiology, symptoms of discomfort, and cognitive behavior of people with self-reported intol-erance to traditional cows’ milk. Nutrition Journal, 2015, 15(1): 35 (doi: 10.1186/s12937-016-0147-z).
- Barnett M.P., McNabb W.C., Roy N.C., Woodford K.B., Clarke A.J. Dietary A1 β-casein affects gastrointestinal transit time, dipeptidyl peptidase-4 activity, and infl ammatory status relative to A2 β-casein in Wistar rats. International Journal of Food Sciences and Nutrition, 2014, 65(6): 720-727 (doi: 10.3109/09637486.2014.898260).
- Jianqin S., Leiming X., Lu X., Yelland G.W., Ni J., Clarke A.J. Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta casein proteins on gastrointestinal physiology, symptoms of discomfort, and cognitive behavior of people with self-reported intoler-ance to traditional cows' milk. Nutrition Journal, 2016, 15: 35 (doi: 10.1186/s12937-016-0147-z).
- Schettini G.P., Lambert S.M., da Silva Souza B.M.P., Costa R.B., de Camargo, G.M.F. Genetic potential of Sindhi cattle for A2 milk production. Animal Production Science, 2020, 60(7): 893-895 (doi: 10.1071/an18677).
- Teixeira D.P., Costa R.B., de Camargo G.M.F. Guzerat indicine cattle and A2 milk production. Animal Biotechnology, 2023, 34(2): 467-469 (doi: 10.1080/10495398.2021.1962336).
- Muntean I.A., Bocsan I.C., Wiest L.K., Pintea I., Dobrican C.T., Duca E., Ureche C., Buzoi-anu A.D., Deleanu D. Predictive factors for oral immune modulation in cow milk allergy. Nutri-ents, 2022, 14(3): 494 (doi: 10.3390/nu14030494).
- Kamiński S. Co-occurrence of kappa-casein B and beta-casein A1 alleles in Holstein bulls. Applied Animal Science, 2021, 37(2): 122-125 (doi: 10.15232/aas.2020-02094).
- Brüssow H. Nutrition, population growth and disease: a short history of lactose. Environmental Microbiology, 2013, 15(8): 2154-2161 (doi: 10.1111/1462-2920.12117).
- Sebastiani C., Arcangeli C., Ciullo M., Torricelli M., Cinti G., Fisichella S., Biagetti M. Fre-quencies evaluation of β-casein gene polymorphisms in dairy cows reared in central Italy. Animals, 2020, 10(2): 252 (doi: 10.3390/ani10020252).
- Кузьменко Н.Б., Кузина А.Н. Роль -казеина в питании детей первых лет жизни. Лечащий врач, 2016, 1: 16-19.
- Pizzorno J. Glutathione! Integr. Med. (Encinitas), 2014, 13(1): 8-12.
- Antonopoulos D. Vougiouklaki D., Laliotis G. P., Tsironi T., Valasi I., Chatzilazarou A., Hal-vatsiotis P., Houhoula D. Identification of polymorphisms of the CSN2 gene encoding β-casein in greek local breeds of cattle. Veterinary Sciences, 2021, 8(11): 257 (doi: 10.3390/vetsci8110257).
- Boutrou R., Gaudichon C., Dupont D., Jardin J., Airinei G., Marsset-Baglieri A., Benam-ouzig R., Tomé D., Leonil J. Sequential release of milk protein-derived bioactive peptides in the jejunum in healthy humans. The American Journal of Clinical Nutrition, 2013, 97(6): 1314-1323 (doi: 10.3945/ajcn.112.055202).
- Chia J., McRae J.L., Enjapoori A.K., Lefèvre C.M., Kukuljan S., Dwyer K.M. Dietary Cows' Milk Protein A1 Beta-Casein Increases the Incidence of T1D in NOD Mice. Nutrients, 2018, 10(9): 1291 (doi: 10.3390/nu10091291).
- Firouzamandi M., Gholami M., Toloui M., Eshghi D. Genetic variation of β-casein gene using AS-PCR and ARMS-PCR techniques in bovine populations. Russian Journal of Genetics, 2018, 54(11): 1352-1357 (doi: 10.1134/S1022795418110054).
- Сорвачева Т.Н., Евдокимова Т.А., Сафронова А.Н., Чедия Е.С. Коровье молоко: новые аспекты известной темы. Вопросы диетологии, 2018, 8(3): 42-46 (doi: 10.20953/2224-5448-2018-3-42-46).
- Lange K.W., Hauser J., Reissmann A. Gluten-free and casein-free diets in the therapy of autism. Current Opinion in Clinical Nutrition and Metabolic Care, 2015, 18(6): 572-575 (doi: 10.1097/MCO.0000000000000228).
- Bisutti V., Pegolo S., Giannuzzi D. Mota L. F. M., Vanzin A., Toscano A., Trevisi E., Ajmone Marsan P., M. Brasca, Cecchinato A. The -casein (CSN2) A2 allelic variant alters milk protein profile and slightly worsens coagulation properties in Holstein cows. Journal of Dairy Science, 2022, 105(5): 3794-3809 (doi: 10.3168/jds.2021-21537).


