Бактериальная люминесценция марганец- и кобальтсодержащих ультрадисперсных частиц (Mn2O3 и Co3O4) в рубцовой жидкости
Автор: Шошин Д.Е., Сизова Е.А., Камирова А.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Минеральные элементы и токсиканты
Статья в выпуске: 6 т.58, 2023 года.
Бесплатный доступ
Наряду с основными нутриентами (белками, жирами и углеводами) важное значение в кормлении сельскохозяйственных животных, включая крупный рогатый скот и птицу, имеют минеральные элементы (Д.В. Машнин с соавт., 2022; Т.М. Околелова с соавт., 2018). Они включаются в состав премиксов в неорганическом или органическом виде (М.Ю. Мишанин с соавт., 2021; О.С. Кощаева, 2018). Однако более перспективны нанокомпозиции, свойства которых могут быть смоделированы посредством изменения формы, путей синтеза и размера ультрадисперсных частиц (УДЧ) (S. Miroshnikov с соавт., 2019). Вместе с тем использование УДЧ имеет ряд ограничений, связанных с их потенциальной токсичностью (E. Rusakova соавт., 2015). Также известно, что симбионтная микрофлора формирует многокомпонентную суспензию органических веществ, промежуточных и конечных метаболитов микробиома, способных взаимодействовать с УДЧ (Б.С. Нуржанов с соавт., 2019). В настоящей работе впервые установлена динамика люминесценции бактериального тест-объекта при внесении в питательную среду комплекса УДЧ и рубцовой жидкости. Показано, что эта комбинация нивелирует токсичность наноструктур. Целью нашей работы была оценка свойств ультрадисперсных частиц на примере различных концентраций окиси марганца и кобальта в биохимической среде руминального сообщества на основе метода ингибирования бактериальной люминесценции. Исследование проводили на базе центра «Нанотехнологии в сельском хозяйстве» ФГБУ ФНЦ БСТ РАН (г. Оренбург) в 2022 году. Химически чистые для анализа (99 %) УДЧ окиси марганца Mn2O3 и кобальта Co3O4 в количестве 157,8 и 240,7 мг диспергировали ультразвуком частотой 35 кГц в 1 мл дистиллированной воды в течение 30 мин при 25 °C. Отбор рубцовой жидкости (РЖ) проводили через хроническую фистулу рубца (d = 80 мм, «ANKOM Technology Corporation», США) спустя 3 ч после кормления у быка породы казахская белоголовая, основной рацион которого включал 30 % концентратов и 70 % грубых кормов без добавления УДЧ. Использовали люминесцентный бактериальный тест «Эколюм» («НВО ИММУНОТЕХ», Россия), представленный лиофилизированной культурой микроорганизмов Escherichia coli , несущих гибридную плазмиду pUC19 с клонированными lux CDABE генами P. leiognathi 54D10. В биолюминесцентном планшете проводили серию двукратных разбавлений суспензии УДЧ и РЖ, начиная со следующих значений: 50 мкл Mn2O3 (1 моль/л) + 50 мкл РЖ; 50 мкл Co3O4 (1 моль/л) + 50 мкл РЖ; 50 мкл Mn2O3 (1 моль/л) + 50 мкл дистиллированной воды; 50 мкл Co3O4 (1 моль/л) + 50 мкл дистиллированной воды; 100 мкл РЖ; 100 мкл дистиллированной воды (контроль). Затем в каждую ячейку добавляли по 100 мкл тест-системы «Эколюм», получая итоговые концентрации УДЧ от 0,25 до 0,00025 моль/л и разведения РЖ от 1:2 до 1:2048 в чистом опыте и от 1:4 до 1:4096 в опыте с УДЧ. Токсичность исследуемых образцов определяли на многофункциональном микропланшетном ридере TECAN Infinite F200 («Tecan Austria GmbH», Австрия), фиксируя значение люминесценции бактериального штамма E. coli K12 TG1 в среде с разным содержанием ультрадисперсных частиц и рубцовой жидкости в течение 3 ч с периодом 5 мин. На основе полученных данных строили графики, отражающие динамику ингибирования биолюминесценции, и вычисляли индекс токсичности (T). Также рассчитывали относительное значение биолюминесценции (A). Установлено, что УДЧ в чистом виде вызывают дозозависимое ингибирование бактериальной люминесценции, подавляя свыше 50 % свечения (ЕС50) даже при разведении в 2048 раз (0,00025 моль/л). Значения индекса токсичности, при вычислении которого контроль принимается за 100 %, наглядно свидетельствуют о снижении ядовитых свойств суспензий с уменьшением в них доли УДЧ. Для Mn2O3 эта величина составляла от 89,76 % при концентрации 0,25 моль/л до 38,57 % при 0,00025 моль/л на 1-й мин эксперимента и от 95,16 до 52,85 % в конце 3-го ч; для Co3O4 - соответственно 99,44 и 32,80 % на 1-й мин, 99,43 и 54,72 % в конце 3-го ч. Аналогичные показатели в опыте с рубцовой жидкостью проявлялись лишь на первых минутах экспозиции, после чего светимость значительно возрастала, достигая 769,10 % к контролю при 64-кратном разведении. При комбинации рубцовой жидкости с УДЧ наблюдалась регрессия ядовитых свойств последних, хотя максимальные показатели светимости в комплексе с Mn2O3 составляли лишь 43,28 % от аналогичных для нативной РЖ, в сочетании с Co3O4 - 36,44 %. Наблюдаемые изменения люминесценции были разделены на три типа: контрольный (свечение меняется пропорционально фазам роста бактериальной культуры; без добавок); глубокий (подавление люминесценции на протяжении всего периода экспозиции; с добавлением УДЧ); конкурентный (рост свечения от начала к концу опыта; с добавлением РЖ или комплекса РЖ + УДЧ). Таким образом, сочетание рубцовой жидкости с частицами окислов металлов приводит к ингибиции их токсичности по отношению к тест-объекту.
Ультрадисперсные частицы, бактериальные клетки, биолюминесценция, оксид марганца, оксид кобальта, рубцовая жидкость
Короткий адрес: https://sciup.org/142240688
IDR: 142240688 | УДК: 636.085.12:636.087.72 | DOI: 10.15389/agrobiology.2023.6.1122rus
Текст научной статьи Бактериальная люминесценция марганец- и кобальтсодержащих ультрадисперсных частиц (Mn2O3 и Co3O4) в рубцовой жидкости
Наряду с основными нутриентами — белками, жирами и углеводами важное значение в кормлении сельскохозяйственных животных, включая крупный рогатый скот и птицу, имеют минеральные элементы (1, 2). Они входят в состав акцессорных веществ (дыхательных пигментов, витаминов, гормонов, ферментов и коферментов) и влияют на разнообразные физиологические реакции, что отражается на процессах роста и развития (3, 4). Оптимальное поступление микроэлементов с кормом — один из факторов, опосредующих высокую продуктивность животных (5, 6). В связи с этим актуальна разработка премиксов с минеральными компонентами в различной форме.
Традиционно в составе премиксов используются неорганические и органические соединения (7, 8), однако более перспективны хелаты и наноформы эссенциальных элементов (9-11). Свойства последних могут быть смоделированы посредством изменения формы, путей синтеза и размера частиц (12). Этот более дешевый и высокорентабельный способ обогащения кормов микроэлементами (13, 14) имеет некоторые ограничения. При использовании ультрадисперсных частиц (УДЧ) следует учитывать риски потенциальной токсичности (15). Так, стабильные оксиды металлов абсолютно инертны, а металлические УДЧ с окислительно-восстановительным потенциалом могут быть гено- и цитотоксичными (16) ввиду высокой биодоступности, возможности синергетического эффекта с другими загрязнителями (17) и широкой вариабельности свойств в зависимости от природы, размера, концентрации, ζ-потенциала, формы и реакционной среды.
Последнее особенно актуально для жвачных животных, у которых руминальное содержимое, по сути, представляет собой целостную экосистему со множеством связей (18). Симбионтная микрофлора также нуждается в макро- и микроэлементах для поддержания нормального метаболизма и формирует многокомпонентную суспензию органических веществ — промежуточных и конечных метаболитов микробиома, способных взаимодействовать с УДЧ (19). Подобное обстоятельство должно учитываться при определении максимально допустимых доз УДЧ в рационе животных.
В настоящей работе впервые установлена динамика люминесценции бактериального тест-объекта при внесении в питательную среду комплекса УДЧ и рубцовой жидкости. Показано, что эта комбинация нивелирует токсичность наноструктур.
Целью нашей работы была оценка свойств ультрадисперсных частиц на примере различных концентраций окиси марганца и кобальта в биохимической среде руминального сообщества на основе метода ингибирования бактериальной люминесценции.
Методика. Исследование проводили на базе центра «Нанотехнологии в сельском хозяйстве» ФГБУ ФНЦ БСТ РАН (г. Оренбург) в 2022 году.
Химически чистые для анализа (99 %) УДЧ окиси марганца Mn 2 O 3 и кобальта Co 3 O 4 (ИП Хисамутдинов Р.А., Россия) в количестве 157,8 и 240,7 мг (весы лабораторные ВЛА-225М, класс точности I, допускаемая погрешность ±0,5 мг, «Госметр», Россия) диспергировали ультразвуком с частотой 35 кГц в 1 мл дистиллированной воды в течение 30 мин при 25 ° C.
Отбор рубцовой жидкости (РЖ) проводили через хроническую фистулу рубца (d = 80 мм, «ANKOM Technology Corporation», США) спустя 3 ч после кормления у быка породы казахская белоголовая (250 кг, 10 мес), основной рацион которого включал 30 % концентратов и 70 % грубых кормов без добавления УДЧ. Транспортировку осуществляли в течении 30 мин, поддерживая температурный режим 38,5-39,5 °С. Перед использованием РЖ тщательно встряхивали и процеживали.
Подготовку люминесцентного бактериального теста «Эколюм» («НВО ИММУНОТЕХ», Россия), представленного лиофилизированной культурой микроорганизмов Escherichia coli , несущих гибридную плазмиду pUC19 с клонированными lux CDABE генами P. leiognathi 54D10, осуществляли по методике, предложенной Е.С. Алешиной и соавт. (20). К исходному штамму доливали 10 мл дистиллированной воды, охлажденной до 4 ° C, и выдерживали суспензию 30 мин при той же температуре.
В биолюминесцентном планшете проводили серию двукратных разбавлений суспензии УДЧ и РЖ, начиная со следующих значений: строка A — 50 мкл Mn 2 O 3 (1 моль/л) + 50 мкл РЖ; строка B — 50 мкл Co 3 O 4 (1 моль/л) + 50 мкл РЖ; строка С — 50 мкл Mn 2 O 3 (1 моль/л) + 50 мкл дистиллированной воды; строка D — 50 мкл Co 3 O 4 (1 моль/л) + 50 мкл дистиллированной воды; строка E — 100 мкл РЖ; строка F — 100 мкл дистиллированной воды (контроль). Затем в каждую ячейку добавляли по 100 мкл тест-системы «Эколюм», получая итоговые концентрации УДЧ от 0,25 до 0,00025 моль/л и разведения РЖ от 1:2 до 1:2048 в чистом опыте и от 1:4 до 1:4096 в опыте с УДЧ.
Токсичность исследуемых образцов определяли на многофункциональном микропланшетном ридере TECAN Infinite F200 («Tecan Austria GmbH», Австрия), фиксируя значение люминесценции бактериального штамма E. coli K12 TG1 («Эколюм») в среде с разным содержанием ультра-дисперсных частиц и рубцовой жидкости в течение 3 ч с периодом 5 мин.
На основе полученных данных строили графики, отражающие динамику ингибирования биолюминесценции, и вычисляли индекс токсичности (T), по формуле:
T = (Ik - Io)/Ik х 100 %, где Ik — светимость контрольной пробы, Io — светимость опытной пробы.
Этот показатель позволяет судить о том, насколько сильно проявляется негативное воздействие исследуемого фактора. Однако, если последний имеет позитивную составляющую и интенсифицирует свечение, рациональнее рассчитать относительное значение биолюминесценции (A), чтобы избежать отрицательных величин:
A = Ik/Io ½ 100 %.
В сущности, это величина, обратная индексу токсичности, отражает различие в интенсивности свечения контрольной и опытной проб.
Статистическую обработку результатов проводили с помощью программного пакета Statistica 12 («Stat Soft Inc.», США) и Microsoft Excel («Microsoft», США). Достоверность различий между абсолютными значениями люминесценции определяли по t -критерию Стьюдента с требуемым уровнем значимости p < 0,01. В таблицах указаны относительные значения, соответствующие представленному порогу.
Результаты. Марганец и кобальт, наряду с другими переходными металлами (Fe, Ni, Cu, Zn), относятся к необходимым микроэлементам и участвуют в ряде биохимических превращений у бактерий (21, 22), растений (23-25), простейших (26, 27) беспозвоночных (28, 29) и позвоночных (30, 31) животных. В частности, марганец отвечает за метаболизм макроэлементов, формирование костей, системы защиты от свободных радикалов, клиренс аммиака и синтез нейротрансмиттеров в мозге. Он служит кофактором для ферментов, которые расщепляют активные формы кислорода, в основ- ном для Mn-супероксиддисмутазы (SOD) и Mn-кофакторированных каталаз и пероксидазы (32, 33). Кроме того, Mn заменяет железо в некоторых Fe-мононуклеарных ферментах у E. coli при окислительном стрессе, защищая их от окислительного повреждения, опосредованного реакцией Фентона, и сохраняя при этом каталитическую активность (34, 35). Для поддержания оптимальной концентрации ионов металла бактерии пользуются импортерами и экспортерами (36, 37).
А
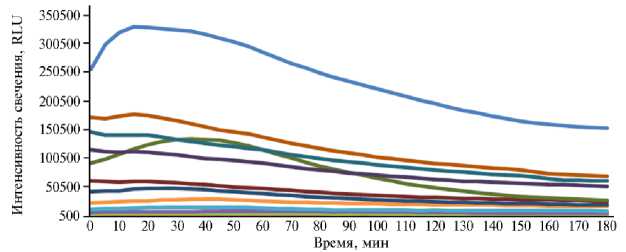
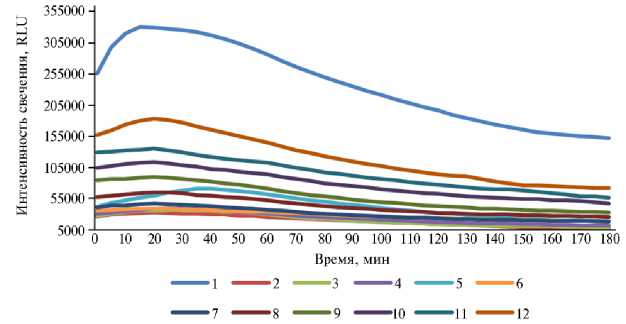
Рис. 1. Динамика биолюминесценции штамма Escherichia coli K12TG1 в суспензии ультрадисперс-ных частиц (УДЧ) Co 3 O 4 (А) и Mn 2 O 3 (Б) при разной концентрации: 1 — 0 моль/л (контроль), 2 — 0,25 моль/л, 3 — 0,125 моль/л, 4 — 0,063 моль/л, 5 — 0,031 моль/л, 6 — 0,016 моль/л, 7 — 0,008 моль/л, 8 — 0,004 моль/л, 9 — 0,002 моль/л, 10 — 0,001 моль/л, 11 — 0,0005 моль/л, 12 — 0,00025 моль/л.
Mn — критический компонент в десятках белков и ферментов, он содержится во всех тканях, особенно в богатых митохондриями и меланином. В нормальных условиях максимальные концентрации Mn наблюдаются в печени и поджелудочной железе (38). При его избытке или недостатке в рационе чаще всего возникают нейродегенеративные нарушения (39-41).
Кобальт используется бактериями для синтеза тетрапиррольного кольца, известного как коррин, витамина B12 (C63H88O14N14PCo) (42, 21), химическая структура и свойства которого подробно описаны D. Osman с соавт. (43). Кобальт участвует в процессах фиксации азота у растений, служит кофактором аденозилкобаламин-зависимых изомераз, этаноламин-ам-миак-лиазы, метилкобаламин-зависимой метилтрансферазы и рибонуклео-тидредуктазы, а также ряда металлопротеинов у животных, бактерий и дрожжей (24). У человека Co входит в состав этилмалонил-КоА-мутазы (MCM) и метионинсинтазы, недостаток которых ведет к метилмалоновой ацидурии и мегалобластной анемии (44), дефектам нервной трубки, инсульту и деменции, затормаживанию интеллектуального развития у детей (45). При избытке Co проявляет генотоксичные и канцерогенные свойства (46).
Биолюминесценция проб с различным содержанием УДЧ окиси марганца и кобальта без добавления РЖ была обратно пропорциональна их концентрации (рис. 1). В начале эксперимента светимость контрольного образца за счет интенсивного расходования питательного субстрата увеличивалась на 22,5 % за 15 мин, после чего постепенно снижалась до 59,6 % от исходного значения. В самом большом разбавлении 0,00025 моль/л светимость бактериального штамма в суспензии Mn 2 O 3 и Co 3 O 4 на первой секунде составляла соответственно 61,4 и 67,2 % от аналогичного показателя контрольной пробы, а при 0,25 моль/л — всего 10,2 и 0,5 %.
-
1. Индекс токсичности (Т, %) суспензии ультрадисперсных частиц (УДЧ) Co 3 O 4 при разной концентрации УДЧ в зависимости от времени контакта с клетками люминесцирующего штамма Escherichia coli K12TG1 в дистиллированной воде
-
2. Индекс токсичности (Т, %) суспензии ультрадисперсных частиц (УДЧ) Mn 2 O 3 при разной концентрации УДЧ в зависимости от времени контакта с клетками люминесцирующего штамма Escherichia coli K12TG1 в дистиллированной воде
-
3. Относительные значения биолюминесценции (А, %) проб с разным содержанием рубцовой жидкости (РЖ) быка породы казахская белоголовая в зависимости от времени контакта с клетками люминесцирующего штамма Escherichia coli K12TG1
Время,
Разведение РЖ, кратность
мин
1:2 1:4 1:8 1:16 1:32 1:64 1:128 1:256 1:512 1:1024 1:2048
-
4. Относительные значения биолюминесценции (А, %) проб с разными разведениями рубцовой жидкости (РЖ) быка породы казахская белоголовая и разной концентрацией ультрадисперсных частиц (УДЧ) Mn 2 O 3 в зависимости от времени контакта с клетками люминесцирующего штамма Escherichia coli K12TG1
-
5. Относительные значения биолюминесценции (А, %) проб с разными разведениями рубцовой жидкости (РЖ) быка породы казахская белоголовая и разной концентрацией ультрадисперсных частиц (УДЧ) Co 3 O 4 в зависимости от времени контакта с клетками люминесцирующего штамма Escherichia coli K12TG1
Время, мин
Концентрация УДЧ, моль½10 - 3 (разведение РЖ, кратность)
250 (1:2)
125 (1:4)
63 (1:8)
31 (1:16)
16 (1:32)
8 (1:64)
4 (1:128)
2 (1:256)
1 (1:512)
0,5 (1:1024)
0,25 (1:2048)
0 4,5/А 5,0/А 5,9/А 10,3/А 17,0/А 29,5/Б 51,9/В 74,5/В 92,8/Г 103,7/Г 97,1/Г
30 11,5/А 16,0/А 17,5/А 27,9/Б 37,8/Б 57,2/В 80,5/Г 101,6/Г 120,1/Д 131,7/Д 117,6/Г
60 14,4/А 24,0/Б 25,1/Б 40,2/Б 53,5/В 75,0/В 84,4/Г 103,9/Г 122,8/Д 128,8/Д 114,5/Г
90 18,2/А 32,0/Б 34,3/Б 53,2/В 68,2/В 93,6/Г 86,2/Г 103,8/Г 127,7/Д 120,6/Д 98,0/Г
120 23,5/Б 41,8/Б 44,9/Б 65,2/В 82,9/Г 114,2/Г 87,6/Г 97,7/Г 122,5/Д 105,9/Г 79,0/В
150 30,6/Б 54,9/В 55,5/В 79,5/В 102,3/Г 139,1/Д 88,1/Г 92,8/Г 113,6/Г 93,1/Г 64,6/В
180 35,7/Б 66,0/В 57,3/В 83,4/Г 113,8/Г 155,1/Д 83,7/Г 82,4/Г 97,1/Г 76,6/В 51,5/В
Примечание. А — ЕС 70 , Б — ЕС 50 , В — ЕС 20 , Г — NTOX, Д — NTOX+, то есть концентрации УДЧ, вызывающие свыше 75, 50 и 20 % тушения биосенсора по сравнению с контролем, нетоксичные и интенсифицирующие свечение концентрации.
-
6. Экологическая модель взаимодействия рубцовой жидкости быка породы казахская белоголовая с биолюминесцентным штаммом Escherichia coli K12TG1
Фактор Этап
Negative
Positive
S F S F S F
1:2 1:4 1:8
Разведение 1:16 1:32 1:64 1:128 1:256 1:512 1:1024 1:2048
BL
M
↑
↑
↑
↑
↑
↑
con
con
↓
↓
↓
A
3,69
5,27
6,03
6,37
6,70
7,69
3,50
1,94
1,39
1,44
1,17
B
8,70
6,84
4,79
4,16
3,38
3,32
1,55
0,88
0,63
0,71
0,59
Примечание. Negative — отрицательные факторы среды (H+, ЛЖК, NH 3 , CH 4 , хищные простейшие, конкурентные анаэробы), positive — питательные субстраты (включая глюкозу), BL — интенсивность био-
люминесценции, A — отношение светимости опытной пробы к светимости в контрольной в конце эксперимента, B — отношение светимости в конце эксперимента к светимости в начале; S (start) — начало опыта, F (finish) — конец опыта, M (movement) — динамика биолюминесценции; ■ — низкое содержание, ■ — высокое содержание, — промежуточное значение компонента в среде; ↓ — снижение, ↑ — рост,
con — поддерживание на одном уровне биолюминесценции.
Значения индекса Т, при вычислении которых контроль принимался за 100 %, наглядно свидетельствовали о снижении токсичных свойств суспензии с уменьшением в ней доли УДЧ. Для Mn 2 O 3 индекс Т составлял от 89,76 % при концентрации 0,25 моль/л до 38,57 % при 0,00025 моль/л на 1-й мин эксперимента и от 95,16 до 52,85 % в конце 3-го ч (табл. 1). Для Co 3 O 4 индекс Т был равен соответственно 99,44 и 32,80 % на 1-й мин, 99,43 и 54,72 % в конце 3-го ч (табл. 2).
В опыте с рубцовой жидкостью без контаминации УДЧ относительное значение биолюминесценции колебалось от 25,29 до 769,10 % с тенденцией к росту. Так, первая проба с внесением нативного руминального содержимого в течение первых 30 мин описывалась критериями ЕС70 и ЕС30, то есть ингибированием соответственно 70 и 30 % свечения люминесциру-ющего штамма. Однако, начиная со 2-го ч, образец не мог оцениваться как токсичный, более того, его показатели к концу опыта превышали контрольные в 3,5 раза (рис. 2). Во втором разведении (1:4) интенсивность биолюминесценции на первой секунде соответствовала показателю EC 50, после чего возрастала в 6,8 раза (или в 5,27 раза относительно контроля). В целом, светимость проб была обратно-пропорциональна концентрации рубцовой жидкости до разведений 1:32-1:64 включительно, после чего тенденция менялась. При этом в пределах одной концентрации значения биолюминесценции росли в течение 3 ч до 128-го разведения, далее (1:256-1:2048) в первые 30 мин регистрировался рост с последующим падением свечения ниже исходных показателей. Общая динамика демонстрировала резкое увеличение светимости в первые 20-30 мин с последующим замедлением (разбавления в 4-128 раз) или медленным снижением уровня биолюминесценции (разбавления в 256-2048 раз) (табл. 3).
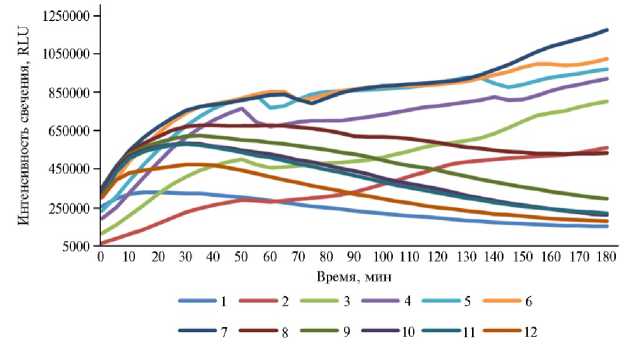
Рис. 2. Динамика биолюминесценции штамма Escherichia coli K12TG1 в рубцовой жидкости быка породы казахская белоголовая при разном разведении: 1 — контроль (дистиллированная вода), 2 — в 2 раза, 3 — в 4 раза, 4 — в 8 раз, 5 — в 16 раз, 6 — в 32 раза, 7 — в 64 раза, 8 — в 128 раз, 9 — в 256 раз, 10 — в 512 раз, 11 — в 1024 раза, 12 — в 2048 раз.
|
0 |
25,2/A |
45,9/Б |
75,19/В |
91,3/Г |
118,4/Д 138,1/Д 134,4/Д 132,0/Д 130,7/Д |
121,1/Д |
118,7/Д |
|
30 |
69,6/В |
126,9/Д |
189,3/Д |
207,7/Д |
228,4/Д 232,2/Д 207,3/Д 191,3/Д 179,9/Д |
178,6/Д |
145,8/Д |
|
60 |
98,5/Г |
160,7/Д |
235,2/Д |
269,6/Д |
298,6/Д 292,2/Д 237,0/Д 206,4/Д 184,3/Д |
178,4/Д |
144,3/Д |
|
90 |
140,6/Д |
208,6/Д |
303,3/Д |
366,0/Д |
369,0/Д 366,7/Д 264,6/Д 224,4/Д 187,4/Д |
177,9/Д |
136,9/Д |
|
120 |
233,4/Д |
294,9/Д |
397,5/Д |
459,8/Д |
453,8/Д 459,8/Д 300,4/Д 226,0/Д 176,7/Д |
167,5/Д |
128,2/Д |
|
150 |
309,6/Д |
423,41/Д |
491,7/Д |
538,0/Д |
592,6/Д 622,1/Д 324,9/Д 216,6/Д 160,1/Д |
156,4/Д |
124,6/Д |
|
180 |
368,7/Д |
526,73/Д |
603,2/Д |
636,7/Д |
670,1/Д 769,1/Д 349,8/Д 193,7/Д 139,0/Д |
144,2/Д |
117,2/Д |
Примечание. А — ЕС 70 , Б — ЕС 50 , В — ЕС 20 , Г — NTOX, Д — NTOX+, то есть концентрации УДЧ, вызывающие свыше 75, 50 и 20 % тушения биосенсора по сравнению с контролем, нетоксичные и интенсифицирующие свечение концентрации.
При комбинации рубцовой жидкости с ультрадисперсными частицами окиси марганца и кобальта наблюдалась регрессия токчичных свойств последних, вследствие чего графическое отображение динамики биолюминесценции приближалось к аналогичному для рубцовой жидкости (рис. 3), хотя максимальные показатели светимости в комплексе с Mn2O3 составляли лишь 43,28 % от аналогичных для нативной РЖ, в сочетании с Co3O4 — 36,44 %. В первом случае образцы с концентрацией УДЧ 0,00025 и 0,0005 моль/л повторяли изменения в контроле, но превышали его по уровню свечения, все остальные пробы изначально уступали по биолюминесценции суспензии без УДЧ, но обгоняли ее в различные интервалы времени, превышая к концу эксперимента в 2,32-3,22 раза. Во втором случае динамику в контроле повторяли, но не превышали значения пробы с концентрациями УДЧ 0,004 и 0,002 моль/л. Напротив, разведения 0,001-0,0002 моль/л, имея ту же динамику, превышали контрольные значения, 0,25-0,031 моль/л — не достигали их, а 0,016 и 0,008 моль/л — превышали всего в 1,14-1,55 раза.
А
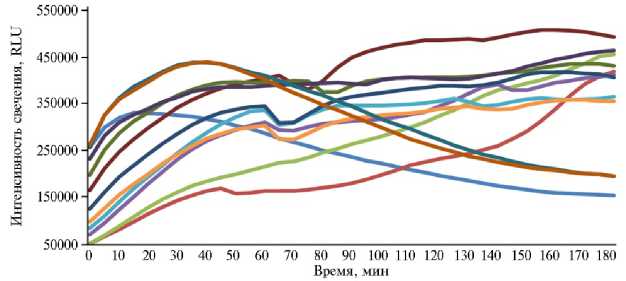
Б
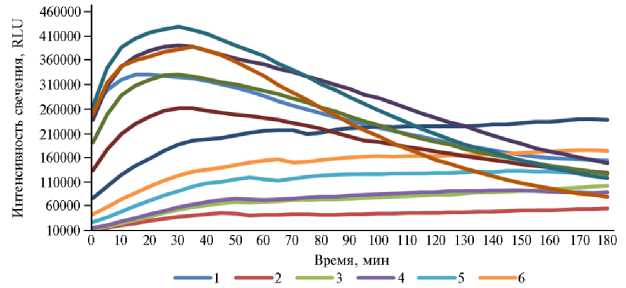
-------7 -------8 ------9 -------10 -------11 -------12
Рис. 3. Динамика биолюминесценции штамма Escherichia coli K12TG1 в рубцовой жидкости быка породы казахская белоголовая при различном разведении и разных концентрациях УДЧ Mn 2 O 3 (А) и Co 3 O 4 (Б) : 1 — 0 моль/л (дистиллированная вода) (контроль), 2 — 0,25 моль/л (разведение в 2 раза), 3 — 0,125 моль/л (в 4 раза), 4 — 0,063 моль/л (в 8 раз), 5 — 0,031 моль/л (в 16 раз), 6 — 0,016 моль/л (в 32 раза), 7 — 0,008 моль/л (в 64 раза), 8 — 0,004 моль/л (в 128 раз), 9 — 0,002 моль/л (в 256 раз), 10 — 0,001 моль/л (в 512 раз), 11 — 0,0005 моль/л (в 1024 раза), 12 — 0,00025 моль/л (в 2048 раз).
|
Время, мин |
Концентрация УДЧ, моль/л½10 - 3 (разведение РЖ, кратность) |
||||||||||
|
250 (1:2) |
125 (1:4) |
63 (1:8) |
31 (1:16) |
16 (1:32) |
8 (1:64) |
4 (1:128) |
2 (1:256) |
1 (1:512) |
0,5 (1:1024) |
0,25 (1:2048) |
|
|
0 19,6/А 19,6/А 27,1/А 32,1/Б 37,6/Б 48,4/Б 64,3/В 77,1/В 90,2/Г 99,9/Г 102,4/Г 30 43,6/Б 49,4/Б 70,6/В 74,9/В 74,0/В 87,7/Г 105,1/Г 113,1/Г 112,0/Г 132,8/Д 132,0/Д 60 56,8/В 75,2/В 108,3/Г 117,4/Г 106,0/Г 120,5/Д 141,0/Д 138,0/Д 136,0/Д 143,3/Д 140,6/Д 90 76,4/В 111,8/Г 132,7/Д 146,9/Д 135,6/Д 154,9/Д 191,0/Д 165,4/Д 166,7/Д 146,5/Д 137,6/Д 120 117,6/Г 164,6/Д 175,2/Д 181,0/Д 172,2/Д 197,9/Д 247,6/Д 206,6/Д 205,7/Д 138,7/Д 129,8/Д 150 175,5/Д 238,0/Д 228,8/Д 217,7/Д 210,1/Д 249,6/Д 304,7/Д 254,2/Д 259,6/Д 132,6/Д 129,3/Д 180 273,7/Д 298,4/Д 269,5/Д 238,5/Д 232,8/Д 265,8/Д 322,5/Д 281,9/Д 304,0/Д 127,5/Д 127,7/Д |
|||||||||||
Примечани е. А — ЕС70, Б — ЕС50, В — ЕС20, Г — NTOX, Д — NTOX+, то есть концентрации УДЧ, вызывающие свыше 75, 50 и 20 % тушения биосенсора по сравнению с контролем, нетоксичные и интенсифицирующие свечение концентрации.
Это свидетельствует о большей токсичности окиси кобальта в сравнении с окисью марганца, что подтвердилось при расчете относительного значения биолюминесценции (табл. 4, 5). Отсюда же выводятся субтоксичные концентрации УДЧ, то есть такое их количество, которое на протяжении всего опыта не вызывало более 20 % гашения биолюминисценции: для Mn2O3 и Co3O4 эта величина составляла 0,001 моль/л в 1024-кратном разбавлении рубцовой жидкости.
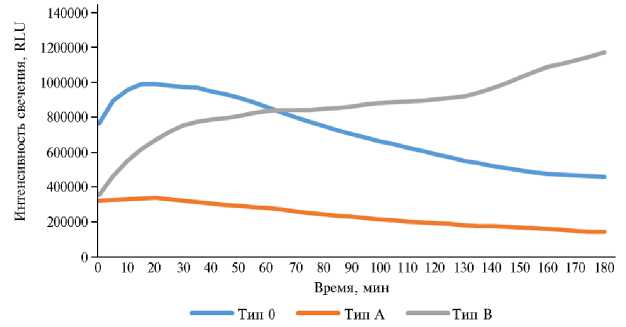
Рис. 4. Динамика биолюминесценции клеток штамма Escherichia coli K12TG1 при контакте с разными образцами: тип 0 — контроль (динамика люминесценции соответствует фазам роста культуры бактерий), тип А — глубокий (подавление свечения при внесении ультрадисперсных частиц на протяжении всего опыта), тип В — конкурентный (рост свечения от отрицательных значений к положительным в среде с рубцовой жидкостью быка породы казахская белоголовая или комплексом УДЧ + РЖ на протяжении всего опыта).
Согласно полученным в настоящей работе данным, все динамические процессы можно было разделить на несколько типов (рис. 4).
Тип 0 (контроль) — при отсутствии в среде УДЧ и РЖ светимость E. coli K12 TG1 была пропорциональна скорости развития культуры и соответствовала фазам логарифмического роста, отрицательного ускорения, стационарной фазе и фазе отмирания (лаг-фаза и период положительного ускорения проходили во время подготовки проб к анализу).
Тип А (глубокий) — в присутствии УДЧ оксидов марганца и кобальта биолюминесценция препарата снижалась на протяжении всего периода экспозиции, что иллюстрировало глубокое дегенеративное воздействие, степень которого уменьшалась вместе с концентрацией УДЧ в суспензии. В проведенном эксперименте она не достигла допустимых значений (T < 20 %) даже при разбавлении в 1024 раза (0,00025 моль/л), что было связано с реакционной способностью и физико-химической динамикой УДЧ
(47), высокая цито- и генотоксичность которых подтверждена в ряде работ. Так, F. Ameen с соавт. (48), используя в качестве объекта исследования почвенную ризофлору, включающую бактерии родов Rhizobium , Bradyrhizobium , Azotobacter , Bacillus , Thiobacillus , Pseudomonas , Azospirillum и микоризные грибы, указал на негативные эффекты металлических УДЧ: индукцию апоптоза, структурные повреждения клеточной стенки, ингибирование биологической фиксации азота, процессов нитрификации, ферментов уреазы, N-аце-тилглюкозаминидазы, глицин-аминопептидазы, арилсульфатазы, полифе-нолоксидазы и пероксидазы, что дестабилизирует почвенное сообщество.
Что касается непосредственно марганца и кобальта, то их токсические свойства были оценены на млекопитающих (49, 50), растениях (51-53), рыбах (29), беспозвоночных (54) и протсейших, включая реснитчатых рубца (26) и паразитических лейшманий (55). S. Rana с соавт. (56), изучая консорциум водорослей и бактерий, выделили следующие этапы воздействия УДЧ: изменение проницаемости мембран, поверхностная адсорбция, повреждение транспортных белков; проникновение внутрь бактериальной клетки; взаимодействие с клеточными органеллами; генерация активных форм кислорода (АФК); начало дегенеративных изменений. Подобный эффект связан со способностью металлов переменной валентности осуществлять процессы перекисного окисления липидов и образовывать вещества, блокирующие активные центры ферментов (57), включая люциферазу, ответственную за биолюминесценцию (58).
При этом большинство исследователей сходятся во мнении, что причиной токсичности УДЧ становится окислительный стресс, сопровождаемый выработкой АФК, снижением содержания восстановленного глутатиона, повышением перикисного окисления липидов и высвобождением ионов металла, вызывающих коагуляцию белка и агрегацию бактерий. Другим механизмом токсичности может выступать иммобилизация УДЧ на плазмалемме клетки, описанная, в частности, Thabitha P. Dasari с соавт. (59) на примере E. coli . Причем в их работе УДЧ располагались по степени токсичности в следующем порядке: ZnO < CuO < Co 3 O 4 < TiO 2 в темноте и ZnO < CuO < TiO 2 < Co 3 O 4 при освещении.
Тип B (конкурентный) — в пробах с руминальным содержимым без контаминации УДЧ и при их добавлении наблюдалось минимальное излучение в начале опыта с последующим ростом. Такую динамику можно объяснить, исходя из состава рубцового содержимого, главный компонент которого — симбионтная микробиальная масса. Она в основном состоит из бактерий, простейших, грибов, архей и небольшой доли фагов, находящихся в динамическом равновесии (60). По сути, это отдельная экосистема со своими консументами и редуцентами, каждый из которых выполняет определенную роль — разрушение растительных клеточных стенок, сбраживание органических компонентов и утилизацию продуктов обмена.
Бактерии представлены главным образом анаэробными лигноцеллюлозолитическими Prevotella , Butyrivibrio , Ruminococcus , Lachnospiraceae , Ruminococcaceae , Bacteroidales и Clostridiales (61), археи — метаногенными Methanobrevibacter , Methanosphaera и Methamassilicoccus (62), грибы — Neocal-limastix , Caecomyces , Piromyces , Anaeromyces , Oorpinomyces и Cyllamyces (63), реснитчатые и жгутиковые простейшие — Entodinium и Epidinium (64). Различные микроорганизмы секретируют пищеварительные ферменты, такие как целлюлазы, гемицеллюлазы и лигниназы. С их помощью микроорганизмы рубца превращают целлюлозу, гемицеллюлозу и лигнины в моно-сахриды, которые могут быть дополнительно преобразованы в летучие жирные кислоты, CH 4 и другие продукты (18, 65).
В работе по оценке влияния нормального компонентного состава рубцовой жидкости на свечение биосенсора Е.А. Дроздова с соавт. (57) предположили, что пониженная светимость обусловлена наличием в РЖ свободных ионов водорода, ферментов и аммиака, а также отдельно исследовали эффекты глюкозы, пропионовой, молочной, янтарной, уксусной кислоты и 10 % раствора аммиака, в результате чего были выявлены интенсификация свечения в первом случае, незначительное ее подавление во втором-четвертом и сильное — в двух последних. Это согласуется с представленной далее экологической моделью динамических процессов в рубце.
Низкую светимость биолюминесцентного штамма на первых минутах нашего эксперимента можно объяснить его адаптацией к химическому содержимому рубцовой жидкости и конкуренцией с анаэробными представителями, доля которых на воздухе будет непременно снижаться. При этом замедляются процессы брожения и, как следствие, синтез короткоцепочечных жирных кислот, аммиака и водорода и далее метана. Иными словами, снимается серия негативных факторов, ингибирующих культуру кишечной палочки. При этом в среде остается достаточно много глюкозы, а единственной угрозой для роста и развития E. coli K12 TG1 выступают инфузории, изменяется структура нативного сообщества.
Подобные выводы подтверждаются нашими данными (см. рис. 2, табл. 4), следовательно, можно постулировать экологическую модель динамики биолюминесценции в руминальном содержимом (табл. 6).
Исходя из этой модели определяется «экологический оптимум» соотношения биолюминесцентный штамм/степень разведения рубцовой жидкости, который соответствует 100 мкл бактериальной суспензии на 100 мкл РЖ в разбавлении 1:64, когда светимость биосенсора растет на протяжении всего эксперимента (критерий B > 1) и превышает контрольные значения (критерий A = Max).
Последний опыт, в котором изучалось взаимодействие УДЧ и РЖ, по сути был усреднением опытов 1 и 2 с динамическими типами A и B. Высвобождаемые ионы металлов связываются жирными кислотами с образованием нетоксичных солей — ацетата, пропионата и др., а также могут асссоциироваться с протеином РЖ с образованием белковой короны (37, 66), использоваться в метаболизме бактерий рубца (67) и инактивироваться грибами (68). В связи с этим изначально низкие при высоких концентрациях УДЧ относительные значения биолюминесценции к концу опыта превышали контрольные показатели (см. табл. 4, 5). Однако отмечались различия между оксидами марганца и кобальта: в первом случае восстановление и рост светимости происходили значительно быстрее, что может быть связано с химической природой самих элементов (59), степенью их дисперсности или возможностью образования крупных агрегатов (69) и согласуется с данными первого опыта.
Таким образом, ультрадисперсные частицы Mn 2 O 3 и Co 3 O 4 в чистом виде дозозависимо, а также пропорционально времени экспозиции ингибируют бактериальную люминесценцию штамма Escherichia coli K12TG1, подавляя свыше 50 % (ЕС 50 ) свечения при разведении даже в 2048 раз (0,00025 моль/л). Так, индекс токсичности для УДЧ Mn 2 O 3 составлял от 89,76 % при концентрации 0,25 моль/л до 38,57 % при 0,00025 моль/л на 1-й мин эксперимента и от 95,16 до 52,85 % в конце 3-го ч; для Co 3 O 4 — соответственно 99,44 и 32,80 % на 1-й мин, 99,43 и 54,72 % в конце 3-го ч. Рубцовая жидкость, полученная от быка породы казахская белоголовая, в свою очередь, подавляет свечение лишь на первых минутах взаимодействия, что может быть опосредовано наличием в ней «конкурирующих» анаэробных микроорганизмов, а также постепенно улетучивающихся токсичных продуктов обмена веществ (аммиак), после чего выступает как дополнительный питательный субстрат, интенсифицируя люминесценцию более чем в 7 раз при разведении 1:64. Сочетание рубцовой жидкости с частицами окислов металлов приводит к ингибированию их токсичности по отношению к тест-объекту, хотя максимальные значения относительной люминесценции все же уступают таковым для нативной рубцовой жидкости, что говорит о взаимном связывании компонентов среды с УДЧ. На основании полученных результатов можно утверждать, что использование ультрадис-персных частиц как источников микроэлементов в кормлении жвачных животных перспективно и требует дальнейших исследований.
Список литературы Бактериальная люминесценция марганец- и кобальтсодержащих ультрадисперсных частиц (Mn2O3 и Co3O4) в рубцовой жидкости
- Viktorova E.V., Savchenkova I.P. Мultipotent mesenchymal stem cells in clinical veterinary prac-tice. IOP Conference Series: Earth and Environmental Science, 2020, 548: 072072 (doi: 10.1088/1755-1315/548/7/072072).
- Platonova S.A., Korovina D.G., Viktorova E.V., Savchenkova I.P. Еquine tendinopathy therapy using mesenchymal stem cells. KnE Life Sciences, 2021, 6(3): 533-541 (doi: 10.18502/kls.v0i0.8987).
- Hade M.D., Suire C.N., Suo Z. Mesenchymal stem cell-derived exosomes: applications in re-generative medicine. Cells, 2021, 10(8): 1959 (doi: 10.3390/cells10081959).
- Gowen A., Shahjin F., Chand S., Odegaard K.E., Yelamanchili S.V. Mesenchymal stem cell-derived extracellular vesicles: challenges in clinical applications. Frontiers in Cell and Developmen-tal Biology, 2020, 8: 149 (doi: 10.3389/fcell.2020.00149).
- Mathivanan S., Ji H., Simpson R.J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics, 2010, 73(10): 1907-1920 (doi: 10.1016/j.jprot.2010.06.006).
- Bazzan E., Tinè M., Casara A., Biondini D., Semenzato U., Cocconcelli E., Balestro E., Da-min M., Radu C.M., Turato G., Baraldo S., Simioni P., Spagnolo P., Saetta M., Cosio M.G. Critical review of the evolution of extracellular vesicles' knowledge: from 1946 to today. Int. J. Mol. Sci., 2021, 22(12): 6417 (doi: 10.3390/ijms22126417).
- Doyle L.M., Zhuo W.M. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosomeiIsolation and analysis. Cells, 2019, 8(7): 727 (doi: 10.3390/cells8070727).
- Tran P., Xiang D., Tran T., Yin W., Zhang Y., Kong L., Chen K., Sun M., Li Y., Hou Y., Zhu Y., Duan W. Exosomes and nanoengineering: a match made for precision therapeutics. Adv. Mater., 2020, 32(18): e1904040 (doi: 10.1002/adma.201904040).
- Fang Y., Zhang Y., Zhou J., Cao K. Adipose-derived mesenchymal stem cell exosomes: a novel pathway for tissues repair. Cell and Tissue Banking, 2019, 20(2): 153-161 (doi: 10.1007/s10561-019-09761-y).
- Doyle L.M., Wang M.Z. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells, 2019, 8(7): 727 (doi: 10.3390/cells8070727).
- Chen J., Liu R., Huang T., Sun H., Jiang H. Adipose stem cells-released extracellular vesicles as a next-generation cargo delivery vehicles: a survey of minimal information implementation, mass production and functional modification. Stem Cell Res. Ther., 2022, 13(1): 182 (doi: 10.1186/s13287-022-02849-5).
- Moccia V., Sammarco A., Cavicchioli L., Castagnaro M., Bongiovanni L., Zappulli V. Extracel-lular vesicles in veterinary medicine. Animals, 2022, 12(19): 2716 (doi: 10.3390/ani12192716).
- Nahand J.S., Mahjoubin-Tehran M., Moghoofei M., Pourhanifeh M.H., Mirzaei H.R., Asemi Z., Khatami A., Bokharaei-Salim F., Mirzaei H., Hamblin M.R. Exosomal miRNAs: novel players in viral infection. Epigenomics, 2020, 12(4): 353-370 (doi: 10.2217/epi-2019-0192).
- Zhou C., Tan L., Sun Y., Qiu X., Lia Y., Song C., Liu W., Nair V., Ding C. Exosomes carry microRNAs into neighboring cells to promote diffusive infection of newcastle disease virus. Vi-ruses, 2019, 11(6): 527 (doi: 10.3390/v11060527).
- Mao L., Liang P., Li W., Zhang S., Liu M., Yang L., Li J., Li H., Hao F., Sun M., Zhang W., Wang L., Cai X., Luo X. Exosomes promote caprine parainfluenza virus type 3 infection by inhibiting autophagy. Journal of General Virology, 2020; 101: 717-734 (doi: 10.1099/jgv.0.001424).
- Волкова И.М., Викторова Е.В., Савченкова И.П., Гулюкин М.И. Характеристика мезен-химных стволовых клеток, выделенных из костного мозга и жировой ткани крупного ро-гатого скота. Сельскохозяйственная биология, 2012, 47(2): 32-38.
- Коровина Д.Г., Юров К.П., Волкова И.М., Алексеенкова С.В., Васильева С.А., Савчен-кова Е.А., Савченкова И.П. Пуповинная кровь лошадей как источник мультипотентных мезенхимных стволовых клеток. Коневодство и конный спорт, 2015, 6: 31-33.
- Коровина Д.Г., Волкова И.М., Васильева С.А., Гулюкин М.И., Савченкова И.П. Мультипо-тентные мезенхимные стволовые клетки, выделенные из костного мозга овцы: получение и криоконсервирование. Цитология, 2019, 61(1): 35-44 (doi: 10.1134/S0041377119010036).
- Савченкова И.П., Васильева С.А., Коровина Д.Г., Шабейкин А.А., Гулюкин А.М. Мезенхимные стволовые клетки из жировой ткани кошек и собак в культуре. Сельскохозяйственная биология, 2019, 54(2): 395-403 (doi: 10.15389/agrobiology.2019.2.395rus).
- Brenner S., Horne R.W. A negative staining method for high resolution electron microscopy of viruses. Biochimica et Biophysica Acta, 1959, 34: 103-110 (doi: 10.1016/0006-3002(59)90237-9).
- Klymiuk M.C., Balz N., Elashry M.I., Heimann M., Wenisch S., Arnhold S. Exosomes isolation and identification from equine mesenchymal stem cells. BMC Vet. Res., 2019, 5(1): 42 (doi: 10.1186/s12917-019-1789-9).
- Aguilera-Rojas M., Badewien-Rentzsch B., Plendl J., Kohn B., Einspanier R. Exploration of serum- and cell culture-derived exosomes from dogs. BMC Vet. Res., 2018, 14(1): 179 (doi: 10.1186/s12917-018-1509-x).
- Sung S.-E., Seo M.-S., Kang K.-K., Choi J.-H., Lee S., Sung M., Kim K., Lee G.-W., Lim J.-H., Yang S.-Y., Yim S.-G., Kim S.-K., Park S., Kwon Y.S., Yun S. Mesenchymal stem cell exosomes derived from feline adipose tissue enhance the effects of anti-inflammation compared to fibro-blasts-derived exosomes. Vet. Sci., 2021, 8(9): 182 (doi: 10.3390/vetsci8090182).
- Soares M.T., Catita J., Martins R.I., A.B. da e Silva O., Henriques A.G. Exosome isolation from distinct biofluids using precipitation and column-based approaches. PLoS ONE, 2018, 13(6): e0198820 (doi: 10.1371/journal.pone.0198820).
- Huang L.-H., Rau C.-S., Wu S.-C., Wu Y.-C., Wu C.-J., Tsai C.-W., Lin C.-W., Lu T.-H., Hsieh C.- H. Identification and characterization of hADSC-derived exosome proteins from dif-ferent isolation methods. J. Cell. Mol. Med., 2021, 25(15): 7436-7450 (doi: 10.1111/jcmm.16775).
- Helwa I., Cai J., Drewry M.D., Zimmerman A., Dinkins M.B., Khaled M.L., Seremwe M., Dismuke W.M., Bieberich E., Stamer W.D., Hamrick M.W., Liu Y. A comparative study of serum exosome isolation using differential ultracentrifugation and three commercial reagents. PLoS ONE, 2017, 12(1): e170628 (doi: 10.1371/journal.pone.0170628).
- Kurian T.K., Banik S., Gopal D., Chakrabarti S., Mazumder N. Elucidating methods for isolation and quantification of exosomes: a review. Molecular Biotechnology, 2021, 63(4): 249-266 (doi: 10.1007/s12033-021-00300-3).
- Coughlan C., Bruce K.D., Burgy O., Boyd T.D., Michel C.R., Garcia-Perez J.E., Adame V., Anton P., Bettcher B.M., Chial H.J., Königshoff M., Hsieh E.W.Y., Graner M., Potter H. Exo-some isolation by ultracentrifugation and precipitation and techniques for downstream analyses. Current Protocols in Cell Biology, 2020, 88(1): e110 (doi: 10.1002/cpcb.110).
- Koritzinsky E.H., Street J.M., Chari R.R., Glispie D.M., Bellomo T.R., Aponte A.M., Star R.A., Yuen P. Circadian variation in the release of small extracellular vesicles can be normalized by vesicle number or TSG101. American Journal of Physiology-Renal Physiology, 2019, 317(5): F1098-F1110 (doi: 10.1152/ajprenal.00568.2017).


