Бессимптомная церебральная ишемия после стентирования сонных артерий как предиктор когнитивных нарушений
Автор: Осипова О.С., Гостев А.А., Бугуров С.В., Игнатенко П.В., Чернявский А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Эндоваскулярная хирургия
Статья в выпуске: 1 т.29, 2025 года.
Бесплатный доступ
Цель. Сравнить когнитивные функции пациентов с бессимптомными церебральными очагами ишемии и без очагов ишемии головного мозга после стентирования внутренних сонных артерий. Методы. Провели проспективное когортное исследование, основанное на субанализе 100 пациентов из базы данных исследования SIBERIA, которым выполнили стентирование внутренних сонных артерий. Из анализа исключили больных с инсультами в анамнезе или контрлатеральной окклюзией внутренней сонной артерии, с развитием сосудистого события или смерти в течение 12 мес. наблюдения, а также лиц, с которыми был потерян контакт. Пациенты проходили опросник MMSE (англ. Mini-Mental State Examination, краткая шкала оценки психического статуса) до стентирования и через 6 и 12 мес. после процедуры. Все 3 тестирования прошли 39 участников с бессимптомными очагами церебральной ишемии и 36 пациентов без очагов ишемии, выявленных на диффузионно-взвешенной магнитно-резонансной томографии головного мозга в раннем послеоперационном периоде. Выполнена псевдорандомизация в соотношении 1:1 методом сопоставления склонностей, после этого в группы включено по 30 человек. Первичная конечная точка — развитие предеменции или деменции. Результаты. В группе пациентов с бессимптомными очагами ишемии головного мозга выявили как статистически значимо меньшую медиану набранных баллов по опроснику MMSE (26 [25; 28] против 28 [28; 29], p < 0,001), так и большее количество лиц с деменцией или предеменцией (18 (60 %) против 7 (23,3 %), p = 0,008) по сравнению с контрольной группой через 12 мес. после стентирования внутренних сонных артерий. Бессимптомные очаги церебральной ишемии увеличивали риск развития предеменции или деменции в течение 12 мес. после стентирования (отношение рисков 2,57 [95% доверительный интервал 1,07; 6,15], p = 0,02). Суммарный объем бессимптомных очагов церебральной ишемии головного мозга ≥ 78 мм3 прогнозировал снижение когнитивных функций. Заключение. Бессимптомные очаги острой ишемии головного мозга после стентирования внутренних сонных артерий статистически значимо приводили к развитию когнитивных нарушений в течение 12 мес. после процедуры.
Ишемия мозга, когнитивное нарушение, нейрокогнитивный тест, стеноз сонной артерии, стентирование сонной артерии
Короткий адрес: https://sciup.org/142243996
IDR: 142243996 | DOI: 10.21688/1681-3472-2025-1-7-17
Текст научной статьи Бессимптомная церебральная ишемия после стентирования сонных артерий как предиктор когнитивных нарушений
О.С. Осипова, https://orcid. org/0000-0002-7418-3298 А.А. Гостев, https://orcid. org/0000-0002-7806-7868 С.В. Бугуров, https://orcid. org/0000-0002-6875-5122 П.В. Игнатенко, https://orcid. org/0000-0001-8695-0848 А.М. Чернявский, https://orcid. org/0000-0001-9818-8678
How to cite: Osipova O.S., Gostev A.A., Bugurov S.V., Ignatenko P.V., Chernyavskiy A.M. Asymptomatic cerebral ischemia after carotid artery stenting as a predictor of cognitive impairment. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2025;29(1):7-17. (In Russ.)
O.S. Osipova, A.A. Gostev, S.V. Bugurov, P.V. Ignatenko, https://orcid.
A.M. Chernyavskiy, https://orcid. org/0000-0001-9818-8678
Инсульт является ключевым показателем эффективности во многих клинических испытаниях, сравнивающих стентирование внутренней сонной артерии (ВСА) и каротидную эндартерэктомию [1–3]. Вероятность развития инвалидизирующего инсульта после обоих методов лечения бессимптомного стеноза сонной артерии сопоставима [3–6]. Однако после реваскуляризирующих процедур могут появляться «немые» очаги церебральной ишемии, которые не вызывают неврологического дефицита [7; 8]. Эндоваскулярные вмешательства демонстрируют более высокую частоту возникновения «немых» очагов ишемии головного мозга (ГМ) в сравнении с традици- онным открытым вмешательством [3; 8–10]. Согласно ряду исследований, частота развития бессимптомных ишемических повреждений мозга после стентирования может достигать 80 % случаев [8; 9; 11].
Клинический прогноз бессимптомных ишемических поражений ГМ после реваскуляризации сонных артерий остается недостаточно исследованным. Многие авторы прослеживают взаимосвязь между наличием бессимптомных очагов церебральной ишемии и риском когнитивных нарушений в долгосрочной перспективе [12–14]. Проведено несколько исследований, изучающих когнитивный статус после стентирования ВСА у пациентов с бессимптомными стенозами [15–18], но отсутствие выравнивания групп сравнения, малое число наблюдений и выявленных в них послеоперационных очагов ишемии ГМ являются основными ограничениями этих работ. Более того, отсутствуют данные о пороговом объеме бессимптомного поражения ГМ, который имеет критическое значение для изменения когнитивного статуса. Оценка клинической значимости бессимптомного поражения ГМ будет способствовать оптимизации выбора метода реваскуляризации и формированию послеоперационного плана наблюдения.
Цель — сравнение когнитивных функций пациентов с бессимптомными церебральными очагами ишемии и без очагов ишемии ГМ после стентирования внутренних сонных артерий.
Методы
Дизайн исследования
Провели проспективное когортное исследование, основанное на субанализе 100 пациентов из базы данных рандомизированного контролируемого исследования SIBERIA (ClinicalTrials.gov Identifier: NCT03488199) [19], которым была выполнена чрескожная транслюминальная ангиопластика со стентированием ВСА. Всем больным за 2 дня до операции и через 2 и 30 дней после вмешательства проводили диффузионно-взвешенную магнитно-резонансную томографию (ДВ-МРТ) ГМ и осмотр невролога. По результатам ДВ-МРТ пациентов разделили на 2 исследуемые группы. В 1-ю группу вошли больные с новыми бессимптомными («немыми») очагами ишемии ГМ, во 2-ю группу (контрольную) — лица без очагов ишемии ГМ. Бессимптомными («немыми») очагами ишемии считали обнаруженные с помощью ДВ-МРТ очаги ишемического поражения ГМ, которые не проявлялись никакими неврологическими нарушениями [7; 8]. Пациенты проходили опросник MMSE (англ. Mini-Mental State Examination, краткая шкала оценки психического статуса) за 1–2 дня до процедуры и через 6 и 12 мес. после стентирования. Дизайн исследования представлен на рис. 1.
Исследование проведено в соответствии с принципами Хельсинкской декларации и рекомендациями по надлежащей клинической практике.
2 пациента исключены (инсульт)
Без очагов острой ишемии головного мозга, n = 40
С «немыми» очагами острой ишемии головного мозга, n = 41

n = 39
n = 30


->
Опросник MMSE через 6 и 12 мес. после стентирования

Псевдорандомизация 1:1

6 пациентов исключены: 3 – летальный исход, 3 – отсутствие контакта
n = 36
n = 30
Рис. 1. Дизайн исследования
Примечание. ДВ-МРТ — диффузионно-взвешенная магнитно-резонансная томография; MMSE (англ. Mini-Mental State Examination) — краткая шкала оценки психического статуса.
Исследование SIBERIA одобрено локальным этическим комитетом ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России (протокол № 7 от 26 мая 2017 г.).
Обор пациентов
Критерии включения: пациенты, перенесшие стентирование ВСА, из базы данных исследования SIBERIA, наличие информированного согласия на прохождение нейропсихологического тестирования.
Критерии исключения: базовая оценка по шкале MMSE < 24 баллов, пациенты с инсультом и/или контрлатеральной окклюзией ВСА в анамнезе, сосудистое событие (инсульт/транзиторная ишемическая атака/инфаркт миокарда) или смерть в течение периода наблюдения, отсутствие контакта с пациентом.
Методика стентирования
Все процедуры стентирования ВСА выполнял один и тот же оператор под местной анестезией через трансфеморальный сосудистый доступ с установкой дистального устройства противоэмболиче-ской защиты — фильтр-ловушки Emboshield NAV6 (Abbott, Эбботт-Парк, США). Использовали следующие типы стентов: стент с открытой ячейкой Acculink (AbbottVascular, Эбботт-Парк, США), двуслойный стент CGuard (InspireMD, Тель-Авив, Израиль; Майами, США). Выбор стента определяли рандомизацией согласно протоколу исследования SIBERIA [19].
Медикаментозная терапия
За 3–24 ч до стентирования пациенты получали нагрузочную дозу антиагрегантных препаратов (300 мг ацетилсалициловой кислоты и 300 мг кло-пидогрела). В послеоперационном периоде ежедневно принимали двойную антиагрегантную терапию в объеме 75 мг ацетилсалициловой кислоты и 75 мг клопидогрела в течение как минимум 6 мес. После окончания двойной антиагрегантной терапии продолжали прием ацетилсалициловой кислоты длительно. Также всем больным в предоперационном периоде и после вмешательства назначали гиполипидемическую терапию.
Диффузионно-взвешенная магнитно-резонансная томография
Для обнаружения очагов острой ишемии ГМ за 2 дня до и через 2, 30 дней после стентирования ВСА всем пациентам выполняли ДВ-МРТ ГМ на установке 1,5 Tл Avanto (Siemens, Эрланген, Германия).
Сканирование включало следующие режимы: диффузионно-взвешенное изображение с автоматической реконструкцией измеренного коэффициента диффузии, режимы T1 и T2-взвешенного изображения, режим изображения с инверсией восстановления затухания жидкости (FLAIR). Исследование проводили в аксиальной плоскости с толщиной среза 5 мм, зазор ≤ 15 % толщины среза.
На ДВ-МРТ ГМ, выполненной после стентирования ВСА, новые острые эмболические поражения определяли как очаговые гиперинтенсивные области с низким коэффициентом диффузии, которые отсутствовали при исходном обследовании перед стентированием ВСА. Анализ данных выполнило независимое учреждение по оценке медицинских изображений CoreLab. Два независимых рентгенолога оценивали количество (единичные или множественные очаги), расположение и размер (объем в мм3) очагов острой ишемии ГМ. Сначала выбрали все изображения, на которых ишемия отображалась как области яркого сигнала. На каждом из этих срезов область гиперсигнала выделяли с использованием полуавтоматического метода пороговой сегментации: курсор изначально располагали на самом гиперинтенсивном пикселе, затем порог интенсивности постепенно уменьшали (для выбора всех смежных пикселей с интенсивностью, превышающей установленный порог), пока общая выбранная область не совпадала с гиперинтенсивной областью, которая была бы очерчена вручную. При наличии более одного поражения дополнительные поражения выделяли вручную. Объем очага ишемии измеряли по формуле: (A × B × C) / 2, где А — длина длинной оси очага на аксиальном срезе, В — длина короткой оси очага на аксиальном срезе, С — количество МР-срезов, на которых есть очаг ишемии, умноженное на толщину срезов с зазором пересечения в мм. При наличии нескольких зон ишемического поражения ГМ общий объем поражения вычисляли путем суммирования объемов, измеренных для каждого отдельного очага ишемии.
Нейропсихологическое тестирование
Нейропсихологическое тестирование по опроснику MMSE проводил один и тот же врач за 24–48 ч до и через 6 и 12 мес. после стентирования ВСА. Интерпретацию результатов осуществляли с помощью балльной системы оценки: 28–30 баллов — нет нарушений когнитивных функций; 24–27 баллов — легкие когнитивные нарушения (предеменция); менее 24 баллов — деменция.
Конечные точки
Первичная конечная точка: когнитивные нарушения (предеменция или деменция в соответствии с интерпретацией теста MMSE).
Статистический анализ
Для выравнивания групп по исходным характеристикам использовали метод сопоставления склонностей с помощью алгоритма выбора ближайшего соседа для линейных вероятностей [20]. Показатели склонности рассчитывали с помощью модели логистической регрессии, основанной на следующих ковариатах: возраст, пол, курение, гипертоническая болезнь, ишемическая болезнь сердца, хроническая болезнь почек, сахарный диабет, индекс массы тела 30 кг/м2 и более, поражение контрлатеральной ВСА, тип используемого стента. Абсолютные стандартизированные различия рассчитывали как отношение абсолютной разницы взвешенных средних к суммарной дисперсии для непрерывных переменных и как абсолютную разницу пропорций для бинарных переменных. Коэффициенты дисперсии определяли как отношения взвешенных дисперсий в группах сравнения. Для оценки соответствия применяли «охват циркуля» (caliper) 0,1. Сопоставление было надлежащим при абсолютных стандартизированных различиях
-
< 0,1 и коэффициентах дисперсии < 2 для всех переменных. Для оценки ковариационного баланса использовали R version 4.2 (R Foundation for Statistical Computing, Вена, Австрия).
Для проверки переменных на нормальность распределения использовали критерий Колмогорова – Смирнова. Непрерывные переменные представлены как среднее значение ± стандартное отклонение или медиана с интерквартильным размахом. Статистически значимые различия между независимыми количественными переменными определяли с помощью количественного теста Манна – Уитни, различия между зависимыми количественными переменными — с помощью критерия Уилкоксона. Бинарные переменные представлены в виде абсолютного значения и относительной частоты в процентах, различия между группами проверяли с использованием двустороннего точного критерия Фишера. Анализ предикторов деменции или предеменции и снижения количества баллов по опроснику MMSE проводили с помощью однофакторной и многофакторной регрессии Кокса. В многофакторный регрессионный анализ включали переменные со значением p ≤ 0,25 по данным однофакторного анализа. Для оценки порогового общего объема бессимптомных очагов ишемии ГМ, прогнозирующего деменцию или предеменцию, применяли
Табл. 1. Характеристика пациентов до и после псевдорандомизации
|
Показатель |
Нескорректированные данные |
Скорректированные данные |
||||
|
Пациенты с «немыми» очагами ишемии ГМ, n = 39 |
Пациенты без очагов ишемии ГМ, n = 36 |
АСР |
Пациенты с «немыми» очагами ишемии ГМ, n = 30 |
Пациенты без очагов ишемии ГМ, n = 30 |
АСР |
|
|
Возраст, лет, n (%) |
61,1 ± 3,1 |
59,8 ± 6,3 |
0,013 |
60,4 ± 4,1 |
59,5 ± 5,1 |
0,009 |
|
Мужской пол, n (%) |
29 (74,3) |
31 (86,1) |
0,118 |
24 (80,0) |
25 (83,3) |
0,033 |
|
Курение, n (%) |
18 (46,1) |
13 (36,1) |
0,100 |
13 (43,3) |
11 (36,6) |
0,067 |
|
ГБ, n (%) |
35 (89,7) |
27 (75,0) |
0,147 |
28 (93,3) |
26 (86,6) |
0,067 |
|
ИБС, n (%) |
33 (84,6) |
27 (75,0) |
0,096 |
27 (90,0) |
25 (83,3) |
0,067 |
|
ХБП, n (%) |
8 (20,5) |
4 (11,1) |
0,094 |
5 (16,6) |
4 (13,3) |
0,033 |
|
СД, n (%) |
15 (38,5) |
10 (27,7) |
0,108 |
10 (33,3) |
8 (26,6) |
0,067 |
|
ИМТ ≥ 30 кг/м2, n (%) |
13 (33,3) |
8 (22,2) |
0,111 |
7 (23,3) |
6 (20,0) |
0,033 |
|
Гемодинамически значимый стеноз контрлатеральной ВСА, n (%) |
15 (38,5) |
8 (22,2) |
0,163 |
8 (26,6) |
6 (20,0) |
0,066 |
|
Тип имплантируемого стента Acculink, n (%) |
25 (64,1) |
17 (47,2) |
0,169 |
18 (60) |
16 (53,3) |
0,067 |
Примечание. АСР — абсолютная стандартизированная разница; ВСА — внутренняя сонная артерия; ГБ — гипертоническая болезнь; ГМ — головной мозг; ИБС — ишемическая болезнь сердца; ИМТ — индекс массы тела; СД — сахарный диабет; ХБП — хроническая болезнь почек.
Табл. 2. Характеристика бессимптомных очагов церебральной ишемии в раннем послеоперационном периоде после стентирования внутренних сонных артерий
|
Параметр |
Группа пациентов с «немыми» очагами ишемии головного мозга, n = 30 |
|
Единичные очаги острой ишемии, n (%) |
9 (30) |
|
Множественные очаги острой ишемии, n (%) |
21 (70) |
|
Ипсилатеральные очаги острой ишемии, n (%) |
23 (76,6) |
|
Контрлатеральные очаги острой ишемии, n (%) |
0 |
|
Билатеральные очаги острой ишемии, n (%) |
7 (23,4) |
|
Очаги в корковом веществе головного мозга, n (%) |
20 (66,6) |
|
Очаги в области глубоких ядер мозжечка, n (%) |
6 (20) |
|
Очаги в области подкорковых структур, n (%) |
4 (13,4) |
|
Средний суммарный объем поражения в расчете на каждого пациента с очагами ишемии, мм3 |
81,6 ± 9,8 |
ROC-анализ. Значение р < 0,05 считали статистически значимым. Статистический анализ выполняли с использованием программ Statistica версии 12 (StatSoft, Талса, США) и SPSS Statistics версии 23.0 (IBM, Армонк, США).
Результаты
Характеристика пациентов
Из 100 пациентов, включенных в исследование SIBERIA, исключили 17 больных с инсультом в анамнезе или окклюзией контрлатеральной ВСА. По данным ДВ-МРТ ГМ через 2 и 30 дней, у пациентов с бессимптомными стенозами целевой ВСА выявили 2 инсульта, этих больных исключили из субанализа. В субанализ включили 83 пациента. На 2-е и 30-е сут. после стентирования ВСА у 41 человека выявили «немые» очаги острой ишемии ГМ, у 40 не наблюдали очагов острой ишемии ГМ. В течение 12 мес. наблюдения из субанализа исключили 6 пациентов: 3 в связи с летальным исходом, 3 по причине отсутствия контакта с больным. Повторное тестирование прошли 39 пациентов с послеоперационными бессимптомными очагами острой церебральной ишемии и 36 пациентов без послеоперационных очагов острой ишемии ГМ. После псевдорандомизации 1:1 в группы включили по 30 человек.
Исходная характеристика пациентов до и после псевдорандомизации представлена в табл. 1.
Нескорректированные группы различались по полу, количеству курильщиков, лиц с гипертонической болезнью, сахарным диабетом, ожирением, гемодинамически значимым стенозом контрлатеральной ВСА и типу имплантируемого стента. После псевдорандомизации было достигнуто сопоставление по всем ковариатам.
Характеристика бессимптомных очагов церебральной ишемии представлена в табл. 2. Средний суммарный объем очагов ишемии составил 81,6 ± 9,8 мм3. Преобладали пациенты с множественными и ипсилатеральными очагами ишемии ГМ. Очаги ишемии преимущественно располагались в корковом веществе головного мозга.
Основные результаты
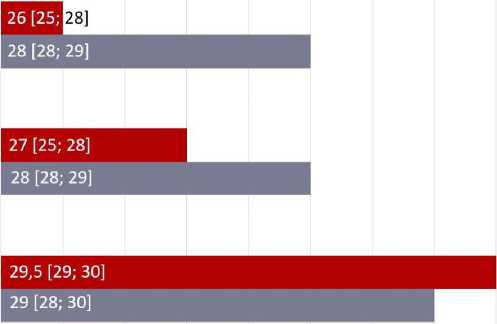
Медианы количества баллов по данным опросника MMSE до стентирования ВСА и через 6 и 12 мес. после процедуры в обеих группах представлены на рис. 2.
Количество баллов по данным опросника MMSE статистически значимо различалось между группами через 6 и 12 мес. наблюдения (p = 0,006 и p < 0,001 соответственно). В группе пациентов с «немыми» очагами ишемии ГМ наблюдалось статистически значимое снижение к 12 мес. наблюдения по сравнению с исходными баллами (p < 0,001). В группе пациентов без очагов острой ишемии ГМ также отмечалось некоторое снижение количества набранных баллов, но статистически значимой разницы между исходными данными и результатами тестов через 6 и 12 мес. наблюдения не получили. У пациентов без очагов церебральной ишемии медиана снижения баллов MMSE составила 0 [0; 2]. У пациентов с «немыми» очагами ишемии ГМ медианное снижение составило 4 [1; 7] балла, что статистически значимо выше по сравнению с контрольной группой (p = 0,001).
Баллы MMSE через 12 мес. после стентирования ВСА
р<0,001
Баллы MMSE через 6 мес. после стентирования ВСА
р=0,006
Баллы MMSEдо стентирования ВСА
р=0,34
25,5 26 26,5 27
27,5 28 28,5 29 29,5 30
-
■ Пациенты с ^немыми" очагами ишемии головного мозга
-
■ Пациенты без очагов ишемии головного мозга
Рис. 2. Баллы по опроснику MMSE в обеих группах
Примечание. ВСА — внутренняя сонная артерия; MMSE (англ. Mini-Mental State Examination) — краткая шкала оценки психического статуса. Данные представлены в виде медианы и интерквартильного размаха.
В группе с «немыми» очагами ишемии ГМ через 12 мес. после стентирования у 17 (56,6 %) пациентов выявили предеменцию (по 2 человека имели 27 и 26 баллов, 8 больных набрали 25 баллов, 5 пациентов — 24 балла), 1 (3,33 %) пациенту диагностировали деменцию (23 балла по опроснику MMSE). В группе без очагов церебральной ишемии через 12 мес. после стентирования было 7 (23,3 %) пациентов с легкими когнитивными нарушениями (по 2 человека набрали 27, 26 и 25 баллов, 1 пациент на- брал 24 балла по опроснику MMSE). Число лиц с предеменцией или деменцией статистически значимо различалось между группами (p = 0,008).
По данным однофакторного регрессионного анализа Кокса, «немые» очаги церебральной ишемии в 2,5 раза увеличивали риск развития деменции или предеменции в течение 12 мес. после стентирования ВСА (отношение рисков (ОР) 2,57 [95% доверительный интервал (ДИ) 1,07; 6,15], p = 0,02) (табл. 3). Других предикторов деменции или предеменции не выявили.
Табл. 3. Результаты однофакторного и многофакторного регрессионного анализа Кокса предикторов деменции или предеменции
|
Предиктор |
Однофакторный анализ |
Многофакторный анализ |
||
|
Отношение рисков [95% доверительный интервал] |
p |
Отношение рисков [95% доверительный интервал] |
p |
|
|
Возраст |
1,23 [0,42; 3,64] |
0,69 |
– |
– |
|
Мужской пол |
2,59 [0,38; 5,14] |
0,78 |
– |
– |
|
Курение |
0,57 [0,22; 1,46] |
0,24 |
0,59 [0,23; 1,50] |
0,27 |
|
Сахарный диабет |
0,72 [0,21; 2,42] |
0,59 |
– |
– |
|
Хроническая болезнь почек |
2,18 [0,46; 3,76] |
0,46 |
– |
– |
|
Ишемическая болезнь сердца |
0,65 [0,11; 2,45] |
0,51 |
– |
– |
|
Гемодинамически значимый стеноз контралатеральной внутренней сонной артерии |
1,82 [0,62; 5,36] |
0,27 |
– |
– |
|
Наличие «немых» очагов ишемии головного мозга |
2,57 [1,07; 6,15] |
0,02 |
2,52 [1,05; 6,05] |
0,03 |
Примечание. Жирным шрифтом выделены статистически значимые различия.
Табл. 4. Результаты однофакторного и многофакторного регрессионного анализа Кокса предикторов снижения количества набранных баллов теста MMSE
Примечание. MMSE (англ. Mini-Mental State Examination) — статистически значимые различия.
По данным однофакторной регрессии Кокса, бессимптомные очаги острой церебральной ишемии в 2 раза увеличивали риск снижения количества баллов теста MMSE в течение 12 мес. после стентирования ВСА (ОР 2,04 [95% ДИ 1,09; 3,81], p = 0,02) (табл. 4). Других предикторов снижения количества набранных баллов по опроснику MMSE не выявили.
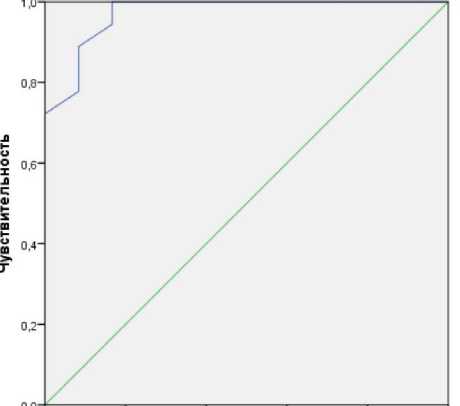
По данным ROC-анализа, пороговое значение суммарного объема бессимптомных очагов острой ишемии ГМ составило 78 мм3. При объеме поражения ГМ, равном или превышающем данное значение, прогнозировали развитие предеменции или деменции. Площадь под ROC-кривой составила 0,97 [95% доверительный интервал 0,92; 1,00] (рис. 3). Чувствительность и специфичность метода — 88,9 и 91,7 % соответственно.
Обсуждение
В проспективном когортном исследовании 60 пациентов со стентированием бессимптомных гемодинамически значимых стенозов ВСА мы выявили, что послеоперационные «немые» очаги церебральной ишемии статистически значимо приводят к снижению когнитивных функций при сравнении с группой пациентов без послеоперационных очагов ишемии ГМ и повышают риск развития деменции или предеменции. Также главной находкой нашего исследования является установление порогового значения суммарного объема «немых» очагов ишемии ГМ, прогнозирующего когнитивные нарушения.
0.0 0,2 0,4 0,6 0,8 1,0
1 - Специфичность
Рис. 3. ROC-кривая суммарного объема бессимптомных очагов церебральной ишемии после стентирования внутренних сонных артерий по отношению к прогнозированию возникновения когнитивных нарушений через 12 мес. после процедуры
Как уже упоминалось, бессимптомные очаги ишемии ГМ часто обнаруживаются после стентирования ВСА. В исследовании SIBERIA такие очаги также были выявлены с высокой частотой — у 50 % участников [19]. Основной причиной развития «немых» очагов ишемии после эндоваскулярных про- цедур является интраоперационная эмболия, как материальная, так и воздушная [21; 22]. Факторами интраоперационной эмболии могут быть клинико-анатомические особенности пациента (возраст, морфология бляшки сонной артерии, анатомия дуги аорты и сонных артерий) и технические аспекты операции (сосудистый доступ, тип антиэмболическо-го устройства, тип стента, опыт оператора) [23; 24].
Несмотря на то что инсульт является причиной деменции, наличие бессимптомных очагов ишемии ГМ пока не признано независимым фактором риска снижения когнитивных функций [25; 26]. Целью нашего исследования было определение связи между бессимптомными очагами ишемии ГМ после стентирования ВСА и изменением когнитивного статуса. Мы использовали шкалу MMSE, так как она широко применяется в клинических исследованиях в качестве теста для оценки когнитивной функции. Опросник MMSE был выбран как оптимальный вариант нейропсихологического тестирования, поскольку пожилые пациенты и лица с цереброваскулярными заболеваниями часто испытывают трудности с участием в длительных нейропсихологических сеансах.
Ряд исследователей заявили о том, что у пациентов с симптомными стенозами сонных артерий происходит улучшение когнитивных функций после стентирования ВСА [26–28]. Авторы связывают данные результаты с восстановлением притока крови к хроническим очагам гипоперфузии ГМ и профилактикой дальнейших инсультов путем предотвращения прогрессирования локальных атеросклеротических поражений. Однако в настоящее исследование мы включали пациентов только с бессимптомными стенозами ВСА без анамнеза инсульта и контрлатеральной окклюзии ВСА, для того чтобы выявить реальный вклад стентирования и бессимптомных очагов ишемии ГМ в изменение когнитивного статуса, а также определить критический суммарный объем бессимптомного поражения ГМ. Возраст больных был менее 65 лет, что снижает риск естественного развития деменции [29]. Метод псевдорандомизации позволил получить сопоставимые исследуемые группы и избежать смещения результатов из-за влияния сопутствующих факторов риска.
Многие авторы прослеживают взаимосвязь между наличием бессимптомных ишемических зон в ГМ и риском когнитивных нарушений в будущем [12–14]. Клиническое течение патологического процесса зависит от локализации, скорости развития, объема поражения ГМ и состояния коллатерального кровотока [30].
S.E. Vermeer и соавт. изучили влияние «немых» очагов ишемии ГМ на развитие деменции у 1 015 человек в возрасте 60–90 лет без деменции и инсульта в анамнезе. У 217 пациентов исходно выявили бессимптомные ишемические очаги ГМ. В течение 3,6 года наблюдения 629 участникам выполнили повторную магнитно-резонансную томографию ГМ. Через 3,6 года у 30 пациентов развилась деменция, у 14 из них исходно обнаружили «немые» очаги ишемии ГМ. Наличие «немых» очагов ишемии ГМ на исходном уровне более чем в 2 раза увеличивало риск деменции (ОР 2,26 [95% ДИ 1,09; 4,70]). Малые таламические инфаркты были связаны со снижением производительности памяти, а неталамические инфаркты — со снижением психомоторной скорости. Однако авторы не исследовали пороговый объем очагов ишемии, прогнозирующий снижение когнитивных функций [14].
-
C. Laza и соавт. в исследовании с участием 32 человек показали, что микроэмболические сигналы во время стентирования сонных артерий коррелировали со снижением когнитивных функций в течение 1 года наблюдения. Средний балл по MMSE снизился с 28,5 на исходном уровне до 27,2 (-1,3 балла; 4,5 %). Но пациентам не проводили ДВ-МРТ ГМ для выявления «немых» очагов ишемии [17].
I.Q. Grunwald и соавт. оценили влияние стентирования сонных артерий на когнитивную функцию 41 пациента с бессимптомными стенозами ВСА в течение короткого промежутка времени после стентирования (3 мес. после процедуры), что не привело к получению каких-либо значимых результатов. При этом очаги острой ишемии ГМ со средним объемом 4 мм2 выявили только в 14 (34,2 %) случаях [16].
Мы не нашли крупных исследований, сравнивающих когнитивные функции после стентирования ВСА у пациентов с «немыми» очагами ишемии ГМ и без них. В свою очередь, расхождения в литературных сообщениях о когнитивном статусе после стентирования ВСА можно объяснить различиями методологических подходов, таких как набор нейропсихологических тестов, размер выборки, типы когорт пациентов, тяжесть стеноза сонной артерии и срок последующего наблюдения.
Ограничения
Ограничениями исследования являются небольшая выборка, использование только одного нейропсихологического теста для оценки когнитивных функций. Некоторые ковариаты могли быть не учтены при псевдорандомизации, но оказать влияние на результаты анализа. В оценке объема очагов ишемии
ГМ возможны неточности, поскольку ДВ-МРТ осуществляли только в аксиальной проекции.
Заключение
В группе пациентов с бессимптомными очагами ишемии ГМ выявили как статистически значимо меньшую медиану набранных баллов по тесту MMSE, так и большее количество пациентов с деменцией или предеменцией по сравнению с контрольной группой через 12 мес. после стентирования ВСА. Наличие бессимптомных очагов ишемии ГМ после стентирования ВСА статистически значимо увеличивало риск развития деменции или предеменции в течение 12 мес. после процедуры. Суммарный объем бессимптомных очагов ишемии ГМ 78 мм3 и более прогнозировал развитие когнитивных нарушений через 12 мес. после стентирования.


