Биохимические характеристики микроорганизмов щелочных гидротерм Прибайкалья
Автор: Лаврентьева Е.В., Раднагуруева А.А., Намсараев Б.Б., Дунаевский Я.Е.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Гидрохимия
Статья в выпуске: 3, 2009 года.
Бесплатный доступ
Изучены биохимические характеристики культур Ur-6, Br-2-2, Ga-9-2, Al-9-1 и Se-1. Показано, что культуры обладают высокой субтилизиноподобной, аминопептидазной активностями. Протеазы стабильны в широком диапазоне температур от 23 до 60оС и рН от 10,9 до 12.
Щелочные гидротермы. бактерии, термостабильные протеазы
Короткий адрес: https://sciup.org/148178757
IDR: 148178757 | УДК: 577.151.01
Текст научной статьи Биохимические характеристики микроорганизмов щелочных гидротерм Прибайкалья
В гидротермах Бурятии широко распространены микроорганизмы – потенциальные продуценты ферментативных систем, устойчивые к высоким значениям температуры и рН. Исследования по выделению, идентификации и классификации ферментов протеолитической активности в последние годы проводятся особенно интенсивно, что объясняется востребованностью и многообразием протеолитических ферментов. Они играют ключевую роль в использовании микроорганизмами органических субстратов [1].
Целью представленной работы было изучение внеклеточной протеазной активности у гетеротрофных алкалотермофильных бактерий, выделенных из гидротерм Бурятии.
Объекты и методы исследования
В качестве источников секретируемых протеолитических ферментов использовали культуральную жидкость 5 алкало-термофильных культур Ur-6, Br-2-2, Ga-9-2, Al-9-1 и Se-1, выделенных из микробных матов и донных осадков горячих источников Байкальской рифтовой зоны. Температура воды в точках отбора проб на выходе и по изливу термальных вод в изученных источниках варьировала от 45 (источник Сея) до 72,50С (источник Гарга). Значения pH изменялись от слабощелочных 8,2 в воде источников Гарга до сильнощелочных 9,9 в гидротерме Алла. Выделенные штаммы Ur-6 и Br-
2-2 относятся к представителям рода Bacillus . Наибольшее сходство у культуры Ur-6 выявлено с Bacillus hemicellulosolyticum C-11 (99%). Штаммы Br-2-2 на 97% близки к B. licheniformis BBDC6 . У штамма Ga-9-2 обнаружено 95% сходства с A. flavithermus DSM 2641 ( Z26932). Штаммы Al-9-1 и Se-1 образуют отдельный кластер на филогенетическом дереве, и ближайшим гомологом является Anoxybacillus pushchinoensis AT-2 (AB234214). Сходство составляет 96 и 95% соответственно .
Определение внеклеточной протеазной активности в культуральной жидкости у изученных культур проводили по методу Эрлангера [2], используя 5 мМ пара-нитроанилидные субстраты протеаз – трипсиноподобных, химотрипсиноподобных, субтилизиноподобных, цистеиновых и аминопептидаз (BAPA, GlpFpNA, GlpAALpNA, GlpFApNA и TpNA, ApNA, LpNA соответственно) и на белковом субстрате азоказеине, используемом для определения общей активности. Для выяснения природы функциональных групп активного центра штаммов к раствору фермента добавляли раствор соответствующего ингибитора, инкубировали 40 мин при температуре 370С, затем добавляли раствор субстрата и определяли активность, как указано выше. В работе использовались ингибиторы металло-протеаз–этилендиаминтетраацетат Na (ЭДТА), цистеиновых протеаз-иодацетамид (ИAA) и сериновых протеаз–фенилметилсульфонилфторид (ФМСФ). Для определения оптимума рН активности исследуемых протеиназ по отношению к синтетическим субстратам были использованы цитратфосфатные, фосфатные, гидрокарбонатные буферы [3] в диапазоне рН 5-12. Температурный оптимум ферментов определяли, измеряя их активность после 5 мин инкубации при температурах от 23-800С.
Результаты и обсуждение
-
1. Определение субстратной специфичности
-
2. Определение температурной стабильности фермента
Внеклеточная протеиназа штамма Ur-6 имела оптимум активности при 600С и сохраняла до 31% активности при 700С. Температурная стабильность фермента находилась в интервале температур 23600С. Культура Ga-9-2 показала оптимум активности при 500С, тогда как культура Br-2-2 при 400С. Стабильность ферментов изученных штаммов сохраняется до 600С (рис. 2).
-
3. Определение рН - оптимума и стабильности фермента
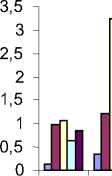
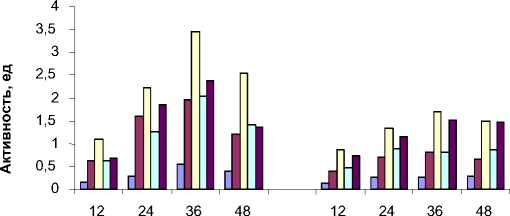
Определение субстратной специфичности показало, что изученные штаммы не гидролизуют субстраты, специфичные для химотрипсинподобных и цистеиновых протеиназ, независимо от времени культивирования (до 60 ч) и источников органического азота (триптон, казеин и желатин). Все изученные культуры наиболее активны в отношении субстратов, специфичных для субтилизинов и аминопептидаз (рис. 1). Результаты исследования зависимости активности протеиназ от температуры культивирования показали, что наиболее высокая активность на субстрате для субтилизиноподобных протеиназ обнаружена при 500С. При этой температуре максимальная удельная активность у культуры Ur-6 обнаружена на 12 ч культивирования и составила 3,24 ед/мг. Показано, что температура 600С является наиболее благоприятной для развития аминопептидазной активности. В целом отмечено, что культуры Ur-6, Br-2-2, Ga-9-2, выделенные из микробных матов горячих источников, кроме суб-тилизиноподобной обладают высокой аминопептидазной активностью. Характерно, что наибольшая активность по субстрату для субтилизиноподобных протеиназ обнаружена на среде с триптоном. Добавление в среду желатина или казеина приводило к слабой индукции субтилизиноподобных протеиназ.
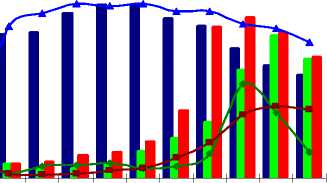
Исследования рН оптимума и стабильности проведены в диапазоне рН 5,8–12,0 для трех культур: Ur-6, Ga-9-2 и Br-2-2 (рис. 3). Как следует из полученных данных, изученные ферменты штаммов Ga-9-2 и Br-2-2 активны в относительно узком интервале рН: активность, превышающая 50%, была выявлена на участке рН 10-12 с максимумом при рН 11,7 и 11,3 соответственно. Исследуемые ферменты были стабильны при рН 10,9- 12,0. Напротив, протеиназа культуры Ur-6 активна в широком диапазоне рН, значения активности более 50% были выявлены на отрезке рН 7,3-12, с максимумом при рН 10. Фермент сохранял стабильность в интервале рН 7,8-12.
Общая активность на азоказеине
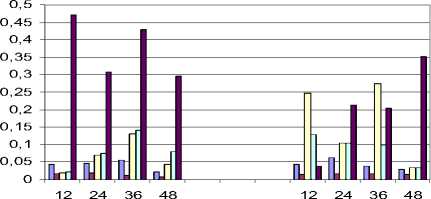
□ Br-2-2
Ga-9-2
□ Sе-1
Аl-9-1
Ur-6
вре мя культивирования , ч
Активность Br-2-2 на различных субстратах
□ БАПА
□ субтилизин
□ аргинин
□ тирозин
□ лейцин
12 24 36 48 12 24 36 48
время культивирования , ч .
Активность Ga-9-2 на различных субстратах
□ БАПА
□ субтилизин
□ аргинин
□ тирозин
□ лейцин время культивирования, ч.
Активность Ур -6 на различных субстратах
1,6
1,4
1,2
0,8
0,6
0,4
0,2
□ БАПА
□ субтилизин
□ аргинин
□ тирозин лейцин
12 24 36 48 12 24 36 48
вре мя культивирова ния , ч
Рис. 1. Внеклеточная протеазная активность на различных субстратах
Температурный оптимум и стабильность
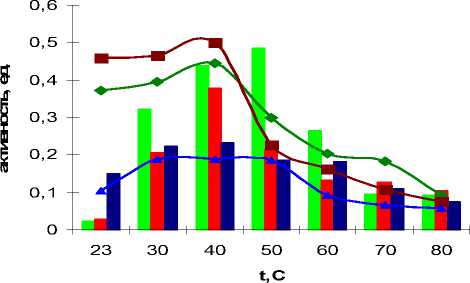
Рис. 2. Температурный оптимум и стабильность культур Ga-9-2, Br-2-2, Ur-6
рН оптимум и стабильность Ur-6, Ga-9-1 и Br-2-2
3,5
2,5
1,5
0,5

%

рН
Ur-6 опт
Ga-9-1 опт
Br-2-2 опт
Ur-6 стаб
Ga-9-1 стаб
Br-2-2 стаб
<Ь „ Ъ . Ф <Ь <ь £. д. д. ^У %, О,У О,.
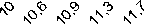
Рис. 3. рН оптимум и стабильность культур Ga-9-2, Br-2-2, Ur-6


