Биоинертные и адгезивные свойства материалов
Автор: Шкодкин С.В., Коган М.И., Колпаков А.Я., Бондарев В.П.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Введение. Использование внутренних стентов, с целью поддержания просвета полого органа, приобрело широкое распространение в различных разделах хирургии, в том числе и урологии. Однако, имеются и негативные стороны использования внутренних дренажей. Недостижимость полной биоинертрости, прямое механическое воздействие на стенку органа приводит к воспалительному отеку, нарушению микроциркуляции и перистальтики. Имеющиеся объективные недостатки внутренних стентов подталкивают к разработке конструкций и к поиску материалов для производства стентов. Материалы и методы. Статья посвящена экспериментальному исследованию биоинертности наноструктурных материалов, а именно - сплавов титана и покрытия на основе аморфного углерода и атомарного серебра. Экспериментальное исследование выполнено на 60 половозрелых белых лабораторных крысах линии Wistar обоего пола, которым материалы были имплантированы в просвет мочевого пузыря. Морфологические исследования произведены на 14-е (когда исчезают неспецифические воспалительные изменения, обусловленные хирургической травмой, и начинают прослеживаться особенности воспалительной реакции в зависимости от вида импланта) и 30-е сутки (когда заканчивается экссудативная фаза воспаления и преобладают процессы организации соединительной ткани с видимой специфической тканевой реакцией). Результаты. При морфологическом изучении воспалительной реакции стенки мочевого пузыря выявлены качественные и количественные статистически достоверные отличия, зависящие от вида имплантированного материала. Данные исследования позволили выделить 2 группы наблюдения. У незащищённых металлических имплантов из сплавов титана определены минимальные показатели биоинертности. Наилучшие биоинертные свойства выявлены у имплантов с наноструктурным покрытием на основе аморфного углерода и атомарного серебра.
Имплантат, биоинертность, воспаление, медицинские материалы
Короткий адрес: https://sciup.org/142188127
IDR: 142188127
Текст научной статьи Биоинертные и адгезивные свойства материалов
экспериментальная и клиническая урология № 3 2 0 16
экспериментальная и клиническая урология №3 201 6
На 30-е сутки после имплантации сплавов титана в стенке □ экспериментальная и клиническая урология №3 20 1 6 мочевого пузыря прогрессировал псевдополипоз (рис. 3а) и сохранялись воспалительные изменения,
распространяющиеся на всю толщу стенки мочевого пузыря, интенсивность которых несколько снизилась
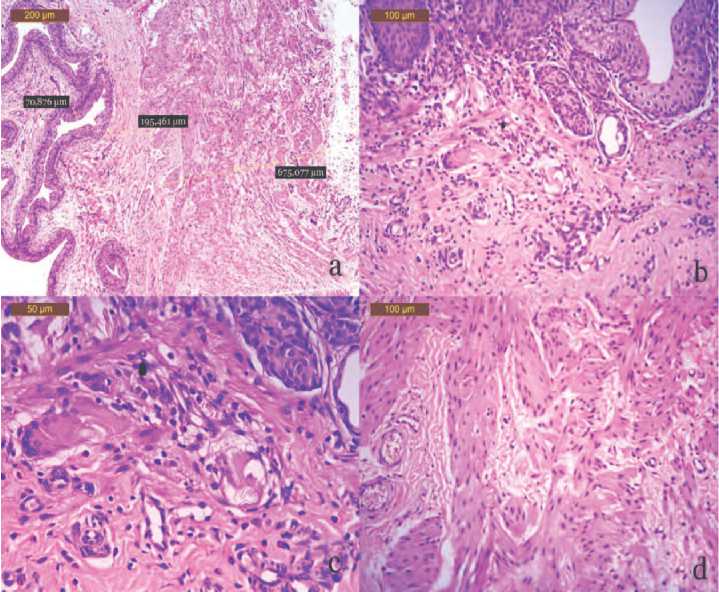
Рис. 2. Морфологические изменения стенки мочевого пузыря на 14-е сутки после внутрипросветного введения пластины с САg: воспалительный отек незначителен, лейкоцитарная инфильтрация имеет диффузный смешанный характер, локализована в подслизистом слое стенки мочевого пузыря. Окр. гематоксилином и эозином. Микрофото. Ув. а – х50; b – х100; с – х400; d – х200
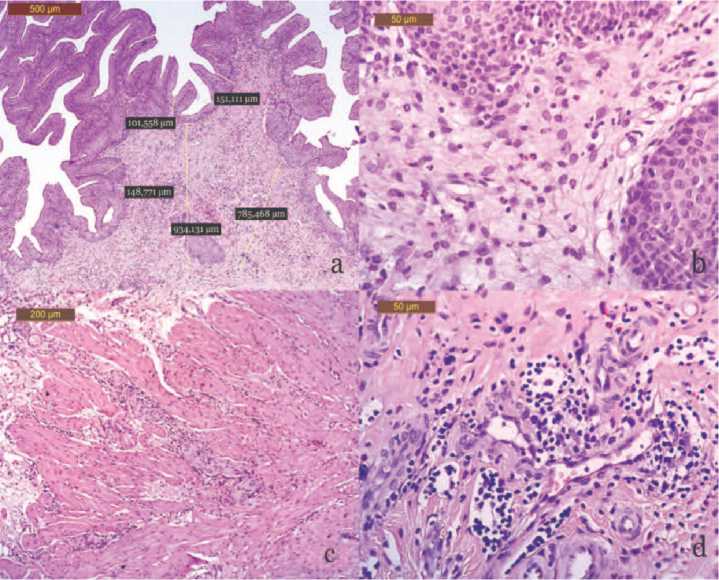
Рис. 3. Морфологические изменения стенки мочевого пузыря на 30-е сутки после внутрипросветного введения пластины из сплава титана: гипертрофические изменения с выраженным псевдополипозом слизистой, воспалительный отек, накопление рыхлой соединительной ткани, умеренная диффузная и очаговая смешанная воспалительная инфильтрация слоев стенки мочевого пузыря. Окр. гематоксилином и эозином. Микрофото. Ув. а – х50; b и d – х400; с– х100
(рис. 3 а-d). Отмечали утолщение и склеротические изменения мочепузырной стенки, большей частью в продслизистом слое и между мышечными пучками детрузора, в которых регистрировали субатрофию мышечных волокон и очаговую смешанную инфильтрацию (рис. 3 а-d). Толщина подслизистого слоя незначительно уменьшилась и составила 841,2±174,8 мкм ( р >0,05), аналогичный показатель для мышечного слоя так же статистически незначимо увеличился – 1488,4± 209,1 мкм ( р >0,05). Со стороны уротелия сохранились как участки дес-квамации эпителия, так и псевдополипоз с увеличением рядности и толщины слизистой до 163,3± 51,8 мкм (рис. 3 а, b). Клеточные инфильтраты носили смешанный характер: полиморфноядерные лейкоциты – 74±19 кл. в п/з, малые лимфоциты – 164±31 кл. в п/з и гистиоциты – 57±16 кл. в п/з (рис. 3 b, d, табл. 1).
Инфильтративные изменения в стенке мочевого пузыря после имплантации материалов группы с СAg были умеренны. Со стороны слизистой отсутствовало язвенное поражение, морфологическая картина представлена гипертрофическим циститом в области шейки мочевого пузыря. В области дна мочевого пузыря слизистая интактна, полипоз выражен незначительно, по сравнению с группой незащищенных металлов, толщина слизистой составила 49,5±9,1 мкм ( р <0,05, рис. 4 а, табл. 1). В исследуемых тканях определялись единичные мелкие очаги воспалительной, главным образом, лимфоидной инфильтрации, ограниченные подслизистой, содержащие малые лимфоциты – 37±11 кл. в п/з и гистиоциты – 13±6 кл. в п/з ( р <0,05, рис. 4 b, табл. 1). Число полиморфноядерных лейкоцитов составило 16±4 кл. в п/з ( р <0,05, рис. 4 b, табл. 1). На границе с мышечным слоем визуализировали увеличение содержания фибробластов 52±5 кл. в п/з и фиброцитов 53±9 кл. в п/з, что достоверно меньше контроля ( р <0,01, табл. 1).
экспериментальная и клиническая урология №3 201 6
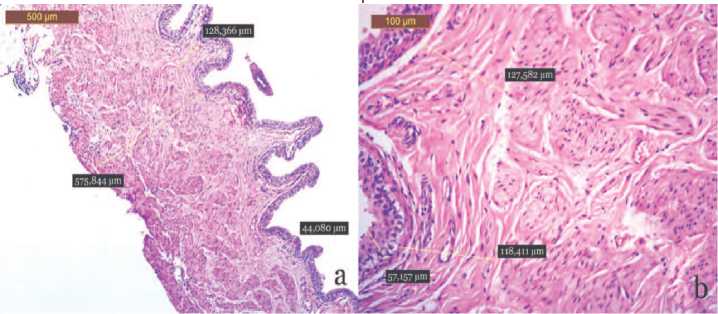
Рис. 4. Морфологические изменения стенки мочевого пузыря на 30-е сутки после внутрипросветного введения пластины с САg: псевдополипы отсутствуют, складчатость умеренно повышена, воспалительный отек не выявляется, лейкоцитарная инфильтрация скудная представлена агранулоцитами, расположенными в подслизистом слое стенки мочевого пузыря. Окр. гематоксилином и эозином. Микрофото. Ув. а – х50; b – х200
Отек подслизистого слоя достоверно снизился по сравнению с предыдущим временным интервалом и был меньше, чем в группе сплавов титана, его толщина варьировала 133,5±26,8 мкм ( p <0,05, табл. 1). Морфометрические характеристики мышечного слоя не изменились и составили 563,9±82,3 мкм, что достоверно меньше группы сравнения ( p <0,05, табл. 1). Не отмечено гипертрофических и дистрофических изменений миоцитов.
В группах сплавов титана отмечены выраженные процессы литогенеза, к 30-м суткам эксперимента в просвете мочевого пузыря животных этих групп обнаруживали конкремент, занимающий весь просвет мочевого пузыря (рис. 5 а). Толщина солевых отложений в 3 – 5 раз превышала толщину импланта, а их масса составила 284,4±41,5% от исходной массы импланта (рис. 5 b-с). В группе САg не зарегистрировано интенсивного камнеобразования. Более 60% поверхности имплантов этой группы были свободны от со-

Рис. 5. Литогенез на поверхности имплантов мочевого пузыря. а – группа сплавы титана макропрепарат мочевого пузыря (1), конкремент (2), занимающий просвет пузыря; b – группа сплавы титана, электронная микроскопия поверхности конкремента; с – группа сплавы титана, электронная микроскопия края излома (3), визуализируется поверхность импланта (4); d – группа нпСAg№2, единичные участки кристаллизации на поверхности импланта. b-d ув. х200
левого налета, толщина которого не превышала 100 мкм, масса импланта увеличилась на 15,2±4,9% ( р <0,01, рис. 5 d).
ОБСУЖДЕНИЕ
На экспериментальной модели нами показано, что реакция со стороны полых органов на введение имплантов гомологична таковой при имплантации в паренхиматозные органы и зависит от показателей биоинертности импланта [17, 18]. У исследованных материалов не зарегистрировано цитотоксичности, отсутствовали некрозы и перфорация стенки мочевого пузыря. Незащищенные металлы (сплав титана с эффектом памяти формы на основе Ti-Ni-(X) и β-сплав) характеризовались меньшими показателями биоинертности, и их имплантация приводила к выраженному отеку и лейкоцитарной инфильтрации всей стенки органов моделей, регистрируемой с 14-х суток эксперимента. К выходу из эксперимента (30-е сут- ки) у животных этих групп отмечено развитие склероза стенки мочевого пузыря в области имплантации. Воспалительные изменения стенки мочевого пузыря в группе САg не выходили за пределы подслизистой, гранулоцитарный компонент был не выражен, что позволило избежать выраженной локальной продукции хемокинов и, как следствие, коллагеногенеза к окончанию эксперимента.
Таким образом, нахождение импланта (стента) в просвете полого органа неминуемо сопровождается воспалением с последующим развитием фиброза даже при временной имплантации, а степень данных изменений во многом зависит от биоинертности импланта. Отсутствие различий в результатах морфометрии между сплавами титана (сплав титана с эффектом памяти формы на основе Ti-Ni-(X) и β-сплав) еще раз подтверждает то, что биоинертность на данных сроках наблюдения определяется титаном, а именно, покрывающей химически инертной пленкой его оксида и не зависит от веществ, входящих в сплав. Однако, наличие пленки из оксида титана не предупредило кристаллизации мочевых солей с ис-ходом в цистолитиаз. Подобное осложнение может быть объяснено с позиций воспалительной теории литогенеза, когда в следствие воспаления и экссудации глобулярной белковой фракции изменяется кислотность и протеазная активность мочи, что приводит к кристаллизации солей на белковом матриксе [19].
ВЫВОДЫ
-
1. Реакция со стороны полых органов на введение имплантов зависит от показателей биоинертности материала, из которого изготовлен имплант.
-
2. Незащищенные металлы (сплав титана с эффектом памяти формы на основе Ti-Ni-(X) и β-сплав) характеризовались меньшими показателями биоинертности, и □
-
3. Воспалительные изменения стенки мочевого пузыря в группе
-
4. Окончательные выводы об эффективности применения наноструктурного покрытия будет возможно сделать после проведения всесторонних экспериментальноклинических исследований.
экспериментальная и клиническая урология № 3 20 16 их имплантация приводила к выраженному отеку и лейкоцитарной инфильтрации всей стенки мочевого пузыря крыс.
Резюме:
Введение. Использование внутренних стентов, с целью поддержания просвета полого органа, приобрело широкое распространение в различных разделах хирургии, в том числе и урологии. Однако, имеются и негативные стороны использования внутренних дренажей. Недостижимость полной био-инертрости, прямое механическое воздействие на стенку органа приводит к воспалительному отеку, нарушению микроциркуляции и перистальтики. Имеющиеся объективные недостатки внутренних стентов подталкивают к разработке конструкций и к поиску материалов для производства стентов.
Материалы и методы. Статья посвящена экспериментальному исследованию биоинертности наноструктурных материалов, а именно – сплавов титана и покрытия на основе аморфного углерода и атомарного серебра. Экспериментальное исследование выполнено на 60 половозрелых белых лабораторных крысах линии Wistar обоего пола, которым материалы были имплантированы в просвет мочевого пузыря. Морфологические исследования произведены на 14-е (когда исчезают неспецифические воспалительные изменения, обусловленные хирургической травмой, и начинают прослеживаться особенности воспалительной реакции в зависимости от вида импланта) и 30-е сутки (когда заканчивается экссудативная фаза воспаления и преобладают процессы организации соединительной ткани с видимой специфической тканевой реакцией).
Результаты. При морфологическом изучении воспалительной реакции стенки мочевого пузыря выявлены качественные и количественные статистически достоверные отличия, зависящие от вида имплантированного материала. Данные исследования позволили выделить 2 группы наблюдения. У незащищённых металлических имплантов из сплавов титана определены минимальные показатели биоинертности. Наилучшие биоинертные свойства выявлены у имплантов с наноструктурным покрытием на основе аморфного углерода и атомарного серебра.
Summary:Bioinert and adhesion properties of materials
S.V. Shkodkin, M.I. Kogan, A.Ya. Kolpakov,V.P. Bondarev
Introduction. The use of internal stents, in order to maintain the lumen of the hollow body, has become widespread in the different sections of surgery, including urology. However, there are negative aspects of the use of internal drainage. Unattainable full bioinertness, direct mechanical effect on the body wall leads to the inflammatory edema, disruption of the microcirculation and peristalsis. Available objective disadvantages of internal stents are pushing the development of structures and the search for materials for the production of stents.
Materials and methods. The article is devoted to the experimental study of bioinertness of nanostructured materials -namely, two titanium alloys and coatings based on amorphous carbon and atomic silver. The experimental study was performed on 60 adult white laboratory Wistar rats of both sexes, which materials were implanted into the lumen of the bladder. Morphological studies made on the fourteenth (where fade nonspecific inflammatory changes caused by the surgical trauma, and begin tracked features of the inflammatory response, depending on the type of implant) and the thirtieth day (when ends inflammation exudative phase and dominated processes of connective tissue organization apparent specific tissue reaction).
Results and conclusions. A morphological study of the inflammatory response of the bladder wall revealed qualitative and quantitative, statistically significant differences depending on the type of the implanted material. These studies made it possible to allocate 2 observation group. In unprotected metal implants of titanium alloys defined minimum performance bioinert. Best bioinert properties were detected in implants with nanostructured coating based on amorphous carbon and atomic silver.
Список литературы Биоинертные и адгезивные свойства материалов
- Naber KG, Cho YH, Matsumoto T, Schaefer AS. Immunoactive prophylaxis of recurrent urinary tract infections: A meta-analysis. Int J Antimicrob 2009;2:111-119.
- Лоран О.Б., Зайцев A.B., Годунов Б.Н. Особенности диагностики и лечения хронического цистита у женщин. Акушерство и гинекология 2000;(3): 40-43.
- Франк У. Антибактериальная терапия в амбулаторно-поликлинической практике. М.: ГЭОТАР-Медиа, 2010. 256 с.
- Перепанова T.C. Инфекции почек и мочевыводящих путей: современные подходы к терапии. Фарматека. 2004; 82(3-4):16-21.
- Палагин И.С., Cухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Шевелев А.Н., Гринев А.В. и др. Исследовательская группа «ДАРМИС». Cовременное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования «ДАРМИС» (2010-2011). Клиническая микробиология. антимикробная химиотерапия 2012;14(4): 280-302.
- Minardi D, d’Anzeo G, Cantoro D. Urinary tract infections in women: etiology and treatment options. Intern J General Med 2011; 4:333-334.
- Apisarnthanarak A, Buppunharun W, Tiengrim S, Sawanpanyalert P, Aswapokee N. An overview of antimicrobial susceptibility patterns for gram-negative bacteria from the National Antimicrobial Resistance Surveillance Thailand (NARST) program from 2000 to 2005. J Med Assoc Thai 2009;92(Suppl.4): 91-94.
- Орельцова O.C., Крупин В.Н. Хронический цистит: новое в диагностике и лечении. Лечащий врач 2008;(7): 18-24.
- Сидоренко С.В., Тишков В.И. Молекулярные основы резистентности к антибиотикам. Успехи биологической химии 2004; 44(3): 263-306.
- Мартов А. Г., Гурбанов Ш. Ш., Мудрая И. C. Оценка сократительной функции верхних мочевыводящих путей методом многоканальной импедансной уретерографии до и после эндоуретеропиелотомии. Урология 2009; 4: 25-30.
- Chatterjee S, Maiti P, Dey R, Kundu A, Dey R. Biofilms on indwelling urologic devices: microbes and antimicrobial management prospect. Ann Med Health Sci Res 2014 4(1):100-104
- Denstedt JD, Cadieux PA. Eliminating biofilm from ureteral stents: the Holy Grail. Curr. Opin. Urol. 2009; 19(2): 205-210.
- Modi AP, Ritch CR, Arend D, Walsh RM, Ordonez M, Landman J, Gupta M, Knudsen BE. Multicenter experience with metallic ureteral stents for malignant and chronic benign ureteral obstruction. JEndourol 2010; 24(7): 1189-93.
- Волова Т.Г. Синтез биорезорбируемых полимеров. &руктура и свойства. Известия высших учебных заведений. Физика 2013; 56(12-3): 27-32.
- Шкуратов С.И., Феофилов И.В., Гюнтер В.Э., Исаенко В.И. Временные и постоянные никелид-титановые стенты при перкутанных операциях по поводу стриктур лоханочно-мочеточникового сегмента. Урология 2007; 4: 31-34.
- Abizaid A., Costa Jr.J.R. New drug-eluting stents: an overview on biodegradable and polymer-free next-generation stent systems. Circ Cardiovasc Interv 2010; 3(4) 384-393.
- Шкодкин С.В., Должиков А.А., Жернакова Н.И., Дмитриев В.Н., Идашкин Ю.Б., Фентисов В.В. Исследование биоинертности материалов при имплантации в паренхиму почки в эксперименте. Научные ведомости Белгородского государственного университета. Серия: Медицина Фармация. 2012; 17(4): 207-213.
- Шкодкин СВ., Иванов СВ., Идашкин Ю.Б., Фентисов В.В. Экспериментальное исследование биоинертности материалов, используемых в производстве хирургических стентов. Курский научно-практический вестник ’’Человек и его здоровье" 2012; 4: 32-39.
- Hsu L, Li H, Pucheril D, Hansen M, Littleton R, Peabody J, Sammon J. Use of percutaneous nephrostomy and ureteral stenting in management of ureteral obstruction. World J Nephrol 2016; 6(5-2): 172-81.


