Биоинформатический анализ миссенс-мутации 1595C>G (Ser447Stop) гена липопротеинлипазы (LPL)
Автор: Бухарбаева Э.Н.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 1 (17), 2018 года.
Бесплатный доступ
Выполнен биоинформатический анализ миссенс-мутации 1595C>G (Ser447Stop) гена липопротеинлипазы (LPL). Анализ показал, что мутантные аллели гена LPL ведут к конформационным изменениям доменов белков и это изменяет их физико-химические свойства. В ходе работы были построены пространственные модели белков.
Биоинформатический анализ, липопротеинлипаза, миссенс-мутация, липидный обмен
Короткий адрес: https://sciup.org/140279766
IDR: 140279766
Текст научной статьи Биоинформатический анализ миссенс-мутации 1595C>G (Ser447Stop) гена липопротеинлипазы (LPL)
Введение. Липиды попадают в организм, главным образом, в форме триглицеридов жирных кислот. В кишечнике под действием ферментов поджелудочной железы они подвергаются гидролизу, продукты которого всасываются клетками стенки кишечника. Здесь из них вновь синтезируются нейтральные жиры, которые через лимфатическую систему поступают в кровь и либо транспортируются в печень, либо отлагаются в жировой ткани [1, 150с]. В контроль и реализацию процесса метаболизма липидов вовлечено большое число генов и их продуктов. В нашем исследовании была изучена миссенс-мутация гена липопротеинпипазы.
В нарушении липидного обмена важную роль играет липопротеинлипаза (LPL) – многофункциональный белок и ключевой фермент метаболизма липидов. Она является основным компонентом триглицерид-насыщенных хиломикронов и липопротеинов очень низкой плотности и играет важную роль в формировании липопротеинов высокой плотности. ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе. Международный код полиморфизма: rs328[2, 2с].
Целью является построение модельной структуры белкового продукта LPL и проведение сравнительного анализа его физико-химических свойств для дальнейшего использования в диссертации.
Изучение молекулярных механизмов действия белков и использование этого знания для направленного дизайна их свойств остается важнейшей задачей современной биоинформатики. В связи с этим актуальным представляется поиск и изучение таких миссенс-мутаций, изменчивость которых приводит к изменению их функциональных характеристик – другими словами, аминокислотных позиций, которые в следствие будут различаться своими физико-химическими и не только свойствами.
Материалы и методы. Биоинформатический анализ нуклеотидных последовательностей полиморфных локусов проводили с применением базы данных GeneBank . Нуклеотидные и аминокислотные последовательности анализировали в двух вариантах: для мутантных и нормальных аллелей изученных генов. Информацию об аминокислотной последовательности белка, а также структурных и функциональных доменах, входящих в его состав, получали из базы данных UniProt . Оценку физико-химических свойств белковых структур проводили в программе ProtParam . Критериями изменения физико-химических свойств белков считали изменение молекулярной массы, изоэлектрической точки, алифатического индекса, являющегося одним из показателей термостабильности, и индекса нестабильности белка, оценивающего стабильность белка in vitro, который у стабильных белков не должен превышать 40[4, 23с]. При поиске гомологов доменов белков, затронутых мутацией, использовали BLAST-поиск по базе данных Protein Data Bank, с алгоритмом PSI-BLAST (матрица BLOSUM62), реализованным в базе данных GeneBank.
Для моделирования пространственных структур изучаемых доменов белковых продуктов гена LPL брали аминокислотные последовательности белковых структур канонических изоформ белка (P48357-1), депонированных в базе данных UniProt.
Для анализируемых доменов рассматриваемого белка в базе данных Protein Data Bank была найдена кристаллизованная белковая структура, пригодные в качестве шаблонов при моделировании. Для LPL – 2PPL_A. Цепь А этой структуры обладает гомологией 38 % с анализируемым нами доменом, что выше порогового значения в 30 % и позволяет достоверно судить о действии рассматриваемой мутации на белковый домен.
Для изучения физико-химических свойств белка использовали программу «ProtParam» и рассматривали такие параметры, как молекулярная масса, изоэлектрическая точка, устойчивость белка при нормальных условиях и индекс термостатирования.
Было установлено, что мутация ведет к увеличению молекулярной массы, к уменьшению изолектрической точки и устойчивости белка при нормальных условиях. Неизменным остается индекс термостатистирования.
Для мутации нами было проведено пространственное моделирование белков, содержащих их. Поиск белковых структур-шаблонов для моделирования проводили при помощи программы «Protein-Blast» : Далее в программе «MMM Server» проводили моделирование участков белков (приблизительно в 51 АК, 26 АК -целевая), содержащих рассматриваемые аминокислоты, подвергшиеся замене. На рис 1. показаны пространственные структуры нормального и мутантного белков.
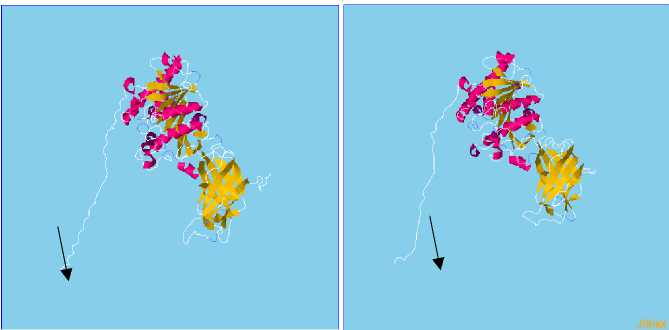
Б
Рис 1. Пространственная структура нормального(А) и мутантного (Б) белкового продукта липопротеинлипазы
Таким образом, полученные данные позволили установить, что мутантные аллели гена LPL ведут к конформационным изменениям доменов белков за счет замены аминокислоты на стоп-кодон, что изменяет их физикохимические свойства. Мутантный аллель гена LPL*S меняет аминокислоту 447 с серина на стоп-кодон, что увеличивает молекулярную массу белка и изменяет его электростатические свойства. Объем экстрацеллюлярного домена белка, затронутого мутацией, увеличивается, при одновременном увеличении его доступной площади, что, возможно, способно оказывать некоторое влияние на рецепцию липопротеинов.
Список литературы Биоинформатический анализ миссенс-мутации 1595C>G (Ser447Stop) гена липопротеинлипазы (LPL)
- Марри Р., Греннер Д., Мейес П., Родуэлл В. Б. Биохимия человека. М.: Мир, 1993. 384 с.
- Р. В. Мулюкова, Е.В. Воробьёва, М.Р. Богданов, В.Ю. Горбунова. Анализ взаимодействия генов липидного обмена, вовлеченных в метаболический синдром // Инновационный потенциал молодежной науки. С.56-60. Уфа. 2013.
- И. В. Николаев, Р.В. Мулюкова, Е.В. Воробьёва, В.Ю. Горбунова. Анализ взаимодействия аллелей генов липидного обмена (LEP, LEPR, LPL, PPARG), при дислипидемии // «Инновационный потенциал молодёжной науки». С.8-12. Уфа, 2014.
- Guruprasad K., Reddy B.V., Pandit M.W. Correlation between stability of a protein and its dipeptide composition: a novel approach for predicting in vivo stability of a protein from its primary sequence // Protein Eng. 1990. Nо. 4. P. 155-161
- National Center for Biotechnology Information [Электронныйресурс] // NCBI. Режим доступа: http://www.ncbi.nlm.nih.gov/, свободный. - Загл. с экрана. (18.05. 2015).
- Protein data bank. An Information Portal to 108789 Biological Macromolecular Structures [Электронныйресурс] // Protein data bank. Режим доступа:http://www.rcsb.org/pdb/home/home.do.
- ProtParam. Bioinformatic resource portal [Электронныйресурс] //ExPASy. Режим доступа:http://web.expasy.org/protparam/, свободный.


