Биологическая активность лекарственного препарата из полипептидов семенников в модели окислительного стресса in vitro
Автор: Хоченкова Ю.А., Мачкова Ю.С., Хоченков Д.А., Сафарова Эльмира Рафиговна, Бастрикова Н.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 3 т.15, 2022 года.
Бесплатный доступ
Введение. Мужское бесплодие является одной из основных причин вынужденной бездетности пар во всем мире. В настоящий момент на рынке представлено ограниченное число лекарственных препаратов для лечения мужского бесплодия. В комплексной терапии часто используются биологически активные добавки (БАДы), в состав которых входит L-карнитин. В настоящей работе представлены результаты определения терапевтической активности нового лекарственного препарата -пептидного комплекса, полученного из семенников крупного рогатого скота (КРС) -PP-R-001, предназначенного для лечения мужского бесплодия, а также сравнение его эффективности с L-карнитином на моделях индукции окислительного стресса в клеточных культурах. Материал и методы. Исследование было проведено на клеточных линиях перевиваемых тестикул поросенка (ПТП) и тестикул эмбриона быка (ТЭБ). Для индукции окислительного стресса (ОС) в клетках тестикул использовали два экспериментальных подхода: сокультивирование клеток либо ПТП, либо ТЭБ с цисплатином (cis-Pt), или перекисью водорода (H2O2). Протективное действие пептидного комплекса PP-R-001 определяли по результатам оценки индукции апоптоза и гибели клеток тестикул, миграционной активности, количеству клеток с двунитевыми разрывами ДНК, уровню активных форм кислорода, митохондриальной активности клеток в условиях ОС. Результаты. Выявлено достоверно более эффективное влияние PP-R-001 в сравнении с L-карнитином на выживаемость и снижение количества апоптотических клеток ПТП и ТЭБ и в условиях ОС. Препарат PP-R-001 достоверно увеличивал миграционную активность клеток обеих линий. Установлено, что PP-R-001 достоверно снижал уровень внутриклеточных повреждений, приводящих к апоптотической гибели клеток ТЭБ и ПТП при воздействии как cis-Pt, так и H2O2: препарат повышал активность митохондрий, снижал количество двунитевыхразрывов ДНК и активных форм кислорода (АФК). Заключение. Полученные данные показывают, что PP-R-001 оказывает мультимодальное воздействие на клетки тестикул ТЭБ и ПТП на моделях окислительного стресса, превосходящее эффект L-карнитина, широко применяемого в составе БАДов для повышения мужской фертильности.
Мужское бесплодие, пептидные препараты, l-карнитин, окислительный стресс, регуляторные пептиды, апоптоз, антиоксидантная терапия, пептидная терапия pp-r-001
Короткий адрес: https://sciup.org/142236637
IDR: 142236637 | DOI: 10.29188/2222-8543-2022-15-3-18-26
Текст научной статьи Биологическая активность лекарственного препарата из полипептидов семенников в модели окислительного стресса in vitro
На сегодняшний день диагноз «бесплодие» яв ляется глобальной проблемой здравоохранения: он за трагивает 187 миллионов пар репродуктивного возраста во всем мире и в 50% случаев ассоциирован с мужским фактором [1, 2].
По литературным данным, у 30–80% мужчин бес плодие связано с окислительным стрессом (ОС), кото рый рассматривается как один из основных повреждающих факторов и обусловлен чрезмерным усилением окислительных процессов при недостаточном функ ционировании антиоксидантной системы [3].
Окислительные реакции в нормальных условиях обеспечивают созревание, капацитацию (приобретение оплодотворяющей способности сперматозоидом в ходе движения по женским половым путям, в том числе ги перактивации и акросомальной реакции сперматозои дов), однако при неблагоприятном воздействии внешней среды, факторов образа жизни и ряда заболеваний, способствующих избыточной продукции активных форм кислорода (АФК), происходит повреждение био логических мембран сперматозоидов, вызывающих на рушение их подвижности, а также появление разрывов в цепочках ДНК (фрагментации ДНК), приводящих к ошибкам слияния генетического материала родителей, неправильному развитию эмбриона и замиранию бере менности на ранних сроках [3].
Было показано, что выраженность ОС имеет значительную отрицательную корреляцию с концент рацией, подвижностью и количеством морфологически нормальных форм сперматозоидов [4]. Показатели ОС в значительной степени положительно коррелируют с фрагментацией ДНК сперматозоидов [1, 4].
В исследовании S. Belloc и соавт. у 4345 бесплод ных мужчин (среди которых 1974 имели нормозооспер мию) была подтверждена положительная корреляция индекса фрагментации (ИФ) ДНК, признанного марке ром ОС, с возрастом (r=0,17) и отрицательная корреля ция ИФ ДНК с прогрессивной подвижностью сперматозоидов (r= - 0,26). Очень высокий ИФ ДНК (> 30%) был выявлен у 5% мужчин с нормозооспермией [4].
В соответствии с Европейскими и Российскими клиническими рекомендациями по лечению мужского бесплодия в состав комплексной терапии для повышения качества эякулята включены антиоксидантные средства, являющиеся биологически активными добавками [5-7].
Одним из основных компонентов данных БАДов является L-карнитин, обладающий свойствами прямого и опосредованного антиоксиданта, а также участвующий в энергетическом обмене и регуляции активности митохондрий. В число механизмов действия L-карнитина относится влияние на клеточную редокс-сигнали-зацию (систему внутриклеточной передачи сигнала) и на совокупность факторов транскрипции генов, контролирующих антиоксидантные и противовоспалительные процессы [6].
Новым классом рецептурных лекарственных средств для терапии мужского бесплодия являются препараты на основе пептидов, обладающих регуляторным механизмом действия, реализующимся через каскад сигналов. В семенниках обнаружено свыше 6000 пептидов, задействованных в регуляции биологических процессов [1]. В частности, пептиды, секретируемые клетками Сертоли, играют важную роль в поддержании сперматогенеза [8].
Среди механизмов действия регуляторных пептидов описаны важные для терапии бесплодия эффекты, в том числе предотвращение повреждения ДНК и усиление репаративных процессов, антиоксидантные и противовоспалительные свойства, подтвержденные многочисленными исследованиями in vitro и in vivo и имеющие важное значение для замедления развития возраст-ассоциированных патологий [6, 7, 9].
PP-R-001 – первый негормональный инъекционный лекарственный препарат для патогенетического лечения различных форм мужского бесплодия, содержащий комплекс регуляторных пептидов семенников крупного рогатого скота (КРС).
Цель настоящей работы – исследовать предполагаемые механизмы действия препарата,связанные с антиоксидантной активностью, в сравнении с L-карнитином на моделях ОС, вызванного cis-Pt и H 2 O 2 в культурах клеток тестикул поросенка и тестикул эмбриона быка (ТЭБ).
МАТЕРИАЛЫ И МЕТОДЫ
Клеточные культуры. Перевиваемые тестикулы поросенка (ПТП) и ТЭБ были получены из «Специализированной коллекции перевиваемых соматических клеточных культур сельскохозяйственных и промысловых животных» криобанка ФГБНУ ФНЦ ВИЭВ РАН. Клеточные культуры ПТП и ТЭБ культивировали в полной питательной среде EМЕМ (Gibco, США), содержащей 10% эмбриональной телячьей сыворотки (ЭТС, HyClone, США), 2 мМ/мл L-глутамина (Sigma- Aldrich, Германия), 10 МЕ/мл смеси пенициллин/стрептоми-цина (Lonza, Швейцария) при температуре 37°C в атмосфере с 5% CO 2 . Клетки поддерживали в логарифмической фазе роста постоянным пересевом культуры через 3–4 дня.
При выполнении работы использовали: перекись водорода (Panreac, Испания), цисплатин (Teva, Израиль), ацетил-L-карнитин (Abcam, США), L-карнитин (Sigma-Aldrich, Китай).
Оценка цитотоксичности. Клетки в количестве 8×103 клеток/лунка вносили в 96-луночный планшет в полной среде EMEM. Через 24 ч. заменяли среду и добавляли цисплатин (цис-Pt) или перекись водорода (Н 2 О 2 ) в диапазоне концентрации 10-2–10-10 М в трехкратных повторах. Инкубацию проводили в течение 48 ч. при 37 °С и 5% СО 2 . Затем вносили раствор МТТ (3-[4,5-диметилтриазол-2-ил]-2,5-дифенилтетразолий бромид (Sigma-Aldrich, Германия) в конечной концентрации 0,5 мг/мл. Клетки инкубировали еще 4 ч., затем среду отбирали и добавляли по 200 мкл/лунка диметилсульфоксида (ДМСО). Оптическую плотность (OD) раствора формазана определяли на спектрофометри-ческом анализаторе Multiscan FC (Thermo Scientific, США) при длине волны 570 нм, используя ДМСО как нулевой контроль. Выживаемость клеток рассчитывали по формуле: (OD экспериментальной группы – OD контрольной группы) / OD контрольной группы × 100%. Для каждого препарата строили график зависимости «доза-эффект» и определяли (полумаксималь-ную ингибирующую концентрацию) IC 50 .
Оценка миграционной активности методом «заживления раны». Клетки ПТП и ТЭБ высевали в 24-луночные лунки в концентрации 2×104 клеток/мл и инкубировали в течение 24 ч. После того как клетки достигали конфлюэнтности, удаляли центральную часть монослоя с помощью наконечника. Среду отбирали, промывали клетки фосфатно-солевым буфером (PBS, ПанЭко, Россия) и в каждую лунку добавляли культуральную среду, содержащую 0,1 μМ Н2О2 или 100 μМ cis-Pt, или их в комбинации с 1 мкг/мл PP-R-001 или 2,5 мМ L-карнитина и инкубировали в течение 48 ч. После инкубации монослой клеток фиксировали при помощи 1% раствора параформальдегида в течение 30 мин., затем клетки окрашивали кристаллическим фиолетовым красителем и отмывали 2 раза дистиллированной водой. Миграционную активность клеток определяли как пролиферацию клеток и их миграцию в сформированную бесклеточную область (зону повреждения). Площадь прироста определяли количественно с помощью программного обеспечения ImageJ v.1.78 (NIH, США) – для каждой группы высчитывали отношение площади прироста в опытных группах по отношению к интактному контролю в %.
Проточная цитометрия. Количество апоптоти-ческих клеток определяли окрашиванием Annexin-V и propidium iodide (PI) с использованием набора Annex-inV-FITC (Invitrogen, США) в соответствии с протоколом производителя. После инкубации с 0,1 μМ Н 2 О 2 или 100 μМ цисплатина, или данными агентами в комбинации с 1 мкг/мл PP-R-001 в течение 48 ч., клетки снимали, отмывали центрифугированием и ресуспен-дировали осадок клеток в 100 мкл PBS. Далее добавляли раствор, содержащий PI и аннексин V. Клетки инкубировали при комнатной температуре в темноте в течение 15 мин., затем добавляли 350–400 мкл связывающего буфера для остановки реакции.
Для оценки функционального состояния митохондрий в клетках использовали митохондриальный селективный флуоресцентный зонд MitoTracker Green FM (Invitrogen, США). Клетки линий ПТП и ТЭБ инкубировали с 0,1 μМ Н 2 О 2 или 100 μМ цисплатина, или в комбинации с 1 мкг/мл PP-R-001 в течение 48 ч. Клетки отмывали центрифугированием дважды в PBS, вносили к осадку клеток MitoTracker Green и инкубировали 30 мин. После отмывки клетки ресуспендиро-вали в PBS для анализа методом проточной цитометрии.
Оценку индукции окислительного стресса проводили при помощи флуоресцентного красителя CellRox DeepR ed (Invitrogen, США), который обнаруживает окислительный стресс в клетках, реагируя с АФК и приобретая флуоресцентную окраску с длиной волны
665 нм. Анализ данных (не менее 10 тыс. событий) проводили на проточном цитометре Novocyte 2000R c использованием программного обеспечения Novoexpress 1.3.5. (Agilent, США).
Иммуноцитохимическое исследование. Клетки ПТП и ТЭБ наращивали на стеклах до 80% монослоя, далее фиксировали в спирте и ацетоне, инкубировали с первичными антителами к ядерному антигену пролиферирующих клеток (PCNA) (Abcam, США) или ви-ментину (Dako, Дания) при 4 ºС в течение 18 ч. Клетки промывали и инкубировали с вторичными антивидовыми антителами, меченными AlexaFluor®488 (Life Technologies, США), а затем с ядерным красителем DAPI (Invitrogen, США). Клетки заключали под покровные стекла с использованием полимерной среды Fluorescent mounting medium (Dako, Дания). Интенсивность окрашивания оценивали на клеточном анализаторе InCell Analyzer 6000 (GE Healthcare, США) с использованием программного обеспечения InCell Investigator (GE Healthcare, США).
Статистический анализ. Все эксперименты были выполнены в трех повторах. Статистический анализ и графический интерфейс представлены с использованием программного обеспечения GraphPad Prizm v.8.0. (GraphPad, США). Статистическую обработку проводили с использованием критерия Манна-Уитни. Статистически значимыми считались различия при р <0,05.
РЕЗУЛЬТАТЫ
Одним из основных механизмов, лежащих в основе мужского бесплодия, является окислительный стресс, который может вызывать повреждения ДНК, поэтому антиоксиданты, такие как L-карнитин, рекомендованы в протоколах терапии мужского бесплодия. Для определения спектра биологической активности пептидного комплекса PP-R-001 на основе экстракта семенников КРС были использованы модели индукции окислительного стресса при помощи cis-Pt и Н 2 О 2 в клеточных линиях ПТП и ТЭБ.
При исследовании жизнеспособности клеток ПТП и ТЭБ методом МТТ было показано, что применение 100 μМ цис-Pt (48 ч.) или 0,1 μМ Н2О2 (24 ч.) вызывает снижение количества живых клеток до 12–25%. Для определения, может ли PP-R-001 сохранять жизнеспособность клеток, мы провели совместное культивирование клеток с каждым из индукторов АФК и PP-R-001 (0,1–1 мкг/мл). В результате было установлено дозозависимое увеличение жизнеспособности клеток при добавлении PP-R-001 до 92–97% в обеих клеточных линиях при концентрации PP-R-001 1 мкг/мл, которую использовали в дальнейших экспериментах. Совместное культивирование клеточных линий с L-карнитином (2,5–5,0 мМ) вызывало менее выраженное увеличение жизнеспособности клеток ТЭБ и ПТП в присутствии цис-Pt или Н2О2 – 60-70%.
Миграция клеток является одним из базовых па раметров оценки функционального состояния клеток поэтому была проведена оценка изменения действия пептидного комплекса PP-R-001 и L-карнитина на миг рационную активность клеток на модели «заживления раны» после формирования бесклеточного участка. Применение как цис-Pt, так и Н 2 О 2 подавляет мигра цию клеток (рис. 1). Прирост монослоя клеток ПТП под действием цис-Pt составил 32,8 ± 11,6% и под дей ствием Н 2 О 2 – 31,5 ± 8,3% от контроля. Схожее ингиби рующее действие оказало и применение 100 μМ цис-P (31,1 ± 4,6%) и 0,1 μМ Н 2 О 2 (37,9±7,6%) на клетках ТЭБ. Добавление PP-R-001 в концентрации 1 мкг/мл цис-P и Н 2 О 2 увеличивало миграционную активность клеток в поврежденную область и восстанавливало монослой клеток. Применение 1 мкг/мл PP-R-001 со 100 μМ цис Pt на клеточной линии ПТП приводило к увеличению площади монослоя клеток в 2,5 раза (81,5 ± 7,8% р <0,05), а в перекисной модели — в 1,9 раза (59,6 ± 9,9 р <0,05) по сравнению c группами без введения 1 мкг/мл PP-R-001. Аналогичный эффект применения 1 мкг/мл PP-R-001 с 100 μМ цис-Pt и 0,1 μМ Н 2 О 2 наблюдали на клеточной линии ТЭБ – (44,9 ± 5,1% и 50,7 ± 7,9%, со ответственно, р <0,05) по сравнению с группами без введения 1 мкг/мл PP-R-001. L-карнитин вызывал несколь ко меньшую стимуляцию миграционной активности (42,5±7,8% и 44,5±4,7% на клеточной линии ПТП, и 41,4±6,4%, 43,5±3,7% на клеточной линии ТЭБ) по
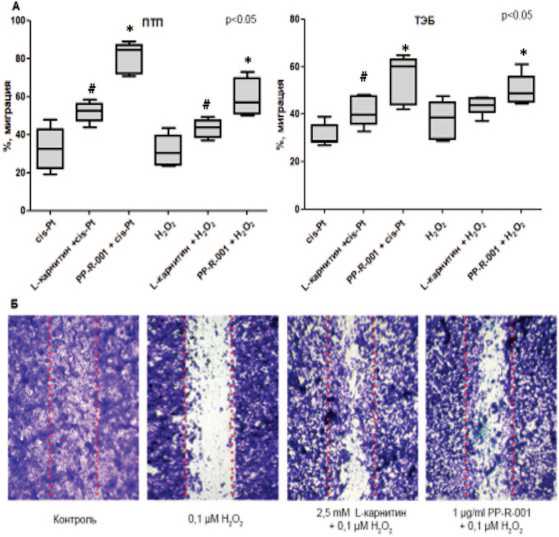
Рис. 1. Миграционная активность клеток ПТП и ТЭБ (А). Микрофотографии миграции клеток ПТП (Б), окраска метиленовым фиолетовым, увеличение ×100. * - р <0,05 – отличия от изменений без препарата, # - р <0,05 – отличия между PPR-001 и L-карнитином
Fig. 1. Migration activity of PTP and TEB cells (A). Micrographs of PTP cell migration (B), stained with crystal violet, ×100 magnification. * - р<0.05 - differences from changes without the drug, # - р<0.05 - differences between PPR-001 and L-carnitine сравнению с PP-R-001 на обеих клеточных линиях. Таким образом, пептидный комплекс оказывает сти мулирующее влияние на миграцию клеток тестикул ТЭБ и ПТП.
Для более углубленного изучения возможных ме ханизмов действия PP-R-001 мы провели оценку ин дукции клеточной гибели, активности АФК, повреж дения ДНК и митохондриальной активности на модели цис-Pt и Н 2 О 2 .
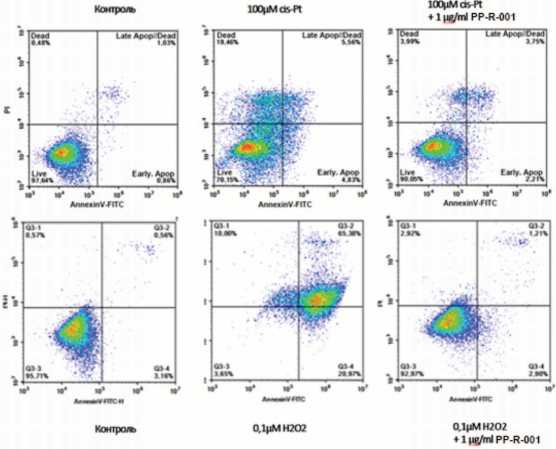
Рис. 2. Оценка апоптоза и гибели клеток линии ПТП под действием цисплатина и H 2 O 2 в комбинации с PP-R-001 при помощи Annexin V/PI после 48 ч. инкубации с 0,1 μМ Н 2 О 2 или 100 μМ cis-Pt, или в комбинации с 1 мкг/мл PP-R-001. По оси абсцисс – количество апоптотических клеток, окрашенных Annexin V-FITC, по оси ординат – количество мертвых клеток, окрашенных PI
Fig. 2. Evaluation of apoptosis and death of PTP cells under the influence of cisplatin and H 2 O 2 in combination with PP-R-001 using Annexin V/PI staining after 48 h incubation with 0.1 μM H 2 O 2 or 100 μM cis-Pt, or in combination with 1 μg/ml PP-R-001. The X-axis shows the number of apoptotic cells stained with Annexin V-FITC; the Y-axis shows the number of dead cells stained with propidium iodide
Оба примененных индуктора клеточного стресса вызывают индукцию апоптоза и гибель клеток ПТП и ТЭБ, что выражается в снижении доли живых клеток при двойной окраске PI и Annexin V-FITC. Для клеточ ной линии ПТП количество живых клеток снижалось с 95–97% до 70% при применении цис-Pt и до 3–5% при применении Н 2 О 2 (основная часть клеток находится в апоптозе). Введение PP-R-001 в среду культивирова ния позволяет восстановить содержание живых клеток до 90–92% (рис. 2). Сходные изменения были установ лены и в случае клеточной линии ТЭБ.
Для оценки роли двунитевых разрывов ДНК (DSB) в индукции клеточной гибели под действием цис-Pt и Н 2 О 2 и восстановлении жизнеспособности клеток под действием PP-R-001 проводили окрашива ние клеток ПТП и ТЭБ антителами к фосфорилиро ванному γH2AX (Ser139), а также индикаторами активности митохондрий MitoTracker Green FM и ак тивных форм кислорода (АФК) CellROX Deep Red. Ко личество позитивно окрашенных клеток определяли методом проточной цитометрии (рис. 3-5).
Согласно полученным данным, и цис-Pt, и Н 2 О 2 вызывают повышение количества клеток с DSB в кле точных линиях ТЭБ и ПТП по сравнению с интактным контролем. В зависимости от клеточной линии и при меняемого агента число клеток с поврежденной ДНК различается: по отношению к цис-Pt более чувстви тельны клетки линии ПТП (72,8%), чем ТЭБ (7,6%). При применении Н 2 О 2 более чувствительны клетки линии ТЭБ (54,2%), чем ПТП (33,7%). Применение PP R-001 статистически значимо снижало количество кле ток с DSB в клеточных линиях ПТП до 40% при cis-P и 4,3% при Н 2 О 2 , для клеток ТЭБ – 20% и 53,5%, соот ветственно (рис. 3).
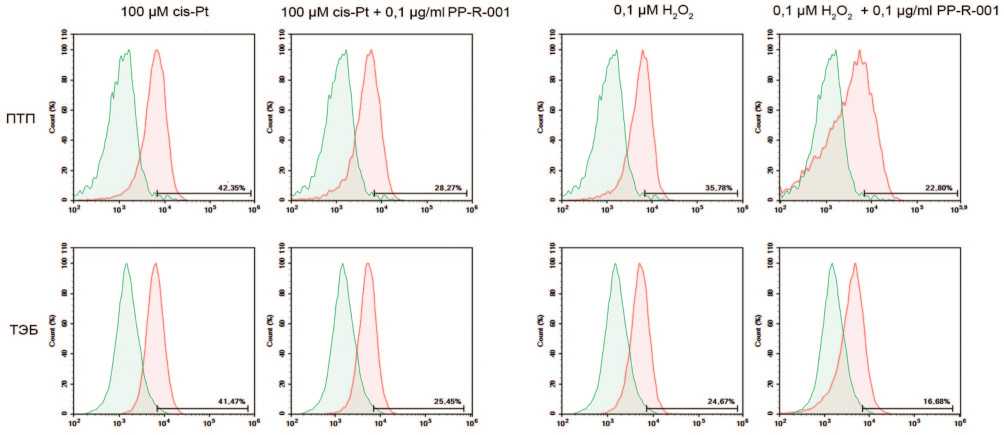
Рис. 3. Количество клеток с двунитевыми разрывами ДНК при окрашивании антителами к p-γH2AX (Ser139) после 48 ч. инкубации с 0,1 μМ Н 2 О 2 или 100 μМ cis-Pt, или в комбинации с 1 мкг/мл PP-R-001. Красная гистограмма – окраска антителами к p-γH2AX (Ser139) клеток опытных групп. Зеленая гистограмма – клетки контрольной группа
Fig. 3. The number of cells with DNA double-strand breaks when stained with antibodies to p-γH2AX (Ser139) after 48 h of incubation with 0.1 μM H 2 O 2 or 100 μM cis-Pt, or in combination with 1 μg/ml PP-R-001. Red histogram - staining with antibodies to p-γH2AX (Ser139) of cells from experimental groups. Green histogram - control group cells


При оценке активности митохондрий при помощи окраски MitoTracker Green установлено, что в клетках ПТП применение цис-Pt и Н 2 О 2 не вызывает изменений активности митохондрий и введение в систему PP-R-001 значимо не увеличивает окраску MitoTracker Green, а, следовательно, и активность митохондрий.
На клеточной линии ТЭБ при применении PP-R-001 после воздействия цис-Pt происходит увеличение количества положительно окрашенных клеток (79,4%), по сравнению с интактным контролем. При примене нии Н 2 О 2 также установлено снижение функций мито хондрий по сравнению с контролем,которые восстанавливается под действием PP-R-001.
Применение cis-Pt и Н 2 О 2 вызывает образование АФК, что выражается в увеличении количества клеток, окрашенных внутриклеточным индикатором АФК – CellROX Deep Red (рис. 5). При применении PP-R-001 количество АФК в клетках значимо снижается во всех экспериментальных группах, но не достигает уровня интактного контроля.
При иммуноцитохимической окраске клеток антителами к PCNA (Proliferating cell nuclear antigen -ядерному антигену пролиферирующих клеток), маркеру пролиферации, и виментину, маркеру клеточной адгезии, установлено, что применение цис-Pt и Н 2 О 2 на клеточных линиях ПТП и ТЭБ вызывает снижение
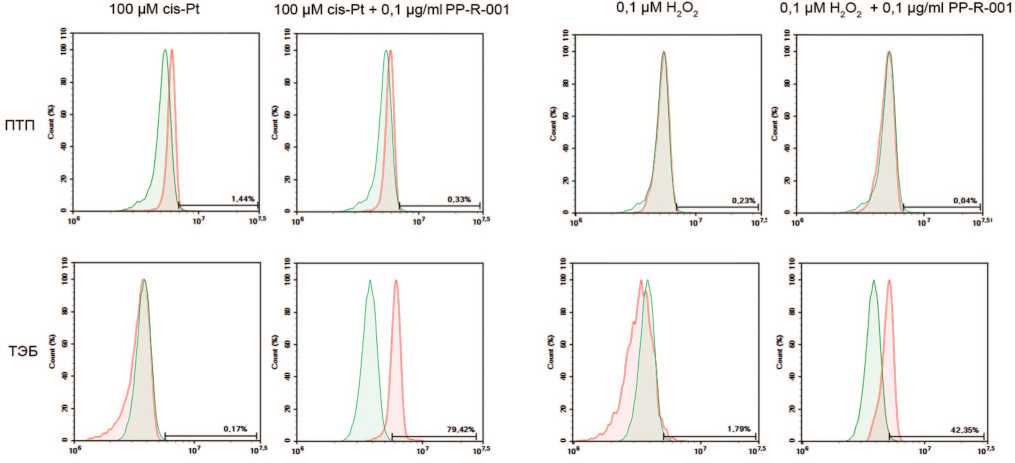
Рис. 4. Окраска клеток ПТП и ТЭБ индикатором активности митохондрий MitoTracker Green после 48 ч. инкубации с 0,1 μМ Н 2 О 2 или 100 μМ cis-Pt, или в комбинации с 1 мкг/мл PP-R-001. Красная гистограмма – окраска MitoTracker Green клеток опытных групп. Зеленая гистограмма – окраска MitoTracker Green клеток контрольной группы
Fig. 4. Staining of PTP and TEB cells with the indicator of mitochondrial activity MitoTracker Green after 48 h of incubation with 0.1 μM H 2 O 2 or 100 μM cis-Pt, or in combination with 1 μg/ml PP-R-001. Red histogram - MitoTracker Green staining of experimental group cells. Green histogram - MitoTracker Green staining of control group cells
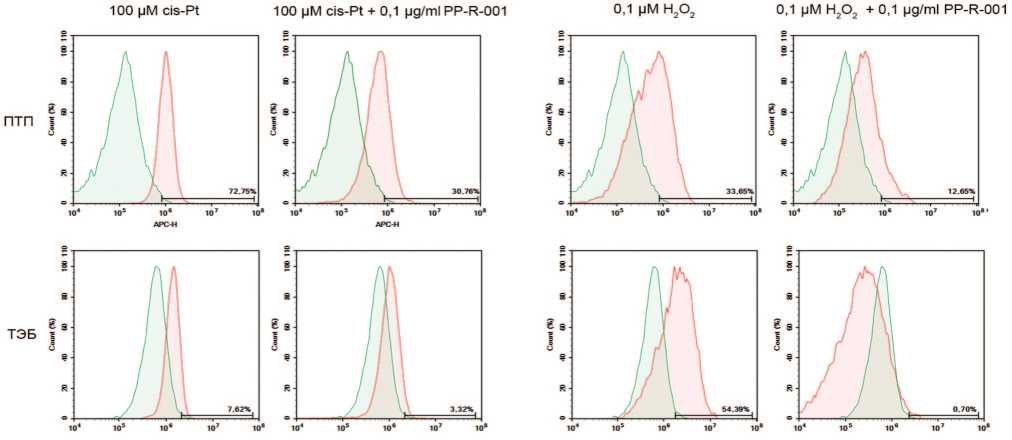
Рис. 5. Определение АФК в клетках ПТП и ТЭБ при помощи CellRox DeepRed после 48 ч. инкубации с 0,1 μМ Н 2 О 2 или 100 μМ cis-Pt, или в комбинации с 1 мкг/мл PP-R-001. Красная гистограмма – окраска CellRox DeepRed клеток опытных групп. Зеленая гистограмма – окраска CellRox DeepRed клеток контрольной группы
Fig. 5. Determination of ROS in PTP and TEB cells using CellROX Deep Red after 48 h incubation with 0.1 μM H 2 O 2 or 100 μM cis-Pt, or in combination with 1 μg/ml PP-R-001. Red histogram - CellRox DeepRed staining of experimental group cells. Green histogram - CellRox DeepRed staining of control group cells
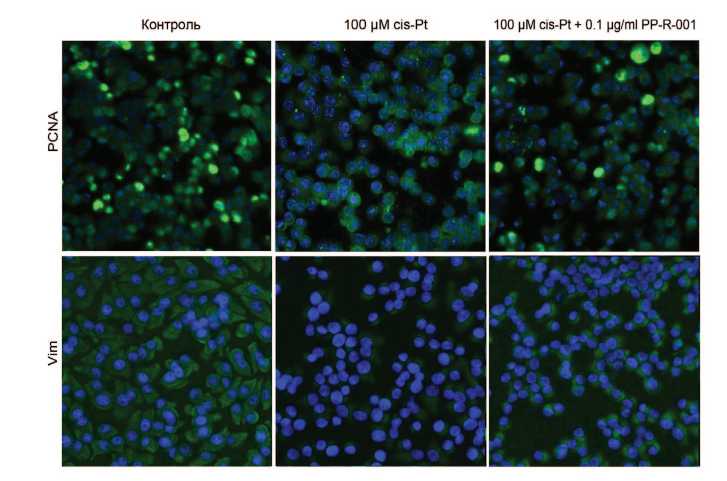
Рис. 6. Окраска клеток ПТП антителами к PCNA или Виментину (зеленая окраска) и ядер клеток при помощи DAPI (синяя окраска) после 48ч инкубации с 100 μМ cis-Pt, или в комбинации с 1 мкг/мл PP-R-001
Fig. 6. Staining of PTP cells with anti-PCNA and anti-Vimentin antibodies (green stain) and cell nuclei with DAPI (blue stain) after 48 h incubation with 100 μM cis-Pt, or in combination with 1 μg/ml PP-R -001
количества PCNA-позитивных клеток, что связано со снижением пролиферации и коррелирует со сниже нием миграционной активности.Совместное приме нение PP-R-001 с цис-Pt или Н 2 О 2 вызывает вос становление пролиферации клеток. Аналогичные из менения установлены в отношении экспрессии вимен тина: снижение под действием цис-Pt и Н 2 О 2 и восстановление при комбинированном применении PP-R-001с цис-Pt или Н 2 О 2 (рис. 6).
ОБСУЖДЕНИЕ
Бесплодие может развиваться как в результате гибели половых клеток,так и вследствие изменения их качества (фрагментация ДНК, изменение подвиж ности), которое, в том числе, обеспечивается поддер живающей ролью клеток тестикул. Использованные в работе клеточные модели воспроизводят поврежде ния клеток тестикул, которые происходят в результате окислительного стресса – одного из важнейших ин дукторов гибели и нарушения функционирования клеток.Модели индукции клеточной гибели при по мощи цис-Pt и Н2О2 имеют отличия в индукции по вреждения клеток [9]. Жизнеспособность клеток восстанавливалась более выраженно и дозозависимо при сокультивировании клеток с PP-R-001, но не с L-карнитином. Миграционная активность, которая связана с жизнеспособностью клеток и активностью митохондрий,была статистически достоверно выше при добавлении PP-R-001 по сравнению с L-карнити ном в обеих культурах.
Ранее было показано,что механизмы действия L-карнитина связаны с активацией MAPK (mitogen activated protein kinase — митоген-активируемая про
Таблица 1. Сравнительная эффективность препаратов на моделях окислительного стресса (по сравнению с результатами, полученными на индукторах окислительного стресса)
Table 1. Comparative efficacy of drugs in models of oxidative stress (compared to the results obtained on oxidative stress inducers)
|
Метод исследования Research method |
Клеточная линия Cell lines |
Модель индукции окислительного стресса Model of oxidative stress induction |
|||
|
Цисплатин Cisplatin |
Н 2 О 2 |
||||
|
+PP-R-001 |
+LC |
+PP-R-001 |
+LC |
||
|
Миграция клеток (изменение площади монослоя клеток) |
ПТП PTP |
↑2,5* |
↑1,6*,# |
↑ 1,9* |
↑1,4*,# |
|
Cell migration (cell monolayer area change) |
ТЭБ TEB |
↑ 1,8* |
↑ 1,3*,# |
↑1,3* |
↑ 1,1 |
* - p <0,05 – в сравнении с индукторами окислительного стресса, # p <0,05 – сравнение между PPR-001 и L-карнитином
* - p <0.05 - compared with oxidative stress inducers, # p <0.05 - comparison between PPR-001 and L-carnitine
теинкиназа) – и Akt-зависимых (RAC-alpha serine/thre onine-protein kinase – RAC-альфа серин/треонин-про теин киназа) сигнальных путей [11]. Возрастные изменениях в семенниках также сопровождаются из менением представленности белков в протеоме,выра женное в повышенном содержании нескольких небольших протеогликанов,богатых лейцином и бел ков внеклеточного матрикса, что может быть связано с нарушением миграции клеток и фиброзными явле ниями [12].
Результаты, суммированные в таблице 1, свиде тельствуют, что препарат PP-R-001 не только защи щает клетки тестикул от гибели под действием индукторов окислительного стресса, но также усили вает способность ткани к восстановлению после по вреждения, что выражается в увеличении миграционной активности по сравнению с L-карнитином, и может быть связано с активацией внутриклеточных сигнальных путей [13].
Жизнеспособность клеток, состояние митохонд рий, двухнитевые разрывы ДНК и концентрация АФК различались на 2 клеточных линиях, что отражено в таблице 2 и на рисунках 3–5. Нарушение процесса го мологичной рекомбинации приводит к бесплодию, врожденным дефектам, связанным с анеуплоидией, и невынашиванием беременности [14]. Установленное снижение количества двухцепочечных разрывов ДНК (D SB – double-strand DNA breaks – двунитевые раз рывы ДНК) под действием PP-R-001 является одним из механизмов его действия. Ранее было показано, что пептидные гормоны также могут участвовать в регу ляции восстановления двунитевых разрывов ДНК [15].
По результатам эксперимента наблюдалось вос становление уровня экспрессии PCNA под действием PP-R-001. В настоящее время имеются свидетельства, что PCNA участвует не только в пролиферации кле ток, но и в восстановлении ДНК после ее повреждения в семенниках [16]. По литературным данным, экспрес сия PCNA наблюдается в ядрах сперматогоний-А-светлых (в мета-, ана- и телофазы митоза) и сперматоцитов, а также в некоторых клетках Сертоли в препубертатном периоде постнатального онтогенеза [17]. Таким образом пептидный препарат PP-R-001 оказывает мультимодальное протективное действие на клеточные линии, использованные в работе, а именно: активация митохондрий, снижение уровня АФК, количества двунитевых разрывов в ДНК и, как следствие, снижение количества клеток, находящихся в апоптозе и некрозе,при действии повреждающих агентов – цис-Pt и Н 2 О 2 .
ЗАКЛЮЧЕНИЕ
Препарат на основе пептидов PP-R-001 обладает выраженным антиоксидантным и пролиферативным действием на клетки тканей семенников в эксперимен тальных моделях in vitro и является более эффектив ным протектором в отношении окислительного стресса по сравнению с L-карнитином, широко применяемым в составе БАДов при мужском бесплодии.
Таблица 2. Влияние PP-R-001 на клеточные механизмы гибели при окислительном стрессе на двух моделях в культурах клеток ТЭБ и ПТП (по сравнению с результатами, полученными на индукторах окислительного стресса)
Table 2. Effect of PP-R-001 on mechanisms of cellular death under oxidative stress using two models both in TEB and PTP cell cultures (compared to the results obtained on oxidative stress inducers)
|
Эффект Effect |
Модель Model |
|||
|
Цисплатин + PP-R-001 Cisplatin + PP-R-001 |
Н 2 О 2 + PP-R-001 |
|||
|
ПТП PTP |
ТЭБ TEB |
ПТП PTP |
ТЭБ TEB |
|
|
Апоптоз, прирост живых клеток Apoptosis, growth of living cells |
↑ 20%* |
↑>75%* |
↑ >85%* |
↑>90%* |
|
Двунитевые разрывы ДНК, % клеток Double strand breaks in DNA, % cell |
↓66,8%* |
↓61,3%* |
↓63,%* |
↓67,6%* |
|
Активность митохондрий Mitochondrial activity |
Без изменений No changes |
↑39,5%* |
↑ 8,1%* |
↑46,7%* |
|
Уровень АФК ROS level |
↓ 65,9%* |
↓ 70,3%* |
↓62.5%* |
↓ 50,8%* |
* - p <0,05 – по сравнению с результатами, полученными на индукторах окислительного стресса
* - p <0.05 – compared with the results obtained on oxidative stress inducers
ЛИТЕ РАТУPA/REFEREN CE S
Information about authors:
Хоченкова Ю.А. – м.н.с. лаборатории биомаркеров и механизмов опухолевого ангиогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; Москва, Россия;
РИНЦ AuthorID 674364
Мачкова Ю.С. – м.н.с. лаборатории биомаркеров и механизмов опухолевого ангиогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; Москва, Россия;
РИНЦ AuthorID 1049589
Сафарова Э.Р. – к.б.н., консультант по исследованиям и разработкам, ООО «ПептидПро»; Москва, Россия
Бастрикова Н.А. – к.б.н.,медицинский директор, ООО «ПептидПро»; Москва, Россия
Вклад авторов:
Хоченкова Ю.А. – выполнение экспериментов, написание текста, 35%
Мачкова Ю.С. – выполнение экспериментов, 10%
Хоченков Д.А. – выполнение экспериментов, написание текста, 35%
Сафарова Э.Р. – концепция и дизайн эксперимента, написание текста, 15%
Бастрикова Н.А. – концепция и дизайн эксперимента, написание текста, 5%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Исследование проведено при финансовой поддержке ООО «ПептидПро».
Khochenkova Yu.A. – junior researcher Laboratory of Biomarkers and Mechanisms of Tumor Angiogenesis, N.N. Blokhin National Medical Research Center of Oncology of the Ministry of Health of Russia; Moscow, Russia;
Machkova Yu.S. – junior researcher Laboratory of Biomarkers and Mechanisms of Tumor Angiogenesis, N.N. Blokhin National Medical Research Center of Oncology of the Ministry of Health of Russia; Moscow, Russia;
Khochenkov D.A. - PhD., head of Laboratory of Biomarkers and Mechanisms of Tumor Angiogenesis, N.N. Blokhin National Medical Research Center of Oncology of the Ministry of Health of Russia; Moscow, Russia;
Safarova E.R. – PhD, R&D consultant, PeptidPro LLC; Moscow, Russia;
Bastrikova N.A. – PhD, Medical Director, PeptidPro LLC; Moscow, Russia
Authors’ contributions:
Khochenkova Yu.A. – performing experiments, article writing, 35%
Machkova Yu.S. – performing experiments, 10%
Khochenkov D.A. – performing experiments, article writing, 35%
Safarova E.R. – concept and design of the experiment, article writing, 15%
Bastrikova N.A. – concept and design of the experiment, article writing, 5%
Conflict of interest. The authors declare no conflict of interest.
Financing. The study was financially supported by PeptidPro Ltd.
Список литературы Биологическая активность лекарственного препарата из полипептидов семенников в модели окислительного стресса in vitro
- Agarwal A, Majzoub A, Parekh N, Henkel R. A schematic overview of the current status of male infertility practice. World J Mens Health 2020(38):308-322. https://doi.org/10.5534/wjmh.190068.
- Kumar N, Singh AK. Trends of male factor infertility, an important cause of infertility: A review of literature. J Hum Reprod Sci 2015(8):191—6. https://doi.org/10.4103/0974-1208.170370.
- Tremellen K. Oxidative stress and male infertility—a clinical perspective. Hum Reprod Update 2008(14):243-258. https://doi.org/10.1093/humupd/dmn004.
- Belloc S, Benkhalifa M, Cohen-Bacrie M, Dalleac A, Amar E, Zini A. Sperm deoxyribonucleic acid damage in normozoospermic men is related to age and sperm progressive motility. Fertil Steril 2014( 101): 1588-93. https://doi.org/10.1016/ j.fertnstert.2014.02.006.
- Ахвледиани Н.Д., Аполихин О.И., Бабенко А.Ю., Боголюбов С.В., Божедомов А.А., Виноградов И.В. и др. Мужское бесплодие. Клинические рекомендации. Министерство здравоохранения Российской Федерации (21.05.2021). URL: http://www.consultant.ru/document/cons_doc_LAW_385208/8efd5f17af55cb35a77 0f73937590c642437b7eb/ [Akhvlediani N.D., Apolikhin O.I., Babenko A.Yu., Bo-golyubov S.V., Bozhedomov A.A., Vinogradov I.V., et al. Male infertility. Clinical guidelines. Ministry of Health of the Russian Federation (21.05.2021). URL: http://www.consultant.ru/document/cons_doc_LAW_385208/8efd5f17af55cb35a77 0f73937590c642437b7eb/ (In Russian)].
- Ljungberg B, Cowan NC, Hanbury DC, Hora M, Kuczyk MA, Merseburger AS, et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol 2010(58):398-406. https://doi.org/10.1016/j.eururo.2010.06.032.
- Calogero A, Condorelli R, Russo G, Vignera SL. Conservative nonhormonal options for the treatment of male infertility: antibiotics, anti-inflammatory drugs, and antioxidants. Bio Med Res Int 2017;2017:4650182. https://doi.org/10.1155/2017/4650182.
- Wu S, Yan M, Ge R, Cheng CY. Crosstalk between sertoli and germ cells in male fertility. Trends Mol Med 2020(26):215-31. https://doi.org/10.1016/j.molmed.2019.09.006.
- Nerush A, Orlova A, Maslennikova A, Brilkina A, Balalaeva I, Antonova N, et al. The study of hydrogen peroxide level under cisplatin action using genetically encoded sensor HyPer. Prog Biomed Opt Imaging - Proc SPIE 2014;8956. https://doi.org/10.1117/12.2037737.
- Huang X, Halicka HD, Darzynkiewicz Z. Detection of histone H2AX phosphorylation on Ser-139 as an indicator of DNA damage (DNA double-strand breaks). Curr Protoc Cytom 2004;Chapter 7:Unit 7.27. https://doi.org/10.1002/0471142956. cy0727s30.
- Terruzzi I, Montesano A, Senesi P, Villa I, Ferraretto A, Bottani M, et al. L-carnitine reduces oxidative stress and promotes cells differentiation and bone matrix proteins expression in human osteoblast-like cells. Bio Med Res Int 2019;2019:e5678548. https://doi.org/10.1155/2019/5678548.
- Stöckl JB, Schmid N, Flenkenthaler F, Drummer C, Behr R, Mayerhofer A, et al. Age-related alterations in the testicular proteome of a non-human primate. Cells 2021(10):1306. https://doi.org/10.3390/cells10061306.
- Li H, Liu S, Wu S, Li L, Ge R, Cheng CY. Bioactive fragments of laminin and collagen chains - lesson from the testis. Reprod Camb Engl 2020(159):R111-R123. https://doi.org/10.1530/REP-19-0288.
- Guan Y, Lin H, Leu NA, Ruthel G, Fuchs SY, Busino L, et al. SCF ubiquitin E3 ligase regulates DNA double-strand breaks in early meiotic recombination. Nucleic Acids Res 2022;gkac304. https://doi.org/10.1093/nar/gkac304.
- Chesnokova V, Melmed S. Peptide Hormone Regulation of DNA damage responses. Endocr Rev 2020;41:bnaa009. https://doi.org/10.1210/endrev/bnaa009.
- Szczepanek K, Lesnefsky EJ, Larner AC. Multi-tasking: nuclear transcription factors with novel roles in the mitochondria. Trends Cell Biol 2012(22):429-37. https://doi.org/10.1016/_j.tcb.2012.05.001.
- Tian P, Lv P, Shi W, Zhu M, Cong B, Wen B. Chronic stress reduces spermato-genic cell proliferation in rat testis. Int J Clin Exp Pathol 2019(12):1921-31.


