Биологическая полноценность эпидидимального семени зубра (Bison bonasus L.) при криоконсервации и длительном хранении
Автор: Иолчиев Б.С., Абилов А.И., Таджиева А.В., Багиров В.А., Насибов Ш.Н., Шайдуллин И.Н., Кленовицкий П.М., Комбарова Н.А., Жилинский М.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Криорезистентность сперматозоидов
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
Сохранение генетических ресурсов имеет важное значение для обеспечения населения продуктами питания в условиях роста его численности, ограниченности ресурсов Земли и исчезновения видов. В зависимости от стратегии сохранения генетических ресурсов используется два основных метода: in situ - сохранение видов в естественной среде обитания, ex situ - сохранение компонентов биологического разнообразия вне естественных мест обитания или посредством криоконсервации биологических материалов. Криоконсервация позволяет использовать генетический ресурс диких видов не только для сохранения и восстановления, но и для интродукции в генотип домашних животных. Зубр ( Bison bonasus ) относится к редким исчезающим видам. В настоящее время численность вольноживущих зубров в России составляет более 1500 гол. Проводится научно-исследовательская работа по сохранению генофонда зубра в России, одна из основных составляющих которой - создание криобанка семени. Настоящая работа посвящена изучению биологической полноценности криоконсервированного эпидидимального семени зубров после длительного (более 20 лет) хранения. Сбор сперматозоидов проводили постмортально из придатка семенника от самцов, получивших несовместимые с жизнью травмы, или от выбракованных (предназначенных для охоты) особей. Количество и подвижность свежеполученного эпидидимального семени определяли по методике, применяемой для оценки качества семени быков-производителей. Семя замораживали в гранулах в соответствии с технологией криоконсервации спермы быков-производителей. Подвижность сперматозоидов оценивали с применением технологии computer-assisted semen analysis (CASA), степень фрагментации ДНК изучали в тесте с акридиновым оранжевым. Состояние акросом определяли с помощью Diff Quik окрашивания. Также изучали морфометрические показатели сперматозоидов, полученных от зубров ( n = 4) и быков-производителей голштинской породы ( n = 15) (использовали эякулированное семя быков). Сперма быков была криоконсервирована в пайетах, сперма зубров - в гранулах. Срок хранения семени зубров составлял более 20 лет, быков - не более 2 лет. Количество сперматозоидов с поступательно-прямолинейным движением у разных зубров существенно различалось: у Мутфиля и Моруса доля сперматозоидов класса А + В в замороженно-оттаянном семени составила более 28 %, у Авеля и Мисира неподвижных сперматозоидов было более 67 %, с манежным и колебательным движением - соответственно 12,1 и 10,4 %. Частота сперматозоидов с патологической морфологией значительно варьировала в зависимости от индивидуальных особенностей зубров: максимальное значение - 14,6 %, минимальное - 6,8 %. Степень фрагментации ДНК в хроматине сперматозоидов изменялась от 7 до 86 %. По всем морфометрическим параметрам, кроме ширины головки, сперматозоиды зубров уступали сперматозоидам быков-производителей. Следует отметить, что различия между группами по показателям, кроме площади головки, не были достоверны (площадь головки сперматозоида у быков оказалась на 3,14 мкм2 больше, чем у зубров).
Зубр, криоконсервация, сперматозоиды, акросомы, индекс фрагментации днк, хроматин
Короткий адрес: https://sciup.org/142214026
IDR: 142214026 | УДК: 636.082:599.735.51:591.463.1 | DOI: 10.15389/agrobiology.2017.2.282rus
Текст научной статьи Биологическая полноценность эпидидимального семени зубра (Bison bonasus L.) при криоконсервации и длительном хранении
В настоящее время один из глобальных вызовов человечеству — задача сохранения флоры и фауны (1, 2). Вследствие неблагоприятной экологической обстановки, техногенных, экономических и других факторов, большинство из которых носят антропогенный характер, некоторые виды находятся под угрозой исчезновения. Доказано, что устойчивость сообщества тем выше, чем больше число составляющих его видов, следовательно, сохранение биоразнообразия — единственный механизм обеспечения стабильности жизни на Земле (3, 4). Кроме того, при высокой скорости роста численности населения и ограниченности ресурсов серьезной проблемой становится обеспечение продуктами питания и сырьем для легкой промышленности. Ее эффективное решение — выведение высокопродуктив-
* Исследования выполнены при финансовой поддержке программы Президиума РАН ¹ IV.13.3.
ных пород и одомашнивание диких видов животных. Генетическое разнообразие исходного материала влияет на успех селекции: длительный отбор сопровождается увеличением гомозиготности, что, в свою очередь, приводит к ряду нарушений — к снижению резистентности, появлению наследственных заболеваний и т.д. Для повышения гетерезиготности часто требуется интродукция нового генетического материала, источником которого могут служить дикие сородичи домашних животных (5-9).
Существуют две основных стратегии сохранения генофонда: in situ (содержание видов в естественной среде обитания или пород домашних животных в условиях выведения) и ex situ (сохранение компонентов биологического разнообразия вне их естественных мест обитания, например в питомниках, зоопарках и т.д., или посредством криоконсервации генетического материала). Метод in situ предполагает разведение и содержание животных и птиц в специальных генофондных хозяйствах и экономически затратен. Метод ex situ имеет важное значение для видов, реинтродукция которых в ближайшем будущем не представляется возможной (10-14). Во многих странах сохранение ex situ — неотъемлемая часть стратегии охраны окружающей среды (15). В зависимости от цели и задачи биологическим материалом для криоконсервации могут быть эмбрионы, ткани животных, мужские (спермии), женские (яйцеклетки) половые клетки (16-22). Криобанк генетических ресурсов дикой фауны можно использовать для сохранения видов, а также для создания новых селекционных форм и пород.
Зубр ( Bison bonasus L.) — дикий лесной бык, относится к редким исчезающим видам. Это самое крупное копытное животное, единственный дикий вид подсемейства Bovinae , обитающий на Европейском континенте (23-25). В начале XX века вольноживущие популяции зубров были уничтожены. В результате длительной научной и селекционной работы численность зубров с 1927 по 2000 год увеличилась более чем в 70 раз и в настоящее время составляет свыше 3500 тыс. особей; в России обитает около 1500 вольноживущих зубров.
Криоконсервация и искусственная репродукция (in vitro) — методы, которые используются для сохранения и восстановления численности редких видов и рекомендованы к применению Конвенцией о биологическом разнообразии и другими международными документами (26-28). Во Всероссийском НИИ животноводства им. академика Л.К. Эрнста была разработана методика отбора и криоконсервации эпидидимального семени зубра, а также создан криобанк семени зубров популяции Приокско-Террасного и Окского государственных природных биосферных заповедников (29). C использованием криобанка эпидидимального семени зубра получены три поколения гибридных животных: от искусственного осеменения коров черно-пестрой породы семенем зубра родились четыре телочки, и в дальнейшем были изучены гибриды F1 и F2 от разных вариантов скрещивания с молочными (черно-пестрая, голштинская) и мясной (абердин-ангус-ская) породами (30, 31).
Эпидидимальное cемя значительно отличается от эякулированного по морфофункциональным характеристикам. Эпидидимальные сперматозоиды неподвижны, имеют невысокий метаболизм. Подвижность сперми-ев инициируется после эякуляции, в результате чего метаболические процессы активируются. Криорезистентность сперматозоидов с низким метаболизмом выше.
Для криоконсервации сперматозоидов, в том числе извлеченных из эпидидимиса, используют среды, которые усиливают метаболизм. Известно, что последний этап конденсации хроматина в ядре сперматозоидов происходит уже после эякуляции, следовательно, этот показатель в извлеченных из эпидидимиса клетках ниже, чем в эякулированных. То есть вероятность повреждения генетического материала при замораживании-оттаивании в ядрах сперматозоидов, полученных из эпидидимиса, выше, чем в эякулированных (32). Процесс криоконсервации отражается на морфометрических показателях: в результате замораживания-оттаивания уменьшаются размеры сперматозоидов, особенно площадь и периметр головки (3336). Криоконсервация также влияет на ультраструктуру сперматозоидов (37-40). В настоящее время используют две технологии криоконсервации спермы — в пайетах и гранулах.
Мы впервые исследовали влияние криоконсервации и срока хранения на морфометрические и морфофункциональные свойства семени зубров.
Целью представляемой работы было изучение биологической полноценности замороженно-оттаянного эпидидимального семени зубра при длительном (более 20 лет) хранении.
Методика . Начиная с 1998 года, эпидидимальное семя получили от четырех самцов зубра (Приокско-Террасный и Окский государственные природные биосферные заповедники). Отбор осуществляли постмортально из придатка семенника у животных, получивших несовместимые с жизнью травмы или выбракованных (предназначенных для охоты). Содержимое хвоста эпидидимиса извлекали в синтетической среде (гомогенизация) с последующей фильтрацией для освобождения от клеточных примесей. Содержание и подвижность свежеполученных эпидидимальных спермиев в образце определяли по методике оценки качества семени быков-производителей. Семя замораживали в гранулах в соответствии с технологией криоконсервации спермы быков-производителей (41).
Рутинную оценку замороженно-оттаянного семени проводили на основании технологии computer-assisted semen analysis (CASA). Степень фрагментации ДНК изучали в тесте с акридиновым оранжевым (АО-тест) с последующей флуоресцентной микроскопией. Состояние акросом оценивали с помощью Diff Quik окрашивания (42-44).
Подвижность замороженно-оттаянных сперматозоидов определяли с использованием программного обеспечения Зоосперм 1.0 («ВидеоТест», Россия), камеры Маклера (Израиль) и микроскопа Nikon Eclipse Ni («Nikon Corp.», Япония). Подвижность оценивали по средним данным для 3 образцов на основе видеосъемки (продолжительность 1 с) трех полей.
Обработка данных и классификация сперматозоидов проходила в автоматическом режиме на основании следующих показателей: VAP — средняя скорость движения головки по усредненной траектории движения, мкм/с; VSL — скорость прямолинейного движения головки (средняя скорость движения головки сперматозоида вдоль прямого отрезка между начальной и конечной точкой траектории), мкм/с; VCL — средняя скорость движения сперматозоидов по реальной траектории движения, мкм/с; ALH — среднее отклонение головки (амплитуда латерального смещения головки сперматозоида от траектории движения), мкм; BCF — частота колебательных усредненных движений (частота пересечений), Гц; средняя частота пересечения криволинейной траекторией движения сперматозоида его усредненной траектории за единицу времени.
Степень прямолинейности направленного движения сперматозоидов (прямолинейность средней траектории движения, %) рассчитывали по формуле STR = VSL/VAP ½ 100, степень волнистости треков (величина колебания истинной траектории движения по отношению к средней траектории, %) — как LIN = VSL/VCL ½ 100.
В зависимости от перечисленных показателей сперматозоиды разделяли на следующие классы: A — с быстрым прямолинейно-поступательным движением (скорость не менее 25 мкм/с; сперматозоиды этого класса в течение 1 с преодолевали расстояние, равное своей длине); B — с медленным прямолинейным движением (скорость менее 25 мкм/с); C — с манежным или колебательным движением; D — неподвижные.
При изучении морфометрических показателей сравнивали сперматозоиды, полученные от зубров ( n = 4) и быков-производителей голштинской породы ( n = 15) (поскольку получать эякулированное семя от зубров в среде их обитания невозможно, были взяты образцы у их домашних сородичей). Сперму быков-производителей криоконсервировали в пайетах. Срок хранения семени зубров составлял более 20 лет, быков — не более 2 лет.
Данные подвергались математической обработке стандартным методом вариационной статистики в пакете программ Microsoft Exсel. В таблицах приведены средние значения ( Х ) и стандартные ошибки ( х ).
1. Доля (%) сперматозоидов разных классов в Результаты. Количе- замороженно-оттаянном семени зубров (Bi- ство сперматозоидов с пря-son bonasus L.) (Х±х) молинейным поступательным
|
Кличка зубра |
Класс |
|||
|
А 1 |
В 1 |
С 1 |
D |
|
|
Мутфиль |
10,3±0,2 |
18,8±0,9 |
20,3±1,2 |
50,6±1,6 |
|
Авель |
8,4±0,1 |
12,3±0,7 |
12,1±0,9 |
67,2±1,8 |
|
Морус |
6,3±0,2 |
22,3±0,8 |
13,2±0,6 |
58,2±2,1 |
|
Мисир |
8,3±0,2 |
13,4±1,2 |
10,4±0,8 |
67,9±3,6 |
|
Примечан |
и е. Описание классов см. |
в разделе «Методика». |
||
движением в нативном и за-мороженно-оттаянном семени зависит от множества факторов, таких как индивидуальные особенности особи, вид, возраст, технология кри- оконсервации, используемые разбавители и криопротекторы, метод оттаи- вания (45-47).
2. Морфометрические показатели заморожен-но-оттаянных сперматозоидов зубров ( Bison bonasus L.) и быков-производителей голштинской породы ( Х ± х )
|
Показатель |
1 Зубры ( n = 4) 1 Быки ( n = 15) |
|
|
Длина сперматозоида, мкм |
65,90±1,57 |
68,3±0,98 |
|
Длина головки, мкм |
8,46±0,66 |
9,58±0,28 |
|
Ширина головки, мкм |
4,72±0,42 |
4,60±0,12 |
|
Периметр головки, мкм |
23,95±1,55 |
24,61±0,36 |
|
Площадь головки, мкм2 |
38,46±1,67 |
41,6±1,32* |
|
Длина жгутика, мкм * P ≤ 0,05. |
57,34±1,96 |
58,72±0,36 |
Исследуемые образцы семени значительно различались по содержанию сперматозоидов классов А и В (табл. 1). Основными факторами, которые влияли на активность сперматозоидов, были возраст, индивидуальные особенности зубров и продолжительность хранения семени, поскольку состав среды, тех- нология криоконсервации и оттаивания для всех образцов здесь были одинаковыми. У зубров Мутфиля и Моруса содержание сперматозоидов класса А + В в замороженно-оттаянном семени составляло более 28 %, у Авеля и Мисира неподвижных сперматозоидов было более 67 %, с манежным и колебательным движением — соответственно 12,1 и 10,4 %.
При получении и криоконсервации семени у быков и зубров применялись разные технологии. Эякулированные и извлеченные из эпидидимиса сперматозоиды существенно различались. По всем морфометрическим параметрам, кроме ширины головки, сперматозоиды зубров уступали сперматозоидам быков-производителей. Следует отметить, что различия между группами по изученным показателям не были статистически значимыми, за исключением площади головки сперматозоида: у быков она оказалась на 3,14 мкм2 больше, чем у зубров (табл. 2).
Нами также были изучены органеллы и морфологические структуры спермиев зубров. Аномальное строение сперматозоидов обусловлено генетической компонентой (48), сезонными и экологическими факторами, индивидуальной предрасположенностью
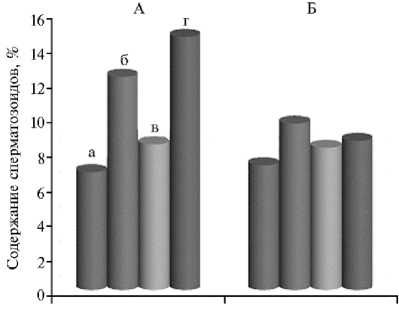
Рис. 1. Доля сперматозоидов с патологической морфологией (А) и поврежденной акросомой (Б) в замороженно-оттаянном семени четырех зубров ( Bison bonasus L.): а — Мутфиль, б — Авель, в — Морус, г — Мисир (сроки хранения семени — более 20 лет).
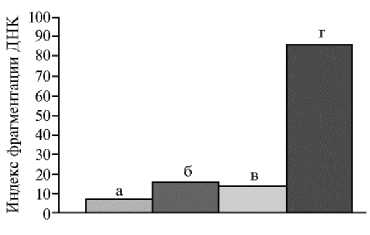
Рис. 2. Индекс фрагментации ДНК в хроматине сперматозоидов в заморожено-оттаянном семени четырех зубров ( Bison bonasus L.): а — Мутфиль, б — Авель, в — Морус, г — Мисир (сроки хранения семени — более 20 лет).
(49-52), а также возрастом (53-56).
Хроматин — один из важнейших структурных элементов сперматозоидов. Причиной идиопатического бесплодия может быть высокий индекс фрагментации ДНК в хроматине (57-61). Степень фрагментации ДНК в сперматозоидах также зависит от многочисленных биотических и абиотических факторов (62-69).
По содержанию сперматозоидов с нарушенной морфологией и поврежденной акросомой между зубрами обнаружили существенную разницу (рис. 1).
Частота встречаемости сперматозоидов с патологической морфологией была наибольшей у Мисира (14,6 %), наименьшей — у Мутфиля (6,8 %). У последнего частота поврежденных акросом по сравнению с другими зубрами оказалась незначительной и составила 7,2 %.
Индекс фрагментации ДНК в хроматине сперматозоидов существенно различался в изучаемых образцах (рис. 2). Высокая степень фрагментации наблюдалась в сперматозоидах Мисира (более 86 %), меньше всего сперматозоидов с фрагментированной ДНК было обнаружено в образцах, по- лученных от Мутфиля (7 %).
Таким образом, показатели, характеризующие биологическую полноценность сперматозоидов в замороженно-оттаянном семени зубров, хранившемся более 20 лет, зависели от индивидуальных особенностей особей. Содержание сперматозоидов с патологической морфологией варьировало от 6,8 до 14,6 %, степень фрагментация ДНК — от 7 до 86 % Результаты наших исследований продемонстрировали, что методы получения и технология криоконсервации влияют на морфометрические показатели сперма- тозоидов, которые в замороженно-оттаянном эпидидимальном семени ока- зались меньше, чем в эякулированном.
Список литературы Биологическая полноценность эпидидимального семени зубра (Bison bonasus L.) при криоконсервации и длительном хранении
- Багиров В.А., Эрнст Л.К., Кленовицкий П.М., Зиновьева Н.А. Сохранение генетических ресурсов редких, исчезающих и уникальных видов животных. Цитология, 2004, 46(9): 767-768. Режим доступа: http://elibrary.ru/item.asp?id=21635266. Без даты.
- Гусев М.В., Мелехова О.П., Романова Э.П. Cохранение и восстановление биоразнообразия. М., 2002.
- Рюмина Е.В., Карачевцев И.Л. Cпецифика проблем сохранения биоразнооборазия в территориальном и временном аспектах. Экономика природопользования, 2005, 1: 112-118.
- Тишков А.А. Биосферные функции природных экосистем России. М., 2005.
- Шайдуллин И.Н. Биологические особенности акклиматизации овец и гибридизации их со снежным бараном Ovis nivicola nivicola в условиях Камчатки. Докт. дис. Дубровицы, 1994.
- Багиров В.А., Эрнст Л.К., Насибов Ш.Н., Кленовицкий П.М., Иолчиев Б.С., Зиновьева Н.А. Сохранение биоразнообразия животного мира и использование отдаленной гибридизации в животноводстве. Достижения науки и техники АПК, 2009, 7: 54-56. Режим доступа: http://elibrary.ru/item.asp?id=13002971. Без даты.
- Иолчиев Б.С., Кленовицкий П.М., Багиров В.А., Воеводин В.А., Кононов В.П., Насибов Ш.Н. Создание гибридов домашней козы и сибирского козерога с использованием криоконсервированного эпидидимального семени. Проблемы биологии продуктивных животных, 2011, 1: 29-31. Режим доступа: http://elibrary.ru/item.asp?id=16092095. Без даты.
- Насибов Ш.Н., Иолчиев Б.С., Кленовицкий П.М., Багиров В.А., Воеводин В.А., Зиновьева Н.А. Криосохранение и рациональное использование генетических ресурсов овец и коз. Достижения науки и техники АПК, 2010, 9: 50-51. Режим доступа: http://elibrary.ru/item.asp?id=15253713. Без даты.
- Багиров В.А., Гладырь Е.А., Эрнст Л.К., Кленовицкий П.М., Зиновьева Н.А., Насибов Ш.Н. Сохранение и рациональное использование генетических ресурсов яка (Bos mutus). Сельскохозяйственная биология, 2009, 2: 37-42.
- Рябова Е.В. Биоразнообразие и способы его сохранения. Киров, 2012.
- Pereira R.M., Marques C.C. Animal oocyte and embryo cryopreservation. Cell and Tissue Banking, 2008, 9(4): 267-277 ( ) DOI: 10.1007/s10561-008-9075-2
- Roldan E.R., Gomendio M., Garde J.J., Espeso G., Ledda S., Berlinguer F., DelOlmo A., Soler A.J., Arregui L., Crespo C., Gonzales R. Inbreeding and reproduction in endangered ungulates: preservation of genetic variation through the organization of genetic resource banks. Reprod. Domest. Anim., 2006, 41: 82-89 ( ) DOI: 10.1111/j.1439-0531.2006.00772.x
- Hanks J. Conservation strategies for Africa’s large mammals. Reprod. Fert. Develop., 2001, 13(7-8): 459-468.
- Сингина Г.Н., Волкова Н.А., Багиров В.А., Зиновьева Н.А. Криобанки соматических клеток как перспективный способ сохранения генетических ресурсов животных. Сельскохозяйственная биология, 2014, 6: 3-14 ( ) DOI: 10.15389/agrobiology.2014.6.3rus
- Blackburn H.D. Development of national animal genetic resource programs. Reprod. Fert. Develop., 2004, 16: 27-32 ( ) DOI: 10.10371/RD03075
- Hiemstra S.J., van der Lende T., Woelders H. The potential of cryopreservation and reproductive technologies for animal genetic resources conservation strategies. Proc. Int. Workshop «The role of biotechnology for the characterisation and conservation of crop, forestry, animal and fishery genetic resources» (Italy, 5-7 March 2005). Turin, 2005: 25-36.
- Boettcher P.J., Stella A., Pizzi F., Gandini G. The combined use of embryos and semen for cryogenic conservation of mammalian livestock genetic resources. Genet. Sel. Evol., 2005, 37(6): 657-675 ( ) DOI: 10.1186/1297-9686-37-7-657
- Niemann H., Lucas-Hahn A. Somatic cell nuclear transfer cloning: practical applications and current legislation. Reprod. Domest. Anim., 2012, 47(5): 2-10 ( ) DOI: 10.1111/j.1439-0531.2012.02121.x
- Blackburn H.D. Genebank development for the conservation of livestock genetic resources in the United States of America. Livestock Sci., 2009, 120: 196-203 ( ) DOI: 10.1016/j.livsci.2008.07.004
- Mariante A., Albuquerque M., Egito A., McManus C., Lopes M., Paiva S. Present status of the conservation of livestock genetic resources in Brazil. Livestock Sci., 2009, 120: 204-212 ( ) DOI: 10.1016/j.livsci.2008.07.007
- Martynik E. Animal genetic resources in Poland: successes and obstacles. Proc. Workshop «International strategic programs for the conservation of animal genetic resources for food and agriculture»/C. Lessard (ed.). Vancouver, B.C., 2010: 29-35 (ISBN: 978-0-88880-566-9).
- Richards K., Lessard C., Plante Y., Anzar M. Canadian animal genetic resources program. Proc. Workshop «International strategic programs for the conservation of animal genetic resources for food and agriculture»/C. Lessard (ed.). Vancouver, B.C., 2010: 12-18 (ISBN: 978-0-88880-566-9).
- Немцев А.С., Раутиан Г.С., Пузаченко А.Ю., Сипко Т.П., Калабушкин Б.А., Мироненко И.В. Зубр на Кавказе. М., 2003.
- Флинт В.Е., Белоусова И.П., Перерва В.И., Казьмин В.Д., Киселева Е.Г., Кудрявцев И.В., Пирожков Н.В., Сипко Т.Г. Стратегия сохранения зубров в России. М., 2002.
- Иолчиев Б.С., Стрекозов Н.И., Абилов А.И., Кленовицкий П.М., Сипко Т.П. Сохранение генофонда зубров и их использование в межвидовой гибридизации. Дубровицы, 2005.
- Nishi J.S. A Review of best practices and principles for bison disease issues: greater Yellowstone and Wood Buffalo areas. Wildlife Conservation Society and American Bison Society (ABS), ABS Working Paper No. 3. Bronx, NY, USA, 2010.
- McFarlane K., Wilson G.A., Nishi J.S. Management strategies for conservation of genetic diversity in wood bison (Bison bison athabascae). File Report No. 135. Department of Environment and Natural Resources, Government of the Northwest Territories, Yellowknife, Northwest Territories, Canada, 2006.
- Shury T.K., Woodley S.J., Reynolds H.W. Proceedings of the Bison Diseases Technical Workshop. Parks Canada, Gatineau, Quebec, 2005.
- Абилов А.И., Эрнст Л.К., Стрекозов Н.И., Кононов В.П., Сипко Т.П. Методические рекомендации по получению гибридов путем осеменения домашних коров (Вos taurus) «эпидидимальным семенем» диких зубров (Bison bonasus). Дубровицы, 1994.
- Стрекозов Н.И., Иолчиев Б.С., Абилов А.И., Виноградов В.Н., Киселева Е.Г., Сипко Т.П. Сравнительные исследования воспроизводственных качеств зубров и крупного рогатого скота. Доклады РАСХН, 1997, 6: 28-29.
- Иолчиев Б.С., Абилов А.И., Стрекозов Н.И. Создание зубровидного скота методом гибридизации крупного рогатого скота и зубра. Доклады РАСХН, 2004, 5: 35-36. Режим доступа: http://elibrary.ru/item.asp?id=18179672. Без даты.
- Шишова Н.В., Абилов А.И., Гахова Э.Н., Максудов Г.Ю. Проблемы и перспективы использования эпидидимального семени млекопитающих post mortem для генетических криобанков. Ветеринарная патология, 2007, 20(1): 34-36. Режим доступа: http://elibrary.ru/item.asp?id=17012920. Без даты.
- Petrunkina A.M., Topfer Petersen E. Heterogeneous osmotic behaviour in boar sperm populations and its relevance for detection of changes in plasma membrane. Reprod. Fertil. Dev., 2000, 12: 297-305 ( ) DOI: 10.1071/RD00087
- Thompson L.A., Brook P.F., Warren M., Barrat C., Cooke I. A morphometric comparison of the nuclear morphology of fresh and frozen-thawed human zona-bound and unbound sperm. J. Androl., 1994, 15: 337-342 ( ) DOI: 10.1002/j.1939-4640.1994.tb00461.x
- Gravance C.G., Casey M.E., Case P.J. Pre-freeze bull sperm head morphometry related with post-thaw fertility. Anim. Reprod. Sci., 2009, 114: 81-88 ( ) DOI: 10.1016/j.anireprosci.2008.09.014
- Peña F.J., Saravia F, García Herreros M., Núñezmartínez I., Tapia J.A., Johannisson A., Wallgren M., Rodríguez-Martínez H. Identification of sperm morphometric subpopulations in two different portions of the boar ejaculate and its relation to post thaw quality. J. Androl., 2005, 26: 716-723 ( ) DOI: 10.2164/jandrol.05030
- García Herreros M., Barón F.J., Aparicio I.M., Santos A.J., García Marín L.J. Morphometric changes in boar spermatozoa induced by cryopreservation. Int. J. Androl., 2008, 31: 490-498 ( ) DOI: 10.1111/j.1365-2605.2007.00794.x
- Arruda R.P., Ball B.A., Gravance C.G., Garcia R.P., Liu I.K. Effects of extenders and cryoprotectants on stallion sperm head morphometry. Theriogenology, 2002, 58: 252-256 ( ) DOI: 10.1016/S0093-691X(02)00858-0
- Peña A.I., Lugilde L.L., Barrio M., Herradon P.G., Quintela L.A. Effects of Equex from different sources on post thaw survival, long evity and intracelular Ca2+ concentration of dog spermatozoa. Theriogenology, 2003, 59: 1725-1739 ( ) DOI: 10.1016/S0093-691X(02)01233-5
- Thomas C., Garner D., De Jarnette J., Marshall C. Fluorometric assessments of acrosomal integrity and viability in cryopreserved bovine spermatozoa. Biol. Reprod., 1997, 56: 991-998.
- Виноградов В.Н., Стрекозов Н.И., Абилов А.И. и др. Национальная технология замораживания и использования спермы племенных быков-производителей. М., 2009.
- Иолчиев Б.С., Багиров В.А., Кленовицкий П.М., Кононов В.П., Насибов Ш.Н., Воеводин В.А. Компьютерная технология для оценки семени животных. Достижения науки и техники АПК, 2011, 9: 54-56. Режим доступа: http://elibrary.ru/item.asp?id=16911151. Без даты.
- Иолчиев Б.С., Багиров В.А., Кленовицкий П.М., Кононов В.П., Таджиева А.В. Индекс фрагментации ДНК хроматина в сперматозоидах при оценке качества семени у быков-производителей. Сельскохозяйственная биология, 2012, 4: 31-35 ( ) DOI: 10.15389/agrobiology.2012.4.31rus
- Таджиева А.В., Сулима Н.Н. Использование метода CASA при оценке качества семени у быков-производителей. Вестник РУДН, серия Агрономия и животноводство, 2015, 4: 89-92. Режим доступа: http://elibrary.ru/item.asp?id=24834978. Без даты.
- Бойко Е.В., Коропец Л.А. Спермопродуктивность быков-производителей голштинской породы. Вестник Брянской государственной сельскохозяйственной академии, 2015, 3-1: 4-8. Режим доступа: http://elibrary.ru/item.asp?id=23478336. Без даты.
- Айбазов М.М., Аксенова П.В., Сердюков И.Г. Влияние технологии замораживания на биологическую полноценность спермы баранов. Российский ветеринарный журнал. Сельскохозяйственные животные, 2013, 4: 9-10. Режим доступа: http://elibrary.ru/item.asp?id=20804276. Без даты.
- Ozkavukcu S., Erdemli E., Isik A., Oztuna D., Karahuseyinoglu S. Effects of cryopreservation on sperm parameters and ultrastructural morphology of human spermatozoa. J. Assist. Reprod. Genet., 2008, 25(8): 403-411 ( ) DOI: 10.1007/s10815-008-9232-3
- Hammadeh M.E., Askari A.S., Georg T., Rosenbaum P., Schmidt W. Effect of freeze-thawing procedure on chromatin stability, morphological and membrane integrity of human spermatozoa in fertile and subfirtile men. Int. J. Androl., 1999, 22: 155-162 ( ) DOI: 10.1046/j.1365-2605.1999.00162.x
- Buhr M.M., Fiser P., Bailey J.L., Curtis E.F. Cryopreservation in different concentrations of glycerol alters boar sperm and their membranes. J. Androl., 2001, 22: 961-969 ( ) DOI: 10.1002/j.1939-4640.2001.tb03436.x
- Gilmore J.A., Liu J., Gao D.Y., Critser J.K. Determination of optimal cryoprotectants and procedures for their addition and removal from human spermatozoa. Hum. Reprod., 1997, 12: 112-118 ( ) DOI: 10.1093/humrep/12.1.112
- Chenoweth P.J. Genetic sperm defects. Theriogenology, 2005, 64: 457-468 ( ) DOI: 10.1016/j.theriogenology.2005.05.005
- Dahlbom M., Andersson M., Viertula M., Alanko M. Morphometry of normal and teratozoospermic canine sperm heads using an image analyser: work in progress. Theriogenology, 1997, 48: 687-698 ( ) DOI: 10.1016/S0093-691X(97)00284-7
- Boersma A.A., Braun J., Stolla R. Influence of random factors and two different staining procedures on1 computer-assisted sperm head morphometry in bulls. Reprod. Domest. Anim., 1999, 34: 77-82 ( ) DOI: 10.1111/j.1439-0531.1999.tb01387.x
- Purwantara B., Arifiantini R.I., Riyadhi M. Sperm morphological assessments of Friesian Holstein bull semen collected from three artificial insemination centers in Indonesia. Journal of the Indonesian Tropical Animal Agriculture, 2010, 2: 89-94 ( ) DOI: 10.14710/jitaa.35.2.90-94
- Söderquist L., Janson L., Håård M., Einarsson S. Influence of season, age, breed and some other factors on the variation in sperm morphological abnormalities in Swedish dairy AI bulls. Anim. Reprod. Sci., 1996, 44: 91-98.
- Padrik P., Jaakma U. Sperm morphology in Estonian Holstein dairy bulls, factors affecting it and relation to fertility. Agraarteadus, 2002, 13: 243-256. Режим доступа: http://agrt.emu.ee/pdf/2002_4_padrik.pdf. Без даты.
- Hallap T., Nagy S., Hllrd M., Jaakma U., Johannisson A., Rodríquez-Martínez H. Sperm chromatin stability in frozen-thawed semen is maintained over age in AI bulls. Theriogenology, 2005, 63: 1752-1763 ( ) DOI: 10.1016/j.theriogenology.2004.08.001
- Makhzoomi A., Lundeheim N., Haard M., Rodríquez-Martínez H. Sperm morphology and fertility of progeny-tested AI dairy bulls in Sweden. Theriogenology, 2008, 70: 682-691 ( ) DOI: 10.1016/j.theriogenology.2008.04.049
- Sarder M.J.U. Effects of age, body weight, body condition and scrotal circumference on sperm abnormalities of bulls used for artificial insemination (AI) programme in Bangladesh. University Journal of Zoology, Rajshahi University, 2008, 27: 73-78 ( ) DOI: 10.3329/ujzru.v27i0.1959
- Benchaib M., Braun V., Lornage J. Hadj S., Salle B., Herve L., François Guérin J. Sperm DNA fragmentation decreases the pregnancy rate in an assisted reproductive technique. Hum. Reprod., 2003, 18(5): 1023-1028 ( ) DOI: 10.1093/humrep/deg228
- Morris I.D., Ilott S., Dixon L., Brison D.R. The spectrum of DNA damage in human sperm assessed by single cell gel electrophoresis (Comet assay) and its relationship to fertilization and embryo development. Hum. Reprod., 2002; 17: 990-998 ( ) DOI: 10.1093/humrep/17.4.990
- Tomsu M., Sharma V., Miller D. Embryo quality and IVF treatment outcomes may correlate with different sperm comet assay parameters. Hum. Reprod., 2002, 17(7): 1856-1862 ( ) DOI: 10.1093/humrep/17.7.1856
- Filatov M.V., Semenova E.V., Vorob'eva O.A., Leont'eva O.A., Drobchenko E.A. Relationship between abnormal sperm chromatin packing and IVF results. Mol. Hum. Reprod., 1999, 5: 825-830 ( ) DOI: 10.1093/molehr/5.9.825
- Host E., Lindenberg S., Smidt-Jensen S. The role of DNA strand breaks in human spermatozoa used for IVF and ICSI. Acta Obstetricia et Gynecologica Scandinavica, 2000, 79: 559-563 ( ) DOI: 10.1034/j.1600-0412.2000.079007559.x
- Larson K.L., DeJonge C.J., Barnes A.M., Jost L.K., Evenson D.P. Sperm chromatin structure assay parameters as predictors of failed pregnancy following assisted reproductive techniques. Hum. Reprod., 2000, 15(8): 1717-1722 ( ) DOI: 10.1093/humrep/15.8.1717
- Галимов Ш.Н., Амирова З.К., Галимова Э.Ф. «Кризис сперматозоида» и техногенное загрязнение окружающей среды. Проблемы репродукции, 2005, 2: 19-22. Режим доступа: http://elibrary.ru/item.asp?id=9157231. Без даты.
- Evenson D.P., Jost L.K., Corzett M., Balhorn R. Characteristics of human sperm chromatin structure following an episode of influenza and high fever: a case study. J. Androl., 2000, 21: 739-746 ( ) DOI: 10.1002/j.1939-4640.2000.tb02142.x
- Boe-Hansen G.B., Ersboll A.K., Greve T., Christensen P. Increasing storage time of extended boar semen reduces sperm DNA integrity. Theriogenology, 2005, 63: 2006-2019 ( ) DOI: 10.1016/j.theriogenology.2004.09.006
- Bochenek M., Herjan T., Okólski A., Smorąg Z. Sperm chromatin abnormalities after semen sexing procedure -preliminary results. Havemeyer Foundation Monograph Series, 2006, 18: 13-14.


