Биологически активные вещества высших водных растений potamogeton perfoliatus l. и zosteranoltii: состав, свойства, применение
Автор: Новиченко О.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (67), 2016 года.
Бесплатный доступ
Преимущественно основное внимание ученых и технологов уделялось изучению традиционных технологий переработки наземных растений. Современные тенденции развития биотехнологий требуют расширения сырьевой базы. Увеличение потребностей медицины, пищевой и кормовой промышленностей в биологически активных веществах заставляет уделять внимание новым нетрадиционным источникам возобновляемого сырья. С этой точки зрения высшие водные растения Zostera noltii и Potamogeton perfoliatus L. можно рассматривать как перспективный объект благодаря высокому содержанию в них уникальных биологически активных веществ различного спектра действия. Обоснован выбор растительного сырья, установлены оптимальные параметры и режимы основных технологических операций для получения биологически активных веществ: экстракция водным спиртом на перемешивающем устройстве при комнатной температуре продолжительностью 7-10 дней. Изучены органолептические и физико-химические показатели готовой продукции, а также показатели безопасности водно-спиртовых экстрактов морских и пресноводных трав. Проведенные исследования (УФ-спектрофотометрический анализ, тонкослойная хроматография, хромато-масс-спектрометрия) показывают, что в составе растений и их экстрактов присутствуют различные биологически активные вещества. Высокое содержание кверцетина и пигментных веществ в экстрактах Z. noltii и Potamogeton perfoliatus L. свидетельствует о перспективном использовании высших водных растений р. Волги и Северного Каспия в качестве дополнительного природного источника флавоноидов и антиоксидантов. Следовательно, препараты растительного происхождения (водно-спиртовые экстракты зостеры малой и рдеста пронзеннолистного), представляющие комбинацию различных соединений, обладают высокой биологической активностью широкого спектра действия: адсорбционной способностью, антиоксидантной и противомикробной активностью. Продукты переработки изученных растений после водно-спиртового экстрагирования могут быть использованы в пищевой промышленности в качестве источников природных минеральных веществ, углеводов, белков, витаминов, флавоноидов, терпеноидов, спиртов, жирных кислот и других веществ. Изысканы направления применения выделенных биологически активных веществ из зостеры и рдеста и травяных остатков после экстракции.
Биологически активные вещества, высшие водные растения, экстракт, биологическая активность
Короткий адрес: https://sciup.org/14040542
IDR: 14040542 | УДК: 633.82 | DOI: 10.20914/2310-1202-2016-1-137-142
Текст научной статьи Биологически активные вещества высших водных растений potamogeton perfoliatus l. и zosteranoltii: состав, свойства, применение
DOI:
На сегодняшний день воздействие человека на Каспий приобрело многообразный характер, включая загрязнение, инвазию, гидротехническое строительство и другие факторы, влияющие на биотические формы жизни.
В то же время наблюдается тенденция к зарастаемости Волго-Каспийского бассейна прибрежной и водной растительностью, что приводит к заболачиваемости акватории дельты Волги, снижению кормовой базы в местах нагула осетровых и частиковых видов рыб, затруднению прохода рыбы на нерестилища, ухудшению гидрологического режима [1].
Экспериментальные данные многих отечественных и зарубежных исследователей характеризуют водные растения как уникальный промышленный возобновляемый источник получения ряда значимых соединений – биологически активных веществ (БАВ) [2]. Химический состав морских и пресноводных трав зависит от вида, стадии развития и условий произрастания.
В растительном сырье содержатся разнообразные по химическому составу вещества как общие для всех высших растений (например, полисахариды, белки, соли), так и специфические для определенных растений.
Некоторые прибрежные и водные растения имеют сбалансированный макро- и микроэле-ментный состав и являются очень ценным сырьем для получения биологически активных веществ: альгиновой кислоты, маннита, витаминов, фенольных и терпеновых соединений, полисахаридов, главным образом пектиновых веществ (зо-стерин, рдестин, ламинарин, агар и т.д.) [3].
Известно, что такие БАВ как пектиновые вещества (ПВ) обладают высокими протекторными свойствами по отношению к радионуклидам и тяжелым металлам и могут быть востребованы для организации лечебного и лечебно-профилактического питания населения, проживающего в зонах экологического неблагополучия, а также лиц, подвергшихся внешнему и внутреннему облучению от инкорпорированных радионуклидов, производство пектина для Астраханской области является весьма актуальной проблемой [4].
Поэтому при наличии данных проблем возникает необходимость изъятия части водных растений без нарушения экологического равновесия реки Волги и Северного Каспия, которые могут быть рационально переработаны с целью получения оригинальных биотехнологических продуктов различного назначения.
С другой стороны, уникальный состав и комплекс биологически активных веществ (БАВ) прибрежных и водных растений Волго-Каспийского бассейна определяет широкий спектр их применения и вызывает особый интерес ученых.
До настоящего времени проблеме исследования высших водных растений (ВВР) реки Волги и Северного Каспия с целью определения возможности их переработки и получения из них биотехнологической продукции придавалось недостаточное значение, а получение продукции различного назначения в основном не проводилось. Весьма актуальным и перспективным направлением является получение водно-спиртовых экстрактов растений, обогащенных биологически активными веществами (БАВ) с антиоксидантными и антибактериальными свойствами, высокой адсорбирующей способностью [5, 6].
На основании вышеизложенного целью настоящей работы является изучение состава, свойств и выделение биологически активных веществ высших водных растений Zostera noltii и Potamogeton perfoliatus L. для получения новых биотехнологических продуктов различного назначения (водно-спиртовых экстрактов с противомикробными и антиоксидантными свойствами).
Материалы и методы исследований
Объектами исследования явились пресноводная трава рдест пронзеннолистный ( Po-tamogeton perfoliatus L.) и штормовые выбросы морской травы зостеры малой ( Zostera noltii ), экстракты (гексановые, водно-спиртовые) с высоким содержанием БАВ.
Сбор и заготовку морской травы зостеры осуществляли в центральной части Северного Каспия на прибрежных зонах острова Кулалы, в территориальных водах Республики Казахстан, при проведении совместной экспедиции работников научно-исследовательской лаборатории АГТУ и специалистов рыбоохранной инспекции Республики Казахстан. Сбор растительного сырья осуществляли в период вегетации, в сентябре 2011 года.
В августе 2012 года были осуществлены выезды на территории банков Володарского района, где были проведены мелиоративные работы по сбору и заготовке пресноводных трав рдеста пронзеннолистного с целью проведения исследований.
Водные растения (стебли и листья) были изъяты из воды, промыты, высушены в естественных условиях и доставлены в лабораторию. Воздушно-сухие растения хранились при относительной влажности 75 % и имели остаточное содержание воды 10-12 %. Исследованию подвергались воздушно-сухие растения зостера малая ( Zostera noltii ) и рдест пронзен-нолистный ( Potamogeton perfoliatus L.).
Состав летучих низкомолекулярных органических соединений (ЛНОС) гексановых растворов ВВР определяли на хромато-масс-спектрометрическом комплексе TRACE DSQ II (Thermo Electron Corporation) с квадрупольным масс-анализатором. Использовали колонку Thermo TR-5ms SQC 15 м х 0.25 мм с фазой ID 0.25 мкм. Газ-носитель - гелий.
Эфирное масло, содержащее летучие низкомолекулярные соединения (ЛНОС), из измельченного воздушно-сухого растительного сырья получали методом гидродистилляции с использованием аппарата Клевенджера (ГОСТ 24027.2-80).
На сегодняшний день научно обоснованным и наиболее распространённым способом получения экстрактов высших водных растений, обогащенных биологически активными веществами, является водно-спиртовая экстракция. Указанная технология были апробированы в лабораторных условиях.
Растительное сырье экстрагировали водным спиртом при подобранном соотношении сырье-экстрагент 1:20 для устойчивости системы.
Затем растворы настаивали в течение 5 минут при комнатной температуре. После настаивания сырая трава имела мягкую неломкую структуру и легко растиралась. Экстракцию проводили на перемешивающем устройстве при комнатной температуре продолжительностью 7-10 дней. Затем полученный экстракт отделяли от травяного остатка фильтрованием через бумажный фильтр. Водно-спиртовые экстракты разливали в бутылки из затемненного стекла объемом 100 мл и стерилизовали при 85 0 С в течение 15-20 мин. Хранили образцы экстрактов при комнатной температуре.
Отбор проб и определение органолептических показателей качества сырья и готовой продукции проводили в соответствии с ГОСТ 31413-2010 «Водоросли, травы морские и продукция из них. Правила приемки и методы отбора проб», ГОСТ 13496.0-80 «Комбикорма, сырье. Методы отбора проб» и ГОСТ 314122010 «Водоросли, травы морские и продукция из них. Методы определения органолептических и физических показателей».
В предварительном анализе биологически активных веществ исследуемых экстрактов высших водных растений использовали УФ-спектрометрический метод и тонкослойную хроматографию (хроматография в тонких слоях сорбента, ТСХ).
Спектрофотометрическое определение по максимумам собственного поглощения является одним из распространенных методов анализа исследуемых соединений с антиоксидантными свойствами.
Спектрофотометрический анализ (Пешкова В.М. и др., 1965) проводили на спектрофотометре UV/Vis Beckman DU 800, оборудованном термостабильной кюветой (Hellma, QS1000) с оптическим путем 1 см. Рабочая температура обеспечивалась термостатом Haake D1, длина волны 517 нм.
Исследования методом ТСХ были проведены в научно-производственной лаборатории биотехнологий АГУ согласно ГОСТ 28366-89 «Реактивы. Метод тонкослойной хроматографии», а также в ЦКП при ГосНИИ Генетика, г. Москва.
В лаборатории хроматографию проводили с использованием высокоэффективных пластин Sorbfil покрытых силикагелем СТХ-1ВЭ 8-12 мкм, толщина слоя 90-110 мкм, УФ возбуждения 254 нм.
В ГосНИИ Генетика исследования по определению содержания высокомолекулярных соединений в экстрактах ВВР проводили на приборе CAMAG TLC Scanner 3 методом тонкослойной хроматографии со свидетелем, заключающимся в сравнении пройденного пути между исследуемыми экстрактами и чистыми веществами-свидетелями, с известной концентрацией. Далее, при длине волны λ = 410 нм, сравнивалось поглощение исходящего и полученного при прохождении через вещество пучка света. Далее прибор автоматически вычисляет концентрацию вещества в смеси, идентичному веществу-свидетелю.
Нанесение веществ-свидетелей и порций экстрактов проводился на семплере CAMAG Automatic TLC Sampler 4 с инъекцией экстрактов для анализа в 4 мкл.
Статистическую обработку результатов проводили общепринятыми методами математической статистики.
Результаты исследований
Высшие растения были освобождены вручную от крупных механических примесей. Ил и песок были удалены промывкой ее в воде.
У промытой и высушенной водной растительности поверхность листьев чистая, без белого налета и следов плесени. Трава ломкая, неэластичная, листья неустойчивые на излом и растирание. Цвет от серо-зеленого до светло-коричневого у зостеры и от зеленого до темно-зеленого у рдеста.
Изучены показатели безопасности высушенных ВВР и водно-спиртовых экстрактов макрофитов, результаты которых свидетельствовали об соответствии требованиям Сан-ПиН 2.3.2.1078-01 и ГОСТ 33331-2015, что подтверждает возможность использования их для получения биотехнологических продуктов с различными свойствами.
Компонентный состав (ЛНОС в эфирном масле) морских и пресноводных трав проводили методом хромато-масс-спектрометрией. В результате проведенного анализа в компонентном составе эфирных масел Zostera noltii и Potamogeton perfoliatus L. выявлено большое количество летучих компонентов, принадлежащих к различным классам органических соединений. В составе эфирного масла рдеста обнаружено 169 соединений, из которых идентифицировано 156, в составе взморника – 147 компонентов, из которых идентифицировано 137.
Обнаруженные в растениях БАВ относятся к различным группам химических соединений: углеводороды, спирты, альдегиды и кетоны, простые и сложные эфиры, жирные кислоты, фенолы, терпены и другие вещества.
Сопоставив результаты исследований компонентного состава эфирных масел рдеста пронзеннолистного P. perfoliatus L. и зостеры малой Z. noltii оказалось, что вне зависимости от места произрастания макрофитов в компонентном составе морских и пресноводных трав обнаружены идентичные соединения, однако их количественное содержание различно.
Для предварительного обнаружения биологически активных веществ в водноспиртовых экстрактах высших водных растений P. perfoliatus L. и Z. noltii был проведен спектрометрический анализ. Результаты спектрометрического анализа растительных экстрактов ВВР представлены на рисунках 1 и 2.
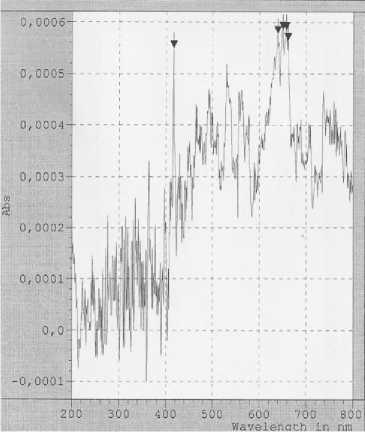
Рисунок 1. Спектрофотометрический анализ экстракта рдеста пронзеннолистного ( Potamogeton perfoliatus L.)
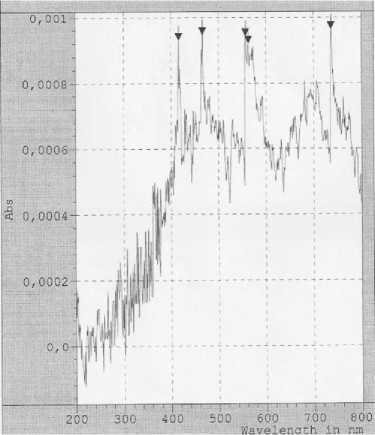
Рисунок 2. Спектрофотометрический анализ экстракта морской травы зостеры малой ( Zostera noltii )
На рисунке 1 - спектрометрический анализ экстракта рдеста пронзеннолистного Po-tamogeton perfoliatus L., который показал наличие 5 пиков значения абсорбции (Абс) при длинах волн 416, 661, 639, 657 и 650 нм .
В результате спектрометрического анализа экстракта взморника малого (рисунок 2) также обнаружено 5 пиков Абс при длинах волн 416, 466, 557, 563 и 736 нм. Совпадение пиков значения абсорбции при 416 нм свидетельствует о наличии одного соединения, но в разных количествах (Абс для экстракта рдеста 0,0005; для зостеры – 0,0009).
Проведенные исследования свидетельствуют о том, что в составе экстрактов водной растительности присутствуют биологически активные вещества. Главным образом, флавоноиды, фенольные кислоты и терпены. Благодаря наличию бензольного кольца в структуре молекул этих веществ, они обладают оптической активностью. Их растворы в спирте (а также других органических растворителях) имеют спектры поглощения в ультрафиолетовой (200-400 нм) и видимой областях (400-760).
Для точного определения количественного и качественного состава исследуемых экстрактов были использованы хроматографические методы анализа исследуемых экстрактов (ТСХ, хромато-масс-спектрометрия).
Для идентификации БАВ, относящихся к определенной группе, необходим подбор элюента при помощи тонкослойной хроматографии. Пластины использовали Sorbfit типа ПТСХ-АФ-В-УФ высокоэффективные, на силикагеле СТХ-1ВЭ с индикатором УФ-возбуждения 254 нм.
Была подобрана система растворителей в зависимости от обнаружения различных групп биологически активных веществ:
-
1 . Этилацетат – гексан (3:7)
-
2 . Бутанол – уксусная кислота – вода (БУВ) (4:1:5)
-
3 . Бутанол – гексан (1:1)
-
4 . Хлороформ – этанол (9:1)
-
5 . Петролейный эфир – ацетон – уксусная кислота – этанол (80:2:1)
-
6 . Бензол-метанол (9:1)
-
7 . Бензол-метанол-уксусная кислота (45:8:4)
-
8 . Хлороформ – ацетон (1:1)
-
9 . Гексан-хлороформ (1:1)
-
10 .Хлороформ – этанол (1:1)
-
11 .Вода – этанол (9:1)
-
12 .Вода – этанол (1:1)
-
13 .Этанол – вода – аммиак (9:1:0,1)
-
14 .Вода – этанол (7:3)
-
15 .Этилацетат – метанол – вода (16:1:1)
Данные соотношения растворителей используются для идентификации флавоноидов, пуриновых алкалоидов, ароматических углеводородов, терпеноидов, пигментных веществ (хлорофиллы).
На несколько пластин длиной 10 см и шириной 2,5 см были нанесены экстракты высших водных растений на расстоянии 5 мм от начала пластины. После элюирования пластину высушивали при температуре 40 0 С в течение 10-15 мин. Полученные хроматограммы (рисунки 3 и 4) смотрели при дневном освещении, в УФ свете, окрашивали кристаллическим йодом и 2 % спиртовым раствором хлорида железа, отмечая изменение окраски зон флуоресценции и рассчитывали значения Rf.
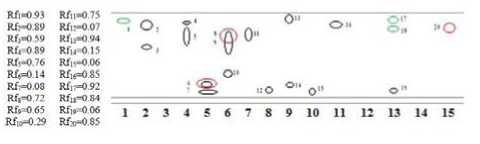
Рисунок 3. Хроматограмма разделения веществ в экстракте Z. noltii
1-15 – системы растворителей; область зеленого цвета – идентификация в УФ-свете, черного цвета – окрашивание I 2 , красного цвета – окрашивание FeCl 3
М:~0 91 Мт-0 5» М> 049 М<ООВ М-0 72 М.-О45
М-0 75 М<-097 М.0О5 MiH)82 М: 1-0 06 М,.-О75

1 1 3 4 5 6 7 S 9 10 11 12 13 14 15
Рисунок 4. Хроматограмма разделения веществ в экстракте Potamogeton perfoliatus L.
1-15 – системы растворителей; область зеленого цвета – идентификация в УФ-свете, черного цвета – окрашивание I 2 , красного цвета – окрашивание FeCl 3
Проведенные качественные реакции дают возможность утверждать, что в составе экстрактов водных растений присутствуют флавоноиды и пигменты.
В результате проведения хроматографии в тонком слое сорбента оптимальной системой для идентификации флавоноидов является БУВ (4:1:5) (Федосеева и др., 2012; Гаврилкин М.В. и др., 2010).
Обнаруженные пятна желтого цвета имеют одинаковые значения Rf для водно-спиртовых экстрактов Z. noltii и Potamogeton perfoliatus L. Значение Rf=0,89 соответствует значению Rf стандарта кверцетина (Бандюкова В.А., 1965; Бандюко-ва В.А. и др., 1983), Rf=0,59 соответствует соединению, относящееся к антоцианидинам (водорастворимым пигментам) (Кирхнер Ю., 1981).
Обнаружение и количественное содержание кверцетина в исследуемых образцах проводили с помощью сканирующего денситометра CAMAG-TLC Scanner 3 (Швейцария). Сравнительный анализ обнаружения кверцетина в экстрактах высших водных растений и стандартного образца кверцетина представлен на рисунке 5 (исследуемый образец водно-спиртовый экстракт зостеры малой) и на рисунке 6 (исследуемый образец водно-спиртовый экстракт рдеста пронзеннолистного).
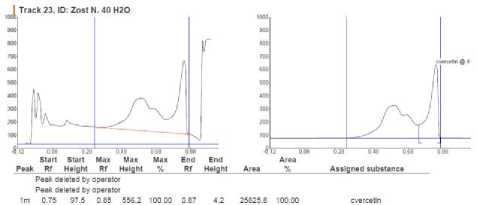
Рисунок 5. Хроматограмма кверцетина в экстракте
Z. noltii и стандартном образце
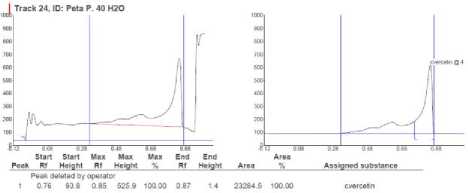
Рисунок 6. Хроматограмма кверцетина в экстракте Potamogeton perfoliatus L. и стандартном образце
Количественная обработка результатов исследований показала, что содержание кверцетина в экстракте Z. noltii составляет более 100 мг/мл, в экстракте P. perfoliatus L. -90,87 мг/мл. Для точного определения содержания кверцетна в экстрактах ВВР, объем жидкого экстракта для проведения анализа уменьшили с 1 до 0,5 мл. Содержание вещества при данной концентрации в зостере составило 62,43 мг/мл, в рдесте – 53,82 мг/мл.
Обсуждение результатов
Обнаруженные в высших водных растениях Волго-Каспийского бассейна биологически активные вещества являются природными антиоксидантами, что представляет широкий интерес для получения биопрепаратов с заданными свойствами.
Антоцианы, составляющие широкую группу флавоноидов, вносят наибольший вклад в формирование окраски растений. Антоцианы оказывают бактерицидное, мочегонное, желчегонное и отхаркивающее действия.
Кверцетин ( Quercetinum ) (3,3',4',5,7 -пентагидроксифлавон) наиболее распространенный из флавонов (А. Блажей и др., 1977). Кверцетин используется в фармацевтической, косметической, пищевой промышленности. В пищевой промышленности при производстве специализированных продуктов питания, в также в качестве сырья для производства биологически активных добавок к пище.
Препараты растительного происхождения (водно-спиртовые экстракты Zostera noltii
Список литературы Биологически активные вещества высших водных растений potamogeton perfoliatus l. и zosteranoltii: состав, свойства, применение
- Громов В.В. Водная и прибрежно-водная растительность Северного Каспия: авандельта реки Волги, калмыцкое и казахское побережья//Journal of Siberian Federal University. 2010. № 3. С. 250-266.
- Astafieva O.V., Novichenko O.V., Egorov М.А. The possibility of use of extracts from higher hydrophytes and geophytes of the Astrakhan region for the needs of cosmetology , 2012. pp. 147-152.
- Суворова Т.Ф., Бисенова А.Р., Мукатова М.Д. Исследование строения клеточных структур водных растений Волго-Каспийского бассейна с целью их использования в качестве промышленного сырья//Вестник АГТУ. 2010. № 2 (50). С. 46-52.
- Подкорытова А.В. Морские водоросли -макрофиты и травы. М.: Изд-во ВНИРО, 2005. 175 с.
- Сухенко Л.Т. Биологически активные вещества некоторых растений и механизмы их противомикробной активности//Естественные науки. 2010. №3. С. 166-176.
- Hengrui Zheng, Xun Sun, Nan Guo, Ronggui Li. Evaluation of antibacterial and antioxidant activity of extracts of eelgrass Zostera marina Linnaeus , 2014, vol. 8, no. 23, pp. 2315-2321.


