Биологические особенности и условия поверхностного культивирования штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. против возбудителей фузариоза льна масличного
Автор: Маслиенко Л.В., Воронкова А.Х.
Рубрика: Защита растений и иммунология
Статья в выпуске: 3 (183), 2020 года.
Бесплатный доступ
Для разработки технологического регламента производства микробиопрепарата в препаративной форме «смачивающийся порошок» изучены биологические особенности и условия поверхностного культивирования штамма-продуцента Т-1 Trichoderma sp. антагониста возбудителей фузариоза льна масличного Fusarium oxysporum Schlecht. emend. Shyd. et Hans. var. orthoceras (App. еt Wr.) Bilai и Fusarium poae (Peck) Wollenw., Lewis. Изучены культуральные и физиологические свойства штамма-продуцента на агаризированных и жидких средах. Наиболее благоприятным для роста мицелия и спороношения является поверхностное выращивание гриба на агаризированной и жидкой среде Рудакова при температуре 25-30 оС. Максимальный рост мицелия со спороношением и наибольшую сухую массу обеспечило стационарное выращивание гриба на жидкой сре де в диапазоне рН от 3 до 6. Из источников углерода максимальный рост мицелия гриба и увеличение его сухой массы обеспечило введение в питательную среду Чапека крахмала. Из источников азота штамм гриба лучше всего ассимилировал кукурузный экстракт. Оптимальные сложные жидкие питательные среды для поверхностного культивирования штамма-продуцента - Рудакова и № 1. Оптимальный срок поверхностного культивирования грибного штамма Т-1 Trichoderma sp. на жидкой питательной среде Рудакова составил 10 суток, а объём посевной культуры к питательной среде - 2,0 %.
Лен масличный, фузариоз, микробиопрепарат, штамм-продуцент т-1 trichoderma sp, strain-producer т-1 trichoderma sp
Короткий адрес: https://sciup.org/142224957
IDR: 142224957 | УДК: 633.854.78: | DOI: 10.25230/2412-608X-2020-3-183-121-128
Текст научной статьи Биологические особенности и условия поверхностного культивирования штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. против возбудителей фузариоза льна масличного
Введение. В связи с возрастанием роли льна масличного как ценной технической культуры многостороннего использования, и учитывая пищевую и биологическую ценность льняного масла, которое применяют и в медицинских целях для получения экологически безопасной продукции, целесообразно применять биологические методы защиты культуры от патогенов. Наиболее вредоносной болезнью льна масличного, которая поражает культуру во всех регионах выращивания, на протяжении всего периода вегетации, является фузариоз. В Краснодарском крае наибольшее поражение растений льна масличного фузариозом отмечено в форме трахеомикозного увядания [1; 2; 3].
В лаборатории биометода ВНИИМК в течение многих лет проводятся исследования по разработке биологических мер борьбы с болезнями масличных культур. В последние годы разрабатывается микробиологический метод снижения вредоносности фузариоза на льне масличном. Зарегистрированных биологических препаратов, защищающих лен масличный от возбудителей фузариоза, нет.
Проведена работа по поиску перспективных штаммов для создания микробиопрепаратов против двух возбудителей фузариоза льна масличного Fusarium oxysporum Schlecht. emend. Shyd. et Hans. var. orthoceras (App. et Wr.) Bilai и Fusarium poae (Peck) Wollenw., Lewis. В результате ступенчатого скрининга грибов и бактерий из коллекции лаборатории биометода выделено 10 перспективных штаммов антагонистов возбудителей фузариоза льна масличного [4; 5; 6]. Одним из перспективных штаммов-продуцентов микробиопрепарата против фузариоза является штамм T-1 Trichoderma sp. Наряду с фунгицидной активностью против фузариоза установлено отсутствие угнетающего влияния штамма на культуру льна масличного и выявлено его ростостимулирующее действие.
В последние годы в лаборатории биометода ведутся исследования по разработке препаративной формы микробиопрепаратов «смачивающийся порошок» (СП) при поверхностном выращивании штаммов-продуцентов на жидких питательных средах. Особенно эта технология перспективна для грибных штаммов-продуцентов. Производимые повсеместно жидкие формы микробиопрепаратов на основе грибов-продуцентов, а также концентраты и паста хранятся недолго даже в холодильнике, что не позволяет перевозить их на дальние расстояния и нарабатывать в период межсезонья. Производимые по технологии поверхностного культивирования на жидких питательных средах СП микробиопрепаратов тонкодисперсные, имеют высокий титр (109–10 КОЕ/г), сохраняющийся как минимум год и низкую норму расхода (50– 150 г/га/т) [7; 8].
Для разработки технологического регламента производства микробиопрепарата в препаративной форме СП изучали культуральные и физиологические признаки гриба T-1 Trichoderma sp., проводили подбор оптимальных сложных жидких питательных сред и условий поверхностного культивирования перспективного штамма-продуцента.
Материалы и методы. Культуральные признаки и физиологические свойства перспективного штамма антагониста T-1 Trichoderma sp. изучали по общепринятым методикам [9; 10; 11; 12].
Культуральные признаки изучали на трёх агаризированных питательных средах: картофельно-сахарозном агаре (КСА), Чапека и Рудакова [13]. Одновременно в центр чашки Петри (ЧП) на каждую питательную среду высевали одинаковый агаровый блок с мицелием и спороношением штамма антагониста и помещали в термостат при температуре 25,0 оС. Описывали форму и диаметр колоний, их структуру, рост, цвет с лицевой и обратной стороны, характер спороношения.
Физиологические признаки активного штамма изучали на жидких питательных средах. Поверхностное культивирование осущестляли в колбах Эрленмейера
-
(250 мл) с объемом питательной среды 100 мл, высевая одинаковый агаровый блок со штаммом-антагонистом.
Для определения оптимальной температуры штамм культивировали на жидкой среде Рудакова при температурах 20, 25, 30 и 35 оС.
Подбор оптимальной кислотности среды проводили, выращивая штамм на жидкой среде Рудакова при оптимальной температуре с добавлением лимонной кислоты или щёлочи. рН среды устанавливали в пределах 3,0; 6,0; 8,0 и 10,0.
Оптимальные элементы питания для штамма определяли на жидкой питательной среде Чапека, заменяя источники углеродного и азотного питания, в тех же дозировках. Источниками углеродного питания служили крахмал, глюкоза, маннит, сахароза; азотного питания – тиомочевина, хлористый аммоний, азотнокислый аммоний, кукурузный экстракт.
Определение оптимальных жидких питательных сред для выращивания перспективного штамма антагониста проводили при стационарном культивировании. Испытывали сложные питательные среды: Чапека, Рудакова, Викерхема и среду № 1 [13].
Оптимальные элементы питания для штамма антагониста, температуру, рН среды и сложные питательные среды определяли культивированием гриба поверхностным способом в течение 10 суток. Рост мицелия оценивали по баллам по разработанной нами шкале:
-
0 – нет роста или только обрастание посевного блока;
-
1 – рост мицелия отдельными колониями;
-
2 – мицелиальная плёнка сплошная тонкая;
-
3 – мицелиальная плёнка сплошная толстая.
По окончании культивирования определяли сухую массу мицелиальной пленки. Влажный мицелий высушивали при температуре 105 оС до постоянного веса.
Для установления оптимальных сроков поверхностного культивирования штамм продуцент выращивали на жидкой питательной среде Рудакова в 3-литровых стеклянных баллонах, с объемом питательной среды 500 мл в течение 10, 15 и 20 суток при оптимальной температуре. Выращенную биомассу гриба отделяли сливом культуральной жидкости. Затем к биомассе добавляли прилипатель, расте-катель и наполнитель. Всё перемешивали, распределяли тонким слоем на гладкой поверхности, высушивали под вытяжкой при температуре 28–30 °С и размалывали на мельнице с охлаждением. Определяли массу порошка и титр.
Для определения оптимального объёма посевной культуры к 500 мл питательной среды добавляли 2,0 и 4,0 % глубинной культуры антагониста, которую предварительно выращивали на жидкой среде, на качалке (195 об./мин) в течение 3-х суток. Определяли влажность сырой биомассы и СП методом высушивания до постоянного веса [14]. Титр СП определяли микробиологическим способом [15]. Во всех опытах повторность 3-кратная.
Результаты и обсуждение. Культуральные признаки штамма Т-1 Tricho-derma sp.
Культуральные признаки штамма гриба-антагониста изучены через 10 суток культивирования на трех агаризирован-ных средах при температуре 25 оС .
Колонии быстрорастущие, занимали всю поверхность питательной среды за 3– 4 суток (рис. 1).
На КСА рост гриба средний, через 10 суток колонии занимали всю поверхность ЧП, мицелий стелющийся, подушечки расположены редкими концентрическими зонами, между которыми видна среда. Цвет колоний с лицевой стороны темнозелёный, с обратной – светло-зелёный. Диаметр колоний через 3 суток 5,6 × 5,7 см, через 10 суток – 9,0 × 9,0 см. Спороноше-ние массовое.
На среде Чапека рост гриба средний, через 10 суток колонии занимали всю поверхность ЧП, подушечки расположены прерывистыми концентрическими зонами: по краю среды – менее прерывисты-123
|
ми, в центре – более прерывистыми. Цвет колоний с лицевой стороны темно-зелёный, в центре – светло-зелено-желтый, с обратной – светло-зелёный. Диаметр колоний через 3 суток 7,0 × 7,8 см, через 10 суток – 9,0 × 9,0 см. Спороношение массовое. КСА f j Чапека Рудакова Рисунок 1 – Рост штамма Т-1 Trichoderma sp. на агаризированных питательных средах через 10 суток при температуре 25 оС (ориг.) На среде Рудакова рост гриба сильный, через 10 суток колонии занимали всю поверхность ЧП, мицелий волокнистый высокий, подушечки расположены плотными радиальными зонами. Цвет колоний с лицевой стороны тёмно-зелёный, с се- |
рым напылением между радиусами, с обратной – коричнево-зелёный. Диаметр колоний через 3 и 10 суток – 9,0 × 9,0 см. Спороношение массовое. Таким образом, максимальный рост колоний штамма Т-1 Trichoderma sp. с массовым спороношением через 10 суток культивирования при температуре 25 оС отмечен на агаризированной питательной среде Рудакова. Физиологические признаки штамма Т-1 Trichoderma sp. Рост мицелия гриба Т-1 Trichoderma sp. на жидких питательных средах оценивали по разработанной нами шкале (рис. 2): 0 баллов 1 балл 2 балла 3 балла Рисунок 2 – Рост штамма Т-1 Trichoderma sp. на жидких питательных средах в соответствии с разработанной шкалой по баллам (ориг.): 0 – нет роста;
|

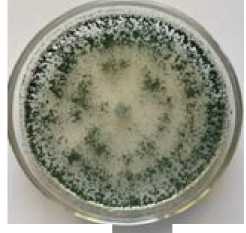
штамма Т-1 Trichoderma sp. на жидкой среде Рудакова.
Установлено, что наиболее благоприятным для роста мицелия и спороноше-ния является выращивание гриба при температурах 25–30 оС, при которых отмечена максимальная мицелиальная пленка и вес сухого мицелия (табл. 1).
Таблица 1
Влияние температуры на рост штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Рудакова г. Краснодар, ВНИИМК, 2019 г.
|
Штамм |
Рост мицелия, балл * /Вес сухого мицелия, г ** |
|||
|
температура, оС |
||||
|
20 |
25 |
30 |
35 |
|
|
Т-1 Tricho- |
2 /0,68 ± |
3 /0,96 ± |
3 /0,83 ± |
2 /0,67 ± |
|
derma sp. |
0,04 |
0,06 |
0,10 |
0,11 |
* – рост мицелия, балл;
** – вес сухого мицелия в расчете на 100 мл питательной среды
Штамм Т-1 Trichoderma sp. оказался требовательным к реакции среды. Максимальный рост мицелия со спороноше-нием и наибольшую сухую массу обеспечило стационарное выращивание гриба на жидкой среде Рудакова в диапазоне рН среды от 3 до 6 (табл. 2).
Таблица 2
Влияние реакции среды на рост штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Рудакова при температуре 25 оС г. Краснодар, ВНИИМК, 2019 г.
|
Штамм |
Рост мицелия, балл*/вес сухого мицелия, г** |
|||
|
рН среды |
||||
|
3,0 |
6,0 |
8,0 |
10,0 |
|
|
Т-1 Trichoderma sp. |
3 /1,21 ± 0 |
3 /1,16± 0 |
2/ 0,77 ± 0 |
2/ 0,71 ± 0 |
* – рост мицелия, балл;
** – вес сухого мицелия в расчете на 100 мл питательной среды
Определение оптимальных элементов питания для культивирования штамма Т-1 Trichoderma sp.
При стационарном культивировании гриба Т-1 Trichoderma sp. на жидкой пи- тательной среде Чапека при температуре 25 оС с добавлением различных источников углерода максимальный рост мицелия и увеличение его сухой массы обеспечило наличие в питательной среде крахмала и глюкозы (табл. 3).
Таблица 3
Влияние источников углерода на рост штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Чапека при температуре 25 оС г. Краснодар, ВНИИМК, 2019 г.
|
Штамм |
Рост мицелия, балл * /вес сухого мицелия, г ** |
|||
|
источник углерода |
||||
|
крахмал |
глюкоза |
сахароза |
маннит |
|
|
Т-1 |
2/0,24± |
2/0,12 ± |
1 /0,02 ± |
1 /0,02 ± |
|
Trichoderma sp. |
0,03 |
0,02 |
0,01 |
0,01 |
* – рост мицелия, балл;
** – вес сухого мицелия в расчете на 100 мл питательной среды
Среди источников азота выявлено, что кукурузный экстракт способствовал наибольшему росту мицелия гриба (3 балла) и максимальной сухой массе (0,31 г) по сравнению с другими вариантами (табл. 4).
Таблица 4
Влияние источников азота на рост штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Чапека при температуре 25 оС г. Краснодар, ВНИИМК, 2019 г.
|
Штамм |
Рост мицелия, балл*/вес сухого мицелия, г** |
|||
|
источник азота |
||||
|
тиомочевина |
NH 4 NO 3 |
NH 4 Cl |
кукурузный экс тракт |
|
|
Т-1 |
1 / 0,06± |
2/ 0,27 ± |
2/ 0,18 ± |
3 / 0,31 ± |
|
Trichoderma sp. |
0,02 |
0,09 |
0,03 |
0,02 |
* – рост мицелия, балл;
** – вес сухого мицелия в расчете на 100 мл питательной среды
Определение оптимальных жидких питательных сред для штамма Т-1 Tricho-derma sp.
Определены оптимальные жидкие питательные среды сложного состава для стационарного культивирования штамма Т-1 Trichoderma sp. Испытаны среды Рудакова, Чапека, Викерхема и № 1, содержащие углеводы и соединения азота, фосфора, калия и магния, а также микроэлементы в разном соотношении (табл. 5).
Таблица 5
Влияние жидких питательных сред и срока стационарного культивирования на рост штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. при температуре 25 оС г. Краснодар, ВНИИМК, 2020 г.
|
Штамм |
Рост мицелия, балл*, через 3, 5, 10 суток** |
|||
|
питательная среда |
||||
|
Чапека |
Рудакова |
Викерхема |
среда № 1 |
|
|
Т-1 Trichoderma sp. |
0 / 0 / 1 |
2 /2/ 3 |
1 /2/2 |
2/2/3 |
|
Вес сухого мицелия, г**, через 10 суток |
||||
|
0,12 ± 0,03 |
1,01 ± 0,05 |
0,60 ± 0,06 |
0,95 ± 0,06 |
|
* – рост мицелия, балл;
** – вес сухого мицелия в расчете на 100 мл питательной среды
Установлено, что максимальный рост мицелиальной плёнки со спороношением гриба обеспечивают среды Рудакова и № 1. Уже через трое суток культивирования на этих средах отмечена сплошная тонкая мицелиальная пленка со спороношением, тогда как на среде Чапека мицелий только обрастал посевной блок в глубине среды. Через 10 суток выращивания на средах Рудакова и № 1 образовались сплошные толстые мицелиальные плёнки со споро-ношением, на среде Викерхема – сплошная тонкая мицелиальная плёнка со спороношением, а на среде Чапека – отдельные колонии, которые не срослись между собой и не образовали сплошную мицелиальную плёнку. Масса сухого мицелия через 10 суток культивирования была максимальной на среде Рудакова.
Определен оптимальный срок поверхностного культивирования и объём посевной суспензии грибного штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. на жидкой питательной среде Рудакова (табл. 6).
Таблица 6
Влияние срока поверхностного культивирования и объёма посевной суспензии грибного штамма-продуцента Т-1 Trichoderma sp. на массу и титр лабораторного образца микробиопрепарата в препаративной форме «смачивающийся порошок»
г. Краснодар, ВНИИМК, 2020 г.
|
Вариант |
Объём посевной суспензии, % |
Срок поверхностного культивирования, сутки |
|||||
|
10 |
15 |
20 |
|||||
|
Масса СП*, г |
Титр, КОЕ**/г |
Масса СП, г |
Титр, КОЕ/г |
Масса СП, г |
Титр, КОЕ/г |
||
|
Т-1 Tricho-derma sp. |
2,0 |
6,35 ± 0,08 |
3,8 × 1010 |
7,41 ± 0,03 |
3,0 × 1010 |
8,51 ± 0,03 |
5,5 × 1010 |
|
4,0 |
6,43 ± 0,03 |
2,9 × 1010 |
7,68 ± 0,07 |
2,7 × 1010 |
8,85 ± 0,05 |
5,3 × 1010 |
|
* СП – микробиопрепарат в препаративной форме «смачивающийся порошок»;
** – КОЕ – колониеобразующих единиц
Установлено, что с увеличением срока поверхностного культивирования грибного штамма-продуцента на жидкой питательной среде, с 10 до 20 суток масса СП увеличивалась незначительно и составляла соответственно 6,43; 7,68 и 8,85 г на 500 мл питательной среды, с влажностью 6,0–6,9 %.
Увеличение объёма посевной культуры к питательной среде с 2,0 до 4,0 % также значительно не повышало выхода СП, который составил 6,35 и 6,43 г; 7,41 и 7,68 г; 8,51 и 8,85 г соответственно через 10, 15 и 20 суток культивирования. Титр опытных образцов СП микробиопрепарата не зависел от сроков культивирования штамма-продуцента и был одного порядка во всех вариантах выращивания (2,7–5,5 × 1010 КОЕ/г).
Таким образом, оптимальный срок поверхностного культивирования грибного штамма Т-1 Trichoderma sp. на жидкой питательной среде Рудакова составил 10 суток, а оптимальный объём посевной культуры к питательной среде – 2,0 %.
Выводы. Максимальный рост колоний штамма Т-1 Trichoderma sp. с массовым спороношением через 10 суток культивирования при температуре 25 оС отмечен на агаризированной питательной среде Рудакова.
Наиболее благоприятным для роста мицелия и спороношения является стационарное выращивание штамма Т-1 Trichoderma sp. на жидкой среде Рудакова в диапазоне температуры 25–30 оС, при рН среды от 3 до 6.
Из источников углеродного питания максимальный рост штамма Т-1 Tricho-derma sp. и увеличение его сухой массы обеспечило введение в жидкую питательную среду Чапека крахмала и глюкозы.
Из источников азота штамм Т-1 Trichoderma sp. лучше всего ассимилировал кукурузный экстракт.
Для стационарного культивирования штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. установлены оптимальными питательные среды Рудакова и № 1.
Оптимальный срок поверхностного культивирования грибного штамма Т-1 Trichoderma sp . на жидкой питательной среде Рудакова составил 10 суток, а оптимальный объём посевной культуры к питательной среде – 2,0 %.
Список литературы Биологические особенности и условия поверхностного культивирования штамма-продуцента микробиопрепарата Т-1 Trichoderma sp. против возбудителей фузариоза льна масличного
- Курилова Д.А., Бушнев А.С., Подлесный С.П. Пораженность масличного льна фузариозом в зависимости от приемов возделывания в условиях центральной зоны Краснодарского края // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2017. -Вып. 2 (174). - С. 112-119.
- Семеренко С.А., Курилова Д.А. Инкрустация семян льна масличного как способ защиты всходов от вредных организмов в условиях центральной зоны Краснодарского края // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2017. - Вып. 4 (172). - С. 125-133.
- Курилова Д.А., Семеренко С.А. Защита посевов масличного льна от фузариоза в условиях центральной зоны Краснодарского края // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2018. - Вып. 4 (176). - С. 167-171.
- Маслиенко Л.В., Воронкова А.Х., Даценко Л.А., Ефимцева Е.А. Первичный скрининг штаммов антагонистов из кол лекции лаборатории биометода ВНИИМК к возбудителю фузариоза льна масличного // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2019. - Вып. 3 (179). - С. 92-99.
- Маслиенко Л.В., Воронкова А.Х., Даценко Л.А., Ефимцева Е.А. Первичный скрининг штаммов антагонистов к возбудителю фузариоза льна масличного // Труды Кубанского государственного аграрного университета. - 2019. - № 3 (780). - С. 91-98.
- Маслиенко Л.В., Воронкова А.Х., Даценко Л.А., Ефимцева Е.А. Биологическая эффективность лабораторных образцов микробиопрепаратов на основе перспективных штаммов антагонистов против возбудителя фузариоза льна масличного на фоне искусственного заражения in vitro // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2019. - Вып. 4 (180). - С. 128-132.
- Маслиенко Л.В., Воронкова А.Х., Шипиевская Е.Ю. Биологические особенности штамма-продуцента микробиопрепарата Т-2 Trichoderma sp. - антагониста возбудителя ложной мучнистой росы подсолнечника // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2017. - Вып. 2 (170). - С. 81-87.
- Маслиенко Л.В., Воронкова А.Х., Шипиевская Е.Ю. Элементы лабораторного регламента производства микробиопрепаратов в препаративной форме "смачивающийся порошок" на основе грибовантагонистов из рода Trichoderma при поверхностном культивировании на жидких питательных средах // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2018. - Вып. 1 (173). - С. 82-86.
- Наумов Н.А. Методы микологических и фитопатологических исследований. - Л.: Сельхозиздат, 1937. - 272 с.
- Хохряков М.К. Методические указания по экспериментальному изучению фитопатогенных грибов. - Л.: Изд-во ВАСХНИЛ, 1969. - 65 с.
- Билай В.И. Фузарии. - Киев: Наукова думка, 1982. - 441 с.
- Паушева З.П. Практикум по цитологии растений. - М.: Колос, 1974. - 273 с.
- Рудаков О.Л. Микофильные грибы, их биология и практическое значение. - М.: Наука, 1981. - 160 с.
- ГОСТ 5180-2015 Грунты. Методы лабораторного определения физических характеристик. - М.: Стандарт информ, 2019.
- Егоров Н.С. Выделение микробовантагонистов и биологические методы учета их антибиотической активности. - М.: Изд-во Моск. ун-та, 1957. - 78 с.


