Биологические особенности перспективных штаммов грибов антагонистов (PV-3 Penicillium verrucosum Dierckx var cyclopium Westling, Samson et al. и PF-1 Penicillium funiculosum Тhом.) возбудителя фомопсиса
Автор: Маслиенко Л.В., Шипиевская Е.Ю., Асатурова А.М.
Статья в выпуске: 2 (137), 2007 года.
Бесплатный доступ
С целью разработки микробиопрепаратов против возбудителя фомопсиса подсолнечника изучены физиологические признаки, условия культивирования, оптимальные питательные среды, а также антибиотическая активность при стационарном и глубинном культивировании перспективных штаммов грибов-антагонистов РV-3 Penicillium verrucosum Dierckx var. cyclopium Westling, Samson et al. и РF-1 Penicillium funiculosum Thom.
Короткий адрес: https://sciup.org/142150825
IDR: 142150825 | УДК: 632.938:615.779.9
Текст научной статьи Биологические особенности перспективных штаммов грибов антагонистов (PV-3 Penicillium verrucosum Dierckx var cyclopium Westling, Samson et al. и PF-1 Penicillium funiculosum Тhом.) возбудителя фомопсиса
Введение. Фомопсис подсолнечника Phomopsis helianthi Munt. Cvet., Mihal. et Petr. – карантинный объект РФ. Накопившийся в течение 15 лет запас инфекционного начала болезни продолжает оставаться большой угрозой снижения урожайности подсолнечника во всех зонах выращивания культуры. Анализ литературных данных показал – биопрепаратов, защищающих сельскохозяйственные культуры, в том числе и подсолнечник, от фомопсиса, крайне недостаточно.
Во ВНИИМК ведётся работа по созданию биологических препаратов в борьбе с болезнями масличных культур на основе активных штаммов антагонистов (Маслиенко, 2005). Создана коллекция перспективных штаммов антагонистов возбудителей наиболее опасных болезней подсолнечника, сои и рапса. На основе двух перспективных штаммов грибов-антагонистов РV-3 Penicillium verrucosum var. cyclopium . и РF-1 Penicillium funiculosum разрабатываются микробиопрепараты (Шипиевская, Маслиенко, 1998; Маслиенко, Шипиевская, Асатурова, 2007). Штаммы выделены из почвы методом ловушек, обладают 100 % фунгицидной активностью к возбудителю фомопсиса. Кроме того, штаммы подавляют возбудителей белой и пепельной гнилей на 80-100 %, вертициллёза – на 75-90, фузариоза – на 60-75 %. Штаммы непатогенны к культуре подсолнечника, а, напротив, обладают высокой ростостимулирующей активностью.
С целью разработки технологии производства микробиопрепаратов изучали биологические особенности штаммов-продуцентов, устанавливали максимальную концентрацию ингибиторов роста возбудителя фомопсиса в культуральной жидкости исследуемых грибов-антагонистов при стационарном и глубинном культивировании.
Материалы и методы . Физиологические признаки перспективных штаммов грибов-антагонистов изучали по общепринятым методикам (Наумов, 1937; Хохряков, 1969).
Подбор элементов питания для активных штаммов изучали на жидкой питательной среде Чапека. Эффективность использования штаммами-антаго-42
нистами источников углерода и азота устанавливалась по интенсивности накопления биомассы гриба, т. е. по скорости развития мицелиального газона (пленки) на поверхности питательной среды, в баллах. Источниками углеродного питания служили глюкоза, ксилоза, сахароза, мальтоза, маннит и кукурузный экстракт. При изучении углеродных источников неизменным компонентом азотного питания служил азотнокислый натрий. Азотсодержащие вещества (азотнокислый натрий, пептон, дрожжевой экстракт, хлористый аммоний, кукурузный экстракт) отдельно добавляли к среде в качестве единственного источника азота, с неизменным компонентом углеродного питания – сахарозой.
Подбор оптимальных питательных сред для выращивания перспективных штаммов антагонистов проводили на жидких средах при стационарном культивировании. Испытывали ряд сложных питательных сред: Чапека, Чапека-Докса, картофельно-сахарозную (КС), Рудакова, Викерхема, “для синтеза пенициллина”, в состав которых входят минеральные соли, сахара, микроэлементы, кукурузный и дрожжевой экстракты.
Для определения оптимальной температуры культивирования штаммы выращивали на среде Рудакова при температурах 20, 25, 30 и 35 оС.
Для определения оптимальной кислотности среды штаммы выращивали на жидкой среде Рудакова при оптимальной температуре. Добавлением лимонной кислоты или щёлочи pH среды устанавливали в пределах от 3,0, до 10,0.
Оптимальные элементы питания штаммов грибов-антагонистов, питательные среды и рН среды определяли следующим образом: грибы культивировали поверхностным способом, в течение 10 суток на жидких средах в колбах Эрленмейера (250 мл), с объёмом питательной среды 100 мл, при температуре 25 оС. Рост мицелиальной пленки (газона) оценивали на третьи, пятые и десятые сутки по 5-балльной шкале: 0 – нет роста; 1 балл – начало роста, пленка тонкая, бесцветная; 2 балла – пленка средняя, сла-боокрашенная (начало образования конидий); 3 балла – пленка средняя, интенсивно окрашенная (массо- вое образование конидий) 4 балла – пленка толстая окрашенная; 5 баллов – пленка толстая, окрашенная, складчатая. По окончании культивирования определяли сухую массу мицелиальной пленки высушиванием влажного мицелия при температуре 105 оС до постоянного веса. Повторность в каждом опыте 3-кратная.
Титр препарата определяли микробиологическим способом (Егоров, 2004). 1,0 г (мл) препарата вносили в колбу со 100 мл стерильной воды и ставили на качалку на 30 мин. Из полученной суспензии готовили разведения от 1:10 до 1:1000000000. Суспензию из соответствующего разведения закапывали по 1 мл в 10 чашек Петри. Затем заливали в чашки по 1520 мл среды, расплавленной и остуженной до 4550 оС, и тщательно перемешивали с посевным материалом вращательным движением. После застывания перевёрнутые чашки Петри ставили в термостат с оптимальной температурой и через 48-96 ч вели подсчёт колоний. Титр вычисляли по формуле:
ТА 10 n
Т V, где Т – титр препарата, количество колониеобразующих единиц (КОЕ/г, мл);
А – среднее количество колоний в 10 чашках Петри;
10n – коэффициент разведения;
V – объем микробной суспензии, закапываемой в чашки Петри.
Антибиотическую активность изучаемых штаммов грибов-антагонистов определяли в условиях стационарного и глубинного культивирования с использованием модифицированного метода разведений (Ваксман, 1947; Егоров, 1986, 2004).
Для этого штаммы антагонистов культивировали (при оптимальной температуре на среде Рудакова) стационарным и глубинным способом в колбах Эр-ленмейера, емкостью 750 мл, с объемом среды 150 мл. Глубинное культивирование штаммов осуществляли на круговой качалке с оборотом двигателя 200 об./мин в течение 4 суток. Стационарное культивирование осуществляли в течение 15 суток.
Культуральную жидкость отбирали стерильно, очищали ее от мицелия и спор через бумажный фильтр и мембранные фильтры Millex GV c диаметром пор 0,22 μм . Далее в стерильные пробирки равного диаметра стерильно разливали расплавленную агаризированную питательную среду (КСА) по 1,0 мл в каждую. После охлаждения питательной среды до 37-40 оС туда же добавляли 1,0 мл очищенной культуральной жидкости испытываемого антагониста. Затем на скошенные агаровые пластинки сеяли мицелий патогена. По росту мицелия патогена или его отсутствию в течение 20 суток судили о наличии антибиотической активности. Контроль – чистая среда, без добавления культуральной жидкости антагониста.
Развитие патогена на поверхности питательной среды определяли по 5-балльной шкале:
0 – нет роста или рост мицелия патогена только на посевном блоке;
-
1 балл – рост мицелия патогена на 10 % поверхности питательной среды;
-
2 балла – рост мицелия патогена на 15-25 % поверхности питательной среды;
-
3 балла – рост мицелия патогена на 30-50 % поверхности питательной среды;
-
4 балла – рост мицелия патогена на 60-75 % поверхности питательной среды;
-
5 баллов – рост мицелия патогена на 80-100 % поверхности питательной среды.
Результаты и обсуждение.
Определение оптимальных элементов питания и на их основе сложных питательных сред для культивирования штаммов грибов-антагонистов.
Наилучшее развитие штамма PF-1 Penicillium fu-niculosum (рис. 1) наблюдалось на питательной среде, где в качестве источников углерода были ксилоза и сахароза. В этих вариантах на третьи сутки культивирования мицелиальная пленка была сплошной, средней толщины, наблюдалось активное образование конидий (2 балла). На пятые сутки и до конца культивирования пленка оставалась средней по толщине, интенсивно окрашенной (3 балла).
На средах, где источником углерода служили глюкоза, мальтоза, маннит и кукурузный экстракт, штамм PF-1 Penicillium funiculosum развивался гораздо хуже: развитие мицелиального газона на третьи сутки культивирования достигало 1 балла, а на пятые – появлялись слегка заметные признаки начала образования конидий (1-2 балла). В дальнейшем уплотнение конидиального газона не происходило, что и отразилось на массе сухого мицелия.
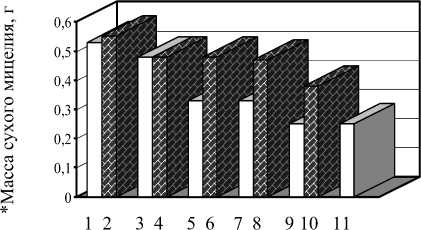
□ – источники углерода;
– источники азота
-
1 – ксилоза, 2 – NH4Cl, 3 – сахароза, 4 – NaNO3, 5 – мальтоза, 6 – кукурузный экстракт, 7 – глюкоза, 8 – дрожжевой экстракт, 9 – кукурузный экстракт, 10 – пептон, 11 – маннит
Рисунок 1 – Влияние различных элементов питания на развитие штамма гриба-антагониста РF-1 Penicil-lium funiculosum (10 суток культивирования)
* – масса сухого мицелия в расчете на 100 мл питательной среды.
Штамм PV-3 Penicillium verrucosum var. cyclopium (рис. 2) оказался менее требовательным к источникам углерода и одинаково хорошо развивался с сахарозой, ксилозой, мальтозой и глюкозой.
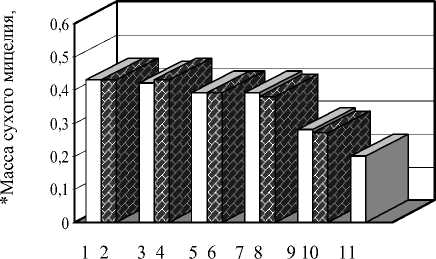
– источники азота

– источники углерода;
1 – сахароза, 2 – NaNO 3 , 3 – ксилоза, 4 – кукурузный экстракт, 5 – мальтоза, 6 – NH4Cl, 7 – глюкоза, 8 – дрожжевой экстракт, 9 – кукурузный экстракт, 10 – пептон, 11 – маннит.
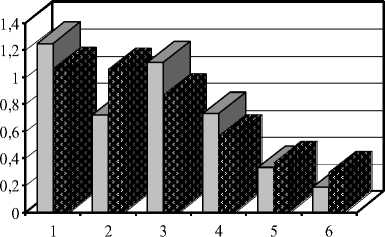
С целью определения оптимальных питательных сред для культивирования штаммов грибов-антагонистов изучали 5 сложных синтетических сред, содержащих в различных соотношениях соединения углерода, азота, фосфора, калия, магния и микроэлементов (Чапека, Чапека-Докса, Рудакова, Викерхема, “для синтеза пенициллина”) и одну органосинтетическую среду (КС) (рис. 3).
– РF-1 Penicillium funiculosum
– РV-3 Penicillium verrucosum var. cyclopium
Рисунок 2 – Влияние различных элементов питания на развитие штамма гриба-антагониста РV-3 Penicil-lium verrucosum var. сyclopium (10 суток культивирования)
* – масса сухого мицелия в расчете на 100 мл питательной среды
Наилучшее развитие обоих штаммов грибов-антагонистов наблюдалось на питательных средах, где в качестве источников азота были азотнокислый натрий, хлористый аммоний, дрожжевой и кукурузный экстракты (рис. 1, 2).
На первом этапе роста более активно, чем в других вариантах, развивался мицелий с добавлением дрожжевого экстракта. Уже на третьи сутки культивирования появлялся не только воздушный мицелий, но и начиналось формирование конидий (2 балла). Конидиальный газон занимал всю поверхность питательного субстрата. Но в конце культивирования у штамма PF-1 Penicillium funiculosum более толстым газон был в варианте с хлористым аммонием, а для штамма PV-3 Penicillium verrucosum var. cyclopium наравне с дрожжевым экстрактом выделились варианты с азотнокислым натрием, кукурузным экстрактом и хлористым аммонием.
На средах, где источником азотного питания служил пептон, культуры обоих штаммов развивались слабо. Масса мицелиальных пленок в этом варианте в среднем была в 1,5 раза ниже других вариантов.
Таким образом, наилучшими источниками углеродного питания для обоих штаммов-антагонистов выявлены сахароза и ксилоза. Оптимальными источниками азотного питания установлены хлористый аммоний, азотнокислый натрий, а также дрожжевой и кукурузный экстракты.
-
1 – Для синтеза пенициллина, 2 – Викерхема, 3 – Рудакова, 4 – картофельно-сахарозная, 5 – Чапека, 6 – Чапека-Докса .
Рисунок 3 – Влияние питательных сред на развитие штаммов грибов-антагонистов (10 суток культивирования)
* – масса сухого мицелия в расчете на 100 мл питательной среды
В течение 5 суток культивирования рост мицелиальной пленки у обоих штаммов во всех вариантах был одинаков и достигал 3 баллов. Через 10 суток у изучаемых штаммов на средах Викерхема, “для синтеза пенициллина” и Рудакова толщина мицелиальной пленки увеличилась в 1,5 раза (4-5 баллов). Масса мицелиальных пленок, выращенных на этих средах, от 1,5 до 6 раз превышала массу пленок со сред Чапека, Чапека-Докса и КС. При этом было отмечено, что мицелиальные газоны на средах Викер-хема и “для синтеза пенициллина” у обоих штаммов отличались. Пленки были жесткие, кожистые, с нехарактерным для этих штаммов цветом, как с лицевой, так и с обратной стороны и с малым количеством конидий.
В опытных партиях биопрепаратов, в препаративной форме паста, изготовленных из мицелиальных пленок штаммов грибов-антагонистов, выращенных на оптимальных питательных средах, определили титр микробиологическим способом.
Максимальный титр препаратов для обоих штаммов определен на среде Рудакова, содержащей наибольшее количество сахара и кукурузного экстракта.
Таким образом, лучшей питательной средой, на которой оба штамма образуют максимальную биомассу, а конечный продукт имеет наивысший титр, является среда Рудакова.
Определение оптимальной температуры и реакции среды для культивирования штаммов грибов-антагонистов
Влияние температуры на жизнедеятельность изучаемых грибов-антагонистов определяли на оптимальной среде Рудакова (рис. 4).
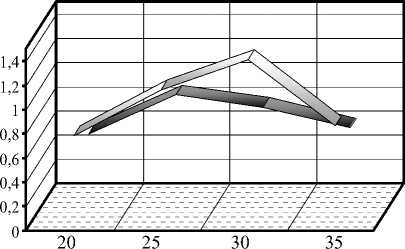
Температура, 0С
□ РF-1 Penicillium funiculosum
□ РV-3 Penicillium verrucosum var. cyclopium
Рисунок 4 – Влияние температуры на развитие штаммов грибов-антагонистов (10 суток культивирования)
* – масса сухого мицелия в расчете на 100 мл питательной среды.
Наблюдения показали, что отношение к температуре у изучаемых штаммов неодинаково.
Штамм РF-1 Penicillium funiculosum более требователен к температурным условиям выращивания. При температуре 30 оС уже на третьи сутки культивирования появлялся не только воздушный мицелий, но и сформировались конидиеносцы с конидиями (3 балла). Конидиальный газон занимал всю поверхность питательного субстрата, и в конце культивирования он становился толстым и складчатым (5 баллов). Масса сухого мицелия в этом варианте в 1,5-2 раза превышала массу мицелия в других вариантах.
У штамма РV-3 Penicillium verrucosum var. cyc-lopium во всех вариантах на 3 сутки культивирования появлялся воздушный мицелий, сформировались конидиеносцы с конидиями и на 5 сутки конидиальный газон занимал всю поверхность питательного субстрата. К концу культивирования в вариантах с температурой 25 и 30 оС мицелиальная пленка была более толстой, и существенной разницы по массе сухого мицелия между этими вариантами не отмечалось.
Следовательно, оптимальной температурой выращивания изучаемых штаммов является для РF-1 Penicillium funiculosum 30 оС, а для РV-3 Penicillium verrucosum var. cyclopium – 25-30 оС.
Одним из важных факторов, определяющих нормальный рост грибов, является реакция среды. При изменении ее в неблагоприятную сторону микроорганизм перестает расти даже в тех случаях, если все остальные условия окружающей среды будут оптимальными.
Для определения оптимальной кислотности среды штаммы культивировали при установленных нами температурах на среде Рудакова с различными начальными значениями рН. Критериями развития культуры, как и ранее, являлись скорость роста, образование воздушного мицелия и развитого конидиального газона, а также масса сухого мицелия (рис. 5).
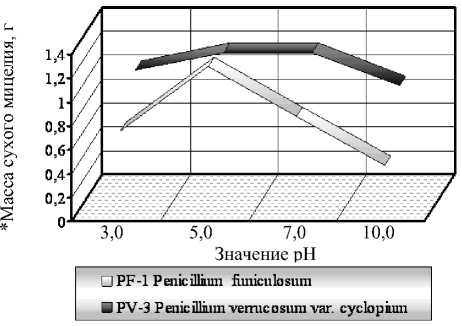
Рисунок 5 – Влияние реакции среды на развитие штаммов грибов-антагонистов (10 суток культивирования)
* – масса сухого мицелия в расчете на 100 мл питательной среды.
Оба штамма образовывали хорошо сформированные мицелиальные газоны с несколько бόльшей толщиной при рН среды 5, но для штамма PV-3 Pe-nicillium verrucosum var. cyclopium наибольшее количество образовавшихся конидий отмечено при рН среды 7. Масса сухого мицелия в этих вариантах была в 1,5-3 раза выше, чем в остальных вариантах. При значении рН среды 10 штаммы значительно замедляли рост и развитие.
Следовательно, наилучшие условия роста отмечены при культивировании штаммов грибов-антагонистов на среде Рудакова при кислотности среды для PF-1 Penicillium funiculosum 5, а для
PV-3 Penicillium verrucosum var. cyclopium – 5-7.
Антибиотическая активность перспективных штаммов грибов-антагонистов PV-3 Penicillium verrucosum var. cyclopium и PF-1 Penicillium funiculosum к возбудителю фомопсиса.
В условиях стационарного культивирования антибиотическую активность культуральных жидкостей антагонистов в отношении возбудителя фомопсиса проверяли на третьи, пятые, шестые, десятые и пятнадцатые сутки культивирования. Учеты роста и развития тест-объекта проводили на третьи, шестые, десятые и двадцатые сутки выращивания (табл. 1).
Таблица 1 – Антибиотическая активность штаммов грибов-антагонистов к возбудителю фомопсиса в условиях стационарного культивирования
Краснодар, ВНИИМК, 2006-2007 гг.
|
Вариант |
Срок куль-тиви-рова-ния штаммов, сутки |
Рост мицелия фомопсиса, баллы |
|||
|
срок выращивания фомопсиса, сутки |
|||||
|
3 |
6 |
10 |
20 |
||
|
Контроль Penicillium funiculosum Penicillium verrucosum var. cyclopium |
3 |
3 0 1 |
4 1 3 |
5 3 4 |
5 5 5 |
|
Контроль Penicillium funiculosum Penicillium verrucosum var. cyclopium |
5 |
3 0 0 |
4 0 0 |
5 0 0 |
5 1 3 |
|
Контроль Penicillium funiculosum Penicillium verrucosum var. cyclopium |
6 |
3 0 0 |
4 0 0 |
5 0 0 |
5 0 0 |
|
Контроль Penicillium funiculosum Penicillium verrucosum var. cyclopium |
10 |
3 1 0 |
4 3 0 |
5 5 2 |
5 5 5 |
|
Контроль Penicillium funiculosum Penicillium verrucosum var. cyclopium |
15 |
3 0 0 |
5 0 0 |
5 0 0 |
5 1 1 |
В результате эксперимента установили, что при добавлении к агаризированной питательной среде фильтратов 3-дневной культуральной жидкости штаммов грибов-антагонистов развитие мицелия фомопсиса в вариантах сдерживалось по сравнению с контролем у штамма PF-1 Penicillium funiculosum в течение 6 суток, у штамма PV-3 Penicillium verrucosum var. cyclopium – 3 суток. Затем патоген начинал активно развиваться и к 20-ым суткам достиг контрольного уровня (5 баллов).
Пятидневные фильтраты культуральных жидкостей обоих штаммов грибов-антагонистов ингибировали полностью рост мицелия фомопсиса в течение 10 суток, тогда как в контрольном варианте к этому моменту развитие мицелия патогена достигало 5 баллов. Однако через 20 суток патоген все же начал разрастаться по поверхности субстрата в варианте с PF-1 Penicillium funi-culosum на 1 балл, с PV-3 Penicillium verrucosum var. cyclopium – на 3 балла.
Шестидневные фильтраты культуральных жидкостей обоих штаммов грибов-антагонистов полностью подавляли развитие мицелия тест-объекта более 20 суток, при этом в контроле патоген разросся на 100 % уже на 7-е сутки выращивания.
Продолжив проверку 10- и 15-дневных фильтратов культуральных жидкостей штаммов-антагонистов, установили, что антибиотическая активность штамма PF-1 Penicillium funiculosum снизилась. Десятидневная культуральная жидкость гриба незначительно, по сравнению с контролем, сдерживала развитие патогена только в течение 3 суток. Затем мицелий тест-объекта начинал активно расти, и на 10-е сутки его развитие в варианте достигало контрольного (5 баллов). Однако 15-дневная культуральная жидкость гриба-антагониста сдерживала развитие мице- лия патогена в течение 10 суток, при этом контроль за этот период разросся на 100 %. Через 20 суток в варианте было отмечено начало роста патогена (1 балл), но мицелий был очень тонким, угнетенным. Антибиотическая активность 10- и 15-дневных фильтратов культуральных жидкостей штамма PV-3 Penicil-lium verrucosum var. cyclopium также незначительно снизилась. Десятидневная культуральная жидкость гриба-антагониста полностью ингибировала развитие патогена в течение 6 суток, и на 10 сутки его развитие в варианте достигало только 2 баллов, при 5 баллах в контроле. Пятнадцатидневная культуральная жид кость гриба-антагониста сдерживала развитие мицелия патогена в течение 10 суток. Через 20 суток было отмечено только начало роста патогена (1 балл), при этом мицелий был очень тонким, угнетенным.
Следовательно, максимальная концентрация ингибиторов роста возбудителя фомопсиса, в культуральной жидкости исследуемых грибов-антагонистов при стационарном культивировании образуется на 6 и 15-е сутки.
Определение антибиотической активности глубинной культуры изучаемых штаммов грибов-антагонистов и возможности накопления ингибиторов в ней проводили в течение всего срока культивирования. Учеты роста и развития возбудителя фо-мопсиса проводили на 3, 5, 7, 10 и 15-е сутки выращивания (табл. 2).
Таблица 2 – Антибиотическая активность штаммов грибов-антагонистов к возбудителю фомопсиса, в условиях глубинного культивирования
Краснодар, ВНИИМК, 2006-2007 гг.
|
Вариант |
Срок культи-виро-вания штаммов, час |
Рост мицелия фомопсиса, балл |
||||
|
срок выращивания фомопсиса, сутки |
||||||
|
3 |
5 |
7 |
10 |
15 |
||
|
Контроль |
2 |
5 |
5 |
5 |
5 |
|
|
Penicillium funiculosum |
24 |
0 |
3 |
4 |
5 |
5 |
|
Penicillium verrucosum var. cyclopium |
1 |
5 |
5 |
5 |
5 |
|
|
Контроль |
2 |
5 |
5 |
5 |
5 |
|
|
Penicillium funiculosum |
48 |
0 |
0 |
1 |
3 |
5 |
|
Penicillium verrucosum var. cyclopium |
2 |
3 |
5 |
5 |
5 |
|
|
Контроль |
2 |
5 |
5 |
5 |
5 |
|
|
Penicillium funiculosum |
72 |
0 |
0 |
1 |
3 |
5 |
|
Penicillium verrucosum var. cyclopium |
2 |
3 |
5 |
5 |
5 |
|
|
Контроль |
2 |
5 |
5 |
5 |
5 |
|
|
Penicillium funiculosum |
96 |
0 |
0 |
0 |
1 |
4 |
|
Penicillium verrucosum var. cyclopium |
0 |
1 |
3 |
5 |
5 |
|
В результате эксперимента установили, что при добавлении к агаризированной питательной среде фильтратов суточной культуральной жидкости штаммов грибов-антагонистов развитие мицелия фомопси-са в вариантах сдерживалось по сравнению с контролем у штамма PF-1 Penicillium funiculosum в течение 7 суток, у штамма PV-3 Penicillium verruco-sum var. cyclopium – 3 суток. Затем, патоген начинал активно развиваться и к 10-м суткам достигал контро- льного уровня (5 баллов).
Двух- и трехсуточные фильтраты культуральных жидкостей штаммов грибов-антагонистов ингибировали развитие мицелия фомопсиса, по сравнению с контролем, у штамма PF-1 Penicillium funiculosum в течение 10 суток, у штамма PV-3 Penicillium verruco-sum var. cyclopium – 5 суток. Далее патоген начинал активно развиваться, и к 15-м суткам достигал контрольного уровня (5 баллов).
Четырехсуточный фильтрат культуральной жидкости штамма PF-1 Penicillium funiculosum подавлял развитие тест-объекта около 10 суток, штамма PV-3 Penicillium verrucosum var. cyclopium – 7 суток. Затем начиналось развитие патогена, но мицелий разрастался очень медленно. Действие ингибиторов продолжалось у штамма PF-1 Penicillium funiculosum 15 суток, у штамма PV-3 Penicillium verrucosum var. cyclopium – 10 суток. При этом в контроле патоген развивался интенсивно и уже к 5-м суткам достигал 5 баллов.
Следовательно, при глубинном культивировании максимальное количество ингибиторов, сдерживающих развитие патогена, образуется в культуральной жидкости штаммов грибов-антагонистов через 96 ч.
Выводы.
-
1. Оптимальными источниками углеродного питания для обоих штаммов-антагонистов установлены сахароза и ксилоза, источниками азотного питания – хлористый аммоний, азотнокислый натрий, а также дрожжевой и кукурузный экстракты.
-
2. Лучшей питательной средой, на которой оба штамма образуют максимальную биомассу, а конечный продукт имеет наивысший титр, является среда Рудакова.
-
3. Оптимальной температурой выращивания изучаемых штаммов является: для РF-1 Penicillium fu-niculosum 30 оС, а для РV-3 Penicillium verrucosum var. cyclopium – 25-30 оС.
-
4. Наилучшие условия роста отмечены при культивировании штаммов грибов-антагонистов на среде Рудакова при кислотности среды для PF-1 Penicillium funiculosum 5, а для PV-3 Penicillium verrucosum var. cyclopium – 5-7.
-
5. Максимальная концентрация ингибиторов роста возбудителя фомопсиса в культуральной жидкости исследуемых грибов-антагонистов при стационарном культивировании образуется на 6 и 15-е сутки.
-
6. При глубинном культивировании максимальное количество ингибиторов, сдерживающих развитие фомопсиса, образуется в культуральной жидкости штаммов грибов-антагонистов через 96 ч.
Работа выполнена при поддержке гранта РФФИ № 06-08-00946-а.


