Биологические особенности штамма-продуцента микробиопрепарата SGRC-1 Pseudomonas fluorescens - антагониста возбудителя ложной мучнистой росы подсолнечника
Автор: Маслиенко Л.В., Воронкова А.Х., Шипиевская Е.Ю.
Рубрика: Защита растений и иммунология
Статья в выпуске: 4 (172), 2017 года.
Бесплатный доступ
Для разработки технологического регламента производства микробиопрепарата в препаративной форме порошок при поверхностном культивировании на жидких питательных средах изучены биологические особенности штамма-продуцента Sgrc-1 Pseudomonas fluorescens - антагониста ложной мучнистой росы подсолнечника. Изучены морфолого-культуральные свойства штамма-продуцента на двух агаризированных средах. Установлены оптимальные условия культивирования штамма: температура - 25-30 оС, рН среды 8. В качестве источников углеродного питания можно использовать глицерин, глюкозу и сахарозу. Оптимальными источниками азотного питания установлены азотнокислый натрий и пептон. Оптимальной сложной питательной средой для культивирования перспективного бактериального штамма Sgrc-1 P. fluorescens установлена среда Кинга В.
Подсолнечник, ложная мучнистая роса, микробиопрепарат, штамм-продуцент sgrc-1 pseudomonas fluorescens
Короткий адрес: https://sciup.org/142214631
IDR: 142214631 | УДК: 633.854.78:632.444.2:632.953.1
Текст научной статьи Биологические особенности штамма-продуцента микробиопрепарата SGRC-1 Pseudomonas fluorescens - антагониста возбудителя ложной мучнистой росы подсолнечника
Введение. Ложная мучнистая роса (ЛМР), вызываемая облигатным паразитом оомицетом Plasmopara halstedii (Farl.) Berl. et de Toni, относится к числу наиболее вредоносных болезней подсолнечника. Основным способом борьбы с этим заболеванием является селекционный. Но в связи с появлением новых агрессивных рас возбудителя, ранее устойчивые сорта и гибриды поражаются болезнью в сильной степени. Химический 119
фунгицид Апрон (металаксил) также снизил эффективность в связи с возникающей резистентностью возбудителя болезни [1]. Решение проблемы защиты от болезней связано с разработкой комплекса мероприятий, включающих и микробиологический метод.
В России и за рубежом проводятся исследования по разработке микробиологических средств защиты растений от возбудителей ложной мучнистой росы, но зарегистрированных микробиопрепаратов нет [2–7].
В лаборатории биометода Всероссийского научно-исследовательского института масличных культур имени В.С. Пус-товойта (ФГБНУ ВНИИМК) в течение многих лет ведутся исследования по разработке микробиологических средств защиты масличных культур от болезней [8]. В последние годы проводится работа по поиску перспективных штаммов-продуцентов для создания микробиопрепаратов против возбудителя ложной мучнистой росы на подсолнечнике [9]. В результате скрининга грибов и бактерий из коллекции лаборатории выделено 14 перспективных штаммов-антагонистов возбудителя ложной мучнистой росы подсолнечника. Одним из перспективных штаммов-продуцентов микробиопрепарата против ЛМР является штамм Sgrc-1 Pseudomonas fluorescens. Наряду с фунгицидной активностью против ЛМР и других опасных патогенов установлено отсутствие угнетающего влияния штамма на культуру подсолнечника и выявлено его ростостимулирующее действие [10].
Для разработки технологического регламента производства микробиопрепарата в препаративной форме смачивающийся порошок изучали морфолого-культуральные и физиологические признаки штамма-продуцента Sgrc-1 Pseudomonas fluorescens, осуществляли подбор оптимальных сложных жидких питательных сред при поверхностном культивировании.
Материалы и методы. Морфологокультуральные признаки перспективного 120
штамма-антагониста Sgrc-1 Pseudomonas fluorescens изучали по общепринятым методикам на агаризированных питательных средах – мясопептонном агаре (МПА) и Кинга В [11].
Морфологические признаки активного штамма определяли с помощью микроскопа «Motic BA 300». Определяли форму и размер клеток, способность к движению, окраску по Грамму. Изучали особенности роста, форму, размер, поверхность, профиль, цвет, блеск и прозрачность колоний, а также их край, структуру и консистенцию на десятые сутки инкубации [12; 13; 14].
Физиологические признаки активного штамма изучали на жидкой питательной среде Кинга В. Поверхностное культивирование осуществляли в колбах Эрлен-мейера (250,0 мл) с объемом питательной среды 100,0 мл и предварительным внесением посевной (маточной) культуры (2,0 % от объема питательной среды), заменяя источники углеродного и азотного питания. Источниками углеродного питания служили глюкоза, сахароза, глицерин и меласса, азотного питания – азотнокислый натрий, пептон, дрожжевой и кукурузный экстракты.
Для определения оптимальной температуры культивирования штамм выращивали на жидкой питательной среде Кинга В при температурах 20,0, 25,0, 30,0 и 35,0 °С.
Для определения оптимальной кислотности среды штамм выращивали на жидкой питательной среде Кинга В при оптимальной температуре. Добавлением лимонной кислоты или щелочи (4 н. раствор NaOH) pH среды устанавливали 3,0; 6,0; 8,0 и 10,0.
Подбор оптимальных жидких питательных сред для выращивания перспективного штамма проводили на жидких средах в условиях поверхностного культивирования. Испытывали ряд питательных сред: мясопептонный бульон (МПБ), Кинга В, Чапека для бактерий, пептон-дрожжевую [11; 15; 16].
Рост бактерии на жидкой среде оценивали по шкале:
-
- слабый – рост отдельными поверхностными колониями;
-
- средний – бактериальная плёнка поверхностная, прерывистая, тонкая;
-
- сильный – бактериальная плёнка поверхностная сплошная, с частичным глубинным ростом;
-
- обильный – бактериальная плёнка поверхностная сплошная, с массовым глубинным ростом.
По окончании культивирования определяли сухой остаток бактериальной массы после высушивания при температуре 105,0 оС до постоянного веса. Повторность в каждом опыте трехкратная.
Результаты и обсуждение. Морфолого-культуральные признаки штамма Sgrc-1 Pseudomonas fluorescens.
Морфологические признаки клеток. Клетки палочковидные, одиночные или соединены попарно, подвижные (движение поступательное), размеры 0,4–0,7 × 1,4–3,1 мкм. Споры отсутствуют. Окраска по Грамму отрицательная.
Культуральные признаки колоний. Культуральные признаки штамма Sgrc-1 P. fluorescens изучали на агаризирован-ных средах – мясопептонном агаре (МПА) и Кинга В (табл. 1, рис. 1). На этих средах форма колоний круглая, поверхность гладкая. Профиль колоний выпуклый, край на обеих средах гладкий, реже волнистый. Колонии блестящие, на Кинга В просвечивающиеся, пигментированные (желто-зеленый флюоресцирующий пигмент, диффундирующий в среду), на МПА непигментированные, непросве-чивающиеся. Структура колоний однородная, консистенция слизистая. Диаметр колоний на десятые сутки инкубации на МПА 30,1–30,7 мм, на среде Кинга В – 20,1–20,8 мм.
Таблица 1
Культурально-морфологические признаки колоний штамма Sgrc-1 Pseudomonas fluorescens при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
Характеристика признака |
Питательная среда |
|
|
МПА |
среда Кинга В |
|
|
1. Форма колоний |
Круглая |
Круглая |
|
2. Диаметр колоний, мм |
30,1–30,7 |
20,1–20,8 |
|
3. Край колоний |
Гладкий, реже волнистый |
Гладкий, реже волнистый |
|
4. Поверхность колоний |
Гладкая |
Гладкая |
|
5. Профиль колоний |
Выпуклый |
Выпуклый |
|
6. Оптические свойства поверхности колоний |
Блестящие, не просвечивающиеся, не пигментированные |
Блестящие, просвечивающиеся, пигментированные (желто-зеленый флюоресцирующий пигмент, диффундирующий в среду) |
|
7. Структура колонии |
Однородная |
Однородная |
|
8. Консистенция |
Слизистая |
Слизистая |

среда Кинга В
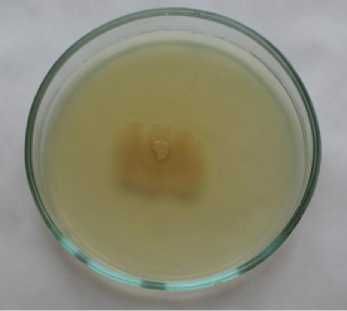
МПБ
Рисунок 1 – Рост штамма Sgrc-1 Pseudomonas fluorescens на агаризированных средах при температуре 25 оС
Физиологические признаки штамма Sgrc-1 Pseudomonas fluorescens
Оптимальные температуры и реакцию среды для культивирования штамма Sgrc-1 Pseudomonas fluorescens определяли выращивая штамм на жидкой питательной среде Кинга В при 20, 25, 30 и 35 °С (табл. 2).
Таблица 2
Влияние температуры на рост штамма Sgrc-1 Pseudomonas fluorescens в условиях стационарного культивирования на жидкой среде Кинга В г. Краснодар, ВНИИМК, 2016 г.
|
Температура, о С |
Рост бактерии |
Вес сухой бактериальной массы, г* |
|
20 |
Средний |
0,32 ± 0,03 |
|
25 |
Обильный |
0,86 ± 0,07 |
|
30 |
Сильный |
0,69 ± 0,05 |
|
35 |
Слабый |
0,12 ± 0 |
* – вес бактериальной массы в расчете на 100 мл питательной среды
Обильный рост колоний штамма Sgrc-1 P. fluorescens и максимальный вес сухой бактериальной массы отмечен в диапазоне температур 25–30 °С.
Оптимальную кислотность среды определяли, выращивая штамм Sgrc-1 P. fluo-rescens на жидкой питательной среде Кинга В с разными значениями рН среды при оптимальной температуре 25 о С (табл. 3).
Таблица 3
Влияние рН среды на рост штамма Sgrc-1 P. fluorescens в условиях стационарного культивирования на жидкой среде Кинга В при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
рН среды |
Рост бактерии |
Вес сухой бактериальной массы, г* |
|
3 |
Слабый |
0,12 ± 0,03 |
|
6 |
сильный |
0,76 ± 0,07 |
|
8 |
обильный |
0,99 ± 0,05 |
|
10 |
сильный |
0,77 ± 0,00 |
* – вес бактериальной массы в расчете на 100 мл питательной среды
Установлен активный рост бактерии в диапазоне рН среды от 6 до 10, при этом 122
максимальный вес сухой бактериальной массы отмечен при значении рН 8 (0,99 г/100 мл питательной среды).
Определение оптимальных источников питания для культивирования штамма Sgrc-1 Pseudomonas fluorescens.
Оптимальные источники питания определяли, выращивая штамм Sgrc-1 P. fluo-rescens на жидкой питательной среде Кинга В при температуре 25 оС. Источниками углеродного питания служили глюкоза, сахароза, меласса и глицерин. При изучении углеродных источников неизменными компонентами азотного питания служил пептон (табл. 4).
Таблица 4
Влияние источников углерода на рост штамма Sgrc-1 P. fluorescens в условиях стационарного культивирования на жидкой среде Кинга В при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
Источник углерода |
Рост бактерии |
Вес сухой бактериальной массы, г* |
|
Меласса |
Средний |
0,36 ± 0,03 |
|
Глюкоза |
Средний |
0,45 ± 0,08 |
|
Глицерин |
Обильный |
0,71 ± 0,02 |
|
Сахароза |
Средний |
0,58 ± 0,06 |
* – вес бактериальной массы в расчете на 100 мл питательной среды
Максимальный рост и вес сухого остатка бактериальной массы отмечены при использовании в качестве единственного источника углерода глицерина (0,71 г на 100 мл питательной среды).
Источниками азота служили азотнокислый натрий, пептон, дрожжевой и кукурузный экстракты, при этом неизменным источником углеродного питания был глицерин. Максимальный рост и вес сухой бактериальной массы отмечены при использовании в качестве единственного источника азота пептона и азотнокислого натрия (0,71–0,73 г на 100 мл питательной среды) (табл. 5).
Таким образом, для штамма Sgrc-1 P. fluorescens установлены оптимальные условия культивирования: температура 25–30 оС, рН среды 8. В качестве источ- ников углеродного питания можно использовать глицерин, глюкозу и сахарозу. Оптимальными источниками азотного питания установлены азотнокислый натрий и пептон.
Таблица 5
Влияние источников азота на рост штамма Sgrc-1 P. fluorescens в условиях стационарного культивирования на жидкой среде
Кинга В при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
Источник азота |
Рост бактерии |
Вес сухой бактериальной массы, г* |
|
Пептон |
Обильный |
0,71 ± 0,02 |
|
Азотнокислый натрий |
Обильный |
0,73 ± 0,05 |
|
Дрожжевой экстракт |
Средний |
0,56 ± 0,05 |
|
Кукурузный экстракт |
Средний |
0,60 ± 0,08 |
* – вес бактериальной массы в расчете на 100 мл питательной среды
Определение оптимальных жидких питательных сред для штамма Sgrc-1 P. fluo-rescens.
Подбор оптимальных питательных сред для штамма Sgrc-1 P. fluorescens проводили при стационарном культивировании на жидких питательных средах сложного состава – Кинга В, Чапека для бактерий, МПБ и пептоне (дрожжевой среде), содержащих углеводы и, в разном соотношении, соединения азота, фосфора, калия и магния, а также микроэлементы (табл. 6).
Таблица 6
Влияние жидких питательных сред и срока стационарного культивирования на рост штамма Sgrc-1 P. fluorescens при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
Питательная среда |
Вес сухой бактериальной массы, г* через 10 суток |
|
Чапека для бактерий |
0,07 ± 0 |
|
Пептон – дрожжевая среда |
0,24 ± 0,06 |
|
МПБ |
0,08 ± 0 |
|
Кинга В |
0,74 ± 0,08 |
* – вес бактериальной массы в расчете на 100 мл питательной среды
Оптимальной сложной питательной средой для культивирования перспектив- ного бактериального штамма Sgrc-1 P. fluorescens установлена среда Кинга В, на которой вес сухой бактериальной массы составил 0,74 г против 0,07–0,24 г на других средах.
Выводы. 1. Обильный рост колоний штамма Sgrc-1 P. fluorescens и максимальный вес сухой бактериальной массы отмечены в диапазоне температур 20– 25 °С.
-
2. Активный рост бактерии установлен в диапазоне рН среды от 6 до 10, при этом максимальный вес сухой бактериальной массы отмечен при значении рН 8.
-
3. Из источников углерода максимальный рост и выход сухого остатка бактериальной массы обеспечило введение в питательную среду глицерина.
-
4. Максимальный рост и вес сухой бактериальной массы отмечены при использовании в качестве единственных источников азота пептона и азотнокислого натрия.
-
5. Оптимальной сложной питательной средой для культивирования перспективного бактериального штамма Sgrc-1 P. fluorescens установлена среда Кинга В.
Исследования выполнены при финансовой поддержке РФФИ и администрации Краснодарского края, грант № 16-48-230293.
Список литературы Биологические особенности штамма-продуцента микробиопрепарата SGRC-1 Pseudomonas fluorescens - антагониста возбудителя ложной мучнистой росы подсолнечника
- Gulya T.J., Draper J., Harbour J., Holen C., Knodel J., Lamey A. Metalaxsyl resistance in sunflower downy mildew in Nord America//Proc. of the 21th Sunfl. Research Workshop, January 14-15. -1999. -P. 118-123.
- Терёшина М.В. Биологическое обоснование методов ранней диагностики и приёмов снижения вредоносности ложной мучнистой росы подсолнечника: автореф. дис. … канд. биол. наук. -Краснодар, 1996. -15 с.
- Патент 2182767 РФ, МКИ F C А01N63|00, A01N63|04 Способ защиты огурца от пероноспороза/Иващенко И.И., Чебыкин М.Ю. -N 99115630|13; Заяв. 19.07.1999; Опубл. 27.05. 2002; НКИ.
- Tosi L., Giovannetti M., Zazzerini A., Sbrana C. Interactions between Plasmopara helianthi and arbuscular mycorrhizal fungi in sunflower seedings susceptible and resistant to downy mildew//Phytopathol. Mediterranea. -1993. -Vol. 32. -Nо 2. -P. 106-114.
- Tosi L., Zazzerini A. Interactions between Plasmopara helianthi, Glomus mossea and two plant activators in sunflower plants//Europ. J. Plant Pathol. -2000. -Vol. 106. -Nо 8. -P. 735-744.
- Yonsel Y.S., Sevim M. Microbial dressing of sunflower seeds with Trichoderma harzianum Kuen 1585//Proc. of 19th Intern. Sunfl. Conf., Edirne, Turkey. 29 May-3 June 2016. -P. 993.
- Ciftcigil T.H., Ozer N., Sabudak T. A preliminary study on control of sunflower downy mildew (Plasmopara halstedii) with culture filtrates of antagonistic fungi//Proc. of 19th International Sunflower Conference, Edirne, Turkey. 29 May-3 June 2016. -P. 1106.
- Маслиенко Л.В. Обоснование и разработка микробиологического метода борьбы с болезнями подсолнечника: автореф. дис.. докт. биол. наук. -Краснодар, 2005. -48 с.
- Маслиенко Л.В., Арасланова Н.М., Ковчигина М.А. Поиск оптимального метода искусственного заражения подсолнечника возбудителем ложной мучнистой росы для определения эффективности опытных образцов микробиопрепаратов//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2014. -Вып. 2 (159-160). -С. 156-162.
- Маслиенко Л.В., Воронкова А.Х., Арасланова Н.М., Ковчигина М.А., Шипиевская Е.Ю., Наумов Г.Н. Скрининг штаммов-антагонистов к возбудителю ложной мучнистой росы подсолнечника//Наука Кубани. -2016. -№ 3. -С. 48-55.
- King E.O., Ward M.K., Raney D.E. Two simple media for the demonstration of pyocyanin and fluorescin//J. Lab. Clin. Med. -1954. -Vol. 44. -P. 301-307.
- Градова Н.Б., Бабусенко Е.С., Горнова И.Б. Лабораторный практикум по общей микробиологии. -М.: ДеЛи принт, 2004. -144 с.
- Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии. -М.: Дрофа, 2004. -256 с.
- Нетрусов Ф.И., Егорова М.А., Захарчук Л.М. Практикум по микробиологии. -М.: Издательский центр «Академия», 2005. -608 с.
- Скворцова И.Н. Методы идентификации и выделения почвенных бактерий рода Pseudo-monas. -М.: Изд-во Моск. ун-та, 1981. -78 с.
- Тихонович И.А., Оследкин Ю.С. Каталог культур микроорганизмов. -СПб-Пушкин, 2005. -88 с.


