Биологические особенности штамма-продуцента микробиопрепарата Т-2 Trichoderma sp. - антагониста возбудителя ложной мучнистой росы подсолнечника
Автор: Маслиенко Л.В., Воронкова А.Х., Шипиевская Е.Ю.
Рубрика: Защита растений и иммунология
Статья в выпуске: 2 (170), 2017 года.
Бесплатный доступ
Для разработки технологического регламента производства микробиопрепарата изучены биологические особенности штамма-продуцента Т-2 Trichoderma sp. - антагониста ложной мучнистой росы подсолнечника. Изучены морфолого-культуральные свойства штамма-продуцента на трёх агаризированных средах. Наиболее благоприятным для роста мицелия и спороношения является выращивание гриба при температуре 25-30 оС на среде Рудакова. Максимальный рост мицелия со спороношением и наибольшую сухую массу обеспечило стационарное выращивание гриба на жидкой среде в диапазоне рН от 3 до 6. Из источников углеродов максимальный рост мицелия гриба и увеличение его сухой массы обеспечило введение в питательную среду крахмала. Из источников азота штамм гриба лучше всего ассимилирует кукурузный экстракт. Оптимальная сложная жидкая питательная среда для культивирования штамма-продуцента - среда Рудакова.
Подсолнечник, ложная мучнистая роса, микробиопрепарат, штамм-продуцент т-2 trichoderma sp, strain-producer т-2 trichoderma sp
Короткий адрес: https://sciup.org/142151369
IDR: 142151369 | УДК: 632.937:632.444.2
Текст научной статьи Биологические особенности штамма-продуцента микробиопрепарата Т-2 Trichoderma sp. - антагониста возбудителя ложной мучнистой росы подсолнечника
Введение. Подсолнечник – ведущая масличная культура в России и многих других странах мира. Серьезным препятствием для получения высоких урожаев подсолнечника зачастую становятся различные болезни. Ложная мучнистая роса (ЛМР), вызываемая облигатным паразитом – оомицетом Plasmopara halstedii (Farl.) Berl. et de Toni, относится к числу наиболее вредоносных. Основным способом борьбы с этой болезнью является селекционный. Создаваемые в нашей стране сорта и гибриды подсолнечника были устойчивыми к наиболее распространённым расам патогена. Однако с началом 90-х годов XX столетия, когда в
Россию начали завозить семенную продукцию подсолнечника иностранных фирм (Франции, Испании, США и других), увеличилась вероятность ввоза новых рас патогена с семенами из-за рубежа. С интенсификацией возделывания подсолнечника и увеличением разнообразия сортимента ускорился естественный процесс сопряжённой эволюции паразита и хозяина, способствующий формированию новых рас. В связи с этим ранее устойчивые сорта и гибриды поражаются болезнью в сильной степени, что приводит к существенному снижению урожая и его качества.
Существующий химический способ защиты подсолнечника от ЛМР с помощью фунгицида Апрона (металаксил, ме-феноксам) снизил свою эффективность в связи с возникающей резистентностью возбудителя болезни [1].
Решение проблемы защиты от болезней связано с разработкой комплекса мероприятий, включающих и микробиологический метод. Снижение отрицательного влияния химических средств защиты растений на окружающую среду и человека остаётся одной из наиболее актуальных проблем современности. Разработка микробиологических средств защиты от фитопатогенов является важной, неотъемлемой компонентой интегрированной защиты растений в современном растениеводстве, а в ряде случаев – единственным средством контроля.
В России нет микробиологических препаратов, зарегистрированных для защиты сельскохозяйственных культур от возбудителей ложной мучнистой росы. Однако исследования в области поиска биологических средств защиты растений от возбудителя этой болезни проводятся и в нашей стране и за рубежом [1–7].
В лаборатории биометода Всероссийского научно-исследовательского института масличных культур имени В.С. Пус-товойта (ФГБНУ ВНИИМК) в течение многих лет ведутся исследования по раз-82
работке микробиологических средств защиты масличных культур от болезней. Создана уникальная коллекция штаммов грибов и бактерий – антагонистов возбудителей белой, серой гнилей, фузариоза и фомопсиса, продуцентов микробиопрепаратов для защиты от болезней масличных и других сельскохозяйственных культур [8]. В последние годы проводится работа по поиску перспективных штаммов для создания микробиопрепаратов против возбудителя ложной мучнистой росы [9]. В результате скрининга грибов и бактерий из коллекции лаборатории выделено 14 перспективных штаммов антагонистов возбудителя ложной мучнистой росы подсолнечника. Одним из перспективных штаммов-продуцентов микробиопрепарата против ЛМР является гриб T-2 Trichoderma sp. Наряду с фунгицидной активностью против ЛМР установлено отсутствие угнетающего влияния штамма на культуру подсолнечника и выявлено его ростостимулирующее действие, которое проявляется в увеличение массы корня проростков за счет интенсивного развития боковых корней [10].
Для разработки технологического регламента производства микробиопрепарата изучали морфолого-культуральные и физиологические признаки штамма-продуцента T-2 Trichoderma sp., осуществляли подбор оптимальных сложных жидких питательных сред при поверхностном культивировании.
Материалы и методы. Морфологокультуральные признаки и физиологические свойства перспективного штамма антагониста T-2 Trichoderma sp. изучали по общепринятым методикам [11; 12; 13].
Морфологические признаки активного штамма определяли с помощью микроскопа «Motic BA 300». Изучали строение, цвет и размер мицелия, конидиеносцев и конидий [14].
Культуральные признаки изучали на трёх твёрдых питательных средах: карто-фельно-сахарозном агаре (КСА), Чапека и Рудакова [15]. На каждую питательную среду одновременно в центр чашки Петри (ЧП) высевали штамм антагониста и помещали в термостат при температуре 25,0 оС. Описывали форму колоний, их структуру, цвет с лицевой и обратной стороны, край, начало и характер спороношения.
Физиологические признаки штамма изучали на жидкой питательной среде Чапека, заменяя источники углеродного и азотного питания, в тех же дозировках. Источниками углеродного питания служили крахмал, глюкоза, маннит, сахароза; азотного питания – тиомочевина, мочевина, хлористый аммоний, азотнокислый аммоний, кукурузный экстракт.
Для определения оптимальной температуры культивирования штамм выращивали на среде Чапека при температурах 20,0; 25,0; 30,0 и 35,0 оС.
Для определения оптимальной кислотности среды штаммы выращивали на жидкой среде Чапека при оптимальной температуре. Добавлением лимонной кислоты или щёлочи pH среды устанавливали в пределах 3,0; 6,0; 8,0 и 10,0.
Оптимальные элементы питания штамма гриба-антагониста, питательные среды, температуру и рН среды определяли следующим образом: гриб культивировали поверхностным способом в течение десяти суток в колбах Эрленмейера объемом 250,0 мл, со 100 мл жидкой питательной среды, при температуре 25,0 оС. Рост мицелиальной пленки (газона) оценивали по шкале:
0 – нет роста;
-
1 – рост мицелия отдельными колониями;
-
2 – мицелиальная плёнка сплошная тонкая;
-
3 – мицелиальная плёнка сплошная толстая.
По окончании культивирования определяли сухую массу мицелиальной пленки – высушиванием влажного мицелия при температуре 105,0 оС до постоянного веса. Повторность в каждом опыте трехкратная.
Подбор оптимальных питательных сред для выращивания перспективного штамма-антагониста проводили на жидких средах при стационарном культивировании. Испытывали ряд сложных питательных сред: Чапека, Рудакова, Ви-керхема и среда № 1, в состав которых входят минеральные соли, сахара, микроэлементы и кукурузный экстракт.
Результаты и обсуждение . Морфолого-культуральные признаки штамма Т-2 Trichoderma sp.
Морфологические признаки. Мицелий состоит из бесцветных, сильно ветвистых гиф 1–12 мк в диаметре. Хламидоспоры интеркаллярные, реже верхушечные, на коротких боковых веточках, шаровидные, бесцветные, гладкие, до 14 мк в диаметре, образуются в среде. Конидиеносцы сильно ветвистые в подушечках, в прерывистых или концентрических зонах, с главной осью около 4,5 мк толщины, с боковыми веточками, одиночными или в группах по 2–3. Все веточки отходят под широким углом. Стеригмы образуют ложные мутовки, изменчивые по величине – 8–14 × 2,4–3 мк, прямые или слегка согнутые, кеглевидные, суженные у основания. Конидии шаровидные, слегка шероховатые, 3,6–4,5 мк в диаметре
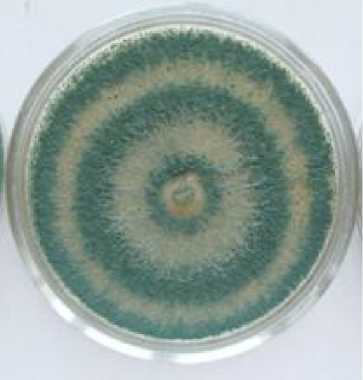
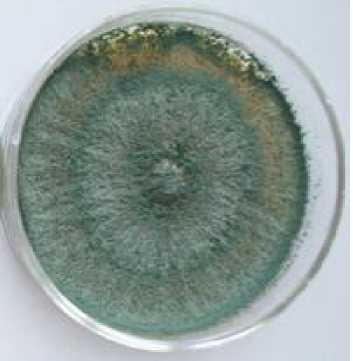
Культуральные признаки. Культуральные признаки штамма гриба-антагониста изучали через десять суток инкубации при температуре 25 оС (рис. 1, табл. 1).
Колонии быстрорастущие, занимали всю поверхность питательной среды за 3– 4 суток.

Таблица 1
Культуральные признаки штамма Т-2 Trichoderma sp. при культивировании на агаризированных средах (возраст 10 суток) при температуре 25 оС.
г. Краснодар, ВНИИМК, 2016 г.
среда Чапека
среда КСА
среда Рудакова
Рисунок 1 – Рост штамма Т-2 Trichoderma sp. на агаризированных питательных средах (возраст 10 суток) при температуре 25 оС
|
Вариант |
Характеристика колонии |
Диаметр колонии, см, через, суток |
Спо-роно-ше-ние |
||||
|
Среда |
рост колонии |
цвет, со стороны |
рост ми- це-лия, балл |
3 |
10 |
||
|
лицевой |
обратной |
||||||
|
Чапека |
Слабый, колонии занимают всю поверхность ЧП, подушечки по краям редкие, в центре расположены кон-центрическими зонами |
Зелёный |
Свет-ло-зе-лёный |
5 |
5,0 × 5,5 |
9,0 × 9,0 |
Массовое |
|
КСА |
Средний, колонии занимают всю поверхность ЧП, подушечки расположены плотными концентрически-ми зонами, но между зонами мицелий редкий |
Голубова-то-зелёный с не-большим беловатым налётом |
Свет-ло-зе-лёный |
5 |
8,8 × 9,0 |
9,0 × 9,0 |
Массовое |
|
Рудакова |
Сильный, колонии занимают всю поверхность ЧП, подушечки расположены плотными концентрически-ми зонами |
Голубова-то-зелёный, с беловатым налётом сверху |
Корич-нево-зе-лёный |
5 |
9,0 × 9,0 |
9,0 × 9,0 |
Массовое |
На среде Чапека рост слабый, колонии занимали всю поверхность ЧП, но подушечки редкие, расположены концентрическими зонами, зелёного цвета, мицелий между зонами прозрачный. С обратной
стороны среда окрашена в светло-зелёный цвет.
На КСА рост средний, колонии занимали всю поверхность ЧП, подушечки расположены плотными концентрическими зонами, но между зонами мицелий редкий, голубовато-зелёного цвета с небольшим беловатым налётом. С обратной стороны окраска среды светло-зелёная.
На среде Рудакова рост сильный, колонии занимали всю поверхность ЧП, подушечки расположены плотными концентрическими зонами, голубовато-зеленые в центре, со светлым налётом сверху. С обратной стороны среда окрашена в коричнево-зелёный цвет.
Таким образом, наиболее сильный рост колоний штамма Т-2 Trichoderma sp. с обильным спороношением через 10 суток культивирования при температуре 25 оС отмечен на агаризированной питательной среде Рудакова.
Физиологические признаки штамма Т-2 Trichoderma sp.
Определение оптимальной температуры и реакции среды для культивирования штамма Т-2 Trichoderma sp .
Гриб – аэроб. Установлено, что наиболее благоприятным для роста мицелия и спороношения является выращивание гриба при температурах 25–30 оС (табл. 2).
Таблица 2
Влияние температуры на рост штамма Т-2 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Чапека г. Краснодар, ВНИИМК, 2016 г.
|
Температура, оС |
Рост мицелия |
Вес сухого мицелия, г* |
|
20 |
Средний |
0,06 ± 0,01 |
|
25 |
Обильный |
0,11 ± 0,05 |
|
30 |
Сильный |
0,09 ± 0,01 |
|
35 |
Средний |
0,05 ± 0,01 |
* – вес мицелия в расчете на 100 мл питательной среды
Гриб Т-2 Trichoderma sp. оказался требовательным к реакции среды. Максимальный рост мицелия со спороношением и наибольшую сухую массу обеспечило стационарное выращивание гриба на жидкой среде Чапека в диапазоне рН среды от 3 до 6 (табл. 3).
Таблица 3
Влияние рН среды на рост штамма Т-2 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Чапека при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
рН среды |
Рост мицелия |
Вес сухого мицелия, г* |
|
3 |
Обильный |
0,12 ± 0,01 |
|
6 |
Средний |
0,06 ± 0,007 |
|
8 |
Слабый |
0,01 ± 0 |
|
10 |
Слабый |
0,01 ± 0 |
* – вес мицелия в расчете на 100 мл питательной среды
Определение оптимальных элементов питания для культивирования штамма Т-2 Trichoderma sp .
При стационарном выращивании гриба на жидкой среде Чапека при температуре 25 оС с добавлением разных источников углерода максимальный рост мицелия и увеличение его сухой массы обеспечило введение в питательную среду крахмала (табл. 4).
Таблица 4
В серии лабораторных опытов выявлено, что из источников азота кукурузный 85
Влияние источников углерода на рост штамма Т-2 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Чапека при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
Источник углерода |
Рост мицелия |
Вес сухого мицелия, г* |
|
Крахмал |
Обильный |
0,24 ± 0,08 |
|
Глюкоза |
Средний |
0,15 ± 0,03 |
|
Маннит |
Слабый |
0,05 ± 0 |
|
Сахароза |
Средний |
0,11 ± 0,05 |
* – вес мицелия в расчете на 100 мл питательной среды экстракт способствовал обильному росту мицелия гриба и максимальной сухой массе по сравнению с другими вариантами (табл. 5).
Таблица 5
Влияние источников азота на рост штамма Т-2 Trichoderma sp. в условиях стационарного культивирования на жидкой среде Чапека при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
Источник азота |
Рост мицелия |
Вес сухого мицелия, г* |
|
Мочевина |
Средний |
0,13 ± 0,01 |
|
Тиомочевина |
Слабый |
0,01 ± 0 |
|
NH 4 NO 3 |
Средний |
0,07 ± 0,01 |
|
NH 4 Cl |
Средний |
0,09 ± 0,01 |
|
Кукурузный экстракт |
Обильный |
0,29 ± 0,07 |
* – вес мицелия в расчете на 100 мл питательной среды
Определение оптимальных жидких питательных сред для штамма Т-2 Trichoderma sp.
Подбор оптимальных питательных сред для штамма Т-2 проводили при стационарном культивировании на жидких питательных средах сложного состава – Рудакова, Чапека, Викерхема и среде № 1, содержащих углероды и соединения азота, фосфора, калия и магния, а также микроэлементы в разном соотношении (табл. 6).
Таблица 6
Влияние жидких питательных сред и срока стационарного культивирования на рост штамма Т-2 Trichoderma sp. при температуре 25 оС г. Краснодар, ВНИИМК, 2016 г.
|
Питательная среда |
Рост мицелия, балл*, через, суток |
Вес сухого мицелия, г** через 10 суток |
||
|
3 |
5 |
10 |
||
|
Чапека |
0 |
0 |
1 |
0,09 ± 0 |
|
Рудакова |
1 |
2 |
3 |
0,93 ± 0,03 |
|
Викерхема |
1 |
2 |
2 |
0,43 ± 0,07 |
|
Среда №1 |
2 |
2 |
3 |
0,67 ± 0,03 |
Список литературы Биологические особенности штамма-продуцента микробиопрепарата Т-2 Trichoderma sp. - антагониста возбудителя ложной мучнистой росы подсолнечника
- Gulya T.J., Draper J., Harbour J., Holen C., Knodel J., Lamey A. Metalaxyl resistance in sunflower downy mildew in North America//Proc. of 21th Sunfl. research workshop, January 14-15, 1999. -P. 118-123.
- Терёшина М.В. Биологическое обоснование методов ранней диагностики и приёмов снижения вредоносности ложной мучнистой росы подсолнечника: автореф. дис. … канд. биол. наук. -Краснодар, 1996. -15 с.
- Пат. 2182767 РФ, МКИ F C А01N63|00, A01N63|04 Способ защиты огурца от пероноспороза/Иващенко И.И., Чебыкин М.Ю. -N 99115630/13; Заяв. 19.07.1999; Опубл. 27.05. 2002; НКИ.
- Tosi L., Giovannettii M., Zazzerini A., Sbrana C. Interactions between Plasmopara helianthi and arbuscular mycorrizal fungi in sunflower seedlings susceptible and resistant to downy mildew//Phytopathol. Mediterraneae. -1993. -Vol. 32. -Nо 2. -P. 106-114.
- Tosi L., Zazzerini A. Interactions between Plasmopara helianthi, Glomus mossea and two plant activators in sunflower plants//Europ. J. Plant Pathol. -2000. -Vol. 106. -Nо 8. -P. 735-744.
- Yonsel Y.S., Sevim M. Microbial dressing of sunflower seeds with Trichoderma harzianum Kuen 1585//Proc. of 19th Intern. Sunfl. Conf., Edirne, Turkey, May 29-June 3, 2016. -P. 993.
- Cifetcigil T.H., Ozer N., Sabudak T. A prelimi-nary study on control of sunflower downy mildew (Plasmopara halstedii) with culture filtrates of antagonistic fungi//Proc. of 19th Intern. Sunfl. Conf., Edirne, Turkey, May 29-June 3, 2016. -P. 1106.
- Маслиенко Л.В. Обоснование и разработка микробиологического метода борьбы с болезнями подсолнечника: автореф. дис. … д-ра биол. наук. -Краснодар, 2005. -48 с.
- Маслиенко Л.В., Арасланова Н.М., Ковчигина М.А. Поиск оптимального метода искусственного заражения подсолнечника возбудителем ложной мучнистой росы для определения эффективности опытных образцов микробиопрепаратов//Масличные культуры: Науч.-тех. бюл. ВНИИМК. -2014. -Вып. 2 (159-160). -С. 156-162.
- Маслиенко Л.В., Воронкова А.Х., Арасланова Н.М., Ковчигина М.А., Шипиевская Е.Ю., Наумов Г.Н. Скрининг штаммов антагонистов к возбудителю ложной мучнистой росы подсолнечника//Наука Кубани. -2016. -№ 3. -С. 48-55.
- Наумов Н.А. Методы микологических и фитопатологических исследований. -Л.: Сельхозиздат, 1937. -272 с.
- Хохряков М.К. Методические указания по экспериментальному изучению фитопатогенных грибов. -Л.: Изд-во ВАСХНИЛ, 1969. -65 с.
- Билай В.И. Фузарии. -Киев: Наукова думка, 1982. -441 с.
- Паушева З.П. Практикум по цитологии растений. -М.: Колос, 1974. -273 с.
- Рудаков О.Л. Микофильные грибы, их биология и практическое значение. -М.: Наука, 1981. -160 с.


