Биологические параметры пищеварительных и обменных процессов у межвидовых гибридов домашней овцы (Ovis aries) и архара (Ovis ammon polii)
Автор: Боголюбова Н.В., Романов В.Н., Девяткин В.А., Гусев И.В., Багиров В.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Продуктивные животные: физиология пищеварения
Статья в выпуске: 4 т.51, 2016 года.
Бесплатный доступ
Интродукция в современные породы домашних овец ( Ovis aries ) аллелофонда диких видов, в частности архара ( Ovis ammon polii ), рассматривается сегодня как один из перспективных подходов при повышении генетического разнообразия и, как следствие, нутриентного биоразнообразия. Изучение процессов пищеварения, усвоения питательных субстратов в организме и обмена веществ - основа разработки систем кормления для создаваемых селекционных форм животных. Целью настоящего исследования стало изучение особенностей процессов пищеварения, обмена веществ, переваримости и использования питательных веществ рационов у гибридов романовской породы овец с архаром. Опыты проводили в условиях вивария Всероссийского НИИ животноводства им. академика Л.К. Эрнста (Московская обл., пос. Дубровицы) в 2014-2015 годах на трех группах валухов разного происхождения с фистулами рубца. В I группу (контроль) входили чистопородные романовские овцы (ROM, n = 3), во II группу - гибриды F3 (HYB1, n = 3) от скрещивания романовских маток с гибридом F2 романовской овцы и архара (12,5 % - архар, 87,5 % - романовская порода); в III группу - гибриды F3 (HYB2, n = 3) от скрещивания гибридов F2 романовской овцы и архара с баранами эдильбаевской породы (12,5 % - архар, 37,5 % - романовская порода, 50 % - эдильбаевская порода). Образцы рубцового содержимого и крови для анализа отбирали за 1 ч до и через 3 ч после кормления. В содержимом рубца определяли общее количество летучих жирных кислот (ЛЖК) методом паровой дистилляции в аппарате Маркгама; количество аммиачного азота микродиффузным методом по Конвею; амилолитическую активность фотометрическим методом; биомассу простейших и бактерий методом дифференцированного центрифугирования. В крови определяли содержание эритроцитов и лейкоцитов, гемоглобина, в сыворотке крови - концентрацию общего белка, альбуминов, глобулинов, мочевины, креатинина, аланинаминотрансферазы, аспартатаминотрансферазы, глюкозы, холестерина. У гибридных овец по сравнению с чистопородными аналогами ферментативные процессы в рубце протекали интенсивнее. Об этом свидетельствовало большее накопление микробиальной массы (+37,0…+37,3 % до кормления и +22,2…+33,3 % после кормления), повышение концентрации ЛЖК (+17,5...+26,1 % до кормления и +8,7...+12,0 % после кормления), амилолитической активности рубцовой жидкости (+10,3…+14,0 %), снижение концентрации аммиака (-8,4…-27,7 %). Усиление ферментативных процессов обусловливало лучшую переваримость и использование питательных веществ гибридными животными. У HYB1 коэффициенты переваримости сухого вещества (+7,8 %), органического вещества (+5,3 %), сырого протеина (+6,9 %), сырого жира (+3,8 %, p
Жвачные животные, гибридные животные, рубцовое пищеварение, ферментативные процессы, переваримость, обмен веществ
Короткий адрес: https://sciup.org/142213957
IDR: 142213957 | УДК: 636.3:636.082.266:591.13:612.015.3 | DOI: 10.15389/agrobiology.2016.4.500rus
Текст научной статьи Биологические параметры пищеварительных и обменных процессов у межвидовых гибридов домашней овцы (Ovis aries) и архара (Ovis ammon polii)
Один из способов повышения продуктивности животноводства и качества получаемой продукции — вовлечение в сельскохозяйственное производство ресурсов дикой фауны посредством создания новых форм животных методом межвидовой гибридизации (1-3).
∗ Работа выполнена при финансовой поддержке РНФ, номер проекта 14-36-00039.
Искусственная гибридизация различных видов Ovis издавна привлекала исследователей. Так, М.Ф. Иванов, используя муфлона, вывел новую породу овец — горного мериноса, пригодного для круглогодичного содержания на горных пастбищах (4). П.А. Мантейфель высказал идею создания северных овец с использованием гибридизации со снежным бараном (5), которая позднее нашла отражение в работах других исследователей (6, 7). На основе гибридизации архара ( O. ammon polii ) с тонкорунными овцами была выведена новая мясошерстная порода — казахский архаромеринос (8). Посредством гибридизации каракульских маток с архаром создан серый тип каракульских овец (9). Интродукция в существующие породы домашних животных аллелофонда диких видов рассматривается как один из перспективных подходов повышения нутриентного разнообразия (10) и обеспечения человека качественной, безопасной и здоровой пищей. В этой связи особое значение имеет раскрытие морфологических, физиологических и биохимических механизмов, регулирующих процессы пищеварения и участвующих в формировании продуктивных признаков у животных новых генотипов (11-13).
Во Всероссийском НИИ животноводства им. академика Л.К. Эрнста (ВИЖ им. Л.К. Эрнста) ведется работа по получению межвидовых гибридов романовской породы овец ( Ovis aries ) и архара ( Ovis ammon ) с целью создания новых селекционных форм с измененным нутриентным составом (14), сочетающих желательные продуктивные, биологические признаки и адаптационные возможности исходных видов. Так, овцы романовской породы имеют выдающиеся продуктивные качества и многоплодие, но низкую резистентность и некоторую изнеженность конституции (15). Архар (аргали), самый крупный из диких баранов, обладает относительной неприхотливостью и способностью выживать в экстремально неблагоприятных условиях внешней среды (16).
Известно, что генотипические особенности отражаются на активности функционирования регуляторных систем, что сопровождается изменениями в интенсивности и направленности пищеварительных и обменных процессов. Переваримость и использование питательных веществ, а также потребность в них у животных разного происхождения неодинаковы (17, 18). Вследствие различий в адаптивных возможностях пищеварительного аппарата у животных разных генотипов в желудочно-кишечном тракте создаются специфические условия, влияющие на активность микроорганизмов и биосинтез метаболитов (19-23). Понимание закономерностей этих процессов необходимо для обоснования рационального кормления поголовья и повышения эффективности использования корма (24-25).
Кроме того, определение показателей, характеризующих пищеварение, усвоение питательных субстратов в организме и обмен веществ, относится к обязательным требованиям при разработке режимов кормления для создаваемых селекционных форм животных (26-29). Учет особенностей их физиолого-биохимического статуса позволяет оптимизировать рационы, обеспечивающие наиболее полную реализацию потенциала высокой продуктивности, достигнутого в результате селекции (30).
В настоящей работе впервые сопоставили ряд биологических параметров пищеварительных и обменных процессов у полученных межвидовых гибридов домашней овцы ( Ovis aries ) (с участием романовской породы или романовской и эдильбаевской пород) с архаром ( Ovis ammon polii ) и получили подтверждение более интенсивного метаболизма и лучшего усвоения питательных веществ у этих овец по сравнению с аналогами романовской породы.
Нашей целью было сравнительное изучение особенностей пищеварения, обмена веществ, переваримости и использования субстратов рациона у чистопородной романовской овцы и гибридов разной кровности от скрещивания домашних овец с архаром.
Методика. Исследования проводили в условиях физиологического двора (ВИЖ им. Л.К. Эрнста, 2014-2015 годы) на трех группах валухов разного происхождения, подобранных по возрасту (6-7 мес) и живой массе и прооперированных с наложением фистул рубца (по Басову). Контроль (I группа) составляли валухи романовской породы (ROM), II группу — гибриды F3 (HYB1) от скрещивания романовских маток с гибридом F2 романовской овцы и архара (12,5 % — архар, 87,5 % — романовская порода); III группу — гибриды F3 (HYB2) от скрещивания гибридов F2 романовской овцы и архара с баранами эдильбаевской породы (12,5 % — архар, 37,5 % — романовская порода, 50,0 % — эдильбаевская порода). Все животные получали комбинированный рацион, сбалансированный по нормам ВИЖ (31) для молодняка романовской породы, состоящий из силоса, сенажа, сена и концентратов.
Продолжительность исследований составила 28 сут. Предварительный период длился 21 сут, учетный — 7 сут. В отобранных образцах кормов, остатков кормов и кале определяли общую влажность, содержание сырого жира — по С.В. Рушковскому, сырого протеина — методом Кьельдаля, сырой клетчатки — по Геннебергу и Штоману. В пробах мочи оценивали количество азота. По результатам балансового опыта рассчитывали количество и коэффициенты переваримости питательных веществ и использования азота согласно общепринятым методикам (32).
За 1 ч до и через 3 ч после утреннего кормления отбирали пробы рубцового содержимого, а также крови.
В содержимом рубца определяли общее количество летучих жирных кислот методом паровой дистилляции в аппарате Маркгама, количество аммиачного азота — микродиффузным методом по Конвею, амилолитическую активность — фотометрическим методом, биомассу простейших и бактерий — дифференцированным осаждением (центрифуга Sigma 3-18, Германия) (33).
Клинический анализ крови с определением концентрации гемоглобина, содержания эритроцитов и лейкоцитов проводили на ветеринарном гематологическом анализаторе Micros ABC VET («HORIBA ABX Diagnostics, Inc.», Франция). Количество общего белка, альбуминов, глобулинов, мочевины, креатинина, глюкозы, холестерина, активность аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ) в сыворотке крови оценивали на автоматическом биохимическом анализаторе Chem Well 2902 (+) («Awareness Technology, Inc.», США) (34).
Статистическую обработку данных осуществляли по общепринятым методикам, используя программное обеспечение Microsoft Excel (35).
ных HYB1 и HYB2 (рис. 1). В этих группах анализируемый показатель до кормления был ниже, чем после его начала. Вo II группе (HYB1) масса симбиотической микрофлоры до кормления и после него была выше соответственно на 37,3 и 33,3 % (p < 0,05), в III группе (HYB2) — на 37,0 и 22,2 % по сравнению с контролем (ROM). Следует отметить, что увеличение микробиальной массы происходило главным образом за счет повышения количества бактерий. У животных HYB1 до и после кормления этот показатель возрастал соответственно на 62,6 (p < 0,05) и 48,3 % (p < 0,05), у HYB2 — соответственно на 46,3 (p < 0,05) и 28,0 % по сравнению с таковым у ROM. Наибольшая разница относительно контроля наблюдалась у гибридов HYB1. Повышение массы симбиотической микрофлоры приводило к увеличению переваримости питательных веществ, а также к лучшему использованию азота рубцовой микрофлорой.
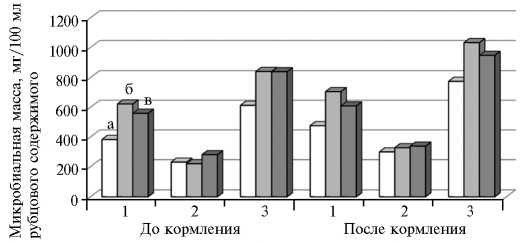
Рис. 1. Состав микробиальной биомассы в рубцовой жидкости у чистопородных романовских овец (а) , гибридов F 3 романовской овцы и архара ( Ovis ammon polii ) (б) , гибридов F 3 романовской овцы и архара с баранами эдильбаевской породы (в) до и после кормления: 1 — бактерии, 2 — простейшие, 3 — общее количество микроорганизмов (Всероссийский НИИ животноводства им. академика Л.К. Эрнста, Московская обл., 2014-2015 годы).

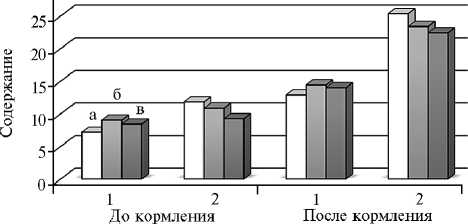
Рис. 2. Содержание летучих жирных кислот (ммоль/100 мл) (1) и азота аммиака (мг%) (2) в рубцовой жидкости у чистопородных романовских овец (а) , гибридов F 3 романовской овцы и архара ( Ovis ammon polii ) (б) , гибридов F 3 романовской овцы и архара с баранами эдильбаевской породы (в) до и после кормления (Всероссийский НИИ животноводства им. академика Л.К. Эрнста, Московская обл., 2014-2015 годы).
ЛЖК — высокоценный энергопластический материал, из которого синтезируются липопротеиды и углеродные скелеты почти всех аминокислот (37). В наших опытах общее количество ЛЖК в рубцовой жидкости возрастало после кормления у всех животных (рис. 2). У гибридных животных по сравнению с чистопородными романовскими овцами концентрация этих метаболитов была выше до и после кормления соответственно на 26,1 и 12,0 % (p < 0,05) во II группе HYB1 и на 17,5 (p < 0,05) и 8,7 % (p < 0,05) в III группе, что свидетельствовало о более интенсивном гидролизе углеводов.
Использование крахмала и других легкоусвояемых углеводов в рубце — необходимое условие поддержания нормальной жизнедеятельности микрофлоры. Амилолитическая активность рубцовой жидкости обеспечивается микроорганизмами, а также наличием свободной амилазы (38). В группах HYB1 и HYB2 этот показатель был выше соответственно на 14,0
(p < 0,05) и 10,3 % по сравнению с таковым у ROM.
Важную роль в превращениях питательных веществ в рубце играет аммиак — конечный продукт распада белковых и небелковых азотистых соединений корма. Часть аммиака всасывается в кровь из пищеварительного тракта, что представляет собой бесполезную потерю азота, поскольку лишь малая его часть возвращается в рубец со слюной и через рубцовую стенку, а б о льшая — выделяется из организма с мочой (39, 40). В наших исследованиях (см. рис. 2) отмечалось снижение концентрации азота аммиака в рубцовой жидкости у гибридных животных до (p < 0,05) и после кормления по сравнению с контролем, а также более низкое количество мочевины в сыворотке крови (табл.), что может свидетельствовать о более эффективном использовании азота протеина микрофлорой рубца.
Концентрация метаболитов белкового и углеводно-липидного обмена в крови у чистопородных романовских овец и их гибридов с архаром ( Ovis ammon polii ) и баранами эдильбаевской породы ( M ± m , Всероссийский НИИ животноводства им. академика Л.К. Эрнста, Московская обл., 2014-2015 годы)
|
Показатель |
Группа |
|||||
|
I ( n = 3) |
II ( n = 3) |
III ( n = 3) |
||||
|
до кормления |
после кормления |
до кормления |
после кормления |
до кормления |
после кормления |
|
|
Общий белок, г/л |
68,2±0,85 |
68,8±1,23 |
70,5±0,50* |
70,7±0,54 |
68,6±1,06 |
69,4±1,49 |
|
Мочевина, ммоль/л |
5,03±0,20 |
6,89±0,14 |
5,03±0,18 |
6,70±0,30 |
4,89±0,23 |
6,66±0,41 |
|
Креатинин, мкмоль/л |
61,40±3,05 |
66,92±1,30 |
76,90±3,60* |
78,11±0,70*** |
68,80±4,10 |
69,20±2,50 |
|
Альбумины, г/л |
28,9±0,26 |
30,4±0,34 |
30,9±0,70* |
32,5±0,43** |
29,9±0,63 |
31,5±0,46 |
|
Глобулины, г/л |
39,2±0,86 |
38,4±1,14 |
39,6±0,78 |
38,2±0,34 |
38,7±0,65 |
37,9±1,20 |
|
А/Г |
0,74±0,02 |
0,79±0,02 |
0,78±0,02 |
0,85±0,01 |
0,77±0,01 |
0,83±0,02 |
|
АлАТ, МЕ/л |
17,0±0,60 |
16,9±0,35 |
17,1±0,60 |
17,2±0,70 |
17,9±0,63 |
18,9±0,50* |
|
АсАТ, МЕ/л |
72,9±2,50 |
76,0±2,84 |
63,7±3,80 |
68,3±2,18 |
84,2±2,65* |
84,8±3,60 |
|
Глюкоза, ммоль/л |
4,56±0,07 |
4,85±0,08 |
4,83±0,09* |
4,99±0,10 |
5,45±0,09*** |
5,63±0,04*** |
|
Холестерин, ммоль/л |
1,64±0,04 |
1,54±0,04 |
1,44±0,04* |
1,32±0,03** |
1,37±0,04** |
1,37±0,03* |
П р и м еч а ни е. I группа — валухи романовской породы, II группа — гибриды F3 от скрещивания романовских маток с гибридом F2 романовской овцы и архара (12,5 % — архар, 87,5 % — романовская порода); III группа — гибриды F3 от скрещивания гибридов F2 романовской овцы и архара с баранами эдильбаевской породы (12,5 % — архар, 37,5 % — романовская порода, 50,0 % — эдильбаевская порода). Кровь для анализа брали за 1 ч до кормления и через 3 ч после кормления, А/Г — альбумино-глобу-линовый коэффициент, АлАТ — аланинаминотрансфераза, АсАТ — аспартатаминотрансфераза.
*, **, *** Различия с контролем (I группа) достоверны соответственно при p < 0,05, p < 0,01, p < 0,001.
Изменение направленности процессов преджелудочного пищеварения у животных в зависимости от происхождения сказывалось на переваривании разных питательных веществ корма. У HYB1 коэффициенты переваримости сухого вещества, органического вещества, сырого протеина, сырого жира, сырой клетчатки и безазотистых экстрактивных веществ были соответственно на 7,8; 5,3; 6,9; 3,8 (p < 0,05); 6,5 (p < 0,05) и 4,5 % выше по сравнению с таковыми у ROM. У HYB2 также отмечался рост этих показателей относительно контроля.
Исследованные нами группы характеризовались различиями в использовании питательных веществ рациона. Количество и процент переваренного и отложенного в теле азота у гибридных животных были выше, несмотря на некоторое увеличение его содержания в кале (III группа) и моче (II группа). Коэффициент использования азота в группе ROM (контроль) составил 27,9 %, что было на 8,9 и 8,5 % меньше, чем у животных HYB1 и HYB2. В крови у гибридных животных концентрация общего белка также повышалась, мочевины — снижалась, альбумино-глобулиновый коэффициент возрастал (см. табл.), что может свидетельствовать о более интенсивном белковом обмене.
У гибридных животных по сравнению с ROM достоверно увеличивалось содержание глюкозы в крови (см. табл.), что подтверждало факт более интенсивного поступления микробной биомассы из сложного же-504
0,22 (p < 0,05, p < 0,01) и 0,17-0,27 ммоль/л (p < 0,05, p < 0,01).
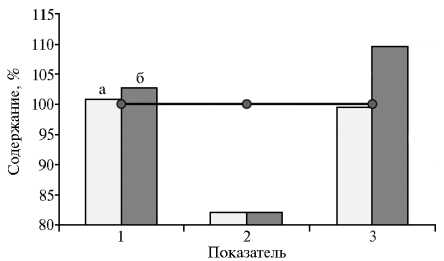
Рис. 3. Содержание (%) эритроцитов (1) , лейкоцитов (2) и гемоглобина (3) в крови у чистопородных романовских овец (график) , гибридов F 3 романовской овцы и архара ( Ovis ammon polii ) (а) , гибридов F 3 романовской овцы и архара с баранами эдильбаевской породы (б) после кормления (Всероссийский НИИ животноводства им. академика Л.К. Эрнста, Московская обл., 2014-2015 годы).
Азотистый обмен у животных HYB1 по сравнению с ROM характеризовался следующими особенностями: отмечалось некоторое увеличение количества общего белка (p < 0,05), альбуминов (p < 0,05, p < 0,01), уменьшение концентрации мочевины после кормления, повышение альбуми-но-глобулинового коэффициента. В крови животных HYB2 происходило снижение концентрации мочевины, а также некоторое повышение содержания альбуминов, значения альбумино-глобулинового коэффициента были выше, чем у романовских овец. Количе- ство креатинина (донора фосфорного остатка для АДФ, восстановление которого до АТФ повышает энергетический потенциал клеток) оказалось существенно больше у гибридных животных по сравнению с чистопород- ными. Значение этого показателя до и после кормления во II группе превысило контроль на 25,2 (p < 0,05) и 16,7 % (p < 0,001), в III группе — соответственно на 12,0 и 3,4 %.
В крови у гибридных животных отмечалось более высокое содержание эритроцитов (на 0,8-2,9 %) при снижении числа лейкоцитов на 21,8 % (p < 0,05) (рис. 3). У гибридов из III группы по сравнению с чистопородными аналогами количество гемоглобина также было повышено (на 9,6 %) (p < 0,01). Эти результаты косвенно отражают тот факт, что гибридизация оказала в целом благоприятное влияние на общее физиологи- ческое состояние животных.
Таким образом, у полученных гибридов домашней овцы и архара разной кровности (12,5 % — архар, 87,5 % — романовская порода; 12,5 % — архар, 37,5 % — романовская порода, 50,0 % — эдильбаевская порода) по сравнению с чистопородной романовской овцой возрастает интенсивность преджелудочного пищеварения, что выражается в повышении массы симбиотической микрофлоры, концентрации летучих жирных кислот и амилолитической активности в содержимом рубца. Как следствие, переваримость, использование питательных веществ, направленность белкового и углеводно-липидного обмена у гибридов и чистопородных аналогов также различаются. Учет выявленных особенностей и физиологических потребностей новых селекционных форм необходим для разработки норм и систем кормления, позволяющих эффективно реализовать их генетический потенциал продуктивности.
Список литературы Биологические параметры пищеварительных и обменных процессов у межвидовых гибридов домашней овцы (Ovis aries) и архара (Ovis ammon polii)
- Эрнст Л.К., Зиновьева Н.А. Биологические проблемы животноводства в XXI веке. М., 2008.
- Багиров В.А., Эрнст Л.К., Насибов Ш.Н., Кленовицкий П.М., Иолчиев Б.С., Зиновьева Н.А. Сохранение биоразнообразия животного мира и использование отдаленной гибридизации в животноводстве. Достижения науки и техники АПК, 2009, 7: 54-56.
- Насибов Ш.Н., Багиров В.А., Кленовицкий П.М., Иолчиев Б.С., Зиновьева Н.А., Воеводин В.А., Амиршоев Ф.С. Генетический потенциал дикой фауны в создании новых селекционных форм животных. Достижения науки и техники АПК, 2010, 8: 59-62.
- Рокицкий П.Ф., Васина-Попова Е.Т. Развитие генетики сельскохозяйственных животных в СССР: Историко-биологические исследования. Вып. 6. М., 1978.
- Мантейфель П.А. Реконструкция фауны и одомашнивание новых видов животных. М., 1934.
- Насимович А.А. Некоторые общие вопросы и итоги акклиматизации наземных животных. Зоологический журнал, 1961, 40(7): 957-970.
- Шайдуллин И.Н. Гибриды плодовиты. Овцеводство, 1992, 3: 18-21.
- Рубайлова Н.Г. Отдаленная гибридизация домашних животных. М., 1965.
- Гигинейшвили Н.С. Гибридизация серых каракульских овец с диким бараном. В кн.: Отдаленная гибридизация растений и животных. М., 1960.
- Доклад комиссии по генетическим ресурсам для производства продовольствия и ведения сельского хозяйства (CGRFA-15/15/Report). FAO: Пятнадцатая очередная сессия. Рим, 2015.
- Munn A.J., Dawson T.J., McLeod S.R., Dennis T., Maloney S.K. Energy, water and space use by free-living red kangaroos Macropus rufus and domestic sheep Ovis aries in an Australian rangeland. Comparative Physiology, 2013, 183(6): 843-858 ( ) DOI: 10.1007/s00360-013-0741-8
- Charismiadou M.A., Bizelis J.A., Rogdakis E. Metabolic changes during the perinatal period in dairy sheep in relation to level of nutrition and breed. I. Late pregnancy. J. Anim. Physiol. Anim. Nutr., 2000, 84(3-4): 61-72 ( ) DOI: 10.1046/j.1439-0396.2000.00282.x
- Malau-Aduli A.E.O., Siebert B.D., Bottema C.D.K., Pitchford W.S. Heterosis, sex and breed differences in the fatty acid composition of muscle phospholipids in beef cattle. J. Anim. Physiol. Anim. Nutr., 2000, 83(3): 113-120 ( ) DOI: 10.1046/j.1439-0396.2000.00255.x
- Багиров В.А., Кленовицкий П.М., Иолчиев Б.С., Зиновьева Н.А., Калашников В.В., Шило О.В., Солошенко В.А., Насибов Ш.Н., Кононов В.П., Колесников А.В. Цитогенетическая характеристика архара Ovis ammon ammon, снежного барана O. nivicola borealis и их гибридов. Сельскохозяйственная биология, 2012, 6: 43-48 ( , 10.15389/agrobiology.2012.6.43eng) DOI: 10.15389/agrobiology.2012.6.43rus
- Арсеньев Д.Д., Лобков В.Ю. Проблемы и перспективы развития романовского овцеводства. Вестник АПК Верхневолжья, 2013, 3: 27-32.
- Данилкин А.А. Млекопитающие России и сопредельных регионов. Полорогие (Bovidae). М., 2005.
- Meza-Herrera C.A., Serradilla J.M., Muñoz-Mejías M.E., Baena-Manzano F., Menendez-Buxadera A. Effect of breed and some environmental factors on body weights till weaning and litter size in five goat breeds in Mexico. Small Ruminant Res., 2014, 121(2-3): 215-219 ( ) DOI: 10.1016/j.smallrumres.2014.07.006
- Lourenço A.L., Dias-da-Silva A., Santos A.S., Rodrigues M.A.M., Cone J.W., Ferreira L.M.M. Comparative digestibility of low-quality grass hay by two breeds of cattle differing in mature live weight. J. Anim. Physiol. Anim. Nutr., 2013, 98(3): 453-457 ( ) DOI: 10.1111/jpn.12090
- Zishiri O.T., Cloete S.W.P., Olivier J.J., Dzama K. Genetic parameters for growth, reproduction and fitness traits in the South African Dorper sheep breed. Small Ruminant Res., 2013, 112(1-3): 39-48 ( ) DOI: 10.1016/j.smallrumres.2013.01.004
- Jetana T., Tasripoo K., Vongpipatana C., Kitsamra S., Sophon S. The comparative study digestion and metabolism of nitrogen and purine derivatives in male, Thai, Swamp buffalo and Thai, Brahman cattle. Anim. Sci. J., 2009, 80(2): 130-139 ( ) DOI: 10.1111/j.1740-0929.2008.00618.x
- Sales J., Jančík F., Homolka P. Quantifying differences in total tract nutrient digestibilities between goats and sheep. J. Anim. Physiol. Anim. Nutr., 2007, 96(4): 660-670 ( ) DOI: 10.1111/j.1439-0396.2011.01194.x
- Clauss M., Hofmann R.R., Streich W.J., Fickel J., Hummel J. Convergence in the macroscopic anatomy of the reticulum in wild ruminant species of different feeding types and a new resulting hypothesis on reticular function. J. Zool., 2010, 281(1): 26-38 ( ) DOI: 10.1111/j.1469-7998.2009.00675.x
- Henderson G., Cox F., Ganesh S., Jonker A., Young W., Janssen P.H. Rumen microbial community composition varies with diet and host, but a core microbiome is found across a wide geographical range. Scientific Reports, 2015, 5, Article number: 14567 ( ) DOI: 10.1038/srep14567
- Lourenço A.L., Cone J.W., Fontes P., Dias-da-Silva A.A. Effects of ambient temperature and soybean meal supplementation on intake and digestion of two sheep breeds differing in mature size. J. Anim. Physiol. Anim. Nutr., 2010, 94(5): 571-583 ( ) DOI: 10.1111/j.1439-0396.2009.00942.x
- Karasov W.H., Douglas A.E. Comparative digestive physiology. Compr. Physiol., 2013, 3: 741-783 ( ) DOI: 10.1002/cphy.c110054
- Claussm M., Hummel J. The digestive performance of mammalian herbivores: why big may not be that much better. Mammal Rev., 2005, 35: 174-187 ( ) DOI: 10.1111/j.1365-2907.2005.00062.x
- Aikman P.C., Reynolds C.K., Beever D.E. Diet digestibility, rate of passage, and eating and rumination behavior of jersey and Holstein cows. J. Dairy Sci., 2008, 91: 1103-1114 ( ) DOI: 10.3168/jds.2007-0724
- Rihawi S., Iñiguez L., Knaus W.F., Zaklouta M., Wurzinger M., Soelkner J., Larbi A., Bomfim M.A.D. Fattening performance of lambs of different Awassi genotypes, fed under cost-reducing diets and contrasting housing conditions. Small Ruminant Res., 2010, 94(1-3): 38-44 ( ) DOI: 10.1016/j.smallrumres.2010.06.007
- Özcan M., Demirel G., Yakan A., Ekiz B., Tölü C., Sav T. Genotype, production system and sex effects on fatty acid composition of meat from goat kids. Anim. Sci. J., 2015, 86(2): 200-206 ( ) DOI: 10.1111/asj.12273
- Харитонов Е.Л. Методические и инструментальные подходы к изучению физиологических и биохимических процессов образования конечных продуктов переваривания у продуктивных жвачных животных. Проблемы биологии продуктивных животных, 2008, 4: 42-71.
- Нормы и рационы кормления сельскохозяйственных животных: Справочное пособие/Под ред. А.П. Калашникова, В.И. Фисинина, В.В. Щеглова, Н.И. Клейменова. М., 2003.
- Овсянников А.И. Основы опытного дела в животноводстве. М., 1976.
- Изучение пищеварения у жвачных: Методические рекомендации/Под ред. Н.В. Курилова. Боровск, 1987.
- Методы ветеринарной клинической лабораторной диагностики: Справочник/Под. ред. И.П. Кондрахина. М., 2004.
- Меркурьева Е.К. Биометрия в селекции и генетике сельскохозяйственных животных. М., 1979.
- Niwińska B. Digestion in ruminants. In: Carbohydrates -comprehensive studies on glycobiology and glycotechnology/Chuan-Fa Chang (ed.). InTech d.o.o., Croatia, 2016 ( ) DOI: 10.5772/51574
- Elsden S.R., Hitchcock M.W.S., Marshall R.A., Phillipson A.T. Volatile acid in the digesta of ruminants and other animals. Experimental Biology, 1946, 22: 191-202.
- Van Vuuren A.M., Hindle V.A., Klop A., Cone J.W. Effect of maize starch concentration in the diet on starch and cell wall digestion in the dairy cow. J. Anim. Physiol. Anim. Nutr., 2010, 94: 319-329 ( ) DOI: 10.1111/j.1439-0396.2008.00911.x
- Recavarren M.I., Milano G.D. The rate and pattern of urea infusion into the rumen of wethers alters nitrogen balance and plasma ammonia. J. Anim. Physiol. Anim. Nutr., 2014, 98(6): 1047-1053 ( ) DOI: 10.1111/jpn.12168
- Rius A.G., Kittelmann S., Macdonald K.A., Waghorn G.C., Janssen P.H., Sikkema E. Nitrogen metabolism and rumen microbial enumeration in lactating cows with divergent residual feed intake fed high-digestibility pasture. J. Dairy Sci., 2012, 95: 5024-5034 ( ) DOI: 10.3168/jds.2012-5392


