Биологические подтипы опухоли как основа адьювантного лечения рака молочной железы у мужчин
Автор: Николаев К.С., Семиглазов В.Ф., Иванов В.Г., Жильцова Е.К., Иванова О.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Фундаментальная онкология и экспериментальная медицина
Статья в выпуске: 1 (17), 2016 года.
Бесплатный доступ
Открытие, а в последующем изучение биологических подтипов рака молочной железы (РМЖ) у женщин, позволило оптимизировать лечебную тактику адьювантной терапии. Однако изучению биологических подтипов рака молочной железы у мужчин, в связи с незначительным количеством случаев, посвящены единичные работы. Поэтому лечение рака молочной железы у мужчин в целом основано на тех исследованиях, которые были достигнуты при изучении рака молочной железы у женщин. По аналогии с молекулярными подтипами рака молочной железы у женщин, определение подтипов рака молочной железы у мужчин должно иметь важное значение в назначении адьювантного лечения. На сегодняшний день существует ограниченное число исследований молекулярных подтипов рака молочной железы у мужчин. В представленной работе проанализированы 84 случая РМЖ у мужчин, пролеченных в НИИ онкологии им. Н. Н. Петрова и Городском клиническом онкологическом диспансере в период с 2000 г. по 2014 г. Анализ данных показал, что имеются значительные различия в молекулярных подтипах рака молочной железы у женщин и мужчин. В частности, у мужчин максимальный удельный вес приходился на люминальный А подтип, составляя 54%. Не было зарегистрировано ни одного случая HER2-сверхэкспрессирующего РМЖ, а использование химиотерапии при люминальном А подтипе заболевания не имеет преимущества перед адъювантной эндокринотерапией. При всех остальных подтипах РМЖ, которые были объединены нами в группу «Нелюминальный А рак», больные, получавшие химиотерапию с последующей гормонотерапией, имели более высокие показатели 5-летней общей выживаемости, чем больные, получавшие только эндокринотерапию.
Рак молочной железы у мужчин, биологический подтип, адъювантное лечение
Короткий адрес: https://sciup.org/140222636
IDR: 140222636
Текст научной статьи Биологические подтипы опухоли как основа адьювантного лечения рака молочной железы у мужчин
Рак молочной железы у мужчин является редким заболеванием, составляющим примерно 0,1% всех злокачественных опухолей у мужчин и менее 1% от числа всех опухолей молочной железы [1–3]. Увеличение частоты РМЖ у мужчин стал причиной поиска новых возможностей лечения и диагностики этого заболевания [4]. На сегодняшний день в литературе недостаточно информации о проводимых клинических и эпидемиологических исследованиях РМЖ у мужчин, нет данных об особенностях РМЖ у мужчин, отличающих его от РМЖ у женщин, однако понимание этих особенностей крайне необходимо. РМЖ у мужчин чаще диагностируется в запущенных стадиях, что предопределяет перспективы общей и безрецидивной выживаемости. Иммуногистохимическое (ИГХ) исследование у мужчин показывает, что опухоль чаще экспрессирует рецепторы эстрогенов (РЭ) и прогестерона (РП) и имеет различное клеточное происхождение [5, 6].
Знание о ИГХ свойствах РМЖ у мужчин является основой для назначения эндокринотерапии, которая по данным ряда авторов является наиболее оптимальным адьювант-ным лечением при положительном статусе гормональных рецепторов.
В 2000 году Perou с соавторами на основе кластерного анализа генной экспрессии разделили рак молочной железы на 5 подтипов: люминальный А, люминальный В,
HER2-сверхэкспрессирующий, низкоклаудиновый и базально-подобный [7]. Однако в рутинной клинической практике выделение подтипов с помощью профилирования генной экспрессии в настоящее время трудно осуществимо из-за высокой стоимости исследования, поэтому в настоящее время используется иммуногистохимический метод определения молекулярных подтипов, признанный в рекомендациях NCCN и панелью экспертов St. Gallen [8, 9].
В нашей работе в качестве заменителей ДНК микрочипов при определении подтипов рака молочной железы мы также руководствовались иммуногистохимической оценкой определения рецепторов эстрогенов (РЭ), прогестерона (РП), HER2-neu и Ki-67. Совокупность данных позволила распределить всех больных на следующие биологические подтипы РМЖ: Люминальный А, Люминальный В (HER2-негативный), Люминальный В (HER2-позитив-ный), HER2 – сверхэкспрессирующий и трижды-негатив-ный. Несмотря на различие в трактовках уровня маркера пролиферации Ki-67 мы использовали данные нашей лаборатории: показатель выше 20% оценивался как высокий, ниже 20% – как низкий. Однако, если достоверная оценка индекса Ki-67 недоступна, можно использовать степень гистологической злокачественности (G) как альтернативу оценке индекса пролиферации.
В многоцентровых международных клинических исследованиях было показано, что при раке молочной железы у женщин молекулярные подтипы имеют важное прогностическое значение. Известно, что данные о биологических подтипах хорошо коррелировали с клиническими исходами по показателю общей и безрецидивной выживаемости. Наиболее неблагоприятный результат наблюдался при HER2-сверхэкспрессирующем и базально-подобном подтипах рака молочной железы [10, 11]. В тех случаях, когда опухоль обладала высокой степенью злокачественности, высокой пролиферативной активностью (Ki67>20%), отсутствием РЭ и РП и высокой экспрессией HER2-neu, отмечалось значительное снижение показателей общей и безрецидивной выживаемости. Несмотря на успехи в диагностике и лечении рака молочной железы у женщин, понимание и стратегия лечения рака молочной железы у мужчин ограничены и, в общем, экстраполированы из имеющихся знаний о раке молочной железы у женщин. В частности, существует лишь небольшое число исследований по изучению молекулярных подтипов рака молочной железы у мужчин.
Таким образом, остается актуальным дальнейшее углубленное изучение особенностей диагностики, а также клинического течения прогноза и чувствительности к отдельным видам системного лечения различных биологических подтипов РМЖ у мужчин.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 84 случая РМЖ у мужчин, пролеченных в НИИ онкологии им. Н. Н. Петрова и Городском клиническом онкологическом диспансере в период с 2000 г. по 2014 г.
Всем больным выполнялось ИГХ исследование операционного материала. Экспрессия рецепторов стероидных гормонов оценивалась полуколичественным методом при помощи Allred scoring system (подсчету подвергалась только ядерная реакция). Результат представлялся в виде суммы двух величин: интенсивность окрашивания опухолевых клеток (0 – отсутствует, 1 – слабая, 2 – умеренная, 3 – выраженная) и количество позитивных опухолевых клеток (0 – окрашивания нет; 1 – при окрашивании менее 1% опухолевых клеток; 2 – при окрашивании 1–10% опухолевых клеток; 3 – при окрашивании 11–33%; 4 – при окрашивании 34–66%; 5 – при окрашивании 67–100% опухолевых клеток).
ИГХ определение экспрессии HER2/neu учитывало экспрессию только в инвазивном компоненте опухоли. Оценка результатов реакции проводилась с помощью балльной шкалы оценки – 0, 1+, 2+, 3+, разработанной производителем теста. 0 – полное отсутствие продукта реакции или выявление его на мембранах менее 10% опухолевых клеток;
-
1+ – слабое прерывистое мембранное окрашивание части мембраны более 10% опухолевых клеток;
-
2+ – умеренное количество продукта реакции на мембранах более чем 10% опухолевых клеток;
-
3+ – наличие ярко выраженного продукта реакции на протяжении всей мембраны клетки при окрашивании более 30% опухолевых клеток.
Экспрессия HER2/neu считалась положительной при иммуногистохимическом значении, равном 3+. При получении промежуточного результата, равного 2+, всем больным выполнялась флуоресцентная гибридизация in situ (FISH). Оценка наличия амплификации гена HER2/neu проводилась путем подсчета сигналов, которыми помечен центромерный участок 17 хромосомы, и сигналов, метящих ген HER/neu. Соотношение данных сигналов больше 2 свидетельствовала о наличии амплификации.
Гистологическая степень злокачественности определялась по Bloom Richardson в модификации по Ellis-Elston. Согласно данной классификации оценивали 3 признака:
-
1. формирование трубочек;
-
2. ядерный полиморфизм;
-
3. число митозов.
Формирование трубочек отражает способность опухоли образовывать типичные протоковые структуры. Полиморфизм ядер является признаком нарушения клеточного деления. Число митозов определялось в 10 полях зрения. Каждый из этих параметров оценивался в баллах от 1 до 3.
Степень гистологической злокачественности (G) определялся по сумме баллов.
I степень (низкая) – 3–5 баллов;
II степень (умеренная) – 6–7 баллов;
-
III степень (высокая) – 8–9 баллов.
Выделение различных биологических подтипов РМЖ осуществлялось согласно следующим критериям:
-
1. Люминальный А: положительный статус рецепторов эстрогенов (РЭ) (по Allred) и прогестерона (РП) (≥ 6 по Allred), экспрессия HER2/neu менее 0–1+, низкая (G1) степень злокачественности.
-
2. Люминальный В (HER2 – отрицательный): положительный статус рецепторов эстрогенов (РЭ) (по Allred) и/или прогестерона (РП) (≤ 5 по Allred), умеренная (G2) и высокая степень гистологической злокачественности (G3).
-
2. Люминальный В (HER2 – положительный): положительный статус рецепторов эстрогенов (РЭ) и/или прогестерона (РП), гиперэкспрессия HER2 (3+).
-
3. HER2 – сверхэкспрессирующий РМЖ: гиперэкспрессия HER2/neu (3+) или амплификация HER (FISH), отсутствие экспрессии рецепторов стероидных гормонов.
-
4. Трижды-негативный РМЖ: отсутствие экспрессии рецепторов стероидных гормонов (РЭ, РП), отсутствие экспрессии HER2/neu (<2+).
Из всех больных, включенных в исследование:
– 11 больным (13,1%) адъювантное лечение не проводилось;
– 17 больных (20,2%) получили только адъювантную химиотерапию: из них 4 – безантрациклиновую (CMF или циклофосфан в монорежиме), 13 больных получали антрациклин-содержащую химиотерапию (FAC, AC).
– 29 больным (34,5%) была назначена адъювантная эндо-кринотерапия. При этом подавляющее число больных 27 (93%) получали эндокринотерапию тамоксифеном и только 2 (7%) больных – ингибиторы ароматазы.
– 27 больных (32,1%) получали комбинированное лечение: химиогормонотерапию.
РЕЗУЛЬТАТЫ
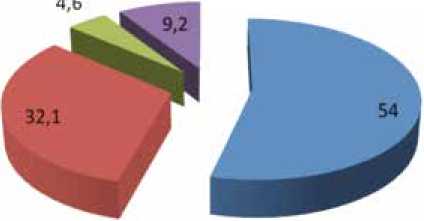
Распределение больных по биологическим (ИГХ) подтипам РМЖ было следующим (рис.1):
Люминальный А – 47 (54%);
Люминальный В (HER2-neu-отрицательный) – 28 (32,1%);
Люминальный-В (HER2-neu–положительный) – 4 (4,6%);
Трижды-негативный – 8 (9,2%).
В таблице 1 представлены основные характеристики биологических подтипов опухолей. Следует отметить, что
Люминальный А
Люминальный В (HER2-neu-отрицательный) – 28 (32,1%)
Люминальный-В (HER2-neu–положительный) – 4 (4,6%)
Трижды-негативный – 8 (9,2%)
Рис. 1. Распределение больных по биологическим (ИГХ) подтипам опухоли в одном случае люминального А РМЖ больному не выполнялась подмышечная лимфаденэктомия, поэтому в анализ патоморфологических характеристик было включено 46 случаев люминальных А опухолей.
Большинству больных люминальным А РМЖ назначалась только адъювантная эндокринотерапия (46,8% больных), тогда как при люминальном В (HER2–отрицательном) РМЖ чаще назначалась химиотерапия с последующей адъювантной эндокринотерапией (35,7%) (табл. 2).
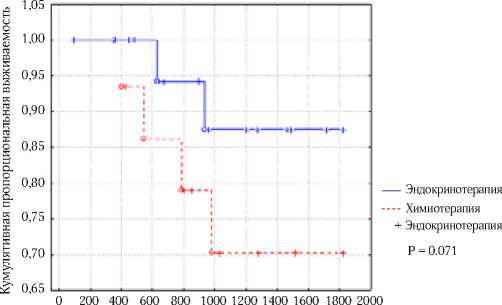
При сравнении показателей 5-летней общей выживаемости больных люминальным А РМЖ, получавших адъю- вантную эндокринотерапию, и больных, которым сначала проводилась адъювантная химиотерапия, затем эндокри-нотерапия безотносительно стадии, статистически значимых отличий не получено (88% против 69%, соответственно, p=0.071) [рис.2]. Однако отмечается тенденция к улучшению показателей 5-летней общей выживаемости в группе больных, получавших только эндокринотерапию. Показатели 5-летней безрецидивной выживаемости в обеих группах (химиогормонотерапии и гормонотерапии) были схожие (84% и 88% соответственно, р>0.5).
|
Таблица 1. Клинические и патоморфологические характеристики различных биологических подтипов РМЖ |
||||
|
Клиническая стадия заболевания |
Люминальный А |
Люминальный В (HER2-отриц.) |
Люминальный В (HER2-пол.) |
Трижды-негативный |
|
n=46 |
n=28 |
n=4 |
n=8 |
|
|
I |
4 (8,7%) |
3 (10,7%) |
0 |
0 |
|
II |
25 (54,3%) |
8(28,6%) |
0 |
4 (50%) |
|
III |
16 (34,8%) |
15 (53,6%) |
4 (100%) |
2 (25%) |
|
IV |
1 (2,1%) |
2 (7,1%) |
0 |
2 (25%) |
|
Статус лимфоузлов |
||||
|
pN0 |
22 (47,8%) |
4 (14,3%) |
0 |
3 (37,5%) |
|
pN+ |
24 (51,1%) |
24 (85,7%) |
4 (100%) |
5 (62,5%) |
Таблица 2. Адъювантное лечение различных биологических подтипов РМЖ
|
Люминальный А |
Люминальный В (HER2-отр.) |
Люминальный В (HER2-пол.) |
Трижды-негативный |
|
|
N |
47 |
28 |
4 |
8 |
|
Наблюдение |
4 (8,5%) |
5 (17,9%) |
0 |
2 (25%) |
|
Только химиотерапия |
6 (12,8%) |
7 (25%) |
1 (25%) |
6 (75%) |
|
Только эндокриноте-рапия |
22 (46,8%) |
6 (21,4%) |
2 (50%) |
0 |
|
Химиотерапия и эндокринотерапия |
15 (31,9%) |
10 (35,7%) |
1 (25%) |
0 |
|
Лучевая терапия |
26 (55,3%) |
18 (64,3%) |
2 (50%) |
4 (50%) |
5-летняя общая выживаемость (Kaplan-Meier)
о Complete + Censored
Время, дни
Рис. 2. 5-летняя общая выживаемость больных люминальным А РМЖ в зависимости от вида адъювантного лечения (p=0.071)
Таким образом, адъювантная химиотерапия не улучшает показатели безрецидивной выживаемости у больных люминальным А подтипом РМЖ безотносительно стадии (рис. 3), и больным с таким биологическим подтипом опухоли целесообразно назначать адъювантную эндо-кринотерапию, поскольку дополнительная цитотоксическая химиотерапия не улучшает отдаленных результатов лечения.
Анализ 5-летней общей выживаемости больных нелюминальным А РМЖ продемонстрировал, что последовательное назначение химиогормонотерапии имеет лучшие показатели по сравнению с назначением только гормонотерапии (87% и 32% соответственно, p<0.05) (рис.4).
В тоже время 5-летняя безрецидивная выживаемость в этих группах не отличалась.
Дополнительные преимущества от проведения химиогормонотерапии по сравнению с адьювантной гормонотерапией были отмечены в группе больных с метастазами в лимфоузлах (87% и 19% соответственно, р=0.04). В тоже
5-летняя безрецидивная выживаемость больным люминальным подтипом А (Kaplan-Meier) о Complete + Censored
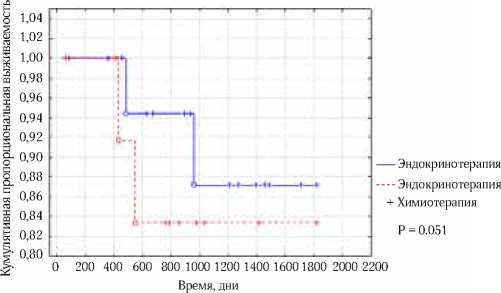
Рис. 3. 5-летняя безрецидивная выживаемость больных люминальным А РМЖ в зависимости от вида адъювантного лечения
(p=0.51)
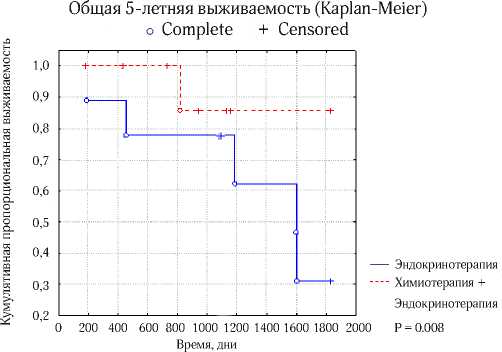
Рис. 4. 5-летняя общая выживаемость больных нелюминальным А РМЖ в зависимости от вида адъювантного лечения (p=0.008)
Общая 5-летняя выживаемость больных нелюминальным А
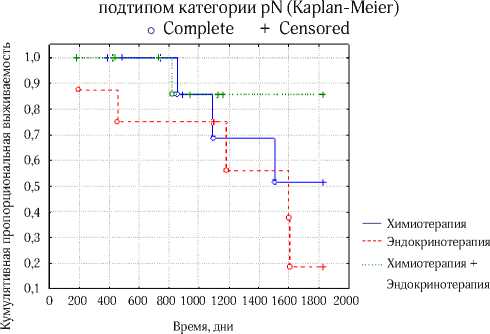
Рис. 5. 5-летняя общая выживаемость больных нелюминальным А РМЖ с метастазами в регионарных лимфатических узлах в зависимости от вида адъювантного лечения (p=0.3)
время проведение только химиотерапии также имело преимущества перед одной гормонотерапией и показало тенденцию к лучшей 5-летней выживаемости (51% и 19% соответственно, p=0.06) (рис. 5).
ЗАКЛЮЧЕНИЕ
Рак молочной железы у мужчин относится к редким формам опухоли. По сравнению с аналогичной патологией у женщин, рак молочной железы у мужчин встречается в 100 раз реже, что определяет нередко запоздалую диагностику и неудовлетворительные результаты лечения [12, 13]. Редкость заболевания не позволяет проводить проспективные рандомизированные клинические исследования, поэтому основные данные собираются ретроспективно в разных клинических центрах и стационарах, а лечение назначается по аналогии с лечебной тактикой у женщин.
Однако все больше данных свидетельствуют о принципиальных различиях в свойствах опухоли у мужчин и женщин. В отличие от рака молочной железы у женщин, у мужчин опухоль является гормон-позитивной и почти в 90% случаев экспрессирует рецепторы эстрогенов и в 81% – рецепторы прогестерона [4]. Значительно реже встречаются HER2-neu позитивные опухоли [14], поэтому назначение адьювантной химиотерапии может быть продиктовано только выраженным местно-распространенным процессом, при котором повышена вероятность развития местного рецидива и отдаленных метастазов. В адьювантном периоде основной упор необходимо делать на гормонотерапию, причем эффективность ингибиторов ароматазы по сравнению с тамоксифеном не подтверждена [15, 16].
В нашем исследовании было показано, что максимальный удельный вес приходится на люминальный А подтип, составляя 54% от всех видов. Не было зарегистрировано ни одного случая HER2-neu экспрессирующего РМЖ.
По аналогии с важным значением молекулярных подтипов рака молочной железы у женщин мы считаем, что необходима дальнейшая работа по сбору данных о молекулярных подтипах рака молочной железы у мужчин. На сегодняшний день, к сожалению, существует лишь небольшое число исследований, посвященных этой теме. Однако именно знание молекулярных подтипов поможет назначить адекватное лечение избежав ненужного назначения химиотерапии.
Полученные в нашей работе данные продемонстрировали, что назначение в адьювантном режиме химиотерапии у больных с люминальным А подтипом не оказывало влияние на улучшение общей и безрецидивной выживаемости по сравнению с гормонотерапией, в то же время назначе- ние комбинированного химиогормонального лечения при всех остальных подтипах РМЖ («нелюминальный А») улучшало показатели 5-летней общей выживаемости по сравнению с больными, получавшими только эндокринотерапию, однако при оценке 5-летней безрецидивной выживаемости в данных группах достоверных отличий получено не было (р=0.36).
Анализ общей выживаемости в зависимости от наличия метастазов в регионарные лимфатические узлы безотносительно биологического подтипа опухоли показал
высокую эффективность комбинированного лечения (химиотерапия + гормонотерапия) по сравнению с эндокри-нотерапией.
Внутригрупповой анализ общей выживаемости у больных нелюминальным А РМЖ с метастазами в подмышечных лимфатических узлах также продемонстрировал более высокие показатели при назначении комбинированного лечения по сравнению монолечением (только химиотерапия или только гормонотерапия).
Список литературы Биологические подтипы опухоли как основа адьювантного лечения рака молочной железы у мужчин
- Аксель Е. М. Злокачественные новообразования молочной железы: состояние онкологической помощи, заболеваемость и смертность.//Маммология. -2006. -№ 1. -c. 9.
- Мерабишвили В. М. Выживаемость онкологических больных. Выпуск второй. Часть 1. // СПб. - 2011. - 350 с. Merabishvili V.M. The survival rate of cancer patients. Second Edition. Part 1. // SPb. - 2011. - 350 p.
- Мерабишвили В. М. Онкологическая статистика. Руководство для врачей. Часть II. -СПб.-2011. -248 с. Merabishvili V.M. Cancer statistics. Guide for physicians. Part II. -SPb. -2011. -248 p.
- Giordano S.H., Cohen D.S., Buzdar A.U. et al. Breast carcinoma in men: a population-based study. Cancer 2004; 101: 51-57.
- Anderson W.F., Jatoi I., Tse J., Rosenberg P.S. Male breast cancer: a population-based comparison with female breast cancer. J Clin Oncol 2010; Vol. 28: pp. 232-9.
- Donegan W.L., Redlich P.N., Lang P.J., Gall M.T. Carcinoma of the breast in males: a multiinstitutional survey. Cancer 1998; Vol.83: pp.498-509.
- Perou C.M., Sorlie T., Eisen M.B., van de Rijn M., Jeffrey S.S., Rees C.A., et al. Molecular portraits of human breast tumours. Nature 2000; Vol. 406: pp. 747-52.
- Jönsson G., Staaf J., Vallon-Christersson J., Ringner M., Holm K., Hegardt C., et al. Genomic subtypes of breast cancer identified by array comparative genomic hybridization display distinct molecular and clinical characteristics. Breast Cancer Res 2010; Vol. 12: p. R42.
- Speirs V, Ball G, Male Breast Cancer Consortium. Male versus female breast cancer: a comparative study of 523 matched cases reveals differences behind similarity. Breast Cancer Res 2010; Vol.12(Suppl.1): p.01.
- Sorlie T, Perou CM, Tibshirani R, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci USA 2001; Vol. 98: pp. 10869-74.
- Sotiriou C., Neo S.Y., McShane L.M., Korn E.L., Long P.M., Jazaeri A., Martiat P., Fox S.B., Harris A.L., Liu E.T.: Breast cancer classification and prognosis based on gene expression profiles from a population-based study. Proc Natl Acad Sci USA 2003; Vol. 100: pp. 10393-10398.
- Семиглазов В. Ф., Семиглазов В. В., Дашян Г. А., Палтуев Р. М., Мигманова Н. Ш., Щедрин Д. Е., Гречухина И. А., Бессонов А. А., Пеньков К. Д., Мерабишвили В. М. Рак молочной железы у мужчин.//Фарматека. -2010. -№ 6. -Т. 200. -с. 40-45.
- Семиглазов В. Ф., Семиглазов В. В., Клецель А. Е. Рак молочной железы у мужчин.//Неинвазивные и инвазивные опухоли молочной железы. СПб. -2006. -с. 288-299.
- Bloom KJ, Govil H, Gattuso P, et al. Status of HER-2 in male and female breast carcinoma. Am J Surg 2001; Vol.182: pp.389-92.
- Николаев К. С., Семиглазов В. Ф. Рак молочной железы у мужчин. Глава в книге. Семиглазов В. Ф., Семиглазов В. В. Рак молочной железы. Биология, местное и системное лечение. -М.: СИМК, -2014. -298-341 с.
- Николаев К. С., Семиглазов В. Ф., Семиглазов В. В. Рак молочной железы у мужчин (обзор литературы).//Современная онкология. -2014. -№ 4. -Т. 16. -31-37 c.


