Биологические свойства парвовируса и его роль в патологии крупного рогатого скота
Автор: Гаффаров Х.З., Ефимова М.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы, итоги
Статья в выпуске: 6 т.48, 2013 года.
Бесплатный доступ
На основе анализа результатов обширных исследований во многих странах описаны свойства и распространенность парвовируса крупного рогатого скота (КРС). К I типу относятся парвовирусы КРС, выделенные в США, Европе, Северной Америке, Африке и Австралии (по антигенным свойствам они идентичны, но отличаются от парвовирусов животных других видов и человека). Японские изоляты, имеющие антигенные отличия от представителей I типа, относят ко II типу. Для парвовируса КРС характерна способность агглютинировать эритроциты морских свинок и человека. Это ДНК-содержащий вирус с размером вириона 23 нм. Репликация и сборка происходят в клеточном ядре. Наибольшие титры (10 6,75-10 8,0 ТЦД 50/мл) достигаются при культивировании парвовируса I типа в первичных культурах клеток легких, почек, селезенки, тестикул и надпочечников эмбриона коровы. Для успешного выделения парвовируса I типа необходимо использовать эмбриональную сыворотку коров, свободную от специфических антител. Пероральное или внутривенное заражение безмолозивных или новорожденных телят, лишенных соответствующих антител, сопровождается развитием симптомокомплекса диареи в течение 24-48 ч. Чаще всего вирус обнаруживают в кишечнике, лейкоцитах крови, лимфоузлах, селезенке, тимусе и в клетках надпочечников. Вирус длительно персистирует в организме коров, обусловливает аборты и эмбриональную смертность, проникая через плацентарный барьер. Вирус обнаруживают в тимусе, легких и селезенке мумифицированных плодов. Сведения, накопленные в основном за рубежом, показывают, что парвовирусная инфекция регистрируют во многих странах. Доля серопозитивных животных в разных стадах (Великобритании, Австралии, Германии, Австрии, Италии, Алжире и др.) варьировала от 14 до 100 %. По нашим данным, в девяти регионах Среднего Поволжья специфические антитела к парвовирусу в ИФА выявляются у 26,6-58,4 % глубокостельных коров и телят. Парвовирус участвует в формировании смешанных респираторно-кишечных инфекций у телят и различных форм патологий репродуктивных органов у взрослого поголовья КРС. Обсуждается необходимость введения в отечественную ветеринарную практику средств иммуноферментной диагностики и инактивированной ассоциированной вакцины с широким спектром специфической защиты.
Парвовирус i типа, крупный рогатый скот, ифа, вакцина
Короткий адрес: https://sciup.org/142134824
IDR: 142134824 | УДК: 636.2:619:578.822.2
Текст обзорной статьи Биологические свойства парвовируса и его роль в патологии крупного рогатого скота
В молочном скотоводстве при использовании интенсивных технологий на фоне высокой продуктивности животных, нарушения обмена веществ и различных иммунодефицитов активизируются возбудители респираторно-кишечных инфекций, из которых экономически наиболее важное значение имеют патогены, обусловливающие бесплодие, раннюю эмбриональную смертность и аборты (1-3). В развитии этих патологий крупного рогатого скота (КРС) доминируют вирус герпеса I типа, вирус диареи КРС — болезни слизистых (ВД-БС), вирус парагриппа-3 (ПГ-3), респираторносинцитиальный вирус (РСВ), аденовирусы I и II подгрупп, парво- и рео-вирусы. Среди этой обширной группы долгие годы малоизвестными и неизученными в нашей стране оставались парвовирусы КРС (4-7).
Парвовирусы патогенны для многих видов животных и птиц, а также для человека. Впервые в США из содержимого кишечника телят с признаками энтерита был выделен вирус, который в отличие от других энтеровирусов КРС обладал гемадсорбирующими свойствами и был назван Haden-virus (hemadsorbing enterovirus) (8). Изучая его основные биологические свойства, P.A. Bachman (9) установил, что вирус хорошо размножается в первичной культуре клеток тестикул теленка, вызывая цитопатоген-ные изменения и полный лизис клеток на 3-4-е сут после заражения. При этом инфекционный титр достигал 104 , 5-105 , 0 ТЦД50/0,1 мл. Через 18-24 ч появлялись эозинофильные ядерные включения. Выяснилось, что вирус
Haden агглютинирует эритроциты крови морской свинки, человека и собаки. Реакции гемагглютинации (РГА) и торможения гемагглютинации (РТГА) происходили при 4 ° C в диапазоне pH 5,0-8,0. Вирус проявлял устойчивость к ряду химических и физических агентов (табл. 1), сохранял активность при pH от 3 до 9. В присутствии ингибиторов синтеза ДНК 5-йод-2-дезоксиуридина и 5-бром-2-дезоксиуридина инфекционная и гемаг-глютинирующая активность подавлялась (см. табл. 1). Следовательно, вирус Haden относился к ДНК-содержащим.
1. Изменение ТЦД 50 и гемагглютинирующей активности (ГА) вируса Haden при действии химических и физических факторов (9)
|
Фактор |
Контроль |
Опыт |
||
|
ТЦД 50 /0,1 мл | |
ГА-титр |
ТЦД 50 /0,1 мл | |
ГА-титр |
|
|
5-Йод-2-деоксиуридин (100 мг/мл) |
10 4,00 |
1:512 |
101,25 |
1:128 |
|
5-Бром-2-деоксиуридин (100 мг/мл) |
104,25 |
1:1024 |
10 0,25 |
1:64 |
|
Хлороформ |
104,25 |
1:1024 |
10 4,25 |
1:1024 |
|
Na-Дезоксихолат |
10 4,50 |
1:1024 |
10 4,00 |
1:1024 |
|
56 ° С, 60 мин |
10 4,00 |
1:1024 |
10 4,25 |
1:1024 |
|
рH 3, 60 мин |
10 4,25 |
1:1024 |
10 4,25 |
1:1024 |
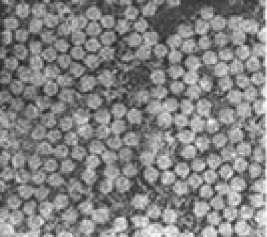
Рис. 1. Парвовирус крупного рогатого скота. Увеличение х 120 000, негативное контрастирование (9).
После очистки и концентрирования вируса в градиенте плотности цезия электронная микроскопия с негативным контрастированием показала, что его вирион имеет размер 23 нм, представляет собой изометрическую частицу без оболочки и содержит 32 капсомера диаметром 2-4 нм, которые уложены по икосаэдрально-му типу (рис. 1). Вместо оболочки выявлены небольшие, похожие на кольцо образования размером 7-8 нм. В вирионах были идентифицированы три белка: с молекулярной массой 66,80 кД (75,6-82,7 %), 76,15 кД (7,7-10,6%) и 85,50 кД (9,6-13,8 %). На основании изученных свойств он классифицирован как парвовирус
КРС I типа и считается референтным штаммом (9-11).
Дальнейшие исследования по выделению и изучению биологических свойств парвовируса КРС проводились на западе США (12), в Алжире (13), Англии (14), Австрии (15), Японии (16), Австралии (17, 18), в России (19).
Оптимальные условия выделения парвовируса КРС I типа. Группа ученых из США (20) в молочных стадах Колорадо и Южной Дакоты, в которых регистрировались болезни новорожденных неонатальной диареей, провели вирусологические исследования 129 проб фекалий и образцов кишечника телят, полученных при вскрытии. После деконтаминации разведения суспензий помещали на монослой активно делящихся клеток почек или легких коровьего эмбриона (соответственно ПЭК и ЛЭК). При этом использовали первичные культуры клеток и сыворотку плода коровы, свободную от антител к парвовирусу КРС. В результате получили 33 вирусных изолята (10 идентифицированы как парвовирус, 23 — как энтеровирус). В Великобритании из проб фекалий 3-месячного павшего теленка, у которого регистрировали признаки энтерита, после инокуляции первичной культуры клеток ПЭК выделили вирус, условно обозначенный как 32459. Он оказался идентичным штамму Haden в перекрестной реакции нейтрализации (РН) и РТГА и характеризовался как мелкий ДНК-содержащий вирус. Штамм 32459 отличался от парвовируса Haden I типа тем, что агглютинировал эритроциты овец, кролика и крыс. У двух 3-месячных телят интравенозная инокуляция и интраназаль- ная инстилляция штамма 32459 вызвали клинические признаки болезни с формированием антител и вирус был обнаружен в носовой слизи через 2 сут после заражения (14, 21). В других экспериментах в США при обследовании 114 гол. скота у 41 особи в 6 стадах из 10, где имели место различные формы патологий, титры антигемагглютининов составили 1:40 и выше. Антитела, аналогичные антителам из фетальной сыворотки, выявлялись также в сыворотке крови телят, не принимавших молозива (12). Антигемагглютинины к парвовирусу КРС I типа обнаружены также в сыворотке крови лошадей, коз и собак (14).
В 65 из 70 проб сывороток крови взрослого поголовья КРС, полученных в 7 стадах Северного Квинсленда (Австралия), установили высокие титры вируснейтрализующих антител к парвовирусу I типа. Результаты этих исследований в дальнейшем подтвердились у большого процента животных в РТГА выявлением антител к парвовирусу КРС I типа, инактивированному p -пропиолактоном. Для выделения возбудителя авторы выбрали серопозитивное стадо из 125 животных до 6-месячного возраста, от которых собрали пробы фекалий. Каждый образец разводили в фосфатном буфере, 3-кратно замораживали, размораживали и осветляли центрифугированием, после чего инокулировали монослой первичной культуры клеток тестикул коровьего эмбриона полученными препаратами (по 0,5 см3, адсорбция при 37 ° С в течение 1 ч). Смену поддерживающей среды, содержащей 1 % эмбриональной сыворотки КРС, свободной от антител к парвовирусу КРС I типа, проводили на 3-и, 7-е и 14-е сут. Дважды в неделю отбирали по две культуры на покровном стекле: одну окрашивали гематоксилином и эозином, другую экстрагировали глициновым буфером для последующего выявления агглютинации с эритроцитами морской свинки и человека 0 группы. В результате выделили 10 цитопатогенных агентов (ЦПА), из которых 4 были идентифицированы как энтеровирусы, 2 — как представители семейства Reoviridae , 3 — как аденовирусы, 1 — как представитель семейства Parvoviridae . Изучение выделенного парвовируса показало, что его гемагглютирующая активность не ингибируется антисыворотками к парвовирусу мышей, крыс, кошек и свиней, а тесты с 25 отрицательными и 25 положительными антисыворотками КРС к инактивированному антигену парвовируса КРС I типа подтвердили принадлежность выделенного ЦПА к этой группе парвовирусов. Более того, в РТГА из 500 проб, случайно отобранных в мясных стадах Северного Квинсленда, 70 % оказались положительными по парвовирусу КРС I типа в разведении 1:100 (17). G. Siegle (22), а также P.J.K. Durham и R.H. Johnson (18) на основании исследования физико-химических и культуральных свойств изолята BPV-267, выделенного в Австралии, также идентифицировали его как парвовирус КРС I типа.
В Австрии от трех латентно инфицированных клинически здоровых телят в возрасте 6-11 нед были получены 105 проб смывов и органов, из которых после инокуляции первично трипсинизированных культур клеток семенника теленка выделили 27 изолятов (из конъюнктивальных и носовых смывов — 6, из проб кала — 7, из респираторного тракта, кишечника, брыжеечных лимфоузлов, селезенки и почек — 14). Чаще всего удавалось выделить парвовирус КРС из желудочно-кишечного тракта. Обнаружение вируса в печени и селезенке интерпретировали как следствие ви-ремического рассеивания (23, 24).
Изолят 214/72 как прототип, идентичный 27 выделенным, был подробно изучен. Цитопатическое действие (ЦПД) регистрировали по появлению гранулированных, круглых и овальных дегенерированных клеток 18
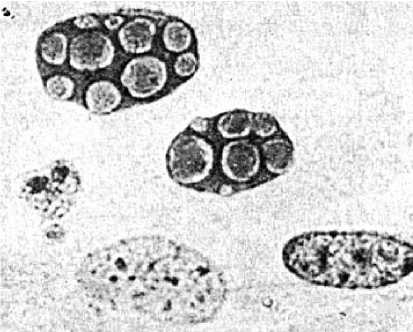
Рис. 2. Множественные внутриядерные тельца — включения парвовируса I типа различной формы через 72-96 ч после заражения первичной культуры клеток семенника теленка. Ядра клеток увеличены, матрикс в напряженном состоянии. Увеличение *1500, окрашивание гематоксилином и эозином (15).
и полному отслоению разрушенных клеток от стекла через 7296 ч после заражения. Культура клеток семенника теленка оказалась вполне пригодной в качестве субстрата. Инфекционный титр составлял 6,5-8,0 lg ТЦД50/0,1 мл (у референтного штамма Haden эти показатели находились в пределах 7,0-8,5 lg ТЦД50/0,1 мл). При выращивании на стеклянных пластинках, которые фиксировали жидкостью Карнуа с окрашиванием гематоксилином и эо- зином, в клетках обнаруживались внутриядерные тельца-включения (рис. 2). Аналогичные включения выявляли при окрашивании акридиновым оранжевым. Биофизические, биохимические и би- ологические свойства полученного изолята полностью соответствовали критериям, установленным для вирусов семейства Parvoviridae. В перекрестной РН он оказался идентичным референтному штамму Haden парвовируса КРС типа I (15).
В СССР парвовирус КРС (штамм B-2) впервые был выделен в 1972 году из носовой слизи больного теленка с респираторным синдромом (19). Вирус оказался устойчивым к воздействию эфира и хлороформа, к прогреванию при 56 и 60 ° С в течение 30-60 мин. Проба с 5-йод-2-дезок-сиуридином показала его принадлежность к ДНК-содержащим вирусам. Электронная микроскопия с негативным контрастированием выявляла вирионы парвовируса размером 24±2 нм. Однако в перекрестных РН и РТГА обнаружилось, что В-2 не имеет антигенного родства с референтным штаммом Haden и в отличие от всех ранее выделенных парвовирусов КРС I типа не обладает гемагглютинирующими свойствами в нативном состоянии, на основании чего его отнесли к третьему серотипу (21, 25). В последующие годы интерес к парвовирусам как объектам исследования получил значительное развитие в работах других авторов (26-29).
Особенности внутриклеточной репродукции и культивирования парвовируса КРС I типа. Репликация ДНК и сборка парвовирусов происходит в клеточном ядре. Относительная простота их генома позволяет предположить, что значительная часть функций, необходимых для репликации, обеспечивает клетка-хозяин. В случаях автономных парвовирусов для синтеза их ДНК необходимо, чтобы зараженная клетка находилась в ранней S-фазе.
В течение первых 3 ч после заражения монослойной культуры клеток адсорбируется 90 % вируса. Эклипс-фаза длится 16 ч, после чего проявляется ЦПД, в том числе наблюдаются внутриядерные включения (30). Новый вирус в культуральной жидкости обнаруживается через 24 ч после инокуляции. Максимальный титр в ТЦД50 равен 10-5 , 5/мл. Количество выявляемых гемагглютининов изменяется пропорционально инфекционному титру вируса (31). Титр внеклеточного вируса в течение всего периода репродукции ниже титра внутриклеточного вируса (32).
Вирусный антиген в цитоплазме можно обнаружить методом флуо- ресцирующих антител через 6 ч после заражения, через 48 ч происходит поражение ядра, к 72-му ч формируются внутриядерные тельца-включения, которые из эозинофильных в процессе развития (через 18-24 ч) превращаются в базофильные. Большая часть вирусов освобождается из клеток к началу проявления ЦПД. В культуре тестикулярных клеток КРС вирус достигает титра 106,75-108,00 (15).
Парвовирус КРС типа I хорошо размножается в первичной культуре клеток легких, селезенки, тестикул, надпочечников и почек эмбрионов, для которых характерна высокая восприимчивость и активное клеточное деление (31, 33).
Для оптимальной репликации парвовируса КРС типа I используют первичные клеточные культуры, приготовленные из органов коровьего эмбриона с использованием 0,5 % раствора трипсина для обработки эмбриональной ткани. В качестве ростовой применяют среду Эрла со сбалансированным содержанием солей, 0,5 % лактоальбумина и эмбриональной сыворотки коров. После подсчета клеток в исходной суспензии ее разводят ростовой питательной средой до значений 150 000-250 000 кл/см3. Через 18-24 ч после посева и образования сплошного монослоя клеточную культуру однократно промывают фосфатным буфером Дульбекко (Dulbecco) с целью удаления сыворотки, вносят вирус, выдерживают 2 ч при 37 °С для его адсорбции, после чего клетки дважды промывают и добавляют поддерживающую среду. Размножение вируса сопровождается развитием цитопатических изменений (появление зернистости, округление и разрушение зараженных клеток), которые в зависимости от инокулируемой дозы и митотического показателя заражаемой культуры клеток развиваются через 3-5 сут после инфицирования (17).
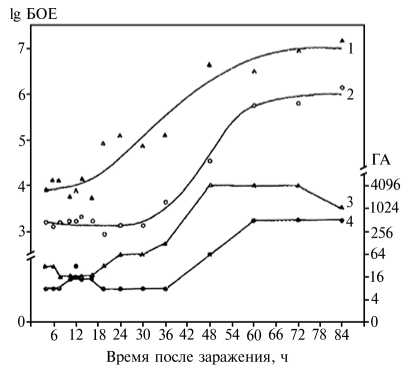
Рис. 3. Репликация (по числу бляшкообразующих единиц — БОЕ) в культуре клеток легкого эмбриона крупного рогатого скота и гемагглютинирующая активность (ГА) у парвовируса: 1 и 2 — соответственно внутри- и экстрацеллюлярный вирус, 3 и 4 — внутри- и экстрацеллюлярный гемагглютинин (31).
Для разных типов клеток высокая гемагглютинирующая активность и инфекционность регистрируется в культуральной жидкости после каждого пассажа. Высокие титры получают при репликации парвовируса I типа в первичных культурах клеток легкого, почек, селезенки, тестикул и надпочечников эмбриона КРС. Установлено, что после трех пассажей наибольшее накопление вируса в клетках легкого наступает обычно через 72 ч после инокуляции (106,2-106,8 ТЦД50/мл). К 20-24-му ч зараженные клетки увеличиваются в размере, приобретают звездчатую форму, спустя 72 ч равномерно округляются и отделяются от стекла. Использование эмбриональной сыворотки коров, свободной от антител, пре дставляется важнейшим предварительным условием для успешного выделения парвовируса КРС I типа (15).
Уровень гемагглютининов, связанных с клетками, достигает максимального титра (1:4096) через 48 ч. В экстрацеллюлярной среде гемагглютинины обнаруживаются через 36 ч, максимальные показатели (1:512)
регистрируют к 60-84 ч после заражения. Следовательно, титр вируса, связанного с клетками, выше, чем титр экстрацеллюлярного вируса (рис. 3).
Сравнительное испытание первичных культур клеток почек и семенника телят, взятых соответственно в возрасте 1-3 и 3-6 сут, показало (30), что использованный в этих опытах штамм Haden удается пассировать 3-5 раз. Размножение вируса контролировали по ЦПД и титру гемагглютининов в культуральной жидкости. Эти же авторы обнаружили, что парвовирус КРС I типа размножается в первичной и вторичной культуре клеток новорожденных телят. Цитопатический эффект, который наступает не ранее 72-го ч, проявляется грануляцией монослоя и округлением клеток. При 3-м пассаже титр гемагглютининов достигал соответственно 1:2048 и 1:1024. При использовании первичных и вторичных клеток семенника теленка вирус размножается только на первом пассаже (34).
Однако G.J. Spahn с соавт. (35), R.C. Bates с соавт. (31) и F.B. Johnson с соавт. (36) подчеркивают, что первичные культуры эмбриональных клеток легкого, почек, селезенки, семенников и надпочечников более восприимчивы к парвовирусу КРС I типа и позволяют получить наиболее высокие титры вируса в РГА (табл. 2).
2. Репликация и гемагглютигирющая активность (ГА) парвовируса I типа при пассировании в эмбриональных и перевиваемых культурах клеток крупного рогатого скота (31)
|
Культура эмбриональных клеток |
ГА-титр по пассажам |
Перевиваемая линия |
ГА-титр по пассажам |
||||
|
1-й | |
2-й |
| 3-й |
1-й |
2-й |
3-й |
||
|
Легкие |
512 |
512 |
2048 |
FB4BM |
256 |
32 |
4 |
|
Почки |
512 |
256 |
128 |
МОВК |
32 |
< 2 |
< 2 |
|
Тестикулы |
2048 |
512 |
128 |
Vero |
< 2 |
< 2 |
< 2 |
|
Селезенка |
256 |
1024 |
512 |
L |
< 2 |
< 2 |
< 2 |
|
Кишечник |
4096 |
4096 |
512 |
HeLa |
< 2 |
< 2 |
< 2 |
|
Надпочечник |
4096 |
128 |
4096 |
BHK |
< 2 |
< 2 |
< 2 |
Во многих работах также показано, что парвовирус КРС I типа не размножается в перевиваемых клеточных линиях КРС, обезьян, мышей, хомяков и человека. В первичных культурах клеток эмбрионов кур и морских свинок наблюдают абортивную инфекцию с постоянной потерей инфекционности (15, 31, 32, 37, 38).
Спектр патогенности парвовируса КРС I типа. Парвовирусы обладают уникальными биологическими свойствами: они способны селективно реплицироваться в делящихся клетках костного мозга, кишечника и эмбрионов млекопитающих. Поэтому органы пищеварения вследствие постоянного обновления клеток слизистой играют ведущую роль в репродукции вируса. Клинически парвовирусная инфекция проявляется в основном в виде поражения пищеварительных органов (18, 22, 23, 31, 35). Неслучайно штамм Haden впервые был выделен именно из фекалий больных телят с симптомокомплексом диареи (8). Экспериментальное пероральное и внутривенное заражение телят, лишенных молозива и необходимых антител, через 24-48 ч приводило к развитию диареи. Более выраженные клинические признаки отмечают у телят, инфицированных внутривенно. Специфический антиген обнаруживают в клетках многих органов, но наиболее часто — в эпителиальных клетках тощей, подвздошной, слепой кишки и в лейкоцитах крови. Исходный вирус выделялся от зараженных телят в период с 24-48 ч до 11 сут после заражения. Вирус изолировали из лейкоцитарной фракции крови через 2 сут после инфицирования, иногда — из эритроцитов. После перорального поступления вируса его регулярно обнаруживали в лимфоузлах, селезенке и тимусе, он накапливался в высоких титрах в клетках надпочечников и был изолирован из легких, по- чек, тестикул и яичников, сердечной мышцы, спинномозговой жидкости и мозга. При внутривенном заражении вирус выделяли из всех органов (самые высокие титры — в лимфатической ткани и надпочечниках) (20, 21, 23).
Наблюдаемая взаимосвязь между парвовирусной инфекцией и патологией репродуктивных органов у разных видов животных (наряду с обнаружением антител против парвовируса КРС I типа в коммерческой эмбриональной сыворотке) (22) стала стимулом для изучения роли парвовируса КРС I типа как этиологического фактора при эмбриональной патологии (24). Экспериментальное заражение коров в разные периоды стельности показало, что вирус проникает через плацентарный барьер и обусловливает аборты и эмбриональную смертность. При введении вируса на 3-4-м мес стельности внутривенно или на 5-6-м мес в амнион коровы абортировали соответственно через 3 и 5 нед (9, 39). Вирус обнаруживали в тимусе, легких и селезенке мумифицированных плодов, а в организме коров он длительно персистировал (39, 40).
После внутривенного введения парвовируса КРС I типа коровам во время 1-го, 2-го и 3-го периодов стельности инфицировались эмбрионы и плацента. Некоторые эмбрионы были абортированы в 1-й и в начале 2-го периода стельности, другие удалены с применением кесарева сечения через 5-60 сут после заражения. При гистологическом изучении обнаружили внутриядерные тельца-включения в паренхиме печени и в эпителиальных клетках кишечника у 4 эмбрионов, зараженных во 2-й период и удаленных через 5-10 сут после заражения. Такие же включения и множественные локальные некрозы обнаруживали в корковом слое надпочечников и в наружном зародышевом слое мозжечка. Плоды, зараженные в 3-й период, родились живыми, но их органы, исследованные через 20 сут после заражения, содержали вирус. Эмбрионы, возраст которых при заражении составил 93 сут и более, через 10 сут продуцировали антитела, ингибирующие гемагглютинацию, что соответствовало появлению IgM и IgG (24, 37, 38).
В опыте H.D. Liggitt с соавт. (41) парвовирус (108 БОЕ в 5 мл) вводили с помощью лапаротомии 130-суточным плодам и исследовали их через 5, 10, 20, 40 и 60 сут после заражения. Между 5-ми и 10-ми сут наблюдали увеличение числа Е-розеткообразующих лимфоцитов, повышение количества IgM в сыворотке крови (максимум — на 20-е сут после заражения), заметное и постепенное увеличение количества IgG и незначительное — IgG2. Вируснейтрализующие антитела выявлялись на 10-е сут (1:128) и к 60-м сут достигали значительного титра (1:2048). Лимфоидная гиперплазия наиболее отчетливо проявлялась в лимфоузлах, расположенных вблизи от места выделения вируса. Парвовирус обнаруживали в плодах в течение всего периода исследования.
Распространенность парвовирусной инфекции КРС среди поголовья молочного скота. Сведения, накопленные в основном за рубежом, показывают, что парвовирусная инфекция КРС широко распространена во многих странах — в США (12, 35), Японии (16), Великобритании (14), Австрии (15), Германии (34), Канаде (42), Австралии (17, 33) и др. После первых сообщений о выделении парвовируса КРС в 1959 году появились данные, указывающие на повсеместное выявление в сыворотке крови животных антител к парвовирусу I типа (22). В частности, F.R. Abinanti с соавт. (8), а также G.J. Spahn с соавт. (35) показали, что в штате Мериленд (США) в трех стадах у 86 % взрослого поголовья КРС в сыворотке крови в РТГА обнаруживаются антитела к парвовирусу КРС в титрах 1:20 и выше. На западе США в 29 из 35 стад, в которых регистрировали аборты среди маточного поголовья или диарею новорожден- ных телят, серологическое обследование выявило антитела к указанному парвовирусу. Доля серопозитивных животных при этом варьировала от 14 до 100 % (23). Обследование 177 коров из 12 молочных стад в Южной Каролине подтвердило парвовирусную инфекцию во всех стадах. При этом у 56,7 % коров титры антител составили 1:16 и выше (43). В Великобритании в 6 стадах из 10 в 46 % случаев была установлена серопозитивность (14). В Северном Квинсленде (Австралия) из 500 взрослых особей (выборка из 7 стад) у 70 % имелись антитела к парвовирусу КРС I типа (17). В северо-восточной Италии при исследовании 101 пробы сывороток крови животных из 350 стад на наличие парвовирусной инфекции КРС у 98 % в РТГА регистрировали положительный результат (44, 45). Аналогичные данные были получены в пробах сывороток крови КРС в Алжире: у 70 % животных подтвердилось наличие антител к парвовирусу КРС I типа (13).
Исследование сывороток крови у группы телят отъемного возраста с респираторным симптомокомплексом показало наличие смешанной инфекции (парвовирус и вирус ПГ-3) (37). При оценке степени распространения этой инфекции среди поголовья молочного скота серопозитивность считалась статистически достоверной, если положительный результат получали для разведений 1:32 и выше. Антитела к парвовирусу КРС I типа могут присутствовать в эмбриональной сыворотке КРС, используемой для выращивания клеточных культур. Это обстоятельство указывает на активную реакцию организма коров на внутриматочную инфекцию (12).
В России многие годы недооценивалась роль парвовирусной инфекции в патологиях крупного рогатого скота, что сдерживало разработку средств лабораторной диагностики и специфической профилактики. Нами предложена тест-система на основе ИФА для выявления антител к парвовирусу КРС I типа в одном разведении (1:400) и количественного определения антител в четырех разведениях (1:800, 1:1600, 1:3200, 1:6400) в сыворотке крови инфицированных, переболевших и вакцинированных животных. Соответствие диагностических параметров и показателей качества этой тест-системы требованиям международных стандартов (46-47) подтверждены испытанием в лабораторных и производственных условиях (48).
Сероиммунологический мониторинг, проведенный нами в девяти регионах Среднего Поволжья, в которых проявлялись клинические признаки поражения желудочно-кишечного тракта и респираторных инфекций у телят, а также имела место патология репродуктивных органов у маточного поголовья, показал, что методом ИФА специфические антитела к парвовирусу выявляются во всех обследованных регионах у 26,6-58,4 % особей. Антитела в диагностически достоверных титрах обнаруживались как у глубокостельных коров и нетелей, так и у телят с 10-х сут жизни. Более высокий процент положительно реагирующих животных наблюдали в хозяйствах, где размещался импортированный скот. Полученные результаты указывают на факты циркуляции в регионе парвовируса КРС I типа среди разных возрастных групп.
Одновременное выявление в тестируемых образцах сывороток крови сероконверсии к антигенам парвовируса КРС I типа, вируса ПГ-3 (77,8 %), вируса герпеса I типа (47,3 %) и реовируса I типа (24,7 %) у больных и переболевших животных позволяет утверждать, что парвовирус I типа участвует в формировании смешанных респираторно-кишечных инфекций у молодняка и нарушениях функций репродуктивных органов у взрослого поголовья КРС.
В настоящее время отечественных аналогов вакцин, изготовленных на основе антигенов парвовируса I типа и реовируса I типа КРС, не существует, в связи с чем нами сконструирована ассоциированная вакцина, 23
обеспечивающая специфическую защиту плода, новорожденных телят, молодняка в период доращивания и откорма, а также стельных коров и телок от инфицирования эпизоотическими (полевыми) штаммами парво-, рео-, герпесвирусов I типа и возбудителя вирусной диареи, циркулирующих на территории РФ (49). Разработанная ассоциированная вакцина содержит антиген парвовируса I типа КРС (штамм Parvo-32459), по комплексу вирусных антигенных компонентов существенно отличается от производимых отечественных средств профилактики широким спектром специфического действия, не имеет аналогов в России, патентоспособна (50).
Таким образом, представление о биологических свойствах, степени распространения и потенциале парвовируса крупного рогатого скота (КРС) I типа в этиопатогенезе респираторно-кишечных инфекций у молодняка и нарушениях функций репродуктивных органов у взрослого поголовья можно считать сложившимся. Для этого вируса характерно латентное носительство преимущественно у взрослых животных. В клетках эмбрио-на/плода он активно размножается, вызывая различные нарушения беременности, ведущие к рассасыванию, отмиранию, мумификации и выкидышам. Описанные методические подходы могут служить ориентиром для выработки рекомендаций по диагностике этой малоизвестной нозоедини-цы. Наиболее высокие титры (по инфекционности и гемагглютинирующей активности) достигаются при репликации парвовируса КРС I типа в первичных культурах эмбриональных клеток легкого, почек, тестикул и надпочечников. Процент серопозитивных животных в разных стадах варьирует от 14 до 100 %, при этом антитела к парвовирусу КРС I типа выявляются повсеместно. С использованием разработанной нами тест-системы и общепринятых методов серодиагностики нами впервые получены данные о распространении парвовируса КРС в хозяйствах Среднего Поволжья, указывающие на его циркуляцию среди разновозрастных групп скота.


