Биологическое изучение родандодекабората натрия (NA2B12H11SCN) - нового эффективного препарата для нейтронозахватной терапии (НЗТ )
Автор: Колдаева Е.Ю., Григорьева Е.Ю., Братцев В.А., Моррис дЖ., Гейнз Д.Ф., Масько А.С., Борисов Г.И., Спрышкова Р.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (33), 2009 года.
Бесплатный доступ
Работа посвящена биологическому изучению моно-родандодекабората натрия (BSCN) - нового носителя 10В при ней- тронозахватной терапии (НЗТ) опухолей. Исследование было выполнено на мышах-самцах линии С57Bl/6 с перевитой мышиной меланомой В-16. Было доказано, что токсичность соединения низкая, а исследование по биораспределению показало, что BSCN обнаруживают в опухолевой ткани в количествах, достаточных для проведения НЗТ. Наши дан- ные позволяют предположить, что BSCN превзойдет используемый в настоящее время в клинической практике моно- меркаптоундекагидрододекаборат натрия (BSH).
Нейтронозахватная терапия (нзт), токсичность, биораспределение, меланома в-16
Короткий адрес: https://sciup.org/14055151
IDR: 14055151 | УДК: 615.277.3:615.076.9
Текст научной статьи Биологическое изучение родандодекабората натрия (NA2B12H11SCN) - нового эффективного препарата для нейтронозахватной терапии (НЗТ )
Группами химиков России, Великобритании и США было обнаружено, что клозо -додекаборат-анион (В12Н122-) претерпевает легкую реакцию роданирования при комнатной температуре при действии роданида калия (KSCN) и обычных химических окислителей, таких как Н2О2 или K2Cr2O7, в среде разбавленной серной кислоты (рис. 1).
Реакция роданирования не останавливается на стадии моно-родандодекабората и при избытке роданид-иона и окислителя протекает далее с образованием 1,7- и 1,12-диродан-додекабората.
Оба изомера были выделены в виде их кристаллических тетраэтиламмониевых солей, и их строение было определено с помощью спектров 11В ЯМР и рентгеноструктурного анализа выделенных монокристаллов (рис. 2).
Моно-родандодекаборат устойчив к действию большинства сильных расщепляющих реагентов. Единственной найденной возможностью была реакция B12H11SCN2- с натрием в жидком аммиаке, где наблюдалось полное восстановление SCN-группы с образованием B12H11SН2-, хотя и с малым выходом. Полу-
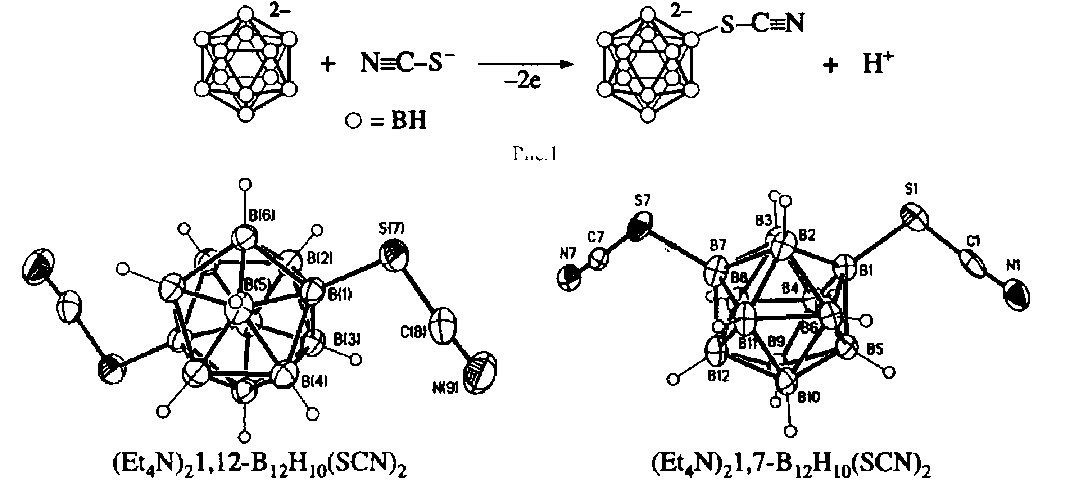
Рис.1
Рис.2
чаемый моно-родандодекаборат выделен в виде тетраэтиламмониевой, цезиевой и натриевой солей и в виде водного раствора натриевой соли, Na2B12H11SCN, испытан в биологических экспериментах на животных на безвредность и накопление в опухолях. Напомним, что к веществам-носителям бора при проведении НЗТ предъявляются определенные требования: так, максимально переносимая доза (МПД) не может быть ниже 10 мкг В/г массы животного, а среднесмертельная доза (ЛД50) – 25мкг В/г массы животного. Абсолютная концентрация бора в опухолевой ткани в течение периода облучения должна быть не меньше 10 мкг/г ткани, а градиент концентрации бора между опухолью и кровью, кожей, мышцами, а также нормальной тканью мозга (для опухолей мозга) должен быть больше 1 [5].
Материалы и методы
Токсичность вещества изучали на мышах-самцах линии C57Bl/6, массой 19–22 г, 70–90 дней жизни. Водные растворы исследуемого вещества вводили внутрибрюшинно в объеме, равном 1/100 массы тела животного. Животных подразделяли на 5–6 групп (6 животных на группу), получавших определенную дозу, и в течение месяца наблюдали за их общим физиологическим состоянием и выживаемостью. Павших животных вскрывали для оценки видимых изменений со стороны внутренних органов. Испытывали дозы: 270,0; 236,25; 202,5; 135,0; 67,5 мкг бора на 1 г массы тела. Определяли максимально переносимую и абсолютно смертельную дозы. Среднесмертельную дозу рассчитывали по методу Кербера [1].
Биораспределение моно-родандодекабората натрия изучали на модели мышей-самцов линии C57Bl/6, массой 20–23 г с подкожно привитой меланомой В-16. Водный раствор вещества в объеме 1/100 от массы тела, содержащий бор из расчета 150 мкг на 1 г массы тела, внутрибрюшинно вводили животным на 11-й день после перевивки опухолевых клеток. Животных дека-питировали через 1, 3, 6, 12, 24 ч после введения соединения. Предварительно у животных брали кровь из подключичной артерии. Для определения бора брали опухоль и прилежащие к ней ткани: кожу и мышцы, органы экскреции: почки, печень, легкие, а также селезенку и сердце. Органы промывали в физиологическом растворе, осушали фильтровальной бумагой, взвешивали и высушивали до постоянного веса. Содержание бора определяли методом нейтроннорадиационного анализа на реакторе ИР-8 ФГУ РНЦ «Курчатовский институт» [3].
Результаты и обсуждение Токсикологические исследования
В поведении животных после введения не летальных доз соединения не отмечали видимых изменений. При введении летальных доз смерть
E.Ю. КОЛДАEВА, E.Ю. ГРИГОРЬEВА, В.А. БРАТЦEВ И ДР.
Токсикологические характеристики BSCN в сравнении с таковыми для BSH
Таблица 1
При вскрытии в первую очередь обращали внимание на темный цвет крови. Со стороны внутренних органов не наблюдали видимых изменений. Выжившие животные не имели физиологических признаков хронического отравления, лишь в отдельных случаях наблюдали незначительную потерю массы тела (до 5 % от первоначальной). Максимально переносимая доза составила 135,7 мкг бора на 1 г массы тела. Абсолютно смертельная доза была равна 270 мкг бора на 1 г массы тела. Среднесмертельная доза, рассчитанная по методу Кербера, составила 236,25 мкг бора на 1 г массы тела. Полученные результаты сравнивали с токсикологическими характеристиками используемого в клинической практике моно-меркаптоунде-кагидрододекабората натрия (BSH).
Можно резюмировать, что использование соединения для целей нейтронозахватной терапии возможно, так как его токсикологические характеристики позволяют вводить адекватные целям НЗТ количества бора. Однако необходимо учитывать возможные осложнения, вызываемые индивидуальной чувствительностью к влиянию соединения на потребление тканями кислорода.
Кроме того, при стоянии в водном растворе моно-родандодекаборат может образовывать высокотоксичный димер, то есть раствор для введения животным должен каждый раз приготовляться ex tempere. При этом очевидна в 2 раза более низкая токсичность нового соединения в сравнении с BSH.
Биораспределение
Максимальная концентрация бора в опухоли достигалась через 1 ч после введения и была равна 47,4 мкг на 1 г ткани. К сожалению, в то же самое время содержание бора в коже было почти таким же (57,6 мкг бора на 1 г ткани). В крови через 1 ч после введения I уровень бора был примерно в 2,5 раза выше, чем в опухоли. Оптимальное соотношение между содержанием бора в опухоли и прилежащих к ней тканях достигалось к 24 ч после введения. В это время в опухоли определяли 15,9 мкг бора на 1 г ткани, в коже, мышцах и крови в 1,7; 5,5; 3,4 раза, соответственно, меньше. Монородан-производное быстро элиминировало из крови. В выведении активно участвовали печень, легкие и почки. Кинетика выведения не указывала на почечную интоксикацию. В сердце отмечали уровень бора, сопоставимый с его содержанием в коже.
Механизм биоутилизации роданистых производных додекаборат-аниона, исходя из имею-
Таблица 2
|
Ткань |
Время после введения, ч |
|||||
|
1 |
3 |
6 |
12 |
24 |
48 |
|
|
Кровь |
113,5 ± 9,2 |
13,3 ± 2,9 |
9,7 ± 4,18 |
57,8 ± 19,2 |
7,9 ± 4,8 |
4,12 ± 1,1 |
|
Опухоль |
47,4 ± 2,7 |
27,8 ± 6,15 |
20,0 ± 4,25 |
35,6 ± 4,8 |
15,9 ± 5,14 |
1,24 ± 0,25 |
|
Кожа |
57,6 ± 10,4 |
16,05 ± 7,1 |
40,4 ± 3,72 |
74,5 ± 0,71 |
11,7 ± 0 |
6,6 ± 1,2 |
|
Мышцы |
9,09 ± 1,85 |
7,44 ± 0,2 |
9,83 ± 4,35 |
38,2 ± 9,2 |
3,7 ± 0,15 |
- |
|
Печень |
213,5 ± 3,5 |
39,7 ± 2,3 |
29,2 ± 6,67 |
147,8 ± 2,13 |
10,6 ± 1,38 |
- |
|
Почки |
127,4 ± 5,7 |
24,2 ± 4,06 |
12,75 ± 3,18 |
107 ± 3,26 |
6,56 ± 1,93 |
- |
|
Легкие |
101,7 ± 20,0 |
20,23 ± 5,3 |
11,8 ± 2,2 |
7,75 ± 1,73 |
4,3 ± 0,26 |
- |
|
Селезенка |
28,0 ± 4,2 |
9,4 ± 1,4 |
3,98 ± 0,88 |
7,32 ± 1,4 |
- |
- |
|
Сердце |
42,0 ± 10,8 |
13,23 ± 4,1 |
7,83 ± 2,35 |
17,5 ± 0 |
9,1 ± 1,14 |
- |
Таблица 3
|
Опухоль/ткань |
Время после введения |
|||||
|
1 |
3 |
6 |
12 |
24 |
48 |
|
|
Опухоль/кровь |
0,42 |
2.1 |
2,06 |
0,62 |
2.01 |
0,3 |
|
Опухоль/кожа |
0,82 |
1.73 |
0,5 |
0,48 |
1.36 |
0,19 |
|
Опухоль/мышцы |
5,21 |
3.73 |
2,03 |
0,93 |
4.3 |
|
Содержание бора в органах и тканях мышей C57Bl/6 после введения BSCN
Градиент концентраций В-10 между опухолью и здоровыми тканями в объеме облучения
щихся представлений, должен напоминать механизм утилизации сульфгидрильных производных, вследствие сходства химической пространственной структуры. Известно, что BSH реализует туморотропность, находясь в клетках эндотелия сосудов опухоли [4]. Транспортируют BSH сывороточные альбумины, связанные с ним через SH-группу. Функционально активной у роданистых соединений является SCN-группа. Можно ожидать, что эта группа будет связана с основными неспецифическими транспортными системами крови – альбуминами, а при насыщении связывающих участков альбумина – с эритроцитами.
Для монородан-производного только в легких наблюдали обычное двухфазовое выведение бора. Все остальные органы и ткани показывали подъем уровня бора после его значительного снижения. Причем в опухоли, крови, печени, почках, селезенке и сердце этот подъем происходил между 6 и 12 ч после введения, а в коже и мышцах – между 3 и 6 ч после введения. Возможно, это связано с одновременно идущими процессами выведения разных транспортных форм вещества. Считается, что прочно связанные с белками вещества экскретирует печень, а слабо связанные – почки. Связанные с эритроцитами метаболиты обычно выводит печень. Исследуемые нами вещества в виде нестабильных комплексов с альбумином могли активно выводиться почками в первые часы после введения, процессы же расщепления метаболических комплексов в печени шли постепенно, и в какой-то момент в кровь возвра- щался тот или иной содержащий бор метаболит исходного вещества.
Также возможно, что метаболиты роданистых производных участвуют в так называемом кишечно-печеночном цикле, хорошо известном для метаболитов гемоглобина: метаболит вместе с желчью выводится в тонкий кишечник, затем часть метаболита резорбируется в кровь и повторно проходит через печень [2]. Из табл. 3 видно, что оптимальное соотношение между содержанием бора в опухоли и прилежащих к ней тканях достигалось к 3 и 24 ч после введения.
Заключение
Из всего изложенного следует, что моноро-дандодекаборат натрия является в настоящее время наиболее перспективным для нейтронозахватной терапии соединением как малотоксичное и достаточно туморотропное вещество, удерживающееся в опухоли в течение необходимого для облучения времени.


