Биомеханический анализ адекватности протезирования клапанов сердца
Автор: Шилько С.В., Хиженок В.Ф., Саливончик С.П.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 1 (27) т.9, 2005 года.
Бесплатный доступ
Рассмотрена проблема восстановления клапанной функции сердца посредством протезирования. Построены компьютерные (2-D, 3-D) и физическая модели гемодинамики в зоне имплантации искусственного клапана дисковой конструкции. Проведенный анализ полей скоростей и давления позволяет оценить адекватность существующих протезов и способствует созданию новых технических решений, минимизирующих гидравлическое сопротивление, тромбообразование, гемолиз и регургитацию путем сохранения естественного кровотока.
Клапанная функция сердца, дисковый протез клапана, гемолиз, тромбообразование, гемодинамика, компьютерное и физическое моделирование
Короткий адрес: https://sciup.org/146215821
IDR: 146215821 | УДК: 531/534:
Текст научной статьи Биомеханический анализ адекватности протезирования клапанов сердца
Лечение врожденных и приобретенных пороков сердца было и остается важной областью кардиохирургии. Имплантация искусственных клапанов сердца (ИКС) в развитых странах мира является массовой (порядка одной операции на 10 тыс. населения в год). В настоящее время экспериментальные и теоретические исследования кардиоимплантатов проводятся в American Society of Artificial Internal Organs, Harvard, Clivland и California Universities , исследовательском центре наиболее известного производителя ИКС – фирмы St. Jude Medical (все в США), а также под патронажем НАТО; в University of Oslo (Норвегия); в России – в Институте сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН, Научном центре хирургии РАМН, НИИ медицинской техники, Лаборатории нейтронной физики им. Франка Объединенного института ядерных исследований (Дубна), воронежском НПО «Энергия» и т.д. В настоящее время ИКС производятся в США, Италии, России и Беларуси.
Однако предпринимаемые разработчиками усилия по совершенствованию ИКС еще не позволили добиться идентичности функциональных характеристик протезов и биологических прототипов. Так, имплантация наиболее распространенных ИКС дисковой конструкции увеличивает градиент давления, является причиной гемолиза и тромбообразования вследствие нарушения естественного кровотока. Послеоперационный пожизненный прием антикоагулянтов для профилактики тромбов препятствует защитно-приспособительным реакциям организма, направленным на быструю остановку кровотечения при травмировании сосудов. Следовательно, для
оптимизации конструкций протезов и лечебной тактики актуальны исследования биомеханических процессов в зоне имплантации.
Одну из нерешенных проблем в этой области можно сформулировать следующим образом: как оценить адекватность искусственного клапана сердца?
В данном случае проведение эксперимента in vivo затруднено (наличие жидкой биологической среды, необходимость использования преимущественно неразрушающих методов контроля, стерильная чистота материалов и оборудования) и целесообразно изучать гемодинамику в зоне имплантации методами математического и физического моделирования. Предварительный анализ показывает, что трудности описания гемодинамики, обусловленные сложной геометрией, анизотропией и нелинейностью деформирования тканей сердца, а также неньютоновским течением крови, могут быть преодолены при помощи численных методов.
Ниже приведены результаты, полученные авторами при изучении кровотока через аортальный клапан дисковой конструкции.
Характеристика и метод оценки адекватности ИКС дисковой конструкции
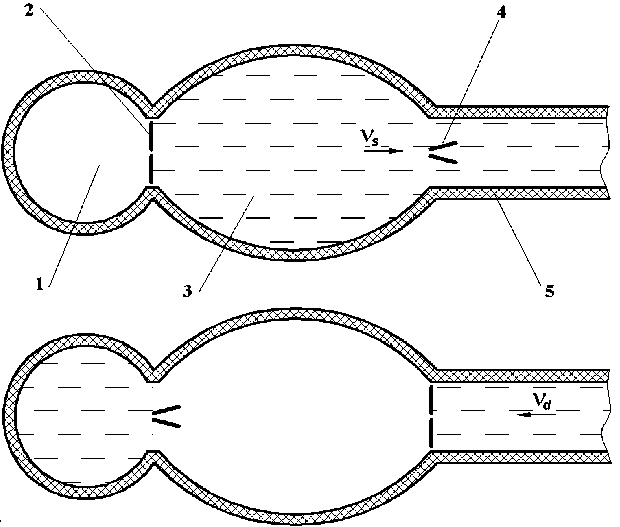
Роль клапанной системы сердца заключается в обеспечении направленного кровотока. В систолической фазе кровь из предсердия через открытый митральный клапан попадает в левый желудочек, при сокращении которого выбрасывается в аорту через открытый аортальный клапан (рис. 1).
-
1) Дефект аортального клапана (или его протеза), приводящий к регургитации, т.е. обратному течению крови в диастолической фазе, можно количественно охарактеризовать отношением площади просвета клапана в диастоле к площади его поперечного сечения в полностью открытом состоянии. Статистически длительность диастолического периода превышает систолический приблизительно в четыре раза. В результате дисфункции клапана происходит сброс крови в емкость сердца, что резко
а
б
Рис. 1. Схема кровотока в систоле (а) и диастоле (б): 1 – левое предсердие; 2 – митральный клапан; 3 – левый желудочек; 4 – аортальный клапан; 5 – аорта снижает эффективность сердечно-сосудистой системы. Необходимость покрытия возникающего дефицита кислорода вызывает патологическое увеличение частоты пульса, рост нагрузки на сердце, снижение качества и продолжительности жизни.
При дисфункции клапана минутный объем обратного кровотока в стадии диастолы V d можно оценить по формуле
V d = 60 q
k ds ,
N 0 ( k ds + 1 )
где q – интенсивность кровотока; k ds – отношение длительностей фаз диастолы и систолы; N 0 – частота пульса в норме.
Интенсивность кровотока q определяется следующим образом q = 1,05 -10 -3 k d
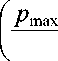
0,5
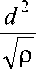
+ p min |
2 )
где k d – степень дисфункции клапана, л; p max , p min – верхний и нижний пределы изменения давления, мм рт. ст.; d - диаметр просвета клапана; р - плотность крови, равная 1,05 г/мл.
Отсюда следует выражение для частоты пульса, учитывающее дисфункцию клапана
N =
N 0 V s
V s - V d
где V s – минутный систолический объем, V d – объем крови, протекающей за минуту обратно.
При помощи зависимостей (1-3) можно оценить влияние дисфункции клапана на частоту сердечных сокращений для трех типичных состояний системы кровообращения (табл. 1).
Рис. 2 иллюстрирует влияние дисфункции аортального клапана на частоту пульса для диаметра просвета клапана d = 20 мм. Можно заметить, что значимость клапанной функции при патологии кровеносной системы выше по сравнению с физиологически нормальным состоянием.
-
2) С другой стороны, следствием патологии нативного клапана и неоптимального протезирования является торможение сердечного выброса при прямом токе крови.
Таблица 1
Характеристика сердечных сокращений в зависимости от состояния системы кровообращения
|
Параметры |
Систолический объем, л |
Давление, мм рт. ст. |
Частота пульса |
|
|
Систола |
Диастола |
|||
|
Физиологическая норма |
0,07 |
120 |
100 |
60 |
|
Анемия апластическая |
0,11 |
90 |
45 |
100 |
|
Преуремия |
0,03 |
240 |
145 |
70 |
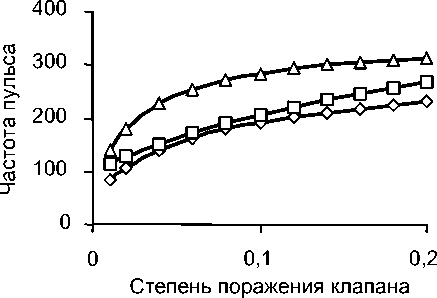
Рис. 2. Зависимость частоты пульса от дисфункции клапана
Норма
Анемия
Преуремия
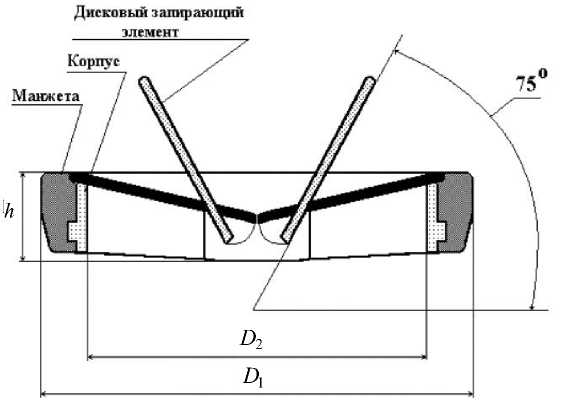
Рис. 3. Конструкция двухстворчатого клапана «Планикс»
Так, ранее были показаны преимущества ИКС с одной и, в особенности, двумя дисковыми створками (рис. 3), получивших распространение в клинической практике благодаря низкому (7-11 мм) профилю, относительно большому углу открытия и высокой надежности. Эффективная площадь открытия дисковых моностворчатых клапанов на 20% больше, чем у биопротезов, и на 30-35% больше, чем у шаровых протезов [1].
Однако створки клапана, которые конструктивно не открываются полностью для гарантированного возврата в закрытое положение и не обладают ротабельностью относительно оси кровотока, создают местное гидравлическое сопротивление. В результате уменьшается пропускная способность системы кровообращения, что компенсируется увеличением частоты пульса и нагрузки на миокард.
Редким, но опасным видом отказа протеза дисковой конструкции является несрабатывание створок клапана. Последнее может быть обусловлено слишком большим предельным углом открытия створок α , при котором обратный ток крови недостаточен для преодоления момента сопротивления закрытию.
Кроме того, в дисковых протезах имеет место разрушение эритроцитов (гемолиз) из-за повышенного, по сравнению с биопрототипом, уровня напряжений и неравномерное разделение потока крови створками, приводящее к его нежелательной турбулизации, что принято считать причиной тромбоэмболий [2]. Отсюда следует необходимость выявления и целенаправленного изменения локализации зон турбулентности, разрежения, высоких давлений и сдвиговых напряжений (напряжений Рейнольдса).
В целом, требуется найти компромиссное решение, а именно, такой предельный угол открытия а , при котором одновременно обеспечиваются нужная локализация зоны турбулентности S turb , минимальный градиент давления p и сдвигового напряжения τ, низкое сопротивление кровотоку в систоле и надежное закрытие клапана с минимальной регургитацией в диастоле. Формальная запись условий, определяющих искомый оптимум, имеет вид
Min p ( а ), т ( а );
Max ( V s ( а ) - V d ( а ));
S ,urb ( a ) = S OP-b ;
M ь(а) = M f(а), где p –давление крови; τ – напряжение сдвига; Vd – минутный объем регургитации; Sturb – зона турбулентности; Stouptb – оптимальный размер зоны турбулентности; Mb – момент вращения, обусловленный давлением крови на створку при обратном токе крови; Mf – момент сопротивления повороту створки.
Потери давления A p (мм рт. ст.), вызванные установкой клапана, можно оценить по формуле, учитывающей связь скорости течения и давления жидкости в соответствии с известным подходом, применяемым в гидродинамических расчетах [3],
A p = 20440 -2- • v2 g 2
(
1 —
k
s ) 2
c
S а V
где S - площадь сечения полностью открытого клапана; S а - площадь сечения частично открытого клапана S а = S (1 - cos а ); v - линейная скорость течения через клапан, определяемая по формуле
V s • N • ( I + k ds )
S
Зависимости (5, 6) позволяют дать оценку градиента давления аортального клапана (рис. 4). К примеру, для угла открытия 65° градиент давления Δ p составляет 5,8 мм рт. ст.
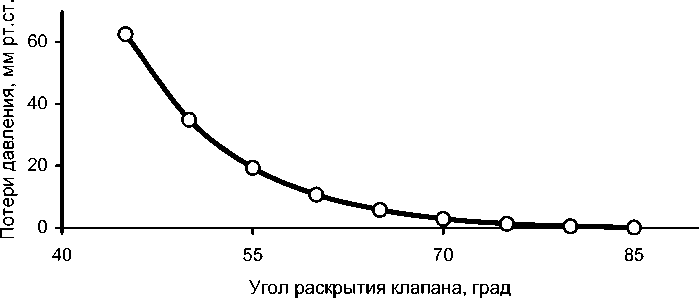
Рис. 4. Зависимость потерь давления от угла раскрытия клапана
Более сложной задачей является определение напряжений и скоростей кровотока. Экспериментально поле скоростей и напряжения Рейнольдса для дисковых ИКС было исследовано методом частиц [4]; для измерения скоростей применялся также метод фотохромной визуализации линий тока [5]. Теоретический анализ базируется, как правило, на численном моделировании процесса течения [2-3, 6-8].
В настоящей работе для исследования процесса течения крови в систолической и диастолической фазах использован метод конечных элементов [3, 6, 8] с последующей проверкой на физической модели отдела сердца «левый желудочек – клапан – аорта», выполненной из оптически прозрачного материала. Преимуществом использованного подхода является детальное описание кровотока с выявлением специфических гемодинамических зон. Это позволяет совершенствовать конструкцию клапана с целью минимизации гидравлического сопротивления и тромбообразования при обеспечении высокой надежности срабатывания при обратном токе крови. В частности, при изучении дискового ИКС «Планикс» [9] варьировался угол открытия створок α (рис. 3).
Необходимо отметить, что решение в объемной постановке существенно нелинейной задачи гемодинамики обусловливает значительные вычислительные трудности. Проведение более экономичного расчета в двумерной постановке (модель щелевого канала) мотивируется симметрией потока в ИКС. При поступательном движении в ламинарном режиме расхождение результатов для 2-D и 3-D моделей невелико (по нашим оценкам, для максимальных скоростей погрешность не превышает 10%). Кроме того, в двумерном расчете значительно упрощается интерпретация графических результатов. Однако двумерная модель не позволяет описать физиологически важный эффект закручивания потока крови при сокращении левого желудочка; поэтому далее задача решалась в объемной постановке.
В дальнейшем принималось, что биоткани не деформируется (в действительности имеет место некоторое увеличение диаметра корня аорты в систоле, способствующее снижению гидравлического сопротивления), а кровь является ньютоновской жидкостью (учет вязкопластических свойств крови является предметом дальнейших исследований авторов).
Двумерная модель гемодинамики
Серия расчетов включала определение полей давлений и скоростей в области установки одно- и двухстворчатых протезов аортального клапана при прямом и обратном токе крови. Предполагалось, что на входе клапана с размером канала 16 мм задан ламинарный поток крови вязкостью 0,005 м2/с и плотностью 1,003 г/см3 , движущийся поступательно со скоростью v s = 0,42 м/с (рис. 1), что соответствует числу Рейнольдса Re = 1380. В качестве варьируемого параметра был взят угол открытия створок α . Результаты расчета в виде безразмерных (по отношению к значениям для угла открытия 75°) давлений и скоростей даны в таблице 2 для фазы открытия (в числителе) и закрытия клапана (в знаменателе).
Анализ поля скоростей показывает, что режим движения крови в стадии открытия клапана аорты в основном ламинарный. В процессе закрытия створок клапана экстремальные значения давления p max , p min и скорости течения v max нелинейно возрастают. Увеличение предельного угла открытия α свыше 75° не приводит к заметному изменению гемодинамических параметров и гемодинамического сопротивления. Это совпадает с приведенной выше аналитической оценкой (рис. 4) и
Таблица 2
Сопоставление безразмерных скоростей и давлений потока
В частности, на рис. 5 и 6 показаны распределения скоростей и давлений для двух значений угла открытия. Аналогичные распределения в момент, предшествующий закрытию ИКС, для скорости v d = 0,42 м/с приведены на рис. 7.
В отличие от моностворчатого ИКС, распределение скоростей для двухстворчатой конструкции симметрично относительно оси потока. При большом угле открытия ( α = 60°) возникает локальная турбулентность. Согласно векторной диаграмме скоростей наблюдается возвратное течение и вихревое движение (турбулентность) в непосредственной близости к створкам (рис. 6).
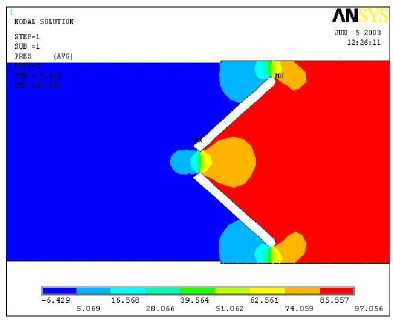
В соответствии с рис. 5 поле давлений характеризуется неоднородностью. Максимальное разрежение наблюдается на начальной стадии открытия α = 50° в отличие от вихревых течений, возникающих при больших углах открытия. Это согласуется с результатами работы [4], где было изучено влияние модификации края створки на гемодинамику при закрытии и показано, что на атриальной стороне края створки быстро развивается отрицательное давление. Две зоны высоких давлений локализуются вблизи кромок створок со стороны набегающего потока, а отрицательные давления (разрежения) прилегают к задним кромкам створок. Можно заметить значительную разность скоростей в центральной и пристеночных областях течения, что является фактором гемолиза крови вследствие сдвигового разрушения эритроцитов. Другой причиной гемолиза и изнашивания элементов клапана является кавитация, возможная в начальные моменты открытия.
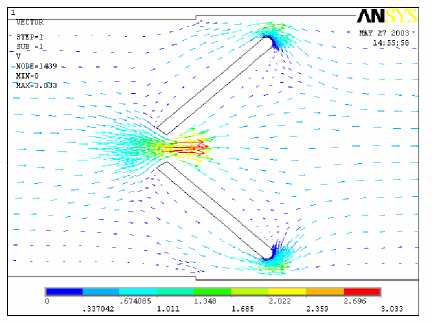
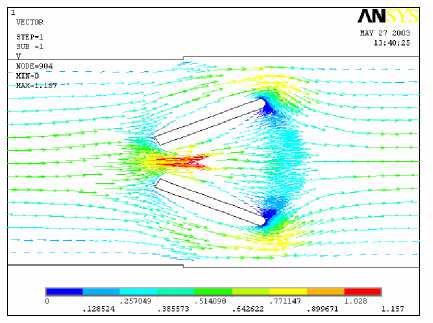
а б
Рис. 5. Поле скоростей при прямом токе крови для угла открытия створок 50° (а) и 70° (б)
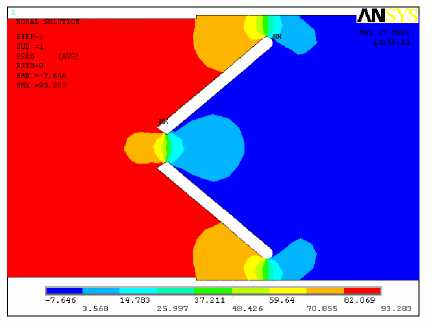
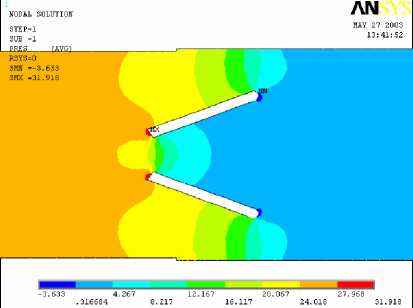
б
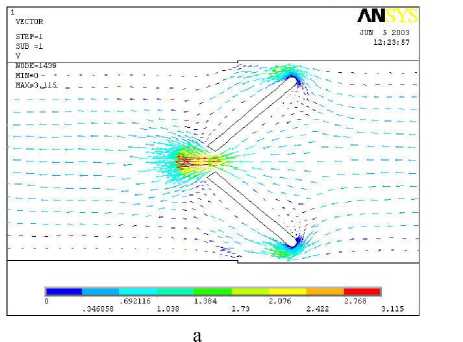
Рис. 7. Поле скоростей (а) и давлений (б) при обратном токе крови для угла открытия
Рис. 6. Поле давлений при прямом токе крови для угла открытия створок 50° (а) и 70° (б)
б
створок 50°
Трехмерная модель гемодинамики
Серия расчетов в 3-D постановке включала определение полей давлений и скоростей в области установки двухстворчатых протезов аортального клапана при прямом токе крови (рис. 1). Предполагалось, что протез клапана дисковой конструкции диаметром 21 мм установлен в цилиндрическом канале длиной 5 см, на входе которого задано поступательно-вращательное движение крови с компонентами скоростей v z = 0,5 м/с [9], v x = v y = 0,5 м/с, а на выходе задана компонента скорости v z = 0,28 м/с [10]. Кроме того, на входе задавалось давление, равное 13 кПа. Результаты расчета давлений и скоростей для угла α , равного 50° и 75° (последнее значение соответствует полному открытию клапана), показаны на рис. 8-10.
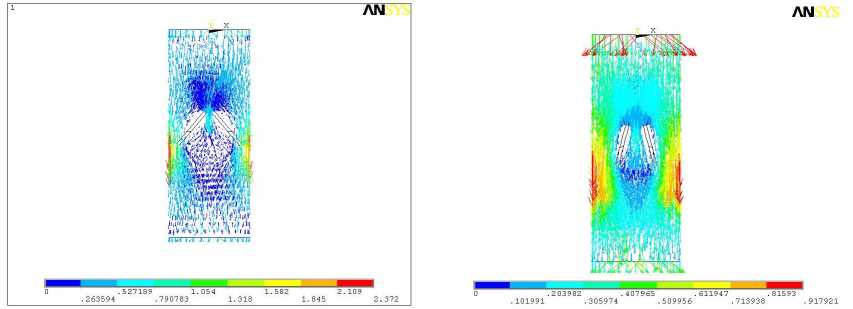
Рис. 8. Поле скоростей для углов открытия 50° (а) и 75° (б) в диаметральном сечении канала
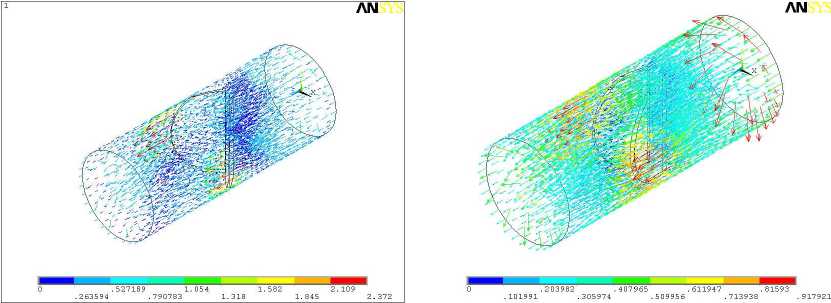
Рис. 9. Поле скоростей для углов открытия 50° (а) и 75° (б) в изометрии
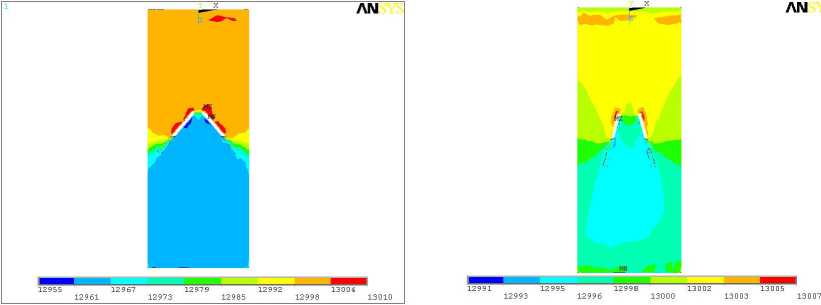
Рис. 10. Поле давлений для углов открытия 50° (а) и 70° (б)
Результаты расчета скорости течения согласуются с экспериментальными данными, полученными методами частиц [4] и фотохромной визуализации [5]. Кроме того, построенные модели позволяют определить распределение давлений, что достаточно трудно выполнить в эксперименте. Видно, что наличие створок приводит к сильному торможению вихревого движения крови, формируемого в процессе сердечного выброса.
Результаты физического моделирования
Преимуществом описанного выше численного анализа является возможность детального изучения движения крови с выявлением зон турбулентности и разрежения для различных вариантов конструкции ИКС, включая размер, кривизну и предельный угол открытия створок. Это позволило оптимизировать параметры протеза аортального клапана, обеспечивающие вращательное движение потока крови с целью снижения гемолиза, тромбообразования и гидравлического сопротивления в систолической стадии.
Для проверки работоспособности модернизированной конструкции протеза был проведен физический эксперимент на имитаторе отдела сердца «левый желудочек – аортальный клапан – аорта» в виде оптически прозрачной камеры из полиметилметакрилата с использованием пульс-дупликатора на основе перистальтического насоса аппарата искусственного кровообращения « Cobe » по схеме, показанной на рис. 11.
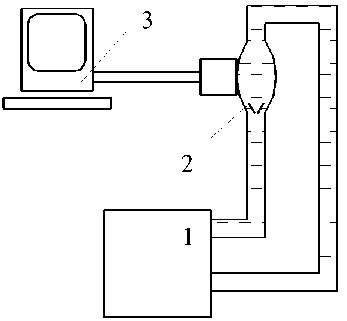
Рис. 11. Схема физического эксперимента: 1 – аппарат искусственного кровообращения, 2 – ИКС, 3 – УЗИ аппарат

Рис. 12. Визуализация течения в зоне установки оптимизированного ИКС
В соответствии с требованиями, изложенными в [11], пульс-дупликатор обеспечивал давление, частоту пульсаций и «ударный объем» в камере, соответствующие условиям живого организма. Визуализация течения заменителя крови при помощи маркеров (рис. 12) показала сохранение вращательного движения (ротации) естественного кровотока после прохождения оптимизированного ИКС.
Заключение
Проведенный анализ полей скоростей и давления в зоне имплантации позволяет оценить адекватность существующих протезов и способствует созданию новых технических решений, минимизирующих гидравлическое сопротивление, тромбообразование, гемолиз и регургитацию путем сохранения естественного кровотока.


