Биомеханический подход к моделированию билиарной системы как шаг в направлении к построению виртуальной модели физиологии человека
Автор: Кучумов А.Г., Няшин Ю.И., Самарцев В.А., Гаврилов В.А., Менар М.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (52) т.15, 2011 года.
Бесплатный доступ
Организм человека вследствие сложной иерархии биологических объектов (молекул, клеток, тканей и органов), образующих взаимосвязанные функциональные системы, является одним из самых затруднительных предметов научного исследования. Технологический прорыв в области диагностики и рассмотрения процессов, происходящих in vivo, а также развитие математических моделей сделали доступной возможность получить достоверные симуляции явлений в организме человека в норме и при патологии. К сожалению, вследствие вышеуказанной сложности это лишь отдельные результаты. Однако перед научным сообществом стоит более глобальная проблема - получить новые знания и объединить уже существующие, полученные для отдельных биологических объектов и систем организма, для создания виртуальной модели физиологии человека. Проект «Виртуальный физиологический человек» (Virtual Physiological Human), началом которого исторически принято считать ноябрь 2005, объединяет учёных из Европы, США и Австралии. Целями данного проекта являются: 1) объяснение и описание физиологических процессов в организме человека, а также патологических состояний и дисфункций;2) идентификация биомаркеров заболеваний для определения точного диагноза; 3) разработка инновационных лекарств;4) индивидуальный подход в лечении каждого пациента, основанный на его персональных характеристиках и особенностях организма, для повышения эффективности терапии;5) построение полной виртуальной модели человека.Целью данной работы является обоснование роли биомеханики в построении модели билиарной системы в рамках проекта «Виртуальный физиологический человек». Модель будет основана на методах вычислительной биомеханики, использовании экспериментальных данных о биологических объектах, входящих в систему, МРТ-снимках, определяющих уникальную анатомию пациента, а также многоуровневом моделировании. В качестве начального этапа в реализации модели в данной работе представлен обзор анатомии билиарной системы, включающей печень, систему желчных протоков, желчный пузырь, сфинктерный аппарат. Рассмотрена гидродинамика желчи в норме; функции печени и её составляющих компонентов на разных уровнях от макро- до нано-. Представлен обзор отдельных работ по биомеханике билиарной системы.
Билиарная система, печень, многоуровневый подход
Короткий адрес: https://sciup.org/146216023
IDR: 146216023 | УДК: 531/534:
Текст научной статьи Биомеханический подход к моделированию билиарной системы как шаг в направлении к построению виртуальной модели физиологии человека
Использующиеся в медицинской практике математические и компьютерные модели процессов, происходящих в организме человека, являются во многих случаях не просто современными подходами, которые играют вспомогательную роль в клинических условиях, но и необходимым инструментом при планировании и моделировании методик операционного вмешательства и оценке возможных последствий, которые сложно предугадать эмпирически. Поэтому одним из актуальных трендов в современной науке на сегодняшний день является проект «Виртуальный физиологический человек» ( Virtual Physiological Human ) [27]. Данный мультидисциплинарный проект объединяет математиков, биомехаников, физиков, биологов, врачей, биохимиков и других специалистов из Европы, США и Австралии. Целями данного проекта являются:
-
• объяснение и описание физиологических процессов в организме человека, а также патологических состояний и дисфункций для развития предиктивной медицины;
-
• идентификация биомаркеров заболеваний для определения точного диагноза;
-
• разработка инновационных лекарств;
-
• индивидуальный подход к лечению каждого пациента, основанный на его персональных характеристиках и особенностях организма, для повышения эффективности терапии;
-
• построение полной виртуальной модели человека.
Спустя пятьдесят лет после открытия Уотсоном и Криком структуры ДНК [29] успехи в молекулярной биологии и клеточной биомеханике повлекли за собой расширение знаний в области генома человека [8, 14], механотрансдукции (передачи внешних механических стимулов в биохимические сигналы на клеточном и субклеточном уровнях) [12, 28], метаболизма [7, 18, 30], изучении эффективности влияния лекарств на системы и органы организма [9]. Данные достижения дали начало новым направлениям медицины, в частности предиктивной (от латинского глагола praedico – предсказывать) медицине [15]. Этот раздел науки ставит задачу не совершенствовать методы лечения заболеваний, а научиться предсказывать вероятность их возникновения. На основе индивидуального строения генома человека и особенностей обменных процессов в его организме (метаболизма) предиктивная медицина может дать правильный прогноз в отношении возможного развития определенных болезней или патологических процессов. Основы предиктивной медицины были заложены в работах французского ученого Жана Доссэ ( Jean Dausset ) [10], получившего Нобелевскую премию в 1980 году, которому удалось обнаружить четкую связь между определенным генетическим набором и заболеваниями, имеющими достаточно сложную, неоднозначную природу возникновения (например, бронхиальная астма, сахарный диабет, гипертоническая болезнь, рак молочной железы, остеопороз) [15]. Это открытие послужило началом для разработки новой методики, позволяющей выявлять варианты сочетаний отдельных участков различных генов, препятствующих развитию болезни или предрасполагающих к ней.
Предиктивная медицина – один из составляющих элементов персонифицированной медицины, направленной на индивидуальное лечение пациента. Важнейшим инструментом персонифицированной медицины должна стать виртуальная модель физиологии человека.
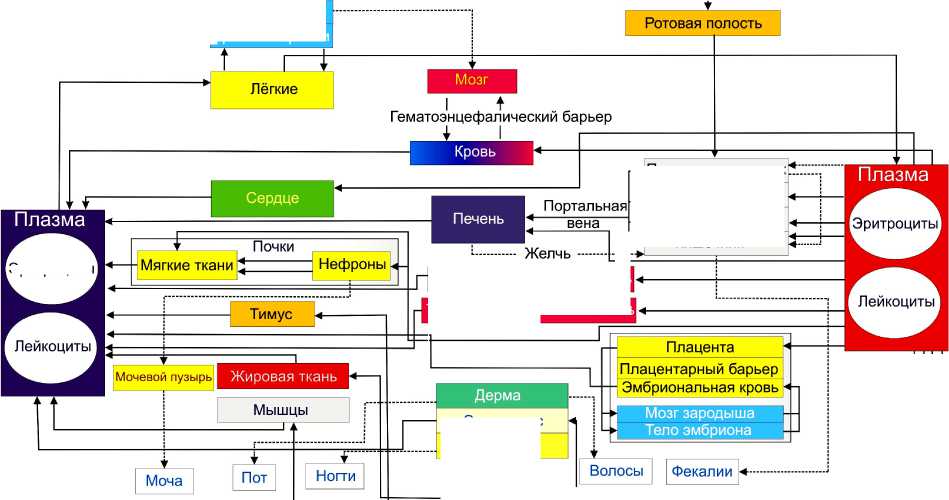
На рис. 1 изображена физиологическая модель организма человека, которая позволяет выделить взаимосвязи между составляющими частями организма на макро- и мезоуровнях. Одним из примеров использования данной модели является анализ влияния химических веществ на процессы в организме, в частности на скорость секреции веществ или на метаболические процессы, с целью разработки базы данных для дозировки лекарственных средств исходя из индивидуальных данных о пациенте (персонифицированная фармакология) [16].
Организм человека вследствие сложной иерархии биологических объектов (молекул, клеток, тканей и органов), образующих взаимосвязанные функциональные системы, является одним из самых затруднительных объектов научного исследования [13].
Вдох
I t
Носоглотка
Трахея и бронхи
Эритроциты
Эпидермис Роговица
— Пищевод и желудок
Селезёнка
_Поджелудочная железа
Кортикальная костная ткань
Трабекулярная костная ткань
Кишечник

Рис. 1. Фармокинетическая модель физиологии организма человека ( physiologically based pharmacokinetic model of whole-body ) [16]
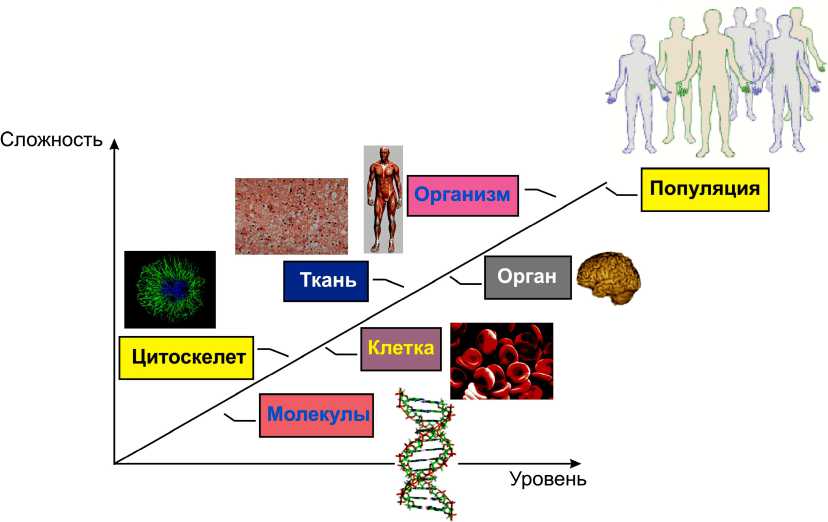
Рис. 2. Многоуровневый подход к построению модели физиологии людей [13]
На рис. 2 изображён многоуровневый подход к построению модели физиологии человека. Ранее было показано, что анатомические единицы тела человека (ткани и органы) обладают комплексной (сложной) гетерогенной структурой (что заключается в нетривиальном взаимодействии между клетками и субклеточными компонентами – цитоскелетом). Сложная структура каждого биологического объекта связана с совокупным механическим, биохимическим, генетическим поведением, определяющим его свойства. Как видно из рис. 2, биологические единицы составляют иерархическую цепочку, которая может быть проанализирована в рамках многоуровневого подхода [13] для установления влияния физиологического поведения отдельных молекулярных объектов на физиологию популяции людей.
В данной работе в рамках многоуровневого подхода описана билиарная система человека. Обосновывается необходимость разработки биомеханической модели, которая будет основана на методах вычислительной биомеханики, использовании экспериментальных данных биологических объектов, входящих в систему, МРТ-снимках, определяющих уникальную анатомию пациента, а также многоуровневом моделировании.
Статья состоит из следующих разделов. В разделе 1 содержатся анатомические сведения о пищеварительной и билиарной системах в целом. Взаимодействие пищеварительной и билиарной систем, в частности, осуществляется посредством секрета печени – желчи, которая поступает в двенадцатиперстную кишку для последующего расщепления жиров. Раздел 2 посвящён биомеханическому анализу печени. Рассмотрена многоуровневая сложная архитектура печени. Описаны функции печени, в том числе секреция желчи (жидкости, играющей важную роль в пищеварении и обменных процессах). В разделе 3 представлен обзор биомеханики течения желчи в желчных протоках и желчном пузыре. Раздел 4 посвящён обзору работ по использованию биомеханического подхода в изучении элементов билиарной системы на различных уровнях.
Пищеварительная система. Взаимодействие пищеварительной И БИЛИАРНОЙ СИСТЕМ
На рис. 3 изображена система пищеварения. При попадании пищи в ротовую полость ( 1 ) происходит первичная обработка. С помощью языка ( 2 ) пища проглатывается. Далее она проходит по длинному и тонкому пищеводу ( 3 ) и попадает в желудок ( 4 ), где с помощью соляной кислоты, вырабатываемой этим органом, происходит дальнейшее переваривание. Кислота может растворить белки, однако жиры ей недоступны. Далее пища небольшими порциями попадает в двенадцатиперстную кишку ( 10 ), где начинается главная обработка пищи, поскольку в кишку открываются как общий желчный проток билиарной системы ( 7 ), так и проток поджелудочной железы ( 12 ) [2].
Почти всегда выводные протоки желчной системы и поджелудочной железы открываются в двенадцатиперстную кишку общим отверстием (фатеров сосочек). Деятельность сосочка регулируется сфинктером Одди ( 11 ), который может как полностью закрывать отверстие, так и открывать [1, 5].
После того как пища размыта желчью и обработана ферментами, крупные молекулы пищи, а именно белки, жиры и углеводы (сахара) разделяются на составляющие их элементы. По мере продвижения пищи по тонкой кишке ( 14 ) эти элементы всасываются клетками. После этого пища поступает в толстую кишку ( 13 ). В толстой кишке всасывается вода, а также некоторые другие вещества, например витамины. Когда вода всосалась, непереваренные остатки пищи превращаются в плотные каловые массы. Червеобразный отросток, или аппендикс ( 15 ), участия в
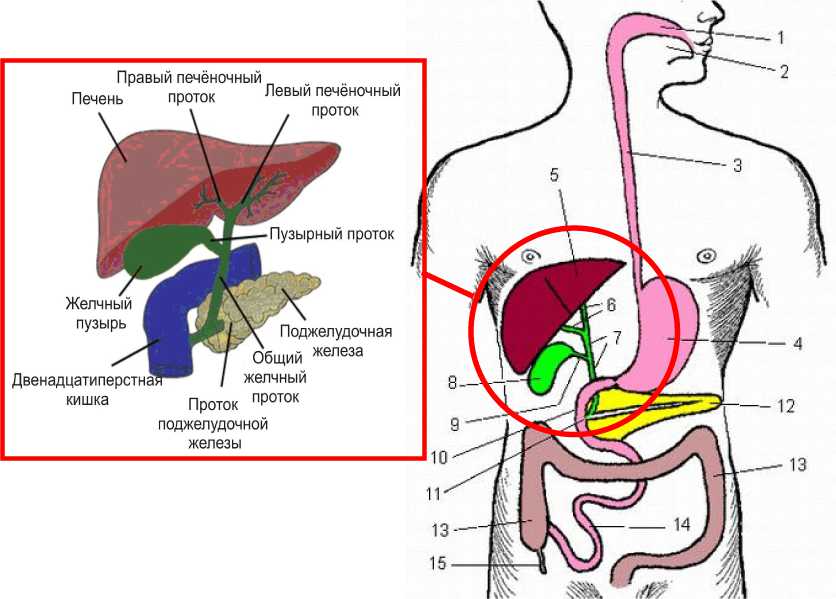
Рис. 3. Схема взаимодействия пищеварительной и билиарной систем: 1 – ротовая полость; 2 – язык; 3 – пищевод; 4 – желудок; 5 – печень; 6 – правый и левый печёночные протоки; 7 – общий желчный проток; 8 – желчный пузырь; 9 – пузырный проток; 10 – двенадцатиперстная кишка; 11 – сфинктер Одди; 12 – проток поджелудочной железы; 13 – толстая кишка; 14 – тонкая кишка; 15 – аппендикс
Макроуровень
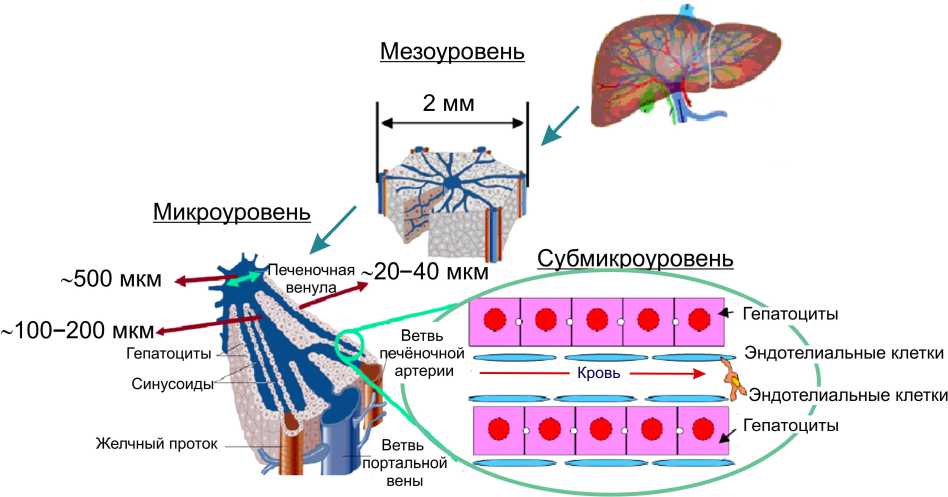
Рис. 4. Многоуровневая архитектура печени пищеварении не принимает, тем не менее он выполняет другую важную функцию – это орган иммунитета брюшной полости [6, 22].
Билиарная система человека включает в себя печень ( 5 ), желчный пузырь ( 8 ), желчный тракт (пузырный проток, печеночные протоки и общие желчные протоки) ( 6, 7 ), сфинктерный аппарат ( 11 ). Рассмотрим элементы билиарной системы подробнее.
Печень
Печень – один из крупных органов в теле человека (рис. 4), участвующий в процессах его жизнедеятельности, которые можно разделить на три категории :
-
1) метаболизм;
-
2) фильтрация и регулирование крови;
-
3) производство желчи.
Ткань печени пронизана двумя системами каналов – портальными трактами и печёночными центральными венозными каналами, которые расположены таким образом, что не касаются друг друга; расстояние между ними составляет 0,5 мм (см. рис. 4). Эти системы каналов расположены перпендикулярно друг другу. Структурной единицей печени на мезоуровне является долька (см. рис. 4), имеющая форму призмы с плоским основанием и плоской вершиной. Общее количество долек в печени равняется примерно пятистам тысячам. Печень получает кровь из печеночной артерии и воротной вены [1, 4]. При вхождении в орган оба сосуда распадаются на долевые, а затем на сегментарные ветви, от последних отходят междольковые вены и артерии, которые вместе с желчными канальцами пронизывают каждую дольку печени. Воротная вена доставляет питательные вещества и венозную кровь из поджелудочной железы и кишечника, а печёночная артерия – артериальную кровь, обогащенную кислородом [6].
Физиология и метаболизм печени
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма белков, жиров и углеводов. К основным функциям печени относятся обмен белков, углеводов, липидов, ферментов, витаминов; водный и минеральный обмен, пигментный обмен, секреция желчи, детоксицирующая функция. Все обменные процессы в печени чрезвычайно энергоемки. Основными источниками энергии являются процессы аэробного окисления цикла Кребса и нуклеотиды, выделяющие значительное количество энергии в результате высвобождения фосфатидных связей при переходе аденозинтрифосфата в аденозиндифосфат.
Детоксицирующая и клиренсная функции печени [2]
Печень участвует в обезвреживании ряда эндогенных токсических продуктов клеточного метаболизма или веществ, поступивших извне. Детоксикации подвергаются вещества, образуемые микробами в кишечнике и через портальную систему попадающие в печень. Это токсические продукты обмена аминокислот – фенол, крезол, скатол, индол, аммиак. Реакции детоксикации осуществляются с помощью ферментов, связанных с гладким эндоплазматическим ретикулюмом и митохондриями.
Некоторые вещества детоксицируются путем включения в синтез веществ, индифферентных для организма или используемых в различных метаболических процессах (включение аммиака в синтез мочевины, нуклеиновых кислот).
Важнейшей реакцией детоксикации является конъюгация, ведущая к инактивированию или повышению растворимости и ускорению выведения образующихся продуктов. Обезвреживание происходит за счет соединения с глюкуроновой или серной кислотой. Химический клиренс крови может осуществляться печенью путем избирательного поглощения вещества из крови и выделения его из организма желчью без химических превращений, например, холестерин может частично выделяться с желчью в неизмененном виде.
Обмен гормонов и витаминов
Стероидные гормоны (например, андрогены и эстрогены) образуются вне печени, но ей принадлежит важнейшая роль в их инактивации и распаде. Именно печень осуществляет ферментативную инактивацию и конъюгацию стероидных гормонов с глюкуроновой и серной кислотами. Печень активно влияет на гомеостатическую регуляцию уровня глюкокортикоидных гормонов. Она синтезирует также специфический транспортный белок крови – транскортин, который связывает гидрокортизон, делая его временно неактивным [5].
Обмен ферментов
Все метаболические процессы в печени осуществляются только благодаря содержащимся в гепатоцитах соответствующим ферментам. Синтез ферментов является одной из важнейших функций печени, а динамическое постоянство ферментных констелляций в печени – необходимое условие ее нормального функционирования. Ферменты имеют белковую природу и синтезируются рибосомами [5]. Некоторые ферменты выделяются с желчью или с мочой.
Патологические процессы в печени вызывают различные нарушения ферментативного равновесия в ней и изменение активности ферментов печеночного происхождения в сыворотке крови. Определение активности тех или иных ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3].
Белковый обмен
Синтез белков в печени осуществляется из свободных аминокислот, приток которых зависит от количественного и качественного состава пищи, активности пищеварительных ферментов, фазы пищеварения и т.д. Колебания поступления аминокислот в нормальных условиях соответствуют суточному циклу активности печеночных клеток.
В печени осуществляются все этапы расщепления белков до образования аммиака и мочевой кислоты, выделяемой затем почками.
Синтез белков и многочисленных ферментов осуществляется в гепатоцитах рибосомами. Большинство заболеваний печени с тяжелыми повреждениями паренхимы сопровождается снижением уровня как альбуминов, так и α-глобулинов. Гипоальбуминемия – один из характерных признаков острой и хронической недостаточности печени.
Углеводный обмен
В печени происходят многочисленные реакции промежуточного обмена углеводов. Особое внимание следует уделить процессу глюкогенеза (формирования глюкозы из аминокислот, лактаты и липидов), а также процессам регуляции глюкозы в крови. Содержание глюкозы в крови превышает норму, поджелудочная железа вырабатывает инсулин, а глюкоза превращается в глюкоген и накапливается в печени. При недостатке в организме питательных веществ или в результате физической активности одним из источников питания служит печеночный гликоген [1].
Жировой обмен
Печень играет ведущую роль в обмене липидных веществ – нейтральных жиров, жирных кислот, фосфолипидов, холестерина. Участие печени в обмене липидов тесно связано с ее желчевыделительной функцией: желчь активно участвует в распаде жиров в кишечнике. При нарушении образования или выделения желчи жиры в повышенном количестве выделяются с калом. Синтез холестерина в основном происходит в печени и кишечнике, где образуется более 90% всего холестерина. Печеночные клетки полностью ответственны за удаление избыточного количества холестерина из организма путем выведения как самого холестерина, так и его производных (желчные кислоты) с желчью. Нарушение печеночно-кишечной циркуляции вследствие окклюзии желчевыводящих путей приводит к резкому возрастанию синтеза желчных кислот из холестерина [4, 7].
Пигментный обмен
Возникновение желтухи всегда обусловлено нарушением обмена билирубина, который образуется в результате распада гемоглобина эритроцитов и разрушения гема (небелковой части гемоглобина). Этот процесс является естественной составной частью постоянного обновления красной крови в организме.
Образование, обмен и транспорт билирубина
Билирубин (от лат. bilis – жёлчь и ruber – красный) – один из желчных пигментов. Билирубин является одним из промежуточных продуктов распада гемоглобина, происходящего в селезёнке, печени и костном мозге [1]. Билирубин содержится в небольших количествах в плазме крови. При затруднении оттока желчи (закупорке жёлчных протоков) и некоторых заболеваниях печени (например, гепатит) концентрация билирубина в крови, а затем и в моче повышается, что вызывает желтуху, а моча окрашивается в характерный тёмный цвет (симптом «моча цвета пива»; нормальный желтоватый цвет мочи также обусловлен билирубином).
Процессы обмена и транспорта билирубина из плазмы в гепатоциты происходят в печеночных синусоидах.
Желчь
Желчь принимает участие в процессах переваривания пищи, а также в регуляции функций желудка и кишечника. Желчь выполняет пищеварительные функции: с нею выводятся экскреты, она участвует в межсуточном обмене. Синтез желчи протекает непрерывно. Она поступает в желчные протоки под давлением 240–300 мм вод. ст. Печень выделяет в сутки около 500–2000 мл желчи, которая состоит главным образом из воды, желчных солей и фосфолипидов. Основные желчные кислоты, хенодезоксихолевая и холевая, синтезируются в печени из холестерина. Желчные кислоты, присутствующие в пище, ингибируют синтез в печени холестерина, но увеличивают его всасывание.
Желчеобразование – многоуровневый процесс, составляющими которого являются: секреция желчи гепатоцитами, экскреция гепатоцитами органических и неорганических компонентов желчи, секреция воды и электролитов эпителиальными клетками желчных протоков, а также реабсорбция воды из первичной желчи эпителием протоковой системы [3].
Различают печеночную (желчь, секретируемая печенью) и пузырную (желчь, меняющая свои свойства вследствие процессов в желчном пузыре) виды желчи.
В табл. 1 представлены концентрации основных компонентов печеночной и пузырной желчи.
В табл. 2 показаны свойства желчи и биомеханические параметры, необходимые для моделирования гидродинамики желчи в билиарной системе.
Гепатоциты
Гепатоциты имеют неправильную многоугольную форму. Средний диаметр клеток – 20–25 мкм. В печени взрослого человека около 250∙109 гепатоцитов, что составляет приблизительно 60% всех клеток, содержащихся в этом органе (рис. 5).
В цитоплазме хорошо развита гранулярная эндоплазматическая сеть, участвующая в синтезе белков крови. Метаболизм углеводов связан с гладкой эндоплазматической сетью.
Встречаются пероксисомы, лизосомы, а также различные включения (жировые, пигментные и др.).
Таблица 1
Концентрация основных компонентов печеночной и пузырной желчи [2]
|
Компонент желчи |
Печеночная желчь |
Пузырная желчь |
|
Вода, % |
98 |
84 |
|
Соли желчных кислот, г% |
0,65–1,4 |
11,5 |
|
Холестерин, г% |
0,08–0,2 |
0,3–1,6 |
|
Фосфолипиды, г% |
0,25 |
0,35 |
|
Билирубин, мг% |
12–140 |
36–630 |
Таблица 2
Биомеханические параметры желчи и билиарной системы [6]
|
Параметр |
Значение |
|
Суточный объем желчи, мл |
500–2000 |
|
Плотность желчи, кг/м3 |
1020 |
|
Кинематическая вязкость желчи, м3/с |
10–6 |
|
Динамическая вязкость желчи, кг/(м∙с) |
10–3 |
|
Длина общего желчного протока, см |
4 |
|
Радиус холедоха, мм |
2,6 |
|
Давление в холедохе, кПа |
1,12 |
|
Давление в двенадцатиперстной кишке, кПа |
0,98 |
|
Давление в желчном пузыре, кПа |
0,59–1,32 |
а б
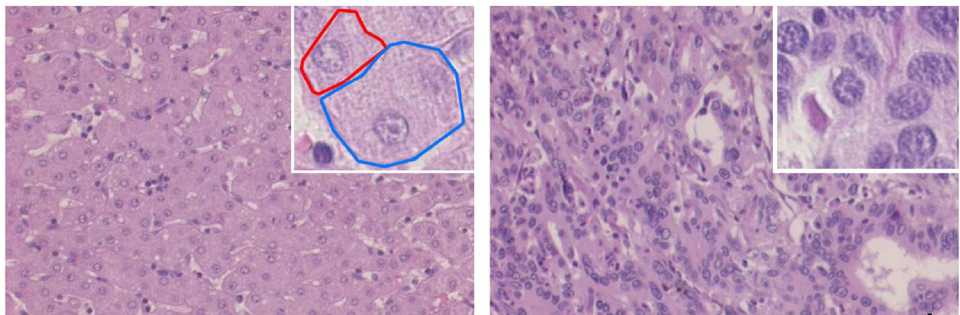
Рис. 5. Влияние внутриклеточных и внешнеклеточных стимулов на структуру и морфологию клетки: а – клетки печени (гепатоциты), которые имеют многоугольную форму in situ ; б – гепатоциты при помещении в культуральную среду постепенно меняют форму на сферическую [13]
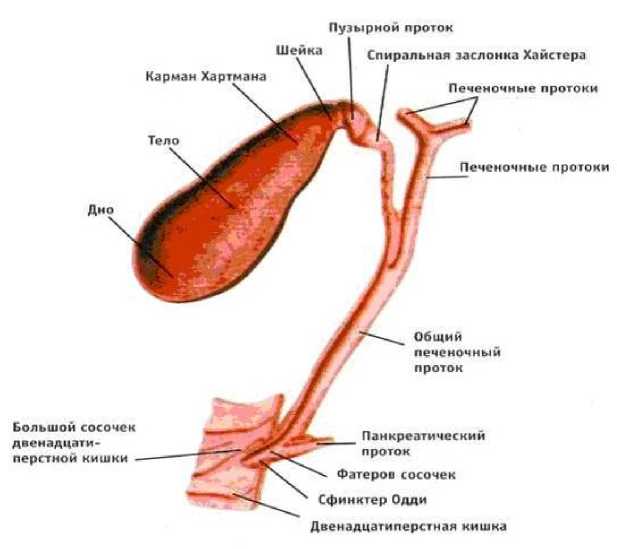
Рис. 6. Система желчных протоков (билиарный тракт) + желчный пузырь + сфинктерный аппарат
Количество включений в гепатоцитах находится в связи с фазами пищеварения. После приема пищи резко возрастает количество гликогена, увеличивается число липидных включений. Для печени характерен выраженный суточный ритм: синтез и выделение желчи интенсивнее происходят днем, а гликоген в большом количестве накапливается ночью. Больше гликогена образуется в клетках, расположенных около центральной вены, а желчи – в гепатоцитах на периферии дольки [20].
Гепатоциты выполняют ряд специфических функций, наиболее важными из которых являются:
-
• мочевинный цикл, в результате которого организм освобождается от избытка продуктов белкового распада, образующихся в кишечнике;
-
• регуляция метаболизма липидов в связи с их обильным поступлением из пищеварительного тракта;
-
• продукция билирубина и желчных кислот с последующей секрецией в желчные канальцы.
Желчный пузырь и желчные протоки
Желчный пузырь
Желчный пузырь – это полый орган, похожий на мешок, имеющий в длину 10 см, который находится в ямке, располагающейся на анатомической границе между правой и левой долями печени. Желчный пузырь имеет дно, тело, воронку и шейку. Дно – это закругленный слепой участок желчного пузыря, который выступает немного за край печени. Тело составляет главную часть желчного пузыря. Шейка представляет собой узкий сегмент желчного пузыря, который расположен между его телом и областью пузырного протока. Воронка, известная также как карман Хартмана, представляет собой небольшой луковицеобразный дивертикул, находящийся на нижней поверхности желчного пузыря. Велика вероятность образования камней в данной области.
Согласно современным исследованиям, накопление желчи в пузыре и его опорожнение – это непрерывные процессы. Переваривание пищи приводит к выделению специального гормона (холецистокинина), который подаёт стимулирующий
Правый печеночный Левый печеночный
кишка
Правый печеночный Левый печеночный
б
а
Правый печеночный
Левый печеночный
проток
проток
Желчный пузырь
Общий печеночный проток
Пузырный проток
Общий желчный проток
Двенадцатиперстная
кишка
Правый печеночный Левый печеночный
в г
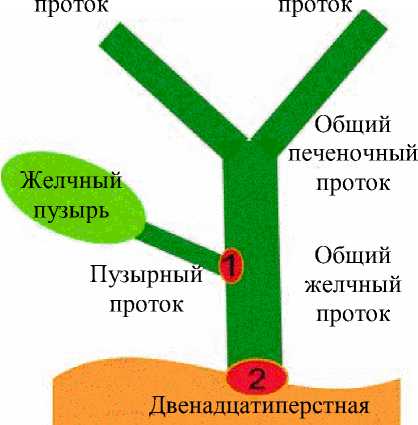
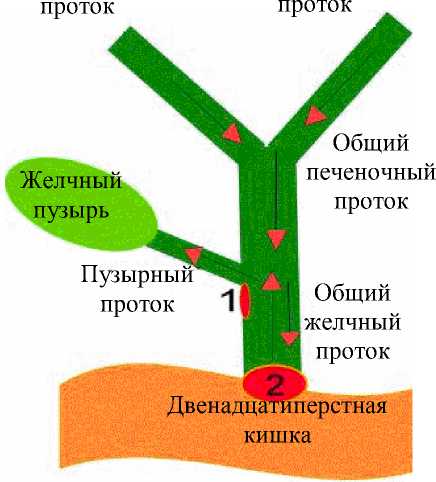
Рис. 7. Система протоков и желчный пузырь: а – исходное состояние (сфинктеры 1 и 2 закрыты); б – стадия поступления желчи в пузырь (сфинктер 1 открыт, сфинктер 2 закрыт); в – движение желчи во время приёма пищи; г – течение желчи после опорожнения желчного пузыря сигнал желчному пузырю для опорожнения. Максимальное опорожнение происходит в течение 90–120 минут после потребления пищи. При сокращении пузыря задействованы элементы нервной системы. Опорожнение желчного пузыря происходит тогда, когда уровень давления внутри желчного протока (связанного с потоком желчи и величиной давления сфинктера) становится выше, чем уровень давления в полости желчного пузыря.
Нарушения моторной функции желчного пузыря могут привести к образованию камней.
Желчные протоки
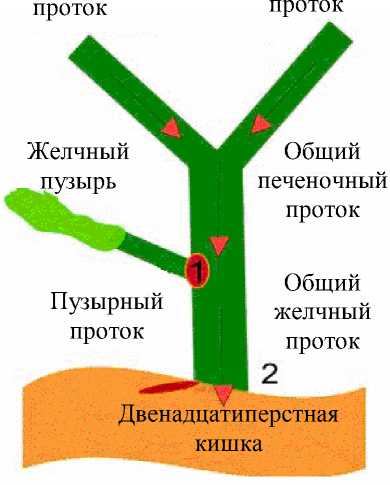
Общий печеночный проток выходит из ворот печени. Пузырный проток служит продолжением шейки желчного пузыря. Общий желчный проток образуется путем слияния общего печеночного и пузырного протоков.
Билиарный тракт (рис. 6) берет свое начало из небольших внутрипеченочных желчных протоков. Правый и левый печеночные протоки выходят из печени и соединяются в воротах, образуя общий печеночный проток, расположенный обычно перед бифуркацией воротной вены и в близком соседстве с правой печеночной артерией. Внепеченочный участок левого протока имеет значительную пpoтяжeннocть. Общий желчный проток обладает протяженностью, составляющей приблизительно 8 см. Он расположен внутри гепатодуоденальной связки, справа от печеночной артерии и впереди воротной вены. Дистальный сегмент общего желчного протока входит в поджелудочную железу. Общий желчный проток открывается в двенадцатиперстную кишку в области фатерового сосочка, отверстия которого окружены сфинктером Одди.
По пути следования желчи из печени в двенадцатиперстную кишку есть несколько сфинктеров, которые предназначены регулировать хранение и использование желчи (рис. 7, а ). Желчь вырабатывается печенью постоянно, однако в периоды между приемами пищи из печени она поступает в желчные протоки. При попадании желчи в общий печеночный проток спиральная заслонка Хайстера (обозначенная номером 1 ) открывается. Одновременно начинает расширяться желчный пузырь, создавая давление, при котором желчь поступает именно в него (рис. 7, б ). Желчный пузырь постепенно наполняется, храня желчь до нужного момента. Стенки пузыря всасывают часть воды из желчи, делая ее более густой. Поэтому желчь из печени отличается от той желчи, которая хранится в желчном пузыре: различают «печеночную» и «пузырную» виды желчи.
Когда в желудок поступает пища, происходит открытие клапана 2 и сокращение желчного пузыря. Он сжимается и выталкивает желчь в общий желчный проток. Далее она уже свободно попадает в двенадцатиперстную кишку (рис. 7, в ).
Когда пузырь опорожнён, но приём пищи продолжается, клапан 1 закрывается и дальше желчь из печени попадает прямо в двенадцатиперстную кишку и этот процесс продолжается до тех пор, пока в ней есть пища (рис. 7, г ).
Биомеханические исследования элементов билиарной системы
Работ, посвященных моделированию отдельных частей билиарной системы, немного. Исследования билиарной системы и реологии желчи с точки зрения биомеханики можно классифицировать следующим образом:
-
• моделирование микроциркуляции крови в печени [23–25];
-
• исследование реологических свойств желчи [19, 22];
-
• моделирование течения желчи в протоке [21];
-
• экспериментальное исследование печени и выбор адекватного определяющего соотношения, описывающего её механическое поведение [11, 17];
-
• моделирование взаимодействия литоэкстракторов из сплавов с памятью формы с желчным протоком [3].
Моделирование микроциркуляции крови в печени
Моделированию микроциркуляции крови в печени посвящены работы [23–25]. В работе [24] Ricken et al. представили модель перестройки течения крови в синусоидах печени при ёё повреждении. Синусоиды рассматривались как пороупругая среда. Авторы предполагают, что синусоиды стремятся расположиться в направлении локального градиента давления. При моделировании нарушения проходимости крови модель способна учесть постепенное выравнивание печенью скорости течения, близкого к норме.
В работе Rani [23] моделировалась область портальной вены и центральной вены, а также синусоидов, соединяющих эти сосуды. Рассматривалось течение крови как в портальной вене с довольно высоким давлением, так и в центральной вене с меньшим давлением.
В работе Siggers [25] разработана математическая модель для оценки микроциркуляции крови в печеночной дольке, которая имеет форму шестиугольной призмы. При решении уравнения Лапласа в области с источниками течения использовался метод конформного отображения.
Исследование реологии желчи
Изучению реологии желчи посвящены работы [19, 22]. В работе [22] исследовалась плотность желчи в желчном пузыре, которая лежит в пределах 965,9– 1014 кг/м3, что близко к значению плотности воды при температуре +20 °С. Однако величина динамической вязкости желчи в желчном пузыре колебалась в пределах от 1,77 до 8 мПа∙с, что значительно отличается от показателя воды. Jungst et al. [19] экспериментально показали, что вязкость желчи, взятой из желчных протоков (0,2 мПа∙с), значительно меньше значения у пациентов с желтыми холестериновыми камнями (5 мПа∙с) и коричневыми пигментными камнями (3,5 мПа∙с).
Моделирование течения желчи в протоках
Моделированию течения желчи в протоках посвящены работы исследователей из Шеффилда [21, 22]. В работе [21] приведены результаты решения одномерной и трёхмерной задач течения желчи как неньютоновской жидкости в упругом желчном протоке с учётом и без учёта влияния стенок протока. Однако недостатком работы являлось идеализированное рассмотрение протока без учёта сфинктеров и реальной структуры стенок протоков, которые имеют анизотропные свойства, поскольку механические свойства желчных протоков обусловлены растяжением образующих соединительную ткань стенки протоков волокон коллагена и эластина [16].
Экспериментальное исследование печени и разработка определяющего соотношения
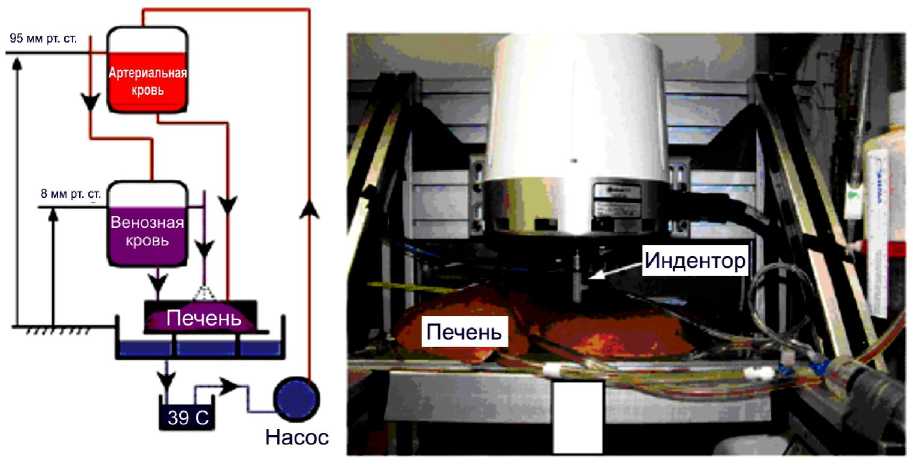
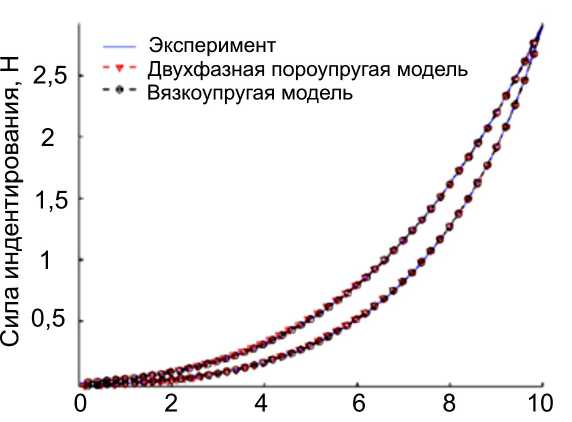
Экспериментальному изучению механического поведения печени ex vivo с помощью метода индентирования c целью изучения свойств данного органа и разработки определяющих соотношений при проведении виртуальных операций посвящены работы [11, 17]. В работе [17] эксперимент проводился на специальной установке с системой перфузии для обеспечения условий, близких к физиологическим. К исследуемому образцу печени, взятой у свиньи, подводили два резервуара с артериальной и венозной кровью, которые поступали в печень при определённых давлениях, как указано на рис. 8. В результате индентирования была получена кривая сила–перемещение. Далее проводился анализ выбора определяющего соотношения для адекватного описания экспериментальных данных. Рассматривались двухфазная пороупругая модель [26] и вязкоупругая модель.
Двухфазная пороупругая модель
В двухфазной модели напряженно-деформированное состояние твёрдой фазы описывается энергией деформации, выраженной в виде полинома второго порядка
Перемещение индентора, мм б
Рис. 8. Изучение механического поведения печени: а – экспериментальная установка; б – сравнение результатов моделей с экспериментом
U = C 1 ( I , - 3) + C 2 ( 1 1 - 3) 2 + 1-JJ 1 - 1) 2 , (1)
D 1
где С 1 , С 2 , D 1 – параметры материала, I 1 – первый инвариант тензора деформации, J el – шаровая часть тензора деформации.
Механическое поведение жидкой фазы описывается законом Дарси:
q = - k V P , (2)
где q - скорость фильтрации, k - коэффициент фильтрации, V P - градиент давления.
Вязкоупругая модель
Вводится потенциал энергии деформации, аналогичный (1), однако рассматривается модуль сдвига в виде
t
G ( t ) - G o ( g „ + g i e т ) , (3)
где G о - мгновенный модуль сдвига, g ю - равновесный модуль сдвига, g 1 - относительная амплитуда релаксации, g 1 = 1 — g ю , т - время релаксации.
а
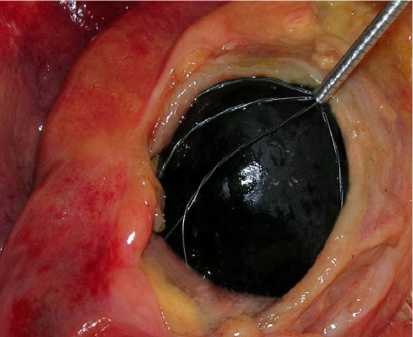
Рис. 9. Литоэкстрактор из материала с памятью формы: а – операция по удаления черного пигментного камня (холедохолитотомия); б – распределение полей деформаций в стенке протока при взаимодействии с экстракторами из нитинола
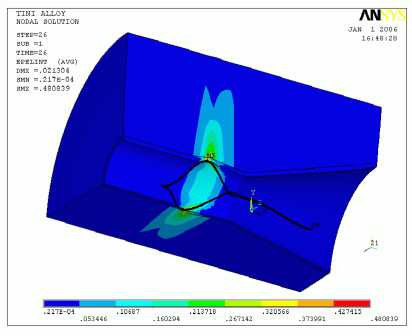
б
Далее проводилась идентификация параметров, входящих в модели. На рис. 8 показано сравнение результатов расчёта с экспериментом.
В работе [11] производились механические испытания мягкой ткани печени на растяжение, сжатие и чистый сдвиг. Были предложены две модели:
-
• гиперупругая модель для изотропного несжимаемого материала;
-
• модифицированная модель Огдена.
Было показано, что обе модели способны описывать нелинейное поведение мягкой ткани в опытах на растяжение–сжатие и дают довольно хорошее приближение в опытах на чистый сдвиг.
Моделирование взаимодействия литоэкстракторов из сплавов с памятью формы с желчным протоком
В работе [3] была показана возможность удаления камней в билиарной системе с использованием нитиноловых литоэкстракторов (рис. 9, а ). Для удаления конкрементов брали литоэкстрактор из никелида титана, охлаждали его, затем деформировали бранши корзины для удобного введения в пузырь проксимальнее камня. Производился захват камня (конкремента), далее при нагревании бранши возвращали первоначальную форму и обхватывали конкремент. После захвата конкремент удалялся из желчных путей. Результаты удаления конкрементов оказались во всех случаях успешными и подтвердили эффективность использования литоэкстракторов из сплава с памятью формы в лечении холелитиаза.
В работе также представлен биомеханический анализ взаимодействия экстракторов (рис. 9, б ), использующихся для удаления камней, со стенками желчных протоков. На основе анализа напряженно-деформированного состояния, полученного в ходе компьютерного моделирования, было определено, что контактные давления литоэкстракторов из никелида титана в несколько раз меньше по сравнению с устройствами из медицинских сталей. Биомеханический анализ позволил выявить факторы билиарной боли и уменьшить риск их возникновения при интраоперационных вмешательствах.
Заключение
Построение полной модели физиологии человека является актуальной задачей биомеханики. Модель должна основываться на результатах применения МРТ-снимков, определяющих уникальную анатомию пациента, а также многоуровневом моделировании, которое должно учитывать поведение организма человека на мелких и крупных уровнях. Основными целями проекта «Виртуальный физиологический человек» являются персонифицированная диагностика и предсказание поведения 46 ISSN 1812-5123. Российский журнал биомеханики. 2011. Т. 15, № 2 (52): 32–48
организма при операционном вмешательстве в случае патологии. В данной работе представлен подход к биомеханическому описанию функционирования билиарной системы. Рассмотрены элементы билиарной системы (печень, желчные протоки, желчный пузырь). Отдельный раздел посвящён результатам, полученным в ходе биомеханических исследований отдельных элементов билиарной системы.
Список литературы Биомеханический подход к моделированию билиарной системы как шаг в направлении к построению виртуальной модели физиологии человека
- Гальперин Э.И., Волкова Н.В. Заболевания желчных путей после холецистэктомии. -М.: Медицина, 1998. -208 с.
- Ильченко А.А. Заболевания желчного пузыря и желчных путей. -М.: Анахарсис, 2006. -448 с.
- Муслов С.А. Обоснование и применение сверхэластичных литоэкстракторов в комплексном лечении холангиолитиаза: автореф. дис. … д-ра биол. наук. -М., 2008. -48 с.
- Панин Л.Е., Костина Н.Е., Шестопалова Л.В. Нарушение обмена билирубина и развитие гипербилирубинемий у новорожденных крысят под влиянием несимметричного диметилгидразина//Сибирский научный медицинский журнал. 2005. Т. 25. № 4. С. 73-78.
- Решетняк В.И. Механизмы желчеобразования и первичный билиарный цирроз печени. -М.: Красная площадь, 2003. -142 с.
- Самарцев В.А. Пути улучшения хирургического лечения холелитиаза у групп высокого операционного риска: оптимизация методов диагностики, этапного эндоскопического и малоинвазивного лечения, прогнозирование и профилактика осложнений: автореф. дис. … д-ра мед. наук. -Пермь, 2005. -38 с.
- Coleman R. Biochemistry of bile secretion//Biochem. J. -1987. -No. 244. -P. 249-261.
- Cortesea R., Krispina M., Weissa G., Berlina K., Eckhardt F. DNA methylation profiling of pseudogene-parental gene pairs and two gene families//Genomics. -2008. -Vol. 91, No. 6. -P. 492-502.
- Csermely P., Agoston V., Pongor S. The efficiency of multi-target drugs: the network approach might help drug design//Trends in Pharmacological Sciences. -2005. -Vol. 26, No. 4. -P. 178-182.
- Dausset J. The cultural impact of scientific innovations. Predictive medicine and its sociological impact. -URL: http://unesdoc.unesco.org/images/0006/000678/067814eb.pdf.
- Gao Z., Lister K., Desai J. Constitutive modeling of liver tissue: experiment and theory//Ann. Biomed. Eng. -2010. -Vol. 38 (2). -P. 23-37.
- Godin L.M., Suzuki S., Jacobs C.R., Donahue H.J., Donahue S.W. Mechanically induced intracellular calcium waves in osteoblasts demonstrate calcium fingerprints in bone cell mechanotransduction//Biomechan. Model. Mechanobiol. -2007. -Vol. 6. -P. 391-398.
- Grizzi F., Chriva-Internati M. The complexity of anatomical systems//Theoretical Biology and Medical Modelling. -2010. -Vol. 14, No. 1. -P. 1-9.
- Hansen T.F., Garm-Spindler K., Andersen F., Lindebjerg J., Brandslund I., Jakobsen A. The predictive value of genetic variations in the vascular endothelial growth factor A gene in metastatic colorectal cancer//The Pharmacogenomics Journal. -2011. -Vol. 11. -P. 53-60.
- Hizel C., Gök S., Sardaş S., Bernard-Gallon D., Maugard C., Genç E. Personalized and predictive medicine in Turkey: a symposium report of the Istanbul working group on personalized medicine//Current Pharmacogenomics and Personalized Medicine. -2009. -Vol. 7. -P. 297-301.
- Ierapetritou M., Georgopoulos P., Roth C., Androulakis I. Tissue-level modelling of xenobiotic metabolism in liver: an emerging tool for enabling clinical translational research//CTS Journal. -2009. -Vol. 2, No. 3. -P. 228-237.
- Jordan P., Socrate S., Zickler T.E., Howe R.D. Constitutive modelling of porcine liver in indentation using 3D ultrasound imaging//J. of the Mechanical Behavior of Biomedical Materials. -2009. -Vol. 17, No. 2. -P. 192-201.
- Julian R. Production and growth related disorders and other metabolic diseases of poultry//The Veterinary Journal. -2005. -Vol. 169. -P. 350-369.
- Jungst D., Niemeyer A., Müller I, Zundt B., Meyer G., Wilhelmi M., del Pozo R. Mucin and phospholipids determine viscosity of gallblader bile in patients with gallstones//World J. Gastroenterology. -2001. -Vol. 7, No. 2. -P. 203-207.
- Lee J., Boyer J. Molecular altrerations in hepatocyte transport mechanisms in acquired cholestatic liver disorders//Seminars in liver disease. -2000. -Vol. 20, No. 3. -P. 373-381.
- Ooi R.C., Luo X.Y., Chin S.B., Johnson A.G., Bird N.C. The flow in the human cystic duct//Journal of Biomechanics. -2004. -Vol. 37 -P. 1913-1922.
- Ooi R.C. Modelling flow of the bile in the human cystic duct. PhD thesis. -University of Sheffield, 2004.
- Rani H., Sheu T., Chang T., Liang P. Numerical investigation of non-Newtonian microcirculatory blood flow in hepatic lobule//J. of Biomechanics. -2009. -Vol. 39, No. 3. -P. 551-563.
- Ricken T.,·Dahmen U., Dirsch A. A biphasic model for sinusoidal liver perfusion remodeling after outflow obstruction//Biomech. Model. Mechanobiol. -2010. -Vol. 9. -P. 435-450.
- Siggers J.H., Bonfiglio A., Leungchavaphongse K., Repetto R. Mathematical modelling of blood circulation in the liver//IFMBE Proceedings. -2010. -No. 1 -P. 454-457.
- Suh J.-K., Spilker R.L. Indentation analysis of biphasic articular cartilage: nonlinear phenomena under finite deformation//J. Biomech. Eng. -1994. -Vol. 116. -P. 1-9. URL: http://europa.eu.int/information_society/activities/health/docs/events/barcelona2005/ec-vph-white-pap er2005nov.pdf.
- Vedula S.R., Lim C.T., Lim T.S., Rajagopal G., Hunziker W., Lane B., Sokabe M. Role of external mechanical forces in cell signal mechanotransduction//Biomechanics at micro-and nanoscale levels/ed. by H. Wada. -World Scientific Publishing, 2007. -P. 172.
- Watson J.D., Crick F. Molecular structure of nucleic acids: a structure for deoxyribose nucleic acid // Nature. - 1954. - Vol. 171 - P. 737-738. Zougbédé S., Miller F., Ravassard P., Rebollo A., Cicéron L., Couraud P., Mazier D., Moreno A. Metabolic acidosis induced by Plasmodium falciparum intraerythrocytic stages alters blood-brain barrier integrity // Journal of Cerebral Blood Flow and Metabolism. - 2010. - Vol. 31. - P. 514-526.


