Биопластический коллагеновый материал Коллост в лечении пациентов с синдромом диабетической стопы (результаты многоцентрового исследования)
Автор: Ступин В.А., Горюнов С.В., Жидких С.Ю., Горский В.А., Сивков А.С., Комаров А.Н., Корейба К.А., Богомолов М.С., Баранцевич Е.Р., Кривихин В.Т., Елисеева М.Е., Бакунов М.Ю., Кривихин Д.В., Богданов Е.А., Габитов Р.Б., Золотарева Л.С., Силина Е.В.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Цель: оценка эффективности применения коллагенового материала у пациентов с синдромом диабетической стопы.Материалы и методы. В многоцентровое исследование включен 71 пациент с синдромом диабетической стопы разной степени тяжести, рандоми- зированных на две однородные группы. Пациенты группы сравнения получали стандартную терапию, у 36 пациентов (основная группа) дополнительно применили коллагеновый биоматериал Коллост.Результаты. Применение биоматериала Коллост приводит к более быстрому и эффективному заживлению язвенного дефекта, площадь раны умень- шалась в основном за счет более быстрого регресса ее ширины, при этом успешность лечения увеличилась в 1,7 раза. Дополнительное использование коллагенового биоматериала привело к увеличению частоты случаев полной эпителизации дефекта с 8,6% до 22,2% на фоне сокращения частоты случаев безрезультатного лечения с 34,3% до 8,3%. Корреляционный анализ показал, что благоприятный исход, выражающийся в хорошем или полном зажив- лении раны/язвы связан с фоново небольшими размерами дефекта, Wagner II без признаков выраженного инфицирования и ишемизации, а также при использовании коллагенового материала. Исход ассоциирован с фоново низким уровнем эритроцитов, сегментоядерных нейтрофилов, белка, с повы- шенным содержанием лимфоцитов, он ухудшался пропорционально стадии и степени поражения, рецидивов СДС, перенесенным ампутациям.
Синдром диабетической стопы, трофическая язва, эпителизация, коллагеновый материал, коллост
Короткий адрес: https://sciup.org/142211704
IDR: 142211704 | УДК: 616-001.4-039.22
Текст научной статьи Биопластический коллагеновый материал Коллост в лечении пациентов с синдромом диабетической стопы (результаты многоцентрового исследования)
В настоящее время заболеваемость сахарным диабетом (СД) демонстрирует резкий рост, принимая характер глобальной эпидемии. Количество людей, страдающих СД, превысило 422 млн, при этом, согласно прогнозам ВОЗ, в ближайшие 25 лет больных СД станет 550 млн [6]. Широкое распространение, продолжительное течение и частое развитие осложнений определяют бремя СД. Одним из таких осложнений, способствующих инвалидизации и социальной дезадаптации, является синдром диабетической стопы (СДС) [21]. Глобальная распространенность СДС составляет 6,3% [23].
В основе развития СДС лежат сосудистая патология [17], и диабетическая нейропатия [16], вследствие которой частым спутником СДС становится отсутствие болевого синдрома и поздняя диагностика заболевания. Большую роль в патогенезе СДС играет образование диабетической язвы и внедрение бактерий в месте дефекта кожных покровов [15]. Возможно также инфицирование раны травматического генеза или операционной раны. Развитие гнойного воспаления и некроза пораженных тканей часто является причиной ампутаций нижних конечностей. При этом 5-летняя выживаемость после ампутации составляет от 30 до 70% [22]. Даже в случае, если пациент выживает, перенеся ампутацию нижней конечности, зачастую подобные операции приводят к инвалидности больного [4; 7].
Лечение СДС требует больших экономических затрат, связанных с частыми госпитализациями, необходимостью реабилитационных мероприятий и высокой стоимостью социального обслуживания лиц с СДС [3].
Для достижения клинического эффекта лечение СДС должно быть мультидисциплинарным [14] и основанным на многофакторном подходе [1; 20]. Обязательными компонентами терапии являются нормализация углеводного обмена, улучшение кровоснабжения пораженной конечности, устранение нагрузки на конечность, антибактериальная терапия и местное лечение [3; 10].
В местном лечении диабетической язвы возможно выделение этапов: этапа санации и этапа стимуляции образования грануляций и эпителизации [3; 8; 9]. Возможно хирургическое иссечение пораженных некротизированных тканей скальпелем, а также использование различных других механических, химических, физических и биологических методов санации.
В литературе описано эффективное местное использование ультразвука, лазера, электромагнитного излучения, различных ферментов, а также коллагена, факторов роста, биоинженерных тканей, гипербарической оксигенации, препаратов серебра и др., способствующее снижению сроков течения гнойно-некротических осложнений СДС [13;8; 9; 11; 2; 5]. Однако, несмотря на использование различных методов лечения, средние сроки заживления язв при СД весьма продолжительны: в случае локализации язв в области пальцев и в передней части стопы они составляют около 150 дней, при локализации язв в средней части стопы – около 190 дней, в пяточной области – около 235-240 дней [19; 18; 12], что свидетельствует о необходимости совершенствования существующих протоколов лечения и разработки и внедрения в практику новых эффективных материалов, используемых для местной терапии СДС.
В связи с этим было проведено многоцентровое исследование основной целью которого являлось изучение эффективности и безопасности использования коллагенового материала Коллост у пациентов с СДС.
Материал и методы
Изучение нового подхода в лечении заживления ран у пациентов с СДС с использованием биоматериала Коллост проводилось в рамках многоцентрового проспективного рандомизированного исследования на базе 5 ведущих лечебнопрофилактических учреждений Москвы, Московской области, Санкт-Петербурга и Казани. Согласно протоколу набор пациентов в исследование осуществлялся по следующим критериям: взрослые пациенты от 18 до 80 лет , с установленным диагнозом СДС в стадии отсутствия декомпенсации сахарного диабета на момент включения в исследование, глубиной поражения: Wagner II, Wagner III, длительность существования раны: 6 недель и более, подписавшие информированное согласие на участие в данном исследовании.
В 2016 году в многоцентровое проспективное сравнительное исследование был включен 71 пациент с синдромом диабетической стопы в возрасте 30-80 лет (средний возраст 58,96±8,11 лет; медиана - 60 лет), в том числе 34 (47,9%) женщины и 37 (52,1%) мужчин, проходивших обследование и лечение на базах специализированных лечебно-профилактических учреждений городов Москва, Санкт-Петербург, Казань, Видное Лыткарино. У 50 пациентов (70,4%) степень поражения соот- ветствовала Wagner II, 21 (29,6%) пациента – Wagner III. Длительность существования язвенного дефекта варьировала от 6 недель до 2 лет, в среднем составила 8,4±9,1 мес (медиана – 6 мес).
В исследование не включались (или были исключены) пациенты с СДС Wagner I, IV, V; с СДС менее 6 недель; при обнаружении персистенции Ps. Aeruginosa / анаэробной инфекции в ране; критической ишемии нижних конечностей; при гипергликемии выше 14 ммоль/л; пациенты с толерантными к проводимой терапии хроническими соматическими заболеваниями в стадии декомпенсации. Инфекционные заболевания, отягощенный аллергоанамнез также являлись критериями исключения.
Включенные в исследование пациенты были распределены на 2 группы путем рандомизации, которая координировалась независимыми специалистами. В группу сравнения вошли 35 человек (19 мужчин и 16 женщин), получавших стандартное лечение без использования коллагенового материала (хирургическая обработка, гидроколлоидные повязки, разгрузка стопы, консервативная фармакотерапия). Основную группу составили 36 пациентов (18 мужчин и 18 женщин) стандартное лечение которых было дополнено использованием коллагенового биоматериала Коллост, применяемого в соответствии с инструкцией в разных формах (гель, мембрана, шарики). Группы пациентов были однородны (p>0,05) (табл. 1).
Исходные размеры дефекта кожи и мягких тканей в обеих группах были сопоставимы (р>0,05). В среднем (медиана) длина в основной группе составила 4,9 см, в группе сравнения – 5,0 см; ширина – 2,8 и 3,0 см соответственно; глубина – 0,3 см в обеих группах. Площадь дефекта составила в среднем в основной группе 13,5 см2 (межквартильный интервал – 5,3 / 38,0 см2), в группе сравнения – 12,6 см2 (межквартильный интервал – 7,5/35,0 см2) (р>0,05), объем – 4,6 см3 (межквартильный интервал – 1,8 / 15,3 см3) и 3,6 см3 (межквартильный интервал – 1,8/ 10,3 см3) соответственно (р>0,05).
Общая продолжительность исследования составила 4 недели для каждого пациента. Оценка состояния проводилась в динамике визит 1 – 1 сутки, визит 2 – 7 сутки, визит 3 – 14
сутки, визит 4 – 28 сутки) и включало следующие методы: сбор анамнеза и жалоб пациента; антропометрические измерения; АД, ЧСС; оценка состояния раны, включая измерение длины, ширины, глубины, площади раны, классификации по Wagner, степени стадии, фотодокументирование; оценка боли по визуальной аналоговой шкале; определение уровня глюкозы крови. При включении в исследование всем пациентам также проводили рентгенографию стопы в двух проекциях; микробиологическое (бактериологическое) исследование отделяемого из раны; оценку состояния макро- и микрогемодинамики (ультразвуковая допплерография (УЗДГ) артерий нижних конечностей, оксиметрия); а также лабораторное обследование, включающее определение уровня гликозилированного гемоглобина наряду со скрининговыми показателями клинического и биохимического анализа крови.
Статистическая обработка результатов исследования проведена с использованием программы SPSS 20.0 с применением стандартных параметрических и непараметрических критериев оценки статистической значимости. Различия считались достоверными при p <0,05. Описательная статистика качественных параметров представлена в виде частот (абс, %), количественных - медиана (Ме), средне ± стандартное отклонение, а также нижний и верхний квартиль в случае, когда параметр имел далекую от нормального функцию распределения. Нормальным принималось распределение, у которого критерий отличия Колмогорова-Смирнова выше 0,05. Для сравнения двух независимых непараметрических выборок использовали критерий Манна-Уитни, для множественного сравнения – Краскелла-Уоллиса. Для сравнения двух зависимых непараметрических выборок использовали критерий Уилкоксона, для множественного сравнения - Фридмана. Качественные переменные сравнивались с помощью теста χ2 (кси-квадрат Пирсона, анализ таблиц сопряженности). Корреляционный анализ выполнен по методу Пирсона.
Результаты исследования и их обсуждение
Результаты исследования показали, что процесс закрытия раны происходил в основном за счет формирования эпителия
Таблица 1
Распределение пациентов по возрасту, полу, классификации Wagner, длительности существования язвенного процесса в обеих группах
Полученный эффект представляет несомненный интерес для медицинских специалистов, потому что оказалось, что уже сама форма дефекта может вызывать обоснованный оптимизм в отношении прогнозируемого исхода или, наоборот, размышления о том, не следует ли раньше подумать о хирургических методах коррекции имеющегося язвенного дефекта.
Результатом достоверного улучшения заживления ширины раны в группе Коллост стала наиболее выраженная и опережающая группу сравнения динамика регресса площади раны (рис. 1). Так, в группе Коллост площадь раны регрессировала в среднем (медиана) с 13,5 см2 на 1-м визите до 10,6 см2 на 2-м визите (в 1,27 раза), 6,3 см2 на 3-м визите (в 2,14 раза) и до 2,1 см2 на 4-м визите (в 6,43 раза). В группе сравнения площадь регрессировала с 12,6 см2 на 1-м визите до 12,5 см2 на 2-м визите (в 1,01 раза), 10,0 см2 на 3-м визите (в 1,26 раза) и до 7,0 см2 на 4-м визите (в 1,80 раза). Статистически значимое межгрупповое различие зарегистрировано на 4-м визите, при котором площадь раны в группе сравнения в среднем была в 3,33 раза больше, чем в группе Коллост (p<0,05).
Скорость регресса объема раны/язвы в группе пациентов с СДС, использующих Коллост, также была наивысшей, достоверно опережающей группу сравнения (рис. 2). Так, в группе Коллост регрессия объема составила в среднем (медиана) с 4,64 см3 на 1-м визите до 2,94 см3 на 2-м визите (в 1,58 раза), 1,30 см3 на 3-м визите (в 3,57 раза) и до 0,34 см3 на 4-м визите (в 13,65 раза). В группе сравнения объем регрессировал с 3,61 см3 на 1-м визите до 3,30 см3 на 2-м визите (в 1,09 раза), 2,34 см3 на 3-м визите (в 1,54 раза) и до 1,10 см3 на 4-м визите (в 3,28 раза).
Таким образом, объективные показатели, подтверждающие лечебные эффекты стандартных методов лечения больных с СДС, были отмечены и в группе сравнения, но эффект от лечения наступал гораздо медленнее. В то же время статистически
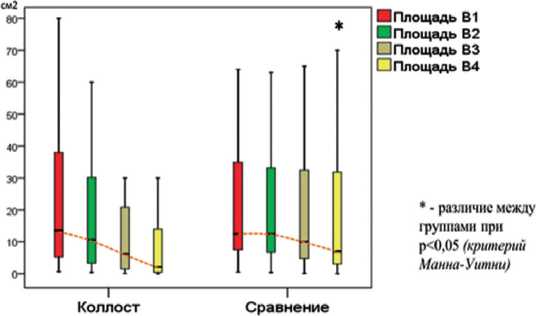
Рис. 1. Динамика площади раны СДС на 1, 7, 14 и 28 сутки исследования в обеих группах (* - различие между группами при р<0,05).
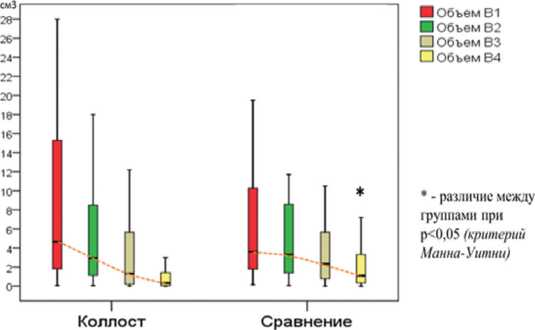
Рис. 2. Динамика объема раны СДС на 1, 7, 14 и 28 сутки исследования в обеих группах (* - различие между группами при р<0,05).
значимое межгрупповое различие зарегистрировано только на 4-м визите, когда объем раны в группе сравнения в среднем был в 3,24 раза больше, чем в группе пациентов, использующих Коллост (p<0,05).
К 28 суткам исследования полная эпителизация была зарегистрирована в 11 случаях (15,5%), в том числе, в 8 случаях в группе Коллост (22,2%) и у 3 пациентов группы сравнения (8,6%). Отсутствие эпителизации или заживление площади раны менее, чем на 25% от первоначальной к 28 суткам (что формулировалось как безрезультатность лечения) была зарегистрирована в 15 случаях (21,1%), в том числе, в 3 случаях в группе Коллост (8,3%) и у 12 пациентов группы сравнения (34,3%). Следовательно, назначение биоматериала Коллост в рамках стандартной терапии СДС приводило уже через месяц лечения к увеличению частоты случаев полной эпители-зации раны в 2,58 раза при одновременном уменьшении частоты случаев безрезультатного лечения в 4,13 раза (табл. 2).
Проведенный корреляционный анализ подтвердил ряд устоявшихся истин. Исход зависит от глубины поражения, размеров раны/язвы (длины и ширины, площади и объема раны/
Таблица 2
Частота случаев полной эпителизации и безрезультатного лечения в обеих группах к 28 суткам (p<0,05; x2)
Благоприятный исход ассоциирован с фоново небольшими размерами язвенного дефекта, с уровнем поражения Wagner II, без признаков выраженного инфицирования и ишемизации раны/язвы. Успех сопутствовал пациентам без гемодинамических нарушений, определяемых по данным инструментальных исследований, а также пациентам, получавших дополнительное лечение с применением материала Коллост. Последнее лишний раз подчеркивает эффективность средств, содержащих коллаген, в рамках лечения пациентов с синдромом диабетической стопы, которые используют привычный для клеток биологический маркер.
Неблагоприятный исход (незаживление или слабое заживление язвенного дефекта <25%) достоверно связан с большими фоновыми размерами СДС, с глубиной поражения Wagner III, а также с гемодинамически значимым нарушением кровоснабжения конечности. При этом исход ухудшался пропорционально стадии и степени поражения, а также уровню перенесенной ампутации конечности по поводу ранее проводимого безуспешного лечения СДС. Кроме того, неблагоприятный исход к 28 суткам лечения был зарегистрирован у пациентов, у которых на 1-м визите наблюдался низкий уровень эритроцитов, сегментоядерных нейтрофилов, белка, а также у пациентов с повышенным содержанием лимфоцитов. Это говорит о значимой роли иммунной системы и белкового обмена в патогенезе сахарного диабета и СДС.
Несмотря на устоявшееся мнение о значимости оценки уровня гликированного гемоглобина для прогноза заживления раны (как и уровня глюкозы крови), проведенный анализ на коротком интервале времени наблюдения за пациентом, это мнение не подтвердил.
Заключение
Таким образом, использование биоматериала Коллост является эффективным и безопасным для лечения синдрома диабетической стопы. Добавление к стандартным методам лечения пациентов с СДС биоматериала Коллост безопасно ускоряет заживление раневых поверхностей и увеличивает число благоприятных результатов.
Вместе с тем остается ряд вопросов, которые не были поставлены при планировании исследования и возникли в процессе его проведения. Так, в результате проведенного многофакторного корреляционного анализа было выявлено, что кроме размеров язвы важными прогностическими признаками успешности предстоящего лечения являются тяжесть органной ишемии, вызванная поражением сосудов нижних конечностей и/или хроническая анемия, отсутствие адекватного иммунного ответа, характеризующегося снижением количества зрелых фагоцитов (сегментоядерных нейтрофилов) и отсутствием молодых лейкоцитарных форм. Зарегистрированный у этих пациентов лимфоцитоз, заставляет думать о попытках организма включить механизмы иммунной защиты, однако эти процессы, видимо не заканчиваются синтезом цитокинов. Учитывая, что у этих же пациентов регистрируется гипо и диспротеинемия, становится очевидным, что причиной всем нарушениям иммунитета служит развивающиеся по разным механизмам нарушения синтеза белков.
Осуществленный корреляционный анализ данных, полученных в процессе проведения исследования, выявил несколько объективных лабораторных факторов, которые ранее не учитывались при проведении лечения у пациентов с синдромом диабетической стопы и не отражены в стандартах оказания помощи. Тесная корреляционная связь, доказанная при анализе материала в представленной группе больных позволит сделать еще один шаг в сторону персонализированной медицины.
Авторы приносят глубокую благодарность всем соисследо-вателям, научным коллективам, участвовавшим в проведении данной исследовательской работы.
Список литературы Биопластический коллагеновый материал Коллост в лечении пациентов с синдромом диабетической стопы (результаты многоцентрового исследования)
- Аникин А.И. Значение оценки микроциркуляторных нарушений в хирургическом лечении гнойно-некротических поражений при синдроме диабетической стопы//Дисс. канд. мед. наук. М.: 2009.
- Грекова Н.М., В.Н. Бордуновский. Хирургия диабетической стопы. М.: Медпрактика-М.: 2009.
- Рациональная антибактериальная терапия гнойных осложнений синдрома диабетической стопы/М.Д. Дибиров //Ангиология и сосудистая хирургия. 2012. № 18. С. 113-114.
- Фармакоэкономические аспекты лечения синдрома диабетической стопы/М.Ф. Калашникова //Сахарный диабет. 2010. № 2. С. 113-119.
- Курлаев П.П., Чернова О.Л., Киргизова С.Б. Воздействие окси-тоцина, лазерного и электромагнитного излучения на персистентные свойства Staphylococcus aureus. Журнал микробиологии, эпидемиологии и иммунологии. Приложение. 2000. № 4. С. 62-64.
- Международная Федерация Диабета//Атлас диабета. 2013. URL: ww.idf.org/diabetesatlas (дата обращения: 23.01.2017).
- Фактическая стоимость комплексного хирургического лечения больных нейроишемической формой синдрома диабетической стопы/В.А. Митиш //Хирургия. 2015. № 4. С. 48-53.
- Москвин С.В. Системный анализ эффективности управления биологическими системами низкоэнергетическим лазерным излучением//Автореф. дисс. д-ра биол. наук. Тула: 2008.
- Сергеев Н.А. Низкоинтенсивное лазерное излучение в лечении трофических язв и длительно незаживающих ран//Рос. журн. кожных и венерических болезней. 2003. № 2. С. 16-20.
- Токмакова А.Ю., Доронина Л.П., Страхова Г.Ю. Хронические раны и Сахарный диабет: современная концепция и перспективы консервативного лечения//Сахарный диабет. 2010. № 4. С. 63-68.
- Молекулярно-клеточные механизмы лазерной и антиоксидантной коррекции заживления ран/М.П. Толстых //Лазерная медицина. 2006. № 2. С. 40-46.
- Усманов Н.У. Гейниц А.В., Хван И.Н. Особенности регенерации ран разного генеза в условиях высокогорья и методы стимуляции репараторных процессов//Лазерная физика и применение лазеров. Минск: 2003.
- Bakker K, Apelqvist J, Schaper NC. International Working Group on Diabetic Foot Editorial Board//Practical guidelines on the management and prevention of the diabetic foot 2011/Diabetes Metab Res Rev. 2012. 28 (1): 225-31.
- Interdisciplinary treatment of diabetic foot wounds in the elderly: Low risk of amputations and mortality and good chance of being mobile with good quality of life/B. Hartmann //Diab Vasc Dis Res. 2017. 14(1): 55-58.
- Izumi Y, Satterfield K, Lee S. Mortality of first-time amputees in diabetics: a 10-year observation//Diabetes Res. Clin. Pract. 2009. 83 (1): 126-131.
- Kempler P. Neuropathies. Pathomechanism, clinical presentation, diagnosis, therapy. Springer. 2002.
- Mills JL. Lower limb ischaemia in patients with diabetic foot ulcers and gangrene: recognition, anatomic patterns and revascularization strategies//Diabetes Metab Res Rev. 2016. 32 (1): 239-45.
- Diabetic foot disease: impact of ulcer location on ulcer healing/K.M. Pickwell//Diabetes Metab Res Rev. 2013. 29 (5): 377-383.
- Resource utilisation and costs associated with the treatment of diabetic foot ulcers. Prospective data from the Eurodiale Study/Prompers L //Diabetologia. 2008. 51(10): 1826-1834.
- Прошин А.В. Особенности динамики раневого процесса у больных с гнойно-некротическими формами синдрома диабетической стопы при использовании комплексного подхода в хирургическом лечении//Вестник Нижегородского Государственного Университета. 2011. № 62. С. 78-83.
- Association of Sociodemographic Factors with Spirituality and Hope in Patients with Diabetic Foot Ulcers/G.M. Salome //Adv Skin Wound Care. 2017. 30(1): 34-39.
- Comparison of Transtibial Amputations in Diabetic Patients With and Without End-Stage Renal Disease/D.K. Wukich //Foot Ankle Int. 2017. 1: 107-110.
- Global epidemiology of diabetic foot ulceration: a systematic review and meta-analysis/P. Zhang //Ann Med. 2017. 49 (2): 106-116.


