Биопленки углеводородокисляющих бактерий антропогенно нарушенных почв г. Когалыма
Автор: Коробейникова А.С., Голубев Д.М., Тарасюк А.К., Уткин Д.В., Нечаева О.В., Глинская Е.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Определены биологические свойства и условия формирования биопленок углеводородокисляющими бактериями для их дальнейшего применения в очистке от нефтезагрязнений и рекультивации антропогенно нарушенных почв. Объектом исследования явились углеводородокисляющие микроорганизмы, выделенные из проб почв г. Когалыма: Bacillus alcalophilus WS-3027B, B. funiculus LY-2403G, B. halodurans MH-3011N, B. niacini TC-8101S, B. psychrodurans LV-1106E, Curtobacterium flaccumfaciens AE-0851V. Для выявления способности бактерий образовывать биопленки использовали метод определения степени формирования биопленок в стационарной фазе роста путем окрашивания кристаллическим фиолетовым по методу O'Toole et al. Обнаружено, что среди нефтеокисляющих микроорганизмов штаммы B. alcalophilus WS-3027B и C. flaccumfaciens AE-0851V характеризуются плотной продукцией биопленки, штаммы B. halodurans MH-3011N, B. niacini TC-8101S, B. funiculus LY-2403G, B. psychrodurans LV-1106E – умеренной продукцией биопленки. Установлены оптимальные условия образования биопленок исследуемыми микроорганизмами. Проведенное изучение биопленкообразования углеводородокисляющих бактерий открывает перспективы использования данных штаммов в качестве активных деструкторов нефтепродуктов при биоремедиации загрязненных почв.
Биопленки, углеводородокисляющие микроорганизмы, почва, нефтяное загрязнение, биоремедиация
Короткий адрес: https://sciup.org/147252648
IDR: 147252648 | УДК: 579.2 | DOI: 10.17072/1994-9952-2025-4-406-414
Текст научной статьи Биопленки углеводородокисляющих бактерий антропогенно нарушенных почв г. Когалыма
Нефть является наиболее востребованным энергетическим ресурсом и основой мирового экономического прогресса и процветания, однако, попадая в окружающую среду, она оказывает негативное воздействие, подвергая риску как качество жизни человечества, так и биосферу в целом [Luo et al., 2024]. Разливы нефти пагубно сказываются на плодородии почвы и приводят к потере сельскохозяйственных угодий [Ajona, Vasanthi, 2021]. Вследствие этого требуется применение современных стратегий в проведении очистительных мероприятий для удаления нефти и нефтепродуктов из почв [Tayyeb at al., 2024; Плешакова и др., 2025].
Углеводородные компоненты нефти, благодаря своей химической стабильности и высокой устойчивости к различным биологическим превращениям, являются опасными загрязнителями окружающей среды, трудности удаления их из почвы связаны со сложностью состава и гидрофобностью [Adeniji, Okoh, Okoh, 2017; Vu, Mulligan, 2022; Hegazy at al., 2024].
Физико-химические подходы к удалению разлитой нефти, несмотря на свое частое применение, обычно оказываются непрактичными как с экономической, так и экологической точки зрения [Rosenberg, 1993]. Поэтому биоремедиация, осуществляемая с помощью микроорганизмов, является наиболее подходящим вариантом очистки почвы от нефти и нефтепродуктов [Ajona, Vasanthi, 2021]. Этот метод основан на способности микроорганизмов вовлекать углеводороды в процессы метаболизма, используя их в качестве источника углерода и энергии и приводя к их минерализации с образованием углекислого газа, воды и безвредных соединений [Bala et al., 2022].
Многие бактерии, обитающие в почве, способны образовывать на поверхности клеточной стенки слизистый слой, защищающий их от действия неблагоприятных факторов окружающей среды (механического повреждения, высушивания, осмотического стресса и т.д.). Кроме того, за счет слизеобразования колонии микроорганизмов прочно удерживаются на твердой поверхности, способны к агрегации и образованию биопленок [Сопрунова, Нгуен Виет Тьен, 2010]. Биопленка представляет собой слой иммобилизованных клеточных полимеров, состоящих из полисахаридов, белков, нуклеиновых кислот, липидов и гумуса [Gupta, Thakur, 2016]. Именно благодаря биопленкам бактерии получают ряд преимуществ, таких как способность к адгезии, возможность обмена метаболитами и устойчивость к стрессам окружающей среды [Santos et al., 2018]. Исследование бактериальных биопленок и условий их формирования позволит глубже изучить экологию микроорганизмов и поможет в разработке биопрепаратов, направленных на очищение загрязненных углеводородами нефти почв [Verma et al., 2023; van Hoogstraten et al., 2024]. Оптимальная температура образования биопленки для большей части бактериальных организмов – в пределах от 20 до 30°C. Снижение температуры ниже 9‒10°C резко ухудшает условия деятельности микроорганизмов [Прикладная экобиотехнология, 2012]. Кроме того, рН среды также оказывает влияние на формирование биопленки [Hostaka, Ciznár, Stefkovicová, 2010; Спирина, Русакова, 2021]. Способность угле-водородокисляющих бактерий к образованию биопленок в почвах с различными значениями рН (кислыми, нейтральными, щелочными) в широком диапазоне температур является важным фактором при разработке препаратов для биоремедиации почв от нефтезагрязнений.
Цель исследования – определить биологические свойства и условия формирования биопленок угле-водородокисляющими бактериями.
Материалы и методы исследования
Объектом исследования явились 6 штаммов углеводородокисляющих бактерий ( Bacillus alcalophilus WS - 3027B , B. funiculus LY - 2403G , B. niacini TC-8101S , B. psychrodurans LV-1106E , B. halodurans MH-3011N , Curtobacterium flaccumfaciens AE-0851V), выделенных из проб почв, отобранных на территории г. Когалыма Ханты-Мансийского автономного округа (ХМАО) Тюменской обл.
Город Когалым расположен в зоне вечной мерзлоты. Климат г. Когалыма, находящийся под непосредственным влиянием Арктики, характеризуется как резко континентальный (субарктический) с суровой продолжительной зимой и коротким теплым летом. Температура почвы на глубине 20 см составляет в среднем 8‒9°С [График температуры: эл. ресурс]. Почва на территории г. Когалыма относится к группе дистрик-гистосолей – торфяно-болотных почв верховых болот, характеризующихся кислой средой [Кле-банович, 2015; Почвы Когалыма: эл. ресурс; Дистрик-гистосоль: эл. ресурс].
В связи с этим представляет интерес изучение способности к формированию биопленок у представителей указанных выше видов при данных климатических и эдафических факторах.
Для оценки степени формирования биопленок использовали агаровые бактериальные культуры в стационарной фазе роста. Бактерии выращивали на ГРМ-агаре рН 7.2 (ФБУН ГНЦ ПМБ Роспотребнадзора, Оболенск) при температуре 28°С в течение 24 ч. Бактериальные взвеси готовили в 0.9% растворе хлорида натрия в концентрации, соответствующей 10 единицам отраслевого стандартного образца мутности (ОСО 42-28-59-85П (10 МЕ), ФГБУ «НЦЭСМП» Минздрава России), эквивалентной концентрации 1.1×108 КОЕ/мл Bacillus sp. [СО мутности…: эл. ресурс]. Взвеси микроорганизмов переносили в ГРМ-бульон (ФБУН ГНЦ ПМБ Роспотребнадзора, Оболенск) с рН, равной 3, 5, 7, 8 и 9, до конечной концентрации 5×107 КОЕ/мл. Культуры микроорганизмов в бульоне вносили по 200 мкл в лунки полистироловых 96-луночных плоскодонных планшетов для культивирования клеток и тканей (Jet Bio-Filtration, Китай, РУ № ФСЗ 2012/12495 от 02.06.2020 г.) и инкубировали при температурах 6, 28, 37, 42°С без встряхивания в течение 72 ч. В лунки отрицательного контроля вносили 200 мкл ГРМ-бульона рН 7.2. Далее из лунок планшетов отбирали среду с планктонными клетками, лунки промывали в течение 2‒3 мин стерильным физиологическим раствором в объеме 200 мкл. Физиологический раствор полностью удаляли из лунок и высушивали планшеты в течение 20 мин. Окраску биопленок на поверхности лунок проводили по методу O'Toole, основанному на способности красителя кристаллического фиолетового связываться с клетками и внеклеточным матриксом биопленок [O'Toole, Kaplan, Kolter, 2000]. Для этого в лунки планшетов вносили по 200 мкл отфильтрованного 0.2% раствора кристаллического фиолетового в 96% этиловом спирте и инкубировали в течение 15 мин при комнатной температуре. Краситель удаляли из лунок. Несвязавшийся краситель отмывали троекратно водопроводной водой. Планшеты высушивали 30 мин. Затем в лунки добавляли 96% раствор этанола в объеме 200 мкл для элюции связанного с биопленкой красителя. Растворитель отбирали, помещали в чистые плоскодонные планшеты и измеряли оптическую плотность при длине волны 595 нм. В качестве контроля использовали лунки, инкубированные с чистой средой, подвергнутые аналогичным манипуляциям.
Количественную оценку образования биопленки в каждой лунке проводили по формуле [Adeniji, Okoh, Okoh, 2017]:
OD отн =OD абс /OD с , где OD отн – относительная оптическая плотность красителя, OD абс – абсолютная оптическая плотность красителя, OD с – оптическая плотность (OD) отрицательного контроля+3 sd.
Умеренную продукцию биопленки считали при 2×OD
с
≤OD
отн
≤4×OD
с
, плотную продукцию считали при 4×OD
с
Статистическую обработку полученных данных осуществляли с применением общепринятых статистических методов [Урбах, 1975; Лакин, 1990] в программе Microsoft Office Excel (Microsoft, США).
Результаты и их обсуждение
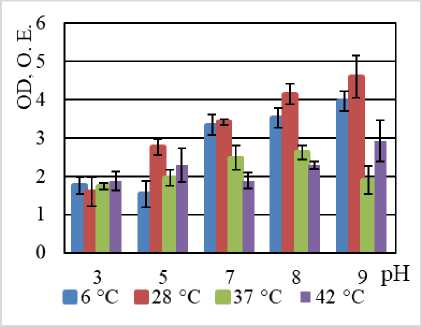
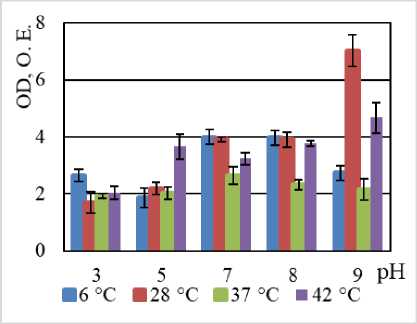
Полученные результаты представлены на рисунке и в таблице.
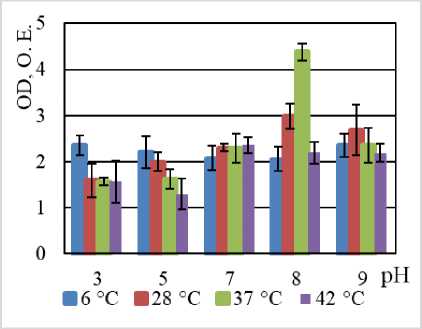
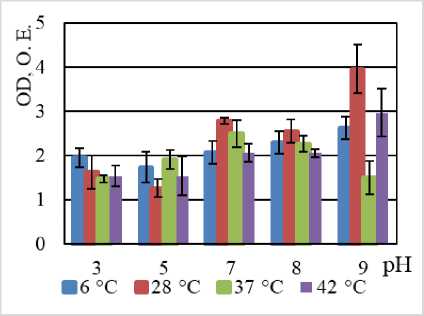
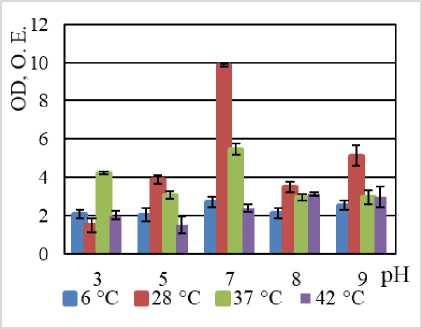
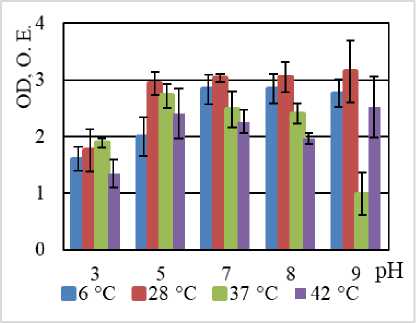
По нашим данным, максимальная продукция биопленки наблюдается у всех штаммов в температурном оптимуме их роста: B. halodurans MH-3011N – при 37°С, B. niacini TC-8101S – 30°С, B. alcalophilus WS-3027B – 30°С, B. funiculus LY-2403G – 22°С, B. psychrodurans LV-1106E – 22°С, C. flaccumfaciens AE-0851V – 30°С [Bacterial Diversity: эл. ресурс]. Среди изучаемых углеводородокисляющих микроорганизмов 2 штамма – Bacillus alcalophilus WS-3027B и C. flaccumfaciens AE-0851V – характеризуются плотной продукцией биопленки по (Stepanovic, Vuković, Hola [2007]), остальные 4 штамма – B. halodurans MH-3011N, B. niacini TC-8101S, B. funiculus LY-2403G, B. psychrodurans LV-1106E характеризуются умеренной продукцией биопленки (см. таблицу). Для большинства исследованных штаммов максимальная продукция биопленки наблюдалась при нейтральных и щелочных показателях среды. Это согласуется с литературными данными об адаптации гало- и алкалофильных бактерий к высоким значениям рН, к кото- рым относятся B. halodurans MH-3011N, B. alcalophilus WS-3027B, к высоким значениям рН [Irwin, 2020;
Alkalihalobacillus : эл. ресурс].
(а)
(б)
(в)
(г)
(д)
(е)
Способность к биопленкообразованию штаммами:
B. halodurans MH-3011N (а), B. niacini TC-8101S (б), B. alcalophilus WS - 3027B (в), B. funiculus LY - 2403G (г), B. psychrodurans LV-1106E (д), C. flaccumfaciens AE-0851V (е)
Biofilm-forming capability of the strains:
B. halodurans MH-3011N (a), B. niacini TC-8101S (b), B. alcalophilus WS - 3027B (c),
B. funiculus LY - 2403G (d), B. psychrodurans LV-1106E (e), C. flaccumfaciens AE-0851V (e)]
Условия биопленкообразования микроорганизмами [Conditions of biofilm formation by microorganisms]
|
Штамм |
Характеристика |
|
B. halodurans MH-3011N |
Наибольшая продукция биопленки наблюдается в щелочной среде (рН 8) при температуре 37°С. При кислых рН (рН=3.5) максимальная продукция биопленки наблюдается при температуре 6°С. Продукция биопленки умеренная. |
|
B. niacini TC-8101S |
Наибольшая продукция биопленки наблюдается в щелочной среде (рН 9) при температуре 28°С. При кислых рН (рН=3) максимальная продукция биопленки наблюдается при температуре 6°С. Продукция биопленки умеренная. |
|
B. alcalophilus WS - 3027B |
Наибольшая продукция биопленки наблюдается в нейтральной среде (рН 7) и в щелочной среде (рН 9) при температуре 28°С. Штамм характеризуется плотной продукцией биопленки (ODc>4). |
|
B. funiculus LY - 2403G |
Равномерная продукция биопленки наблюдается в широком диапазоне рН (от 5 до 9) при температуре 28 и 6°С. Продукция биопленки умеренная. |
|
B. psychrodurans LV-1106E |
Наибольшая продукция биопленки наблюдается в щелочной среде (рН 9) при температуре 28 и 6°С. Продукция биопленки умеренная. |
|
C. flaccumfaciens AE-0851V |
Наибольшая продукция биопленки наблюдается в щелочной среде (рН 9) при температуре 28°С. При кислых рН (рН 3) максимальная продукция биопленки наблюдается при температуре 6°С. Штамм характеризуется плотной продукцией биопленки (ODc>4). |
В то же время представляет интерес поиск штаммов, сохраняющих способность к формированию биопленки в экстремальных условиях субарктического пояса при низких температурах и кислой среде подзолистых почв, подзолов и верховых торфяников для практического использования при биоремедиации почв от нефтезагрязнений углеводородами. Установлено, что в кислых средах у всех штаммов сохранялась умеренная продукция биопленки.
Максимальная продукция биопленки у большинства штаммов наблюдалась при оптимальной температуре роста 28°С. Однако ряд штаммов сохраняли умеренную продукцию биопленки при низких температурах в кислых и слабокислых средах – условиях, имитирующих вечную мерзлоту. Следовательно, наиболее подходящими видами для биоремедиации почв г. Когалыма с учетом биопленкообразования и экологических условий (кислые почвы, низкие температуры) оказались B. halodurans MH-3011N, B. ni-acini TC-8101S , C. flaccumfaciens AE-0851V (таблица). В то же время вид C. flaccumfaciens AE-0851V в качестве свободноживущих бактерий длительно не сохраняется в почве, т. к. не образует спор [ Curto-bacterium flaccumfaciens : эл. ресурс].
Заключение
Таким образом, проведена оценка эффективности биопленкообразования 6 штаммов углеводородо-кисляющих микроорганизмов родов Bacillus и Curtobacterium , выделенных из проб почв г. Когалыма. Установлено, что штаммы углеводородокисляющих бактерий способны к максимальной продукции биопленки в оптимальных для своего роста условиях. В то же время отмечено, что представители B. halodurans MH-3011N, B. niacini TC-8101S , C. flaccumfaciens AE-0851V характеризуются умеренной способностью к пленкообразованию при низких температурах и кислых значениях рН среды, что свидетельствует о перспективности их использования при разработке биопрепаратов для биоремедиации почв от нефтезагрязнений в условиях субарктического пояса.
Полученные в результате исследования данные можно использовать для комплексного подхода при биоремедиации урбосистем и прогнозирования состояния антропогенно нарушенных территорий. Проведенное изучение биопленкообразования углеводородокисляющих бактерий, выделенных из проб почв г. Когалыма, открывает перспективы использования представителей данных видов в качестве активных деструкторов нефтепродуктов.


