Биосинтез бактериальной целлюлозы культурой мedusomyces gisevii
Автор: Гладышева Е.К., Скиба Е.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 3 (65), 2015 года.
Бесплатный доступ
Бактериальная целлюлоза - органический материал, синтезируемый внеклеточно микрорганизмами. Бактериальная целлюлоза может быть использована в различных отраслях промышленности. Особенно широкое применение бактериальная целлюлоза нашла в медицине. Получение бактериальной целлюлозы - сложный и длительный процесс. Главным критерием успешного протекания процесса является получение максимального выхода бактериальной целлюлозы. В России нет действующего производства бактериальной целлюлозы, поэтому исследования в данной области являются ультраактуалными. В статье приведены данные по биосинтезу бактериальной целлюлозы культурой Мedusomyces gisevii. Исследовано влияние уровня активной кислотности на синтез бактериальной целлюлозы. Установлено, что для получения бактериальной целлюлозы с помощью симбиоза Мedusomyces gisevii не требуется искусственное поддержания уровня pH. Изучено влияние концентрации субстрата на выход бактериальной целлюлозы. Установлено, что синтез БЦ сопряжен с ростом уксуснокислых бактерий и условия, отвечающие максимуму численности бактерий, соответствуют максимуму выхода БЦ. Максимальная численность наблюдается при концентрации глюкозы в среде 20 г/л, по мере повышения концентрации глюкозы до 55 г/л, численность уксуснокислых бактерий снижается обратно пропорционально концентрации субстрата, что можно объяснить субстратным ингибированием. Концентрация глюкозы 15 г/л и ниже являетсянедостаточной, вследствие чего численность бактерий снижается прямо пропорционально снижению концентрации субстрата. Показано, что максимальный выход БЦ (8,7-9,0 %) обеспечивается при начальной концентрации глюкозы в среде 20-25 г/л. В условиях, отвечающих максимальному выходу бактериальной целлюлозы, был получен укрупненный образец БЦ массой 605 г. Исследованы физико-химические показатели образца бактериальной целлюлозы. Структура и чистота бактериальной целлюлозы подтверждены методом инфракрасной спектрофотометрии.
Бактериальная целлюлоза, симбиоз, биосинтез, активная кислотность, концентрация субстрата, физикохимические показатели, инфракрасная спектроскопия
Короткий адрес: https://sciup.org/14040456
IDR: 14040456 | УДК: 577.114
Текст научной статьи Биосинтез бактериальной целлюлозы культурой мedusomyces gisevii
Бактериальная целлюлоза (БЦ) характеризуется химической чистотой, в ней отсутствуют примеси лигнина, гемицеллюлоз и других компонентов, сопутствующих растительной целлюлозе. Молекулярная формула и полимерная структура БЦ, соответствуют целлюлозе, выделенной из растительного сырья, но при этом БЦ обладает более высокой кристалличностью, модулем прочности на разрыв, во-допоглащающей способностью, пластичностью, а также характеризуется биосовместимостью и биоразлагаемостью [1].
БЦ может быть использована в различных отраслях. Широкое применение БЦ нашла в медицине – при изготовлении на основе матриц БЦ, композитных раневых покрытий, включающих наночастицы серебра или селена, обладащих антимикробными, противовоспалительными и заживляющими свойствами. Ещё одним активно развивающимся направлением исследований является создание на основе БЦ систем с контролируемым выделением биологически активных соединений. Также возможно использование БЦ в биотехнологической промышленности, в качестве мембран для иммобилизации ферментов и клеток. В электронной промышленности пленки БЦ используются для изготовления органических светоизлучающих диодов, пленочных солнечных батарей, фотохромных материалов и материалов с жидкокристаллическими свойствами. В целлюлозно-бумажной промышленности БЦ используют для изготовления особых сортов бумаги, салфеток и пеленок, в пищевой промышленности – в качестве пищевых добавок и загустителей. Также БЦ можно использовать для получения эфиров, например нитратов с высокой степенью замещения [2].
К синтезу БЦ способны микроорганизмы разных видов. Их объединяет способность производить внеклеточную целлюлозу в виде гель-пленки на поверхности питательной среды [3].
Получение БЦ – сложный и длительный процесс. Главным критерием успешного протекания процесса является получение максимального выхода БЦ. В России нет действующего производства БЦ, поэтому исследования в данной области являются ультраактуалными.
Основными параметрами, влияющими на синтез и выход целевого продукта, являются концентрация субстрата и уровень активной кислотности [4]. Согласно источнику [5] каждый целлюлозосинтезирующий микроорганизм имеет свой оптимальный диапазон pH, отклонение от которого приводит снижению продуктивности биосинтеза БЦ.
Для продуцентов БЦ характерно субстратное ингибирование [6], преодолеть которое позволяет правильный подбор концентрации субстрата в питательной среде. Концентрация субстрата в питательной среде для различных продуцентов должна устанавливаться экспериментально [4, 5]. Оптимальная концентрация субстрата обеспечивает максимальный выход целевого продукта, а также позволяет повысить его качество за счет сокращения образования побочных продуктов (например, для Acetobacter xy-linum IFO 13693 характерно образование глюконовой кислоты, при концентрации глюкозы в питательной среде более 24 г/л [3]).
В данной работе в качестве продуцента использована культура Мedusomyces gisevii , известная как «чайный гриб». Напиток, образующийся в результате культивирования «чайного гриба», широко используется в лечебно-профилактических целях, поскольку положительно влияет на организм человека, благодаря микроорганизмам симбиоза, обладающих антимикробными свойствами и продуцирующих комплекс биологически активных веществ. Технология получения напитков на основе «чайного гриба» в настоящее время продолжает развиваться и занимает значимое место в группе лечебно-профилактических безалкогольных напитков [7].
Продуцент Мedusomyces gisevii представляет собой симбиотическую культуру, состоящую из разных видов уксуснокислых бактерий и дрожжей [4]. Симбиоз обладает огромным адаптивным потенциалом. Благодаря подвижным симбиотическим отношениям культура легко приспосабливается к изменению внешних условий, стрессам, способна утилизировать различные субстраты, устойчива к фагам [4].
Целью данной работы является биосинтез продуцентом Мedusomyces gisevii гель-пленки БЦ . Для достижения данной цели были решены следующие задачи: исследовано влияние уровня активной кислотности на синтез БЦ, изучено влияние концентрации субстрата на выход бактериальной целлюлозы; в условиях, отвечающих максимальному выходу БЦ, получен укрупнённый образец БЦ, исследованы его физико-химические показатели.
Для экспериментов использованы синтетические питательные среды, приготовленные растворением глюкозы в экстракте черного чая. Доза внесения инокулята составила 10 %. Культивирование проводилось в статических условиях при
30 ±0,4°С. Убыль редуцирующих сахаров контролировалась спектрофотометрически (спектрофотометр «UNICOUV-2804», США) с использованием динитросалицилового реактива, прирост пленки БЦ оценивался гравиметрически (взвешивались суховоздушные образцы весы лабораторные аналитические Explorer EX-224), уровень активной кислотности определялся мощью иономера (иономер И-160 МИ). Микробиологические показатели определяли с методом прямого подсчёта клеток на камере Горяева.
Для исследования влияния уровня активной кислотности на синтез БЦ использовалась питательная среда с начальной концентрацией глюкозы 25 г/л. Изучено пять вариантов, различающихся уровнем рН: 3,0; 4,0; 5,0 и 6,0. Активная кислотность на заданном уровне поддерживалась вручную ежесуточно путем внесения молочной кислоты или аммиака. В качестве контроля использовалась среда с нативным рН (4,1 ед. рН), в контрольном опыте значения активной кислотности фиксировались в ходе эксперимента, но не корректировались.
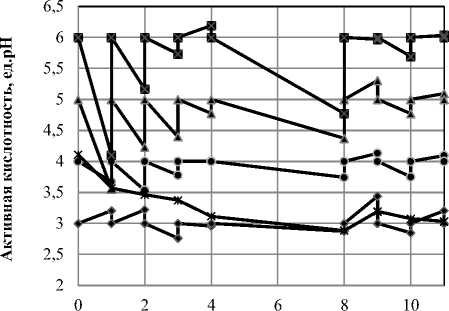
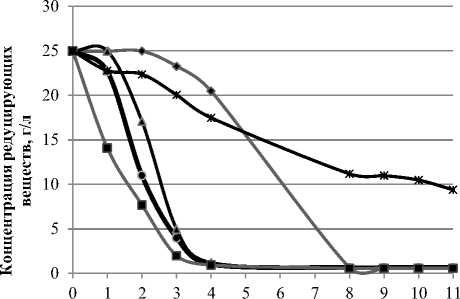
На рисунке 1 представлено изменение уровня активной кислотности сред при культивировании Мedusomyces gisevii. На рисунке 2 представлено изменение концентрации редуцирующих веществ в зависимости от уровня активной кислотности.
Продолжительность культивирования, сутки ф 3 I—е^— 4 —*—5 —о— 6 ж контроль
Рисунок 1. Изменение активной кислотности сред при культивировании Мedusomyces gisevii на средах с разным уровнем рН
Продолжительность культивирования, сутки
—ф— 3 ^■•^* 4 —А— 5 6 контроль
Рисунок 2. Изменение концентрации редуцирующих веществ при культивировании Мedusomyces gisevii на средах с разным уровнем рН
На рисунке 1 видно, что во всех вариантах активная кислотность в процессе культивирования снижалась, особенно значительно уровень pH понизился при pH 5,0 и 6,0 на первые сутки культивирования; исключение представляет образец с начальным pH 3,0 для которого происходит повышение значения рН, то есть микроорганизмы саморегулировали уровень pH сред и приближали его значение к оптимальному. Такое же поведение наблюдалось на 3 и 4 сутки. На четвертые сутки изменение pH не было сильно заметно, далее в течении трех суток уровень pH не контролировался. К 8 суткам произошло снижение или повышение pH, т.е. микроорганизмы снова пытались стабилизировать уровень активной кислотности. На 9 и 10 сутки кислотность не сильно отличалась от заданного уровня. На 11 сутки значение активной кислотности перестало изменяться, что может свидетельствовать о гибели микроорганизмов.
По данным рисунка 2 видно, что потребление субстрата в опытах, где уровень активной кислотности искусственно поддерживался на заданном уровне, протекало быстрее, чем в контроле. Однако образование гель-плёнки БЦ произошло только в контрольном варианте.
Можно предположить, что при отклонении рН от нативного субстрат тратится не на синтез БЦ, а на поддержание жизнеспособности микроорганизмов. При этом сдвигается равновесие между симбионтами и создаются условия, неблагоприятные для развития целлюлозосинтезирующих микроорганизмов. При рН 5 и 6 отмечено газообразование, гель-плёнка отсутствует; при рН 4 образовались рваные нити БЦ, покрытые слизью; при рН 3 синтез БЦ не происходил.
Из полученных данных можно сделать вывод, что для получения БЦ с помощью симбиоза Мedusomyces gisevii не требуется искусственное поддержания уровня pH.
Для изучения влияния концентрации субстрата на выход бактериальной целлюлозы использовались питательные среды, с разными начальными концентрациями глюкозы: 5, 10, 15, 20, 25, 35, 45, 55 г/л. Культивирование проводилось в статических условиях при 27 °С.
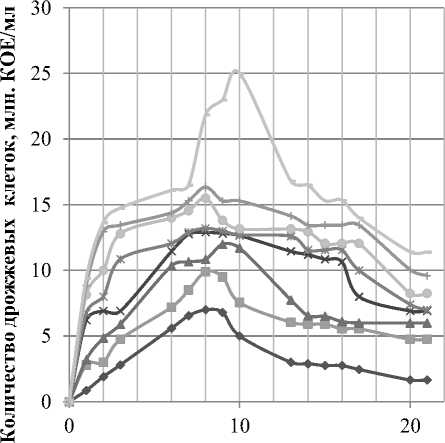
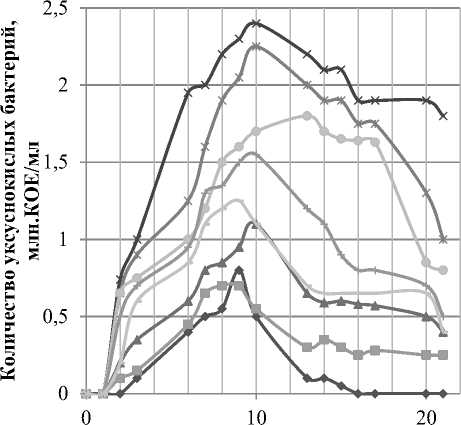
На рисунке 3 и 4 показаны изменения количества клеток дрожжей и уксуснокислых бактерий в зависимости от различной концентрации глюкозы в питательной среде.
Продолжительность культивирования, сутки
Продолжительность культивирования, сутки
5 10 1520
25 35 4555
5 10 1520
25 35 4555
Рисунок 3. Изменение количества дрожжевых клеток при культивировании Medusomyces gisevii на средах с разной концентрацией глюкозы
Рисунок 4. Изменение количества уксуснокислых бактерий при культивировании Medusomyces gisevii на средах с разной концентрацией глюкозы
Из рисунка 3 можно сделать вывод, что при увеличении концентрации глюкозы в питательной среде прямо пропорционально увеличивается концентрация дрожжевых клеток. Также следует отметить, что численность дрожжевых клеток изменялась прямо пропорционально концентрации субстрата в среде: при концентрации глюкозы в питательной среде 5, 10, 15, 20, 25, 35, 45 г/л увеличение количества дрожжевых клеток происходило до 8 суток культивирования, далее отмечалось их снижение; при концентрации 55 г/л увеличение численности дрожжевых клеток происходило до 10 суток, а потом также происходил спад.
Численность уксуснокислых бактерий зависит от концентрации глюкозы в среде не столь однозначно. Из рисунка 4 следует, что по максимальной численности уксуснокислых бактерий в зависимости от концентрации глюкозы в среде результаты экспериментов можно представить в порядке убывания: 20>25>35>45>55>15>10>5. Максимальная численность наблюдается при концентрации глюкозы в среде 20 г/л, затем, по мере повышения концентрации глюкозы до 55 г/л, численность уксуснокислых бактерий снижается обратно пропорционально концентрации субстрата, что можно объяснить субстратным ингибированием. Концентрация глюкозы 15 г/л и ниже является недостаточной, вследствие чего численность бактерий снижается прямо пропорционально снижению концентрации субстрата.
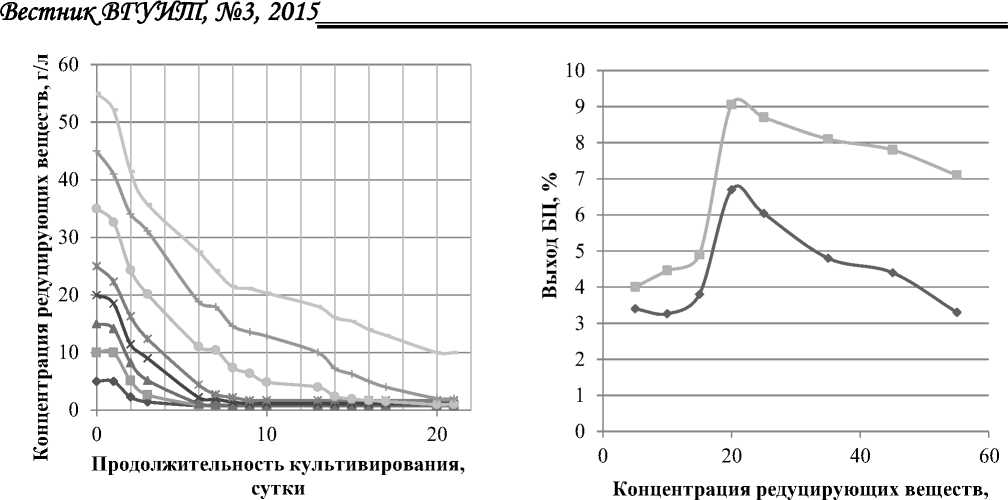
На рисунке 5 представлены изменения концентрации редуцирующих веществ в процессе культивирования Medusomyces gisevii на средах с различной концентрацией глюкозы. На рисунке 6 представлена зависимость выхода БЦ от различной концентрации глюкозы в питательной среде на 7 и 21 сутки культивирования.
—0= 5 г/л ■ 10 г/л —*— 15 г/л 20 г/л г/л
25 г/л • 35 г/л I 45 г/л ^^^^^^^* 55 г/л
—0= 7 сутки ■ 21 сутки
Рисунок 5. Изменения концентрации редуцирующих веществ в процессе культивирования Medusomyces gisevii на средах с различной концентрацией глюкозы
Рисунок 6. Зависимость выхода БЦ от различной концентрации субстрата в питательной среде
Из рисунка 5 видно, что потребление субстрата при разной концентрации глюкозы в среде протекает неодинаково. Полная утилизация субстрата при концентрации глюкозы 5, 10 и 15 г/л зафиксирована на 6 сутки культивирования, при концентрации 20 и 25 г/л – на 10 сутки, при концентрации 35 г/л – на 17 сутки, при концентрации 45 г/г – на 20 сутки. При концентрации 55 г/л не происходит полной утилизации субстрата, в питательной среде остается около 10 г/л глюкозы.
На рисунке 6 представлена зависимость выхода БЦ от различной концентрации глюкозы в питательной среде на 7 и 21 сутки культивирования. Наиболее высокий выход БЦ обеспечивают концентрации глюкозы в питательной среде 20 и 25 г/л. Выход составил на 7 сутки 6,8 и 6,1 %, на 21 сутки – 9,0 и 8,7 %. Следует отметить, что более длительное культивирование вести нецелесообразно, т.к. основной рост БЦ происходит в первые 7 – 10 суток культивирования, далее за последующие 11-21 сутки выход увеличивается всего на 3,2-2,6 %. Также ухудшается состояние пленок: теряется эластичность, пленки становятся неравномерными, водянистыми, начинают расслаиваться. Вследствие этого увеличивается продолжительность их очистки.
По выходу БЦ начальные концентрации глюкозы (г/л) в питательных средах можно по мере убывания расположить в ряд: 20>25>35>45>55>15>10>5. Таким образом, синтез БЦ сопряжен с ростом уксуснокислых бактерий и условия, отвечающие максимуму численности бактерий, соответствуют максимуму выхода БЦ. Следовательно, БЦ является первичным метаболитом целлюлозосинтезирующих микроорганизмов.
С учетом изученных факторов был проведен синтез БЦ в реакторе объёмом 16 л, коэффициент заполнения 50 %. Использовалась синтетическая питательная среда, с начальной концентрацией глюкозы 20 г/л, уровень активной кислотности саморегулировалcя симбиозом. Культивирование проводилось в статических условиях при 26±2 °С в течение 12 суток.
На рисунке 7 представлено фото укрупненного образца бактериальной целлюлозы. Диметр гель-плёнки 33 см, толщина 0,9±0,1 см, масса влажного образца составила 605 г, масса БЦ в пересчете на абсолютно сухое вещество – 6,9 г. Таким образом, выход целевого продукта составил 4,25 %. Можно констатировать, что при увеличении объёма культуральной жидкости от 100 мл до 8 л, отмечается снижение выхода БЦ в 2 раза. Возможно, это связано с колебаниями температуры в процессе культивирования.

Полученный образец БЦ был проанализирован по физико-химическим показателям. Структура полученного образца была исследована с помощью инфракрасного спектрофотометра «Инфралюм ФТ-801» в таблетках KBr.
Определение физико-химических характеристик БЦ (массовой доли кислотонерастворимого лигнина, массовой доли золы, массовой доли альфа-целлюлозы, степени полимеризации целлюлозы) проводили согласно стандартным методикам [7]. Влажность была найдена на определителе влажности МВ 23.
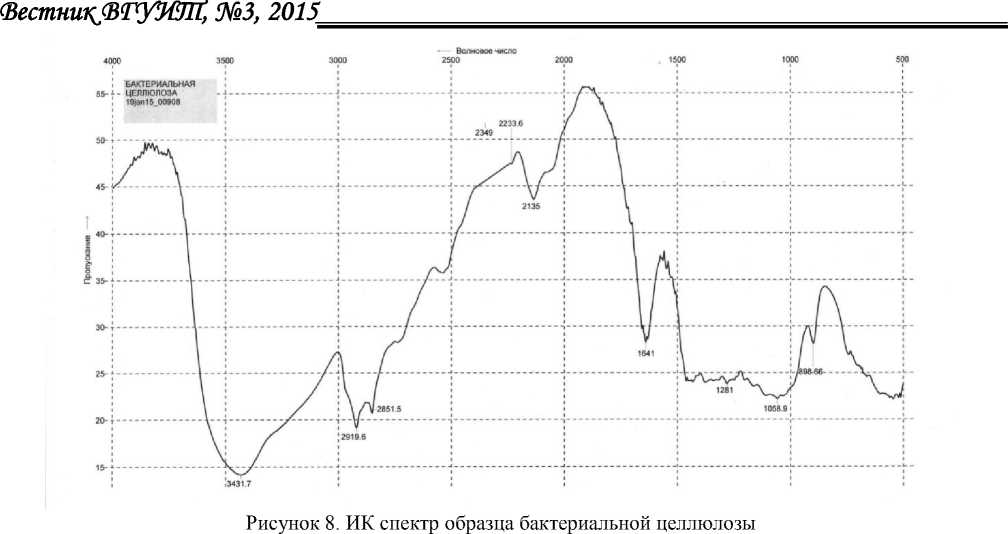
На рисунке 8 представлен ИК-спектр образца бактериальной целлюлозы. Полосы поглощения функциональных групп в образце бактериальной целлюлозы соотносятся с основными функциональными группами БЦ, представленные в литературе [8]. Пик при 3432 см-1 обусловлен валентными колебаниями OH-групп. Пик при 2919 и 2852 см-1 характеризует валентные колебания групп CH и CH2. Пик при 1641 см-1 обусловлен колебаниями связей прочно связанной воды. Полоса при 1281 указывает на валентные колебания OH-групп в спиртах. Полоса поглощения при 1059 см-1 обусловлена в основном валентными колебаниями C-O-C и C-O в спиртах. Полоса при 899 см-1 подтверждает наличие β-1,4 связей. ИК-спектры показывают, что БЦ не содержит примесей, в частности лигнина, присутствующего в растительной целлюлозе, так как отсутствуют полосы поглощения, характерные для ароматических примесей (лигнина), что доказывает чистоту БЦ.
Воздушно-сухая БЦ содержит 4,7 масс. % влаги. Степень полимеризации БЦ составила 2000, что соответствует степени полимеризации растительной хлопковой целлюлозы [9], пригодной для химической модификации.
Известно, что в составе БЦ отсутствуют примеси лигнина и других сопутствующих компонентов [1]. Для подтверждения чистоты БЦ в образце была определена массовая доля лигнина, нерастворимого в серной кислоте, которое составило 0,80 %. Его содержание оказалось выше, чем в хлопковой целлюлозе – 0,50 % [9]. Предположительно, это не истинный лигнин, а лигниноподобные вещества, нерастворимые в серной кислоте, например, фенольные и красящие вещества чая.
Массовая доля зольности в образце БЦ составила 0,14 %. Полученный результат сопоставим с зольностью хлопковой целлюлозы – 0,10 % [9]. При попытке определить массовую долю альфа-целлюлозы по стандартной методике для хлопковой целлюлозы было обнаружено, что измельченный образец, помещенный в 17,5 % раствор гидроксида натрия, не набухает и не растворяется. Содержание альфа-цел-люлозы в образце составило 101,6 % – это свидетельствует о недостаточной промывке образца от гидроксида натрия, а также о высоком содержании высокополимерной целлюлозы.
По результатам работы можно сделать следующие выводы:
-
- исследовано влияние уровня активной кислотности на синтез БЦ. Установлено, что для получения БЦ с помощью симбиоза
Список литературы Биосинтез бактериальной целлюлозы культурой мedusomyces gisevii
- Belgacem M.N., Gandini A. Monomers, Polymers and Composites from Renewable Resources. Amsterdam: Elsevier. 2008, 553 p.
- Гладышева Е.К. Обоснование выбора питательной среды для синтеза бактериальной целлюлозы//Вестник Алтайской науки. 2014. № 1. С. 307-310.
- Koon-Yang Lee, Gizem Buldum, Anthanasios Mantalaris at al. More than Meets the Eye in Bacterial Cellulose: Boisynthesis, Bioprocessing, and Applications in Advanced Fiber Composites//Macromolecular Bioscience. 2014. № 6. P. 10-32.
- Юркевич Д.И., Кутышенко В.П. Медузомицет (Чайный гриб): научная история, состав, особенности физиологии и метаболизма//Биофизика. 2002. № 6. С. 1116-1129.
- Goh W.N., Rosma A., Kaur B. et al. Fermentation of black tea broth (Kombucha): I. Effects of sucrose concentration and fermentation time on the yield of microbial cellulose//International Food Research Journal. 2012. № 19(1). P. 109-117.
- Masaoka S., Ohe T., Sakota N. Production of cellulose from glucose by Acetobacter xylinum//Journal of Fermentation and Bioengineering. 1993. № 75 (1). P. 18-22.
- Жумабекова Б.К., Жумабекова К.А. Технология получения чайного кваса с добавлением экстракта душицы//Фундаментальные исследования. 2015. № 2 (11). С. 2370-2373.
- Оболенская А.В., Ельницкая З.П., Леонович А.А. Лабораторные работы по химии древесины и целлюлозы: учебное пособие для вузов. М.: Экология, 1991. 320 с.
- Xueqiong Yin, Changjiang Yu, Xiaoli Zhang at al. Comparison of succinylation methods for bacterial cellulose and adsorption capacities of bacterial cellulose derivatives for Cu2+ ion//Polymer Bulletin. 2011. № 67. P. 401-412.
- Гисматулина Ю.А., Будаева В.В. Сравнение целлюлоз, выделенных из мискантуса, с хлопковой целлюлозой методом ИК-Фурье спектроскопии//Ползуновский вестник. 2014. № 3. С. 177-181.


