Биосинтез фотопреобразующего трансмембранного белка [2Н] бактериородопсина, меченного дейтерием по остаткам ароматических аминокислот [2,3,4,5,6- 2H 5] Phe, [3,5- 2H 2] Tyr и [2,4,5,6,7- 2H 5] Trp
Автор: Мосин Олег Викторович, Швец В.И., Складнев Д.А., Игнатов Игнат
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Методы измерений
Статья в выпуске: 2 т.23, 2013 года.
Бесплатный доступ
Осуществлен биосинтез фотопреобразующего трансмембранного белка бактериородопсина (выход 8-10 мг), меченного дейтерием по остаткам функционально-важных аминокислот — [2,3,4,5,6- 2H 5]Phe, [3,5- 2H 2]Tyr и [2,4,5,6,7- 2H 5]Trp, что важно для наноиндустрии новых современных отечественных фотопреобразующих наноматериалов и биомолекулярной электроники. Белок выделен из мембран экстремальных фотоорганогетеротрофных галобактерий H alobacterium halobium лизисом клеток в дистиллированной воде, обработкой бактериальной биомассы ультразвуком, спиртовой экстракцией низко- и высокомолекулярных примесей, клеточной РНК, каротиноидов и липидов с последующей солюбилизацией конечного продукта в 0.5 %-м ДДС-Na и фракционированием метанолом. Гомогенность синтезируемого [ 2Н]бактериородопсина и селективность включения дейтерия в молекулу исследованы комбинацией методов разделения и анализа белка, включая электрофорез в 12.5 %-м ПААГ с 0.1 %-м ДДС-Na, гель-проникающую хроматографию на сефадексе G-200, ОФ ВЭЖХ, масс-спектрометрию ЭУ метиловых эфиров N-(диметиламино)нафтален-1-сульфонил хлоридных (дансильных) производных аминокислот.
[2н]бактериородопсин, биосинтез, масс-спектрометрия эу
Короткий адрес: https://sciup.org/14264854
IDR: 14264854 | УДК: 579.871.08+577.112.385.4.08
Текст научной статьи Биосинтез фотопреобразующего трансмембранного белка [2Н] бактериородопсина, меченного дейтерием по остаткам ароматических аминокислот [2,3,4,5,6- 2H 5] Phe, [3,5- 2H 2] Tyr и [2,4,5,6,7- 2H 5] Trp
Бактериородопсин (БР), названный по аналогии с белком зрительного аппарата млекопитающих родопсином, был выделен в 1971 г. Д. Остерхель-том и В. Стохениусом (США) из клеточной мембраны экстремальной фотоорганогетеротрофной галобактерии Halobacterium halobium [1]. Этот фотопреобразующий белок молекулярной массой 26 кДа представляет собой хромопротеид, связанный шиффовым основанием (как в зрительных пигментах животных) с остатком Lys-216, который содержит в качестве хромоформной группы эквимолекулярную смесь 13- цис - и полностью 13- транс -ретинольного С 20 -каротиноида, определяющего пурпурно-красный цвет галофильных бактерий. Наряду с БР в клеточной мембране га-лобактерий содержится небольшое количество других сопутствующих каротиноидных пигментов, основной из которых — бактериоруберин, определяющий устойчивость галобактерий к солнечному излучению [2].
Полипептидная цепь БР состоит из 248 аминокислотных остатков, 67 % которых являются гидрофобными, образованными с участием ароматических аминокислот — фенилаланина, тирозина и триптофана [3]. Согласно структурным исследова- ниям, молекула БР состоит из семи находящихся в конформации α-спирали сегментов, пронизывающих всю толщу мембраны клетки в направлении, перпендикулярном ее плоскости [4]. Гидрофобные домены представляют собой трансмембранные сегменты, а гидрофильные домены выступают из мембраны и соединяют отдельные внутримем-бранные α-спиральные тяжи белковой молекулы [5].
Благодаря своей структуре молекула БР выполняет функции светозависимого протонного насоса, перекачивающего протоны через мембрану клетки и создающего электрохимический градиент протонов Н+ на поверхности клеточной мембраны, энергия которого используется клеткой для синтеза АТФ в анаэробном фотосинтетическом фосфорилировании. При поглощении кванта света происходит обратимая изомеризация 13- Z -БР ( λ макс = 548 нм) (квантовый выход 0.03 при 20 ºС) в all-E -БР ( λ макс = 568 нм) [6], инициирующая каскад фотохимических реакций с образованием промежуточных интермедиантов J 625 , K 590 , L 550 , М 412 , N 560 и O 640 с последующим отрывом Н+ из ретинального остатка БР и его присоединением со стороны цитоплазмы (рис. 1). В этом процессе молекула ретиналя изгибается в мембранном туннеле и переносит протон Н+ с внутренней цитоплаз-
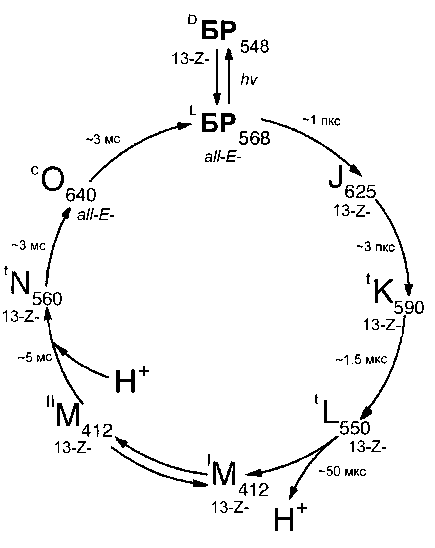
Рис. 1. Фотохимические реакции превращения БР (водная суспензия, рН ∼ 7.2, 20 ºС) [6].
Латинские цифры обозначают спектральные интермедианты БР. Верхние индексы "c" и "t" относятся к циклам 13- цис - и 13- транс -производных БР, "L" и "D" обозначают световую и темновую формы пигментов. Нижние индексы соответствуют положению максимума поглощения интермедиаторов фотоцикла (в нм)
матической мембраны на внешнюю мембрану клетки. В результате между внутренней и внешней поверхностями мембраны образуется градиент концентрации Н+, приводящий к тому, что освещенные клетки галобактерий начинают синтезировать АТФ, т. е. преобразуют энергию света в химическую энергию связей. Этот процесс обратим и в темноте протекает в обратном направлении, что позволяет галобактериям развиваться в темноте, переключая фотосинтетический метаболизм на гетеротрофный [7].
Несмотря на структурно-функциональную изученность, БР остается в центре внимания био- и нанотехнологии прежде всего благодаря своей высокой светочувствительности и разрешающей способности и используется в молекулярной биоэлектронике, как природный фотохромный материал, в качестве управляемых светом или электрическими импульсами модулей компьютерных и оптических систем [8]. БР-содержащие нанопленки, полученные с использованием БР-содержащих пурпурных мембран галобактерий впервые были получены и исследованы в нашей стране в рамках проекта "Родопсин", в ходе которого продемонстрирована эффективность и перспективы использования наноматериалов "Биохром" в качестве фотохромных материалов для голографической записи. Основной задачей при изготовлении БР-содержащих нанопленок является ориентация пурпурных мембран между гидрофобными и гидрофильными средами, например между водой и воздухом, как это распространено в природе. Как правило, для улучшения характеристик БР-содержащих пленок, используется несколько слоев, которые наносятся на поверхность полимерного носителя и высушиваются в определенных условиях с сохранением своей природной структуры. Наилучшие показатели достигаются при изготовлении пленок на основе желатина. Это позволяет добиться высокой концентрации БР (до 50 %) в нанопленках, избежать агрегации фрагментов пурпурных мембран, а также разрушения бактериородопсина в процессе изготовления. Встроенные в желатиновую матрицу фрагменты пурпурных мембран долговечны (около 104 ч) и устойчивы к воздействию многих факторов как при изготовлении, так и в процессе эксплуатации (колебания температуры, интенсивное воздействие светом с помощью лазера и др.).
Кроме этого, БР очень привлекателен как модельный объект для исследований, связанных с изучением функциональной активности и структурных свойств фотопреобразующих мембранных белков в составе искусственных нативных энерго-и фотопреобразующих мембран [9].
Для структурно-функциональных исследований с БР целесообразно вводить в молекулу белка в качестве изотопной метки дейтерий (2H), позволяющий использовать для анализа изотопного включения метод высокочувствительной масс-спектрометрии ЭУ [10]. Большое научно-прикладное значение имеет БР, меченный дейтерием по остаткам функционально-важных ароматических аминокислот — [2H]фенилаланина, [2H]тирозина и [2H]триптофана, участвующих в гидрофобном взаимодействии полипептидной цепи белка с липидным бислоем клеточной мембраны [11]. 2Н-меченые ароматические аминокислоты могут быть синтезированы методом обратного изотопного обмена (1Н-2Н) в молекулах протонированных аминокислот — [2,3,4,5,6-2Н 5 ]фенилаланин в 85 %-й 2H 2 SO 4 при 50 ºC, [3.5-2H 2 ]тирозин в 15 %-й 2H 2 SO 4 при слабом кипячении реакционной смеси, [2,4,5,6,7-2H 5 ]триптофан в 75 %-й [2H]трифторук-сусной кислоте при 25 ºС [12] . Однако, несмотря на изученность современных методов химического синтеза [2Н]ароматических аминокислот, отечественная индустрия индивидуальных [2Н]трансмем-бранных фотопреобразующих белков не получила должного развития.
Целью настоящей работы являлось разработка технологии микропрепаративного получения БР, меченного дейтерием по остаткам функциональноважных ароматических аминокислот [2,3,4,5,6-2Н 5 ]фенилаланина, [3,5-2H 2 ]тирозина и [2,4,5,6,7-2H 5 ]триптофана, для реконструкции искусственных мембран, а также исследование уровней дей-терированности молекулы БР методом масс-спектрометрии ЭУ метиловых эфиров N-(диметиламино)нафтален-1-сульфонил хлоридных (дансильных) производных аминокислот c последующим разделением методом ОФ ВЭЖХ.
ПРИБОРЫ И МАТЕРИАЛЫ
Для синтеза [2Н]аминокислот использовали протонированные D , L- аминокислоты ("Reanal", Венгрия), 2Н 2 О (99.9 ат. % 2H) и 2HСl (95.5 ат. % 2H), полученные из Российского научно-исследовательского центра "Изотоп" (Санкт-Петербург, РФ). Для синтеза производных аминокислот использовали 5-(диметиламино)нафтален-1-сульфо-нил хлорид (Dns-хлорид) ("Sigma", США) и диазометан, получаемый из N-нитрозомочевины ("Merck", ФРГ). Неорганические соли предварительно перекристаллизовывали в 2Н 2 О, 2H 2 O дистиллировали над KMnO 4 с последующим контролем изотопной чистоты 1Н-ЯМР-спектроскопией на приборе Brucker WM-250 ("Brucker Daltonics", ФРГ) (рабочая частота 70 МГц, внутренний стандарт Me 4 Si).
Электрофорез БР проводили в 12.5 %-м ПААГ с 0.1 %-м ДДС-Na в соответствии с протоколом фирмы LKB (Швеция). Для количественного определения содержания синтезированного в клетке белка проводили сканирование прокрашенного в растворе "кумасси-голубой" R-250 электрофоретического геля на лазерном денситометре Beckman CDS-200 ("Beckman Coulter", США).
Центрифугирование проб проводили на центрифуге Т-26 ("Carl Zeiss", ФРГ) при 2000 g 10 мин.
Масс-спектры метиловых эфиров N-Dns-производных аминокислот получали методом электронного удара на приборе МB-80A ("Hitachi", Япония) при энергии ионизирующих электронов 70 эВ, ускоряющем напряжении 8 кВ и температуре катодного источника 180 - 200 ºС. Сканирование анализируемых образцов проводили при разрешении 7500 усл. ед., используя 10 % резкость изображения.
Спектры 1Н-ЯМР регистрировали в 2Н2О на приборе Brucker WM-250 ("Brucker Daltonics", ФРГ) с рабочей частотой 70 МГц; химические сдвиги протонов ( δ , ppm) измерены в миллионных долях по отношению к Ме 4 Si.
Спектры поглощения регистрировали на программируемом спектрофотометре Beckman DU-6
("Beckman Coulter", США) в диапазоне длин волн 200 - 700 нм.
ОФ ВЭЖХ проводили на жидкостном хроматографе Knauer Smartline ("Knauer", ФРГ), снабженном насосом Gilson ("Gilson Inc.", ФРГ), детектором UF-2563 и интегратором СR-3A ("Shimadzy", Япония), используя колонку 250 × 10 мм с неподвижной обращенной фазой сепарон С18 (Kova, Словакия); элюент: (А) — ацетонитрил— трифторуксусная кислота 100: 0.1–0.5 об. % и (Б) — ацетонитрил 100 об. %; скорость элюирования — 1.5 мл / мин: от 0 до 20 % Б — 5 мин, от 20 до 100 % Б — 30 мин, 100 % Б — 5 мин, от 100 до 0 % Б — 2 мин, 0 % Б — 10 мин. ТСХ N-Dns-производных аминокислот проводили на хроматографических пластинках с закрепленным слоем флуоресцентного носителя Silufol UV-254 ("Kava-lier", Словакия) в системе растворителей (A): н-бутанол—уксусная кислота—вода (12 : 3 : 5 об. %).
УСЛОВИЯ ЭКСПЕРИМЕНТА
Штамм-продуцент БР
В качестве продуцента БР использовали каро-тиноидсодержащий штамм экстремальных фото-органогетеротрофных галобактерий Halobacterium halobium ЕТ 1001, полученный из коллекции культур МГУ. Штамм модифицирован селекцией отдельных колоний на твердой (2 %-й агар) пептоновой среде с 4.3 М NaCl.
Синтез L -[2,3,4,5,6- 2 H 5 ]фенилаланина
40 г фенилаланина растворяли в 300 мл 85 % 2Н 2 SО 4 (в 2Н 2 О) и нагревали с обратным водяным холодильником при 50 - 60 ºС при перемешивании 3 сут. По окончании реакционную смесь охлаждали, нейтрализовали 30 %-м NH 4 OН до рН 5.5. Продукт экстрагировали этанолом. Выход 24 г (58.7 %); Т пл = 271 - 273; [ α ] d 25 = 4.47 (5 М НСl); рK a = 2.20 (СООН), 9.31 (NH 2 ); R f = 0.6 (A). УФ-спектр (0.1 М НCl): λ макс [нм] ( ε М–1 см–1) = 257.5 ( ε = 195). Спектр 1Н-ЯМР (2Н 2 SO 4 в 2Н 2 О) ( δ , ppm): δ 3.25 (2H, H β ), δ 4.4 (1H, H α ), δ 7.2 - 7.4 (0.07Н), УД = 90 ат.% 2Н. Масс-спектр ЭУ ([M]+ — m/z ( I , %): 165 (34)), метиловый эфир N-Dns-[2,3,4,5,6-2H 5 ]фенилаланина: 417 (14), 418 (6).
Синтез L -[3,5- 2 H 2 ]тирозина
100 г тирозина растворяли в 150 мл 3 М 2Н 2 SO 4 . Реакционную смесь нагревали 2 сут. при 40 - 50 ºС с обратным водяным холодильником в токе азота. По окончании нейтрализовали 30 %-м NH4OH до рН 4.5 и охлаждали 1 сут. при 4 ºС. Кристаллический продукт фильтровали, промывали 2Н 2 О и сушили при 10 мм рт. ст. Выход 90 г (86.5 %);
Т пл = 316–317; [ α ] d 25 = 10.03 (5 М НСl); рK a = 2.20 (СООН), 9.21 (NH 2 ); R f = 0.45 (A). УФ-спектр (0.1 М НCl): λ макс [нм] ( ε М–1 см–1) = 223 ( ε = 8200) и 274.5 ( ε = 1340). Спектр 1Н-ЯМР (1 М 2НCl) ( δ , ppm): δ 3.32 (2H), δ 4.35 (1H), δ 6.9 (1H), δ 7.2 (2H), УД = = 96 ат.% 2Н. Масс-спектр ЭУ ([M]+ — m/z ( I , %)): 181 (21); метиловый эфир N-Dns-[3,5-2H 2 ] тирозина: 429 (15), 430 (5).
Синтез L-[2,4,5,6,7-2H5]триптофана
К 40 мл 100 % 2Н 2 О добавляли при 4 ºС и перемешивании 80 мл трифторуксусного ангидрида (0.5 моль) и выдерживали 2 ч при 4 ºС, затем дробными порциями добавляли 25 г триптофана. Реакционную смесь выдерживали 3 сут. в темноте при 22 ºС, растворитель удаляли при 10 мм рт. ст., нейтрализовали 30 %-м NH 4 OH до рН 5.9, охлаждали 1 сут. при 4 ºС. Кристаллический продукт фильтровали, промывали 2Н 2 О и сушили при 10 мм рт. ст. Выход 19 г (60.3 %); Т пл = 283 - 285; [ α ] d 25 = 2.8 (1 М НСl); рK a = 2.46 (СООН), 9.41 (NH 2 ); R f = 0.5 (A). УФ-спектр (0.1 М НCl): λ макс [нм] ( ε М–1 см–1) = 218 ( ε = 3350), 278 ( ε = 5550), 287.5 ( ε = 4550). Спектр 1Н-ЯМР (CF 3 COOH в 2Н 2 О) ( δ , ppm): δ 3.4 (2H, H β ), δ 4.4 (1H, H α ), δ 7.3 (1H, H ε ), δ 7.2 - 7.4 (0.1Н, In-Н), УД = 98 ат.% 2Н. Масс-спектр ЭУ ([M]+ — m/z ( I , %)): 204 (28); метиловый эфир N-Dns-[2,4,5,6,7-2H 5 ]триптофана: 455 (9), 456 (11).
Синтез N-Dns-аминокислот
К 4 мг сухого гидролизата БР в 1 мл 2 Μ NaHCO 3 (рН 9 - 10) порциями при перемешивании добавляли 25.6 мг Dns-хлорида в 2 мл ацетона. Реакционную смесь выдерживали 1 ч при перемешивании при 40 ºС, подкисляли 2 н. HCl до рН 3.0 и экстрагировали этилацетатом (3 × 5 мл). Объединенный экстракт промывали дистиллированной Н 2 О до рН 7.0 (2 × 1 мл), сушили безводным Na 2 SO 4 , растворитель удаляли при 10 мм рт. ст. Выход 15.3 мг (78 %).
Синтез метиловых эфиров N-Dns-аминокислот
Для получения диазометана к 20 мл 40 % KОН в 40 мл диэтилового эфира добавляли 3 г влажной Ν -нитрозометилмочевины и перемешивали 15 20 мин на водяной бане со льдом. После окончания газовыделения эфирный слой отделяли, промывали дистиллированной Н 2 О до рН 7.0, сушили Na 2 SO 4 и использовали для обработки N-Dns-аминокислот. Выход 17.4 мг (69 %).
Биосинтез БР
Биосинтетический БР (выход 8 - 10 мг с 1 г биомассы) получен в синтетической среде, в которой протонированные фенилаланин, тирозин и триптофан были замещены их дейтерированными аналогами — L -[2,3,4,5,6-2H 5 ]фенилаланином, L -[3,5-2H 2 ]тирозином и L -[2,4,5,6,7-2H 5 ]трип-тофаном (г/л): D,L -аланин — 0.43; L -аргинин — 0.4; D,L -аспарагиновая кислота — 0.45; L -цистеин — 0.05; L -глутаминовая кислота — 1.3; L -глицин — 0.06; D,L -гистидин — 0.3; D,L -изолейцин — 0.44; L -лейцин — 0.8; L -лизин — 0.85; D,L -метионин — 0.37; D,L -фенилаланин — 0.26; L -пролин — 0.05; D,L -серин — 0.61; D,L -треонин — 0.5; L -тирозин — 0.2; D,L -триптофан — 0.5; D,L -валин — 1.0; АМФ — 0.1; УМФ — 0.1; NaCl — 250; MgSO 4 × × 7H 2 O — 20; KСl — 2; NH 4 Cl — 0.5; KNO 3 — 0.1; KH 2 PO 4 — 0.05; K 2 HPO 4 — 0.05; Na+-цитрат — 0.5; MnSO 4 . 2H 2 O — 3.10–4; CaCl 2 . 6H 2 O — 0.065; ZnSO 4 . 7H 2 O — 4 . 10–5; FeSO 4 . 7H 2 O — 5 . 10–4; CuSO 4 . 5H 2 O — 5 . 10–5; глицерин — 1.0; биотин — 1 . 10–4; фолиевая кислота — 1.5 . 10–4; витамин В12 — 2 . 10–5. Ростовую среду автоклавировали 30 мин при 0.5 атм; рН доводили 0.5 М KОН до 6.5 - 6.7. Выращивание бактерий проводили в колбах Эр-ленмейера, вместимостью 500 мл (объем реакционной смеси 100 мл) 4 - 5 сут. при 35 ºС в условиях интенсивной аэрации на орбитальном шейкере Biorad 380-S (Венгрия) и освещении монохромными лампами ЛДС-40 (3 лампы по 1.5 лк). Последующие операции по выделению БР проводили с использованием светозащитной лампы с оранжевым светофильтром ОРЖ-1.
Выделение фракции пурпурных мембран (ПМ)
Биомассу (1 г) промывали дистиллированной водой и осаждали центрифугированием (1500 g, 20 мин). Осадок суспендировали в 100 мл дистиллированной Н2О и выдерживали 3 ч при 4 ºС. Реакционную смесь центрифугировали (1500 g, 15 мин), осадок ресуспендировали в 20 мл дистиллированной Н2О и дезинтегрировали ультразвуком (22 кГц, 3 раза по 5 мин) в водяной бане со льдом (0 ºС). Клеточный гомогенат после промывки дистиллированной Н2О суспендировали в 10 мл буфера (125 мМ NaCl, 20 мМ MgCl2, 4 мМ Трис-HCl, рН 8.0), добавляли 5 мкг РНК Ι (2-3 ед. акт.) и инкубировали 2 ч при 37 ºС. Затем добавляли 10 мл того же буфера, выдерживали 10-12 ч при 4 ºС. Водную фракцию отделяли центрифугированием (1500 g, 20 мин), осадок ПМ обрабатывали 50 %-м этанолом (5 × 7 мл) при 4 ºС с последующим отделением растворителя. Процедуру повторяли трижды до получения бесцветных промывных вод.
Содержание белка в пробах определяли спектрофотометрически по соотношению D 280 / D 568 ( ε 280 =1.1 . 105 и ε 568 = 6.3 . 104 M–1 см–1 [13]). Регенерацию ПМ проводили, как описано в работе [14]. Выход фракции ПМ 120 мг (х. ч. 80 - 85 %).
Выделение БР
Фракцию ПМ (в Н 2 О) (1 мг / мл) растворяли в 1 мл 0.5 % ДДС-Na, инкубировали 5–7 ч при 37 ºС с последующим центрифугированием (1200 g, 15 мин). Осадок отделяли, к супернатанту добавляли дробными порциями метанол (3 раза по 100 мкл) при 0 ºС, выдерживали 14 - 15 ч при 4 ºС и центрифугировали при охлаждении (1200 g , 15 мин). Фракционирование проводили трижды, уменьшая концентрацию 0.5 % ДДС-Na до 0.2 и 0.1 %. Кристаллический белок (8 - 10 мг) промывали холодной дистиллированной 2Н2О (2 × 1 мл) и центрифугировали (1200 g, 15 мин).
Очистка БР
Пробу белка (5 мг) растворяли в 100 мкл буферного раствора и помещали на колонку размером 150 × 10 мм; неподвижная фаза — сефадекс G-200 ("Pharmaсia", США) (удельный объем упакованных гранул — 30 - 40 ед. на 1 г сух. сефадекса), уравновешенная буферным раствором, содержащим 0.1 %-й ДДС-Na и 2.5 мМ ЭТДА. Элюирование проводили 0.09 М трис-боратным буфером, содержащим 0.5 М NaCl с pH 8.35 ( I = 0.075) со скоростью 10 мл / (см2 ч). Объединенные белковые фракции подвергали лиофильной сушке, запаивали в стеклянные ампулы (10 × 50 мм) и хранили при –4 ºС.
Получение апомембран (АП)
Суспензию ПМ (50 мг) в 50 мл 1 М NH 2 OH (pН 6.0) выдерживали 10 ч при перемешивании на ледяной бане (4 ºС) при освещении реакционной смеси ксеноновой лампой. Осадок отделяли центрифугированием (1000 g, 10 мин), дважды промывали дистиллированной водой и центрифугировали. Фракцию АП суспендировали в 2 мл 5 мМ 2-(N-морфолино)-этансульфониламида в 100 мМ NaCl.
Регенерация АП с 13-транс-ретиналем
К 2 мл суспензии АП (2 . 10–5 М) в кварцевой кювете добавляли при перемешивании 0.1 мл 2 мМ раствора полностью 13-транс-ретиналя в метаноле и выдерживали 6–8 ч в темноте при 40 ºС. Степень регенерации ПМ определяли спек- трофотометрически по соотношению Dнат.280, Dнат.568 и Dрег.280, Dрег.568, где D280 и D568 — поглощение суспензии нативных и регенерированных ПМ при λ = 280 и λ = 568 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Биосинтез БР
Выбор стратегии биосинтеза 2Н-меченного БР c использованием штамма экстремальной фотоор-ганогетеротрофной галобактерии Halobacterium halobium определялся целью исследования, связанной с изучением принципиальной возможности получения 2Н-меченных трансмембранных фотопреобразующих белков в микропрепаративных количествах для реконструкции искусственных мембран в 2Н 2 О и БР-содержащих нанопленок.
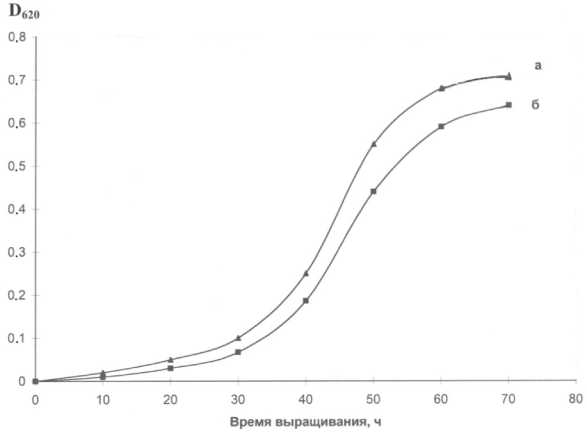
При выборе [2,3,4,5,6-2Н 5 ]фенилаланина, [3,5-2H 2 ]тирозина и [2,4,5,6,7-2H 5 ]триптофана в качестве источников дейтерия учитывалась их исключительная важность в гидрофобном взаимодействии молекулы БР с липидным бислоем клеточной мембраны, устойчивость к реакциям (1H-2H) обмена в водной среде в условиях выращивания штамма-продуцента, а также возможность применения метода высокочувствительной масс-спектрометрии ЭУ для последующего анализа. 2Н-меченный БР получен микробным синтезом штамма-продуцента фотоорганогетеротрофных галобактерий H. halobium при выращивании в синтетической среде (4.3 М NaCl) с [2,3,4,5,6-2Н 5 ]фе-нилаланином, [3,5-2H 2 ]тирозином и [2,4,5,6,7-2H 5 ]триптофаном. В оптимальных условиях выращивания H. halobium (период инкубации 4 - 5 сут., 35 ºС при освещении монохромным светом при λ = 560 нм) в клетках синтезировался каротиноид-содержащий фиолетовый пигмент, по спектральному соотношению белкового и хромофорного фрагментов молекулы D 280 / D 568 1.5 : 1.0 идентичный природному БР. Как показали результаты исследования, рост штамма на синтетической среде (рис. 2, б) ингибировался незначительно по сравнению с контролем (рис. 2, а) на протонированной среде, что существенно упрощает оптимизацию условий биосинтеза 2Н-меченного БР, заключающуюся в эквивалентной замене протонированных ароматических аминокислот их дейтерированными аналогами — [2,3,4,5,6-2Н 5 ]фенилаланином (0.26 г/л), [3,5-2H 2 ]тирозином (0.2 г/л) и [2,4,5,6,7-2H 5 ]триптофаном (0.5 г/л).
Основными этапами эксперимента являлись: выращивание штамма продуцента H. halobium на синтетической среде с [2,3,4,5,6-2Н 5 ]фенилалани-ном (0.26 г/л), [3,5-2H 2 ]тирозином (0.2 г/л) и [2,4,5,6,7-2H 5 ]триптофаном (0.5 г/л), отделение от клеточного содержимого, выделение фракции
D
300 400 500 600 700 нм
Рис. 2. Динамика роста штамма H. halobium в различных экспериментальных условиях.
Протонированная синтетическая среда (а); синтетическая среда с [2,3,4,5,6-2Н5]Phe (0.26 г/л), [3,5-2H 2 ]Tyr (0.2 г/л) и [2,4,5,6,7-2H 5 ]Trp (0.5 г/л) (б). Период инкубации 4– 5 сут., 35 ºС, освещение монохромным светом при λ = 560 нм
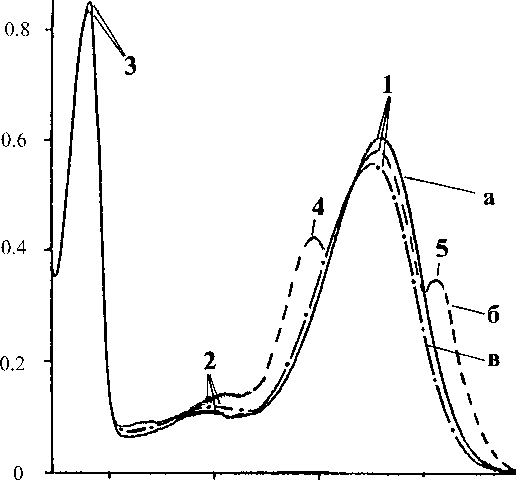
Рис. 3. Спектры поглощения ПМ (в 50 %-м этаноле) на различных стадиях обработки.
Природный БР (а); ПМ после промежуточной обработки (б); очищенные от посторонних каротиноидов ПМ (в). Полоса 1 — спектральная форма БР568, 2 — примесь спектральной формы мета-бактериородопсина М412, 3 — полоса поглощения ароматических аминокислот, 4 и 5 — посторонние каротиноиды. В качестве контроля использовали природный БР пурпурных мембран (ПМ), отделение низко- и высокомолекулярных примесей, клеточной РНК, пигментов (преимущественно каротиноидов) и липидов, фракционирование солюбилизированного в 0.5 % SDS-Na белка метанолом, ГПХ на сефадексе G-200, электрофорез в 12.5 %-м ПААГ с 0.1 %-м ДДС-Na. Поскольку белок локализуется в ПМ, освобождение от низкомолекулярных примесей и внутриклеточного содержимого достигали осмотическим шоком клеток дистиллированной водой на холоде после удаления 4.3 М NaCl и последующим разрушением клеточной оболочки ультразвуком при 22 кГц. Для разрушения клеточной РНК проводили обработку клеточного гомогената РНК-азой Ι (2-3 ед. акт.). Фракция ПМ наряду с искомым белком в комплексе с липидами и полисахаридами содержала примесь связанных каротиноидов и посторонних белков. Поэтому применялись специальные методы фракционирования белка без повреждения его нативной струк- туры и диссоциации, что требовало применения специальных методов очистки от каротиноидов и липидов и последующей колоночной гель-проникающей хроматографии на сефадексе G-200. Очистка от каротиноидов, заключающаяся в многократной обработке ПМ 50 %-м этанолом при 4 ºС, являлась рутинным, но обязательным этапом, несмотря на значительные потери хромопротеина. Использовалось не менее пяти обработок 50 %-м этанолом, чтобы получить спектр поглощения суспензии ПМ, очищенный от каротиноидов 4 и 5 (степень хроматографической чистоты 80-85 %), показанный на рис. 3, б и в, на различных стадиях обработки относительно природного БР (рис. 3, а). Образование ретинальпротеинового комплекса в молекуле БР приводит к батохромному сдвигу в спектре поглощения ПМ (рис. 3, в): основная полоса (1) при максимуме поглощения λ = 568 нм, вызванная световой изомеризацией хромофора по связи С13=С14, определяется наличием 13-транс-ретинального остатка ретиналя БР568, дополнительная малоинтенсивная полоса 2 при λ = 412 нм характеризует незначительную примесь образующейся на свету спектральной формы мета-бактериородопсина M412 c депротонированной альди-минной связью между остатком 13-транс-ретиналя и белком, а полоса 3 при λ = 280 нм определяется поглощением ароматических аминокислот в поли-пептидной цепи белка (для чистого БР соотношение D280 / D568 равно 1.5 : 1.0).
Выделение и очистка БР
Следующим необходимым этапом являлось фракционирование и хроматографическая очистка белка. Поскольку БР, будучи трансмембранным белком (Мr 26.7 кДа), пронизывает билипидный слой в виде семи α-спиралей, применение сульфата аммония и других традиционных высаливающих агентов не дает положительного результата. Решение проблемы заключалось в переводе белка в растворимую форму солюбилизацией в 0.5 %-м ДДС-Na. Использование ионного детергента ДДС-Na диктовалось необходимостью максимальной солюбилизации белка в нативной биологически-активной форме в комплексе с 13-транс-ретина-лем с комбинированием стадии делипидизации и осаждения, поскольку солюбилизированный в слабоконцентрированном растворе ДДС-Na (0.5 %) БР, сохраняет спиральную α-конфигурацию [15]. Поэтому отпала необходимость использования органических растворителей — ацетона, метанола и хлороформа для очистки от липидов, а делипиди-зация и осаждение белка совмещались в одну стадию, что существенно упрощало дальнейшее фракционирование. Значительным преимуществом метода является то, что выделяемый белок в комплексе с молекулами липидов и детергента распределяется в надосадочной жидкости, а другие высокомолекулярные примеси — в непрореагировавшем осадке, легко отделяемом центрифугированием. Фракционирование солюбилизован-ного в 0.5 %-м растворе ДДС-Na белка с его последующим выделением в кристаллическом виде достигали в три стадии дробным низкотемпературным (4 ºС) осаждением метанола, уменьшая концентрацию детергента соответственно в 2.5 и 5 раз. Окончательная стадия очистки БР заключалась в отделении белка от низкомолекулярных примесей гель-проникающей хроматографией, для чего БР-содержащие фракции дважды пропускали через колонку с декстрановым сефадексом G-200, уравновешенным 0.09 М трис-боратным буфером (рН 8.35) с 0.1 %-м ДДС-Na и 2.5 мМ ЭТДА. Согласно разработанному методу, получено 8-10 мг 2Н-меченного БР из 1 г бактериальной биомассы, гомогенность которого удовлетворяла требованиям, предъявляемым для реконструкции мембран, и подтверждалась электрофорезом в 12.5 %-м ПААГ с 0.1 %-м ДДС-Na, регенерацией апомембран с 13-транс-ретиналем и ОФ ВЭЖХ метиловых эфиров N-Dns-аминокислот. Небольшой выход БР не был препятствием для последующего масс-спектрометрического анализа, однако необходимо подчеркнуть, что для обеспечения высокого выхода белка нужно наработать большее количество сырьевой биомассы.
Условия проведения гидролиза 2Н-меченного БР определялись необходимостью предотвращения реакций изотопного (1Н-2Н) обмена водорода на дейтерий в молекуле фенилаланина и сохранения остатков триптофана в белке. Рассматривались два альтернативных варианта — кислотный и щелочной гидролиз. Кислотный гидролиз белка в стандартных условиях (6 н. HСl или 8 н. H 2 SO 4 , 110 ºС, 24 ч) приводит к полному разрушению триптофана и частичному разрушению серина, треонина и некоторых других аминокислот в белке [16], которые для настоящего исследования не играют существенной роли. Модификация этого метода, заключающаяся в добавлении в реакционную среду фенола, тиогликолевой кислоты, β -меркапто-этанола, позволяет сохранить до 80 85 % триптофана [17]. Использование п-толуол сульфокислоты с 0.2 % 3-(2-аминоэтил)-индолом или 3 М меркаптоэтансульфокислоты также эффективно для сохранения триптофана (до 93 %) [18]. Однако для решения поставленной задачи вышеперечисленные методы непригодны, поскольку обладают существенным недостатком: в условиях кислотного гидролиза с высокой скоростью происходит изотопный (1Н-2Н) обмен ароматических протонов (дейтеронов) в молекулах триптофана,
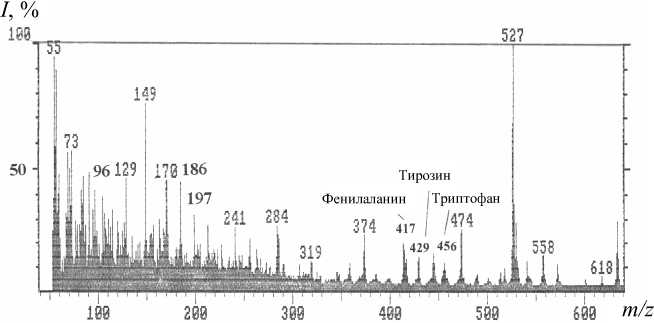
Рис. 4. Полный масс-спектр ЭУ метиловых эфиров N-Dns-[2H]производных ароматических аминокислот, выделенных из гидролизата БР из H. halobium (70 эВ, ускоряющее напряжение 8 кВ, 180–200 ºС).
Условия получения: синтетическая среда с [2,3,4,5,6-2H 5 ]Phe, [3,5-2H 2 ]Tyr и [2,4,5,6,7-2H 5 ]Trp. Условия гидролиза БР: 4 н. Ba(OH) 2 (в 2Н 2 О), 110 ºС, 24 ч. Пики молекулярных ионов аминокислот соответствуют их производным. I — интенсивность пиков (%)
тирозина и гистидина, а также протонов при атоме С3 аспарагиновой и С4 глутаминовой кислот [19]. Поэтому даже проведение гидролиза в дейтерированных реагентах (6 н. 2HCl, 4 н. 2H 2 SO 4 в 2H 2 O) не позволяет получать реальные данные о включении дейтерия в белок.
В условиях щелочного гидролиза (4 н. Ba(OH) 2 или 4 н. NaOH, 110 ºC, 24 ч) реакций изотопного (1Н-2Н) обмена практически не наблюдается (исключением является протон (дейтерон) у атома С2 гистидина, а триптофан не разрушается, что определило выбор этого метода гидролиза в настоящей работе. Упрощение процедуры выделения смеси свободных аминокислот за счет нейтрализации H 2 SO 4 (в 2H 2 O) явилось причиной выбора в качестве гидролизующего агента 4 н. Ba(OH) 2 . Возможная D , L -рацемизация аминокислот при щелочном гидролизе не влияла на результат последующего масс-спектрометрического исследования уровня дейтерированности молекул аминокислот.
Исследование уровня дейтерированности БР масс-спектрометрией ЭУ
Для изучения включения [2Н]ароматических кислот в молекулу БР использовали метод масс-спектрометрии ЭУ после модификации смеси аминокислот гидролизата БР в метиловые эфиры N-Dns-производных аминокислот. Чтобы получить воспроизводимый результат по уровню дей-терированности 2Н-меченного белка, сначала регистрировали полный скан масс-спектра ЭУ смеси метиловых эфиров N-Dns-производных [2Н]амино-кислот, полученных из гидролизата БР. Уровень дейтерированности рассчитывали по пикам молекулярных ионов [М]+ производных. Затем проводили разделение метиловых эфиров N-Dns-[2Н]производных ароматических аминокислот обращенно-фазовой ВЭЖХ и получали масс-спектры ЭУ для каждой выделенной индивидуальной [2Н]аминокислоты.
Полный масс-спектр электронного удара ЭУ смеси метиловых эфиров N-Dns-производных аминокислот, показанный на рис. 4 (сканирование при m/z 50 - 640, базовый пик m/z 527, 100 %), характеризуется непрерывностью: пики в интервале m/z от 50 до 400 на шкале массовых чисел представлены фрагментами метастабильных ионов, низкомолекулярных примесей, а также продуктами химической модификации аминокислот. Анализируемые [2Н]ароматические аминокислоты, занимающие шкалу массовых чисел m/z от 415 до 456, представлены смесями молекул с различным количеством включенных атомов дейтерия, поэтому молекулярные ионы [М]+ полиморфно расщеплялись на отдельные кластеры со статистическим набором значений m/z в зависимости от количества водородных атомов в молекуле. Учитывая эффект изотопного полиморфизма, подсчет уровня дейтерированности молекул [2Н]аминокис-лот проводили по наиболее распространенному пику молекулярного иона [М]+ в каждом кластере с математически усредненной величиной [М]+ (рис. 4) — для фенилаланина пик молекулярного
Величины пиков молекулярных ионов [М]+ в масс-спектре ЭУ метиловых эфиров N-Dns-[2,3,4,5,6-2H5]Phe, N-Dns-[3,5-2H2]Tyr и N-Dns-[2,4,5,6,7-2H5]Trp и уровни дейтерированности
|
Соединение |
Величина пика [М]+ |
Интенсивность, % |
Количест во атомов * дейтерия |
Уровень дейтери-рованности, % от общего количества атомов водорода** |
|
N-Dns- |
413 |
7 |
1 |
13 |
|
[2,3,4,5,6- 2H 5 ]Phe-OMe |
414 |
18 |
2 |
25 |
|
415 |
15 |
3 |
38 |
|
|
416 |
11 |
4 |
50 |
|
|
417 |
14 |
5 |
63 |
|
|
418 |
6 |
6 |
75 |
|
|
N-Dns-[3,5- |
428 |
12 |
— |
— |
|
2H 2 ]Tyr-OMe |
429 |
15 |
1 |
14 |
|
430 |
5 |
2 |
29 |
|
|
N-Dns- |
453 |
5 |
2 |
26 |
|
[2,4,5,6,7- 2H 5 ]Trp-OMe |
454 |
6 |
3 |
38 |
|
455 |
9 |
4 |
50 |
|
|
456 |
11 |
5 |
64 |
|
|
457 |
5 |
6 |
77 |
Примечание.
* — прочерк означает отсутствие включения дейтерия; ** — при подсчете уровня дейтерированности протоны (дейтероны) при карбоксильных СООН- и амино NH 2 -группах аминокислот не учитывались из-за легкости изотопного (1Н-2Н) обмена.
иона определялся [М]+ при m/z 417, 14 % (вместо [М]+ при m/z 412, 20 % для немеченного производного (пики немеченных аминокислот не показаны)), тирозина — [М]+ при m/z 429, 15 % (вместо [М]+ при m/z 428, 13 %), триптофана — [М]+ при m/z= = 456, 11 % (вместо [М]+ при m/z 451, 17 %). Уровень дейтерированности, соответствующий увеличению молекулярной массы, составил для [2H]тирозина — 2 (96 ат.% 2Н), [2H]фенилала-нина — 5 (90 ат. % 2Н) и [2H]триптофана —5 (98 ат.% 2Н) атомов дейтерия, что совпадает с данными по уровню дейтерированости исходных ароматических аминокислот — [3,5-2H 2 ]Tyr, [2,3,4,5,6-2H 5 ]Phe и [2,4,5,6,7-2H 5 ]Trp, добавляемых в ростовую среду штамма продуцента. Полученные данные по уровню дейтерированности
[2H]фенилаланина, [2H]тирозина и [2H]триптофана позволяют сделать вывод о высокой селективности включения [2H]ароматических аминокислот в молекулу БР: дейтерий детектировался во всех остатках [2H]ароматических аминокислот (таблица). Присутствие в масс-спектре ЭУ пиков [M]+ протонированных и полудейтерированных аналогов фенилаланина с [M]+ при m/z 413 - 418, тирозина с [M]+ при m/z 428 - 430 и триптофана с [M]+ при m/z 453 - 457 с различными вкладами в уровни дей-терированности молекул, свидетельствует о сохранении небольшой доли минорных путей биосинтеза de novo , приводящим к разбавлению дейтериевой метки и определяется условиями биосинтеза 2Н-меченного БР (таблица).
а
б
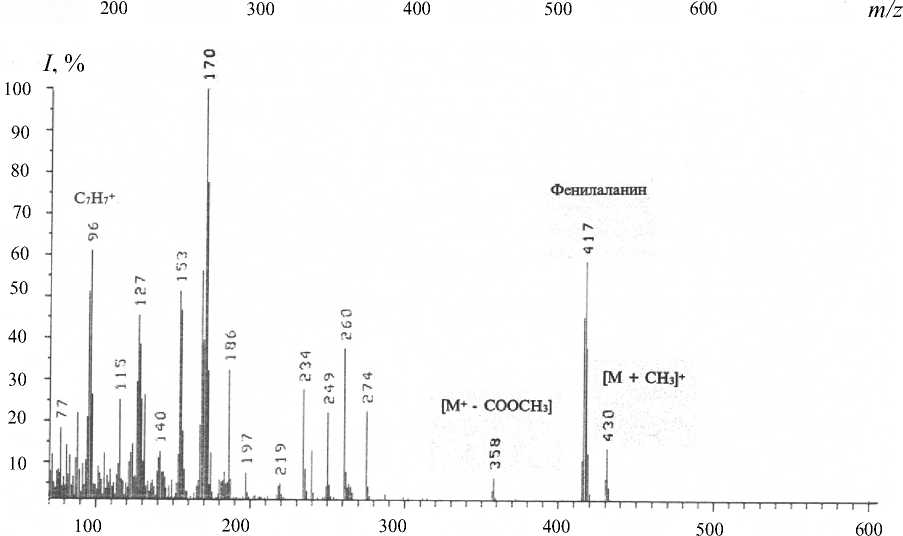
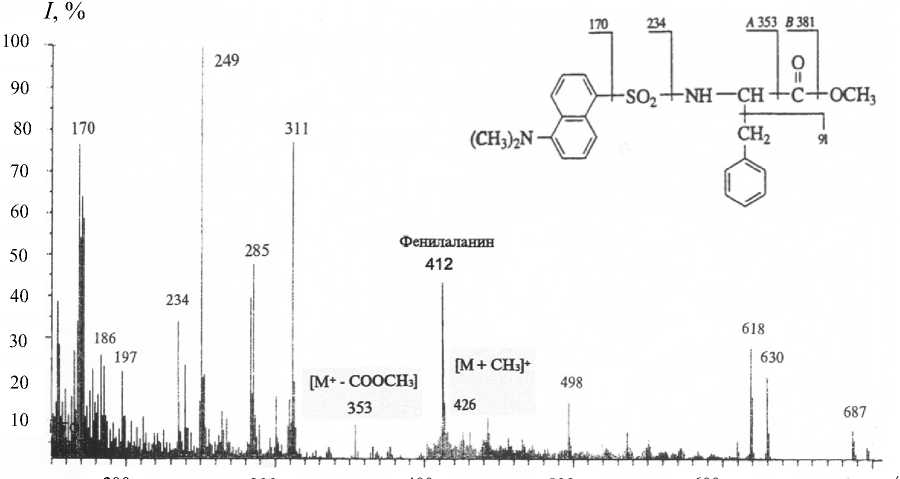
Рис. 5. Масс-спектры ЭУ метилового эфира N-Dns-[2,3,4,5,6-2H 5 ]Phe в различных экспериментальных условиях.
а — немеченный метиловый эфир N-Dns-Phe; б — метиловый эфир N-Dns-[2,3,4,5,6-2H5]Phe, выделенный из гидролизата БР методом ОФ ВЭЖХ. Условия разделения: жидкостной хроматограф Knauer ("Knauer", ФРГ), неподвижная фаза — сепарон С18 (Kova, Cловакия), колонка 250 × 10 мм; элюент: (А) — CH 3 CN—CF 3 COOH (100 : 0.1–0.5 об.%) и (Б) — CH 3 CN (100 об.%)
m/z
Согласно данным масс-спектрометрического анализа, пики молекулярных ионов [М]+ метиловых эфиров N-Dns-[2H]-производных ароматических аминокислот обладали низкой интенсивностью и полиморфно расщеплялись, поэтому области их молекулярного обогащения были сильно уширены.
Кроме этого, масс-спектры компонентов смеси аддитивны, поэтому смеси можно анализировать, только если имеются спектры различных компонентов, записанные в тех же условиях. Проводимые вычисления предусматривают решение системы из n уравнений с n неизвестными для смеси из n компонентов. Для компонентов, концентрация которых превышает 10 мол. %, правильность и воспроизводимость результатов анализа составляет ± 0.5 мол. % (при доверительной вероятности 90 %). Поэтому для получения воспроизводимого результата необходимо хроматографически выделять индивидуальные производные [2Н]амино-кислот из белкового гидролизата. Для решения поставленной задачи использовали ОФ ВЭЖХ на октадецилсилановом селикагеле силасорб С18, эффективность которого подтверждалась разделением смеси метиловых эфиров N-Dns-произ-водных [2Н]аминокислот из других микробных объектов, таких как метилотрофные бактерии и микроводоросли [20]. Метод адаптировали к условиям хроматографического разделения смеси метиловых эфиров N-Dns-[2H]-производных аминокислот гидролизата БР, что заключалось в оптимизации соотношения элюентов, форме градиента и скорости элюирования с колонки. Наилучшее разделение достигалось при градиентном элюировании метиловых эфиров N-Dns-[2H]-производных аминокислот смесью растворителей CH3CN— CF3COOH (100 : 0.1–0.5 об. %). При этом удалось разделить триптофан и трудно разрешимую пару фенилаланин / тирозин. Степени хроматографической чистоты выделенных из смеси белкового гидролизата БР метиловых эфиров N-Dns-[2,3,4,5,6-2H5]фенилаланина, N-Dns-[3,5-2H2]тиро-зина и N-Dns-[2,4,5,6,7-2H5]триптофана составили 89, 91 и 90 % соответственно. Полученный результат подтвердил рис. 5, б, на котором приведен масс-спектр ЭУ метилового эфира N-Dns-[2,3,4,5,6-2H5]фенилаланина, выделенного ОФ ВЭЖХ (сканирование при m/z 70-600, базовый пик m/z 170, 100 %) (масс-спектр приведен относительно немеченного метилового эфира N-Dns-фенилаланина (рис. 5, а), сканирование при m/z= = 150-700, базовый пик m/z 250, 100 %). Доказательством включения дейтерия в молекулу фенилаланина является пик тяжелого молекулярного иона метилового эфира N-Dns-[2H]фенилаланина ([М]+ m/z 417, 59 % вместо [М]+ m/z 412, 44 % для немеченного производного фенилаланина) и дополнительный пик обогащенного дейтерием бензильного С6Н5СН2-фрагмента молекулы [2H]фе-нилаланина m/z 96, 61 % (вместо m/z 91, 55 % в контроле (не показан)) (рис. 5, б). Пики второстепенных фрагментов различной интенсивности со значениями m/z 249, 234 и 170 являются продуктами вторичного распада дансильного остатка до N-диметиламинонафталина, низкоинтенсивный пик [M - COOCH3]+ m/z 358, 7 % (m/z 353, 10 %, контроль) является продуктом отщепления кар-боксиметильной СООСН3-группы из метилового эфира N-Dns-[2H]фенилаланина, а пик [M + CH3]+ m/z 430, 15 % (m/z 426, 8 %, контроль) — продуктом дополнительного метилирования по α-амино-группе [2H]фенилаланина (рис. 5, б). Согласно данным масс-спектрометрии ЭУ, разница между молекулярной массой легкого и тяжелого пиков [M]+ метилового эфира N-Dns-фенилаланина составляет пять единиц, что совпадает с первичными данными по уровню дейтерированности исходного [2,3,4,5,6-2H5]фенилаланина, добавляемого в среду выращивания. Масс-спектрометрические данные по уровням дейтерированности [3,5-2H2]тирозина и [2,4,5,6,7-2H5]триптофана также находятся в корреляции и подтверждены спектроскопией 1Н ЯМР.
ЗАКЛЮЧЕНИЕ
Полученные экспериментальные данные свидетельствуют о высокой эффективности мечения БР дейтерием по остаткам ароматических аминокислот Phe, Tyr и Trp с выходом [2H]БР 8–10 мг на 1 г биомассы. Главным преимуществом метода является то, что выделенный [2Н]БР сохраняет природную биологически активную конфигурацию в комплексе с 13- транс -ретиналем и способность к фотохимическим превращениям in vitro , что было доказано электрофорезом в 12.5 %-м ПААГ с 0.1 %-м ДДС-Na и регенерацией апомембран с 13- транс -ретиналем. Метод также применим к получению других аналогичных БР трансмембранных белков галофильных бактерий — сенсородопсина и гало-родопсина. Уникальные свойства природных бактериородопсинов обеспечивают широкий диапазон био- и нанотехнологических приложений, в которых могут найти применение их 2Н-меченные аналоги. В дальнейшем планируется получать полностью дейтерированные препараты БР для реконструкции функционально активных систем трансмембранных белков в тяжелой воде с очищенными [2Н]жирными кислотами и другими биологически активными соединениями. Эти исследования позволят дать ответ на вопрос, как функционирует БР в составе нативных мембран в условиях полного замещения протонов на дейтерий.
Работа осуществлялась при поддержке Научноисследовательского центра медицинской биофизики (Болгария). Грант № 012.

![Биосинтез фотопреобразующего трансмембранного белка [2Н] бактериородопсина, меченного дейтерием по остаткам ароматических аминокислот [2,3,4,5,6- 2H 5] Phe, [3,5- 2H 2] Tyr и [2,4,5,6,7- 2H 5] Trp Биосинтез фотопреобразующего трансмембранного белка [2Н] бактериородопсина, меченного дейтерием по остаткам ароматических аминокислот [2,3,4,5,6- 2H 5] Phe, [3,5- 2H 2] Tyr и [2,4,5,6,7- 2H 5] Trp](/file/cover/14264854/biosintez-fotopreobrazujushhego-transmembrannogo-belka-2n-bakteriorodopsina.png)
