Биосовместимость кальцийфосфатных материалов биогенного происхождения при имплантации в область дефектов костей собак
Автор: Талашова Ирина Александровна, Силантьева Тамара Алексеевна, Кононович Наталья Андреевна, Лунева Светлана Николаевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Цель. Оценить биосовместимость имплантационных кальцийфосфатных материалов из костной ткани быков в зависимости от их состава. Материалы и методы. В эксперименте на животных (собаки) оценивали биосовместимость трех имплантационных кальцийфосфатных материалов, произведенных по оригинальной технологии. Материалы получены из бычьей костной ткани путем ее деминерализации и осаждения из раствора солей фосфатов кальция. Для улучшения характеристик биосовместимости в их состав дополнительно вводили белки с молекулярной массой от 20 до 30 кДа, выделенные из сыворотки крови собак с активным остеогенезом. Выделение проводили с применением методов высаливания, диализа и гель-проникающей хроматографии. Кальцийфосфатные материалы и их композиты имплантировали в дефекты метафизов трубчатых костей. Исследование выполнено с применением методов инфракрасной спектроскопии, рентгеновского электронно-зондового микроанализа, световой и сканирующей электронной микроскопии. Количественно и качественно определяли химический состав материалов, характер и интенсивность репаративного костеобразования. Гистоморфометрически оценивали диаметр частиц имплантатов в составе тканей, заполняющих область дефекта губчатой кости. Результаты. Установлено, что имплантируемые материалы в разной степени обладали свойствами биодеградации, остеоиндукции и остеокондукции. Кальцийфосфатные материалы, наиболее приближенные по своему составу к костной ткани, имели высокую степень биосовместимости. Заключение. Предложенные кальцийфосфатные материалы могут найти применение в клинической практике при возмещении посттравматических дефектов, коррекции патологических состояний, сопровождающихся остеопорозом и потерей костного вещества.
Кальцийфосфатные материалы, биосовместимость, остеоиндукция, остеокондукция, биодеградация, биоинтеграция
Короткий адрес: https://sciup.org/142121934
IDR: 142121934 | УДК: [546.41''181.1:606:611.018.4]-089.84-092.9 | DOI: 10.18019/1028-4427-2016-4-95-103
Текст научной статьи Биосовместимость кальцийфосфатных материалов биогенного происхождения при имплантации в область дефектов костей собак
Биосовместимые имплантационные материалы для восстановления костной ткани человека в течение длительного периода времени востребованы в практической ортопедии и травматологии. Определенные ограничения в использовании аутогенной губчатой костной ткани, «золотого» стандарта костной пластики, предопределяют поиск новых остеопластических материалов как биологического, так и искусственного происхождения [1, 2]. Эти материалы должны обладать свойствами остеоиндуктивности, то есть стимулировать дифференциацию некоммитированных и коммитированных клеток в остеогенном направлении, а также остеокондуктивности, образуя плотные поверхностные контакты с новообразованной костной тканью [3-6]. Вышеуказанные свойства обеспечивают биоинтеграцию, или способность материала форми-
ровать механически прочную конструкцию совместно с вновь образованной костью [7]. Биодеградация, или способность к элиминации совместно с провизорными костными трабекулами в процессе физиологической реорганизации, также является обязательным свойством имплантационного материала [8]. Комплекс перечисленных качеств объединяется понятием биосовместимости или способности биоматериала выполнять необходимые функции в процессе заживления дефектов кости для получения положительного клинического результата [9]. Кальцийфосфатные соединения (CP), в том числе полученные из нативного костного матрикса, в значительной степени соответствуют этому комплексу требований [10, 11]. При имплантации в дефекты губчатой кости собак и овец подтверждена их низкая иммуногенность и хорошая биосовместимость
[12, 13]. Для любых имплантационных CP материалов имеют значение химический состав, размер и форма частиц [5, 14]. В связи с этим, достижение положительных результатов напрямую зависит от технологии их производства [15]. Задачей настоящего исследования являлось изучение свойств и биосовместимости, а именно, биодеградации, остеоиндуктивности и остео-кондуктивности CP материалов, полученных с использованием трех различных технологий из костной ткани
крупного рогатого скота (КРС) и имплантированных в дефекты метафизов трубчатых костей собак. Поскольку сыворотка крови, полученная в активной фазе дистракционного остеогенеза, содержат максимальную концентрацию остеоиндуцирующих факторов [16, 17], также было проверено предположение о том, что выделенные из нее белковые компоненты (SP) окажут оптимизирующее влияние на формирование кости и биосовместимость CP материалов.
МАТЕРИАЛЫ И МЕТОДЫ
Получение СР материалов
CP соединения были получены из диафизов костей взрослых сельскохозяйственных животных (КРС) по трем различным технологиям:
-
1) CP1: деминерализация костей 0,5 N раствором HCl и седиментация СР с использованием 52,2 % водного раствора NaOH;
-
2) СР2: деминерализация костей 0,5 N раствором HCl, седиментация СР с использованием 52,2 % водного раствора NaOH и дополнительная обработка 8M водным раствором карбамида;
-
3) CP3: деминерализация костей 6 N раствором HCl и седиментация СР с использованием 0,12 % водного раствора CaO.
Полученные CP материалы стерилизовали β-излучением в дозе 20 кГр с использованием линейного резонансного ускорителя электронов LUE-8-5V (НИИЭФА, Россия).
Исследование состава CP материалов
Качественный состав разработанных CP материалов исследовали методом инфракрасной спектроскопии (IR) с использованием ИК-Фурье спектрометра (Инфралюм ФТ-02, Люмэкс, Россия). Для количественного определения кальция (Ca), фосфора (P), магния (Mg) и серы (S) в образцах CP материалов и костной ткани собак методом рентгеновского электронно-зондового анализа использовали электронно-зондовый энергодисперсионный микроанализатор Oxford INCA Energy 200 (Oxford Instruments, UK), смонтированный на сканирующем электронном микроскопе JSM-840 (JEOL, Japan); исследование проводили при ускоряющем напряжении 20 kV. Количественные данные представлены в виде значений выборочного среднего и его стандартного отклонения (M ± SD).
Разделение белков сыворотки крови
Гомологичные SP активной фазы дистракционного остеогенеза были получены из сыворотки крови собак, которым выполняли удлинение костей голени посредством аппарата Илизарова в ходе параллельного экспериментального исследования [18]. Полученную сыворотку крови разводили в два раза 0,15 М раствором NaCl, подвергали сатурации сульфатом аммония до 30 % насыщения, охлаждали и удаляли осадок путем ультрацентрифугирования (Optima LE-80K, Beckman Coulter, USA) при 40000 g в течение 15 мин. Надосадочную жидкость подвергали сатурации сульфатом аммония до 50 % насыщения для дальнейшего центрифугирования. Очищение протеинов выполняли с использованием системы для гель-проникающей хроматографии (GF) LKB (Pharmacia LKB Biotechnology AB, Sweden). Осадок, образовавшийся после второго этапа высаливания, растворяли в 8М растворе мочевины и фракционировали в соответствии с молекулярной массой с использованием GF на носителе TSK-гель TOYOPEARL HW65S (ToyoSoda, Japan).
Фракции с объемом выхода, соответствующим относительной молекулярной массе в 20-30 кДа, подвергали диализу против дистиллированной воды и лиофилизировали. Затем порции полученных SP весом от 0,02 до 0,03 г растворяли в 1 мл физиологического раствора и смешивали с 5,0-5,2 г каждого из трех СР материалов. Полученную композицию разбавляли физиологическим раствором до пастообразной консистенции. Затем каждый из CP+SP композитов помещали в стеклянный флакон, закрытый резиновой пробкой с алюминиевыми колпачками, и подвергали стерилизации β-излучением в дозе 20 кГр с использованием линейного резонансного ускорителя электронов LUE-8-5V (НИИЭФА, Россия).
Имплантация CP материалов в дефект губчатой кости собак
Эксперимент по имплантации выполнен на 24 взрослых беспородных собак обоего пола в возрасте от одного года до трех лет с массой тела 8,8 ± 3,2 кг. Моделирование несквозных конических дефектов диаметром 5-7 мм (n = 120) проксимальных метафизов плечевой и большеберцовой костей осуществляли с применением сверла. Полученные дефекты заполняли пастообразными CP материалами и CP+SP биокомпозитами: CPI (n = 16), CP2 (n = 16), CP3 (n = 16), CP1+SP (n = 16), CP2+SP (n = 16) и CP3+SP (n = 16). У семи животных, составивших контрольную группу, имплантацию материалов в костные дефекты (n = 24) не проводили. Животных выводили из эксперимента через 21 и 42 суток после операции путем внутривенного введения летальных доз 5 % раствора тиопентала натрия. Оперативные вмешательства, уход за животными и эвтаназию выполняли в соответствии с Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 1986). Выполнение исследований было одобрено комитетом по этике ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» (протокол № 3 от 12.03.2001), результаты разрешены к публикации редакционным советом (протокол № 3-28 от 27.09.2013).
Гистологическое исследование биосовместимости
Образцы тканей метафизов оперированных животных, полученные через 21 и 42 суток эксперимента, обрабатывали в соответствии с общепринятыми гистологическими методиками [19]. Репаративное костеобразование в области создания дефекта и биосовместимость CP материалов исследовали методом световой микроскопии. Целлоидиновые срезы, окрашенные гематоксилином и эозином, по Массону, исследовали в световом фотомикроскопе (OPTON Feintechnik GmbH, Germany). Оцифрованные изображения полей зрения были получены с использованием АПК ДиаМорф (ДиаМорф, Россия), смонтированном на фотомикроскопе. Оцифрованные тотальные изображения гистотопографических целлоидиновых препаратов получали с использованием сканера HP ScanJet 7400C (Hewlett-Packard, USA). Для выпол-
нения гистоморфометрических исследований применяли программное обеспечение ВидеоТесТ-Морфология (VideoTesT, Россия). Количественно оценивали объемную долю губчатой кости в дефекте (Vcb, %), объемную плотность трабекул в губчатой кости регенерата (Vtr, %), диаметр гранул имплантационного материала (Dg, мкм). Измерения выполняли не менее чем в 30 полях зрения для каждого гистологического препарата. Гранулы диаметром менее 100 мкм относили к категории «мелкие», если диаметр составлял 100-250 мкм – к категории «средние», а свыше 250 мкм – «крупные». Так как полученные
данные не отвечали нормальному распределению, для их стастистической обработки были применены методы непараметрической статистики, результаты представлены в виде медиан (Me) и их доверительных интервалов (95 % CI). Для оценки различия между группами наблюдений использовали U-критерий Манна-Уитни [20]. Различия считались статистически значимыми при р < 0,05. Статистическую обработку выполняли с использованием программы анализа данных AtteStat, версия 10.8.8 (надстройка программного продукта Microsoft Excel, свидетельство № 2002611109 от 28.06.2002).
РЕЗУЛЬТАТЫ
Инфракрасная спектроскопия CP материалов
Исследования методом IR спектроскопии показали, что CP материалы помимо неорганической составляющей, представленной кальцием и фосфором, включали в свой состав и другие группы. В CP1 это было небольшое количество карбонат-ионов – CO32-, достаточно высокое содержание протеинов, гидроксильных групп – OH, карбоксильных групп – COO и амидов (рис. 1, а). Инфракрасный спектр CP2 указывал на то, что в данном соединении практически отсутствовали вещества белковой природы, интенсивность полосы поглощения кар-бонат-ионов была низкой (рис. 1, b). Материал CP3 имел в своем составе карбонат-ионы, а также незначительное количество белковых соединений (рис. 1, c).
SEM и EPMA исследование состава и морфологии CP материалов
Исследование образцов CP материалов методами SEM и EPMA позволило установить, что все они представляли собой смесь гранулярного и порошкообразного компонентов. Гранулы имели неправильную форму, их размеры значительно варьировали (рис. 2). Результаты количетвенного анализа химических элементов представлены в таблице 1. Содержание Ca, P и Mg в материалах CP1 и CP2 было выше, чем в нативной костной ткани вследствие элиминации органических компонентов матрикса. Соотношение содаржания Ca и P было приближено к таковому в костной ткани интактных животных. По нашему мнению, присутствие S в образцах СР1 могло быть обусловлено частичным соосаждением матриксных протеинов. Материал CP3 наиболее сильно отличался от нативной костной ткани.
Гистологическое и гистоморфометрическое исследование биосовместимости CP материалов в области имплантации
21-е сутки эксперимента
Во всех экспериментальных группах после имплантации кальцийфосфатных материалов в область дефекта дно и стенки полости покрывал слой новообразованной губчатой костной ткани с грубоволокнистыми трабекулами и студенистым костным мозгом. Большую часть дефекта заполняла рыхлая волокнистая соединительная ткань, обильно васкуляризированная полнокровными синусоидными капиллярами. При имплантации CP3 в составе волокнистой соединительной ткани отмечали большое количество моноцитов и макрофагов, обширные кистозные полости. Гранулы имплантированных CP1 и CP2 материалов располагались одиночно, в составе трабекулярной костной и рыхлой соединительной тканей (рис. 3, a, b). На их поверхности обнаруживались прикрепленные многоядерные фагоциты. В группах, где использовали биокомпозиты, включающие белки сыворотки крови, отмечали плотный контакт трабекулярных и гранулярных поверхностей, прилегание капилляров соединительной и костной ткани к частицам СР материалов (рис. 3, d, e). Имплантат CP3 был
представлен скоплениями неструктурированного материала и рыхлых гранул, окруженных волокнистой соединительной тканью (рис. 3, c). Сочетание СР3 и сывороточных белков, по-видимому, увеличивало скорость резорбции имплантата, так как гранулы в составе волокнистой соединительной ткани были единичными (рис. 3, c). В обоих случаях поверхность новообразованных костных трабекул и гранул экспериментального материала резорбировали многоядерные фагоцитирующие клетки (рис. 3, f). Остео-индуктивные саойства СР материалов оценивали, измеряя Vcb и Vtr. В группах CP2 and CP2+SP были выявлены наиболее высокие значения показателей Vcb и Vtr, при этом заполнение дефекта губчатой костной тканью соответствовало таковому в контрольной группе, а Vtr превышала контрольный уровень. Имплантация материалов CP1 и CP3 статистически значимо снижала образование губчатой костной ткани в области регенерации, а Vtr не отличалась от контрольных значений. Применение CP+SP биокомпозитов значимо увеличивало заполнение дефекта губчатой костью во всех экспериментальных группах и влияло на объемную плотность трабекул (табл. 2).
42-е сутки эксперимента
На данном этапе эксперимента во всех группах в области дефекта преобладала губчатая костная ткань (рис. 4). Самые высокие показатели костеобразования были отмечены в группах с CP1, особенно при имплантации CP1+SP. Среднее значение Vcb превышало контрольные значения параметра, а Vtr приближалась к таковой в контроле. Трабекулы были сформированы пластинчатой костной тканью, в промежутках между ними располагался красный костный мозг. В группах CP2 и CP3 новообразованная губчатая костная ткань подвергалась реорганизации. Значения Vcb в области регенерации были снижены в сравнении с контролем. Введение SP в состав материала CP2 не оказывало значимого влияния на параметры костеобразования, тогда как в группе CP3+SP эти параметры были снижены по сравнению с эффектом от имплантации одного CP3 (табл. 3). Гранулы CP1 обнаруживались в составе костного вещества либо находились в плотном контакте с пластинчатыми трабекулами (рис. 5, a). Гранулы CP2 распределялись в костном веществе, межтрабекулярных промежутках и волокнистой соединительной ткани регенерата (рис. 5, b), а отдельно лежащие гранулы резорбировались многоядерными фагоцитами (рис. 5, b). Частицы материала CP3 формировали обширные скопления либо хлопьевидные включения в составе рыхлой соединительной ткани, инфильтрованной моноцитами и макрофагами (рис. 5, c). Введение SP в состав имплантационных материалов улучшало остеокондуктивность CP1 и CP2. Их гранулы контактировали как с поверхностью костных трабекул, так и с капиллярами соединительной ткани (рис. 5, d, e). В группе CP3+SP имплантационный материал полностью разорбировался (рис. 5, f).
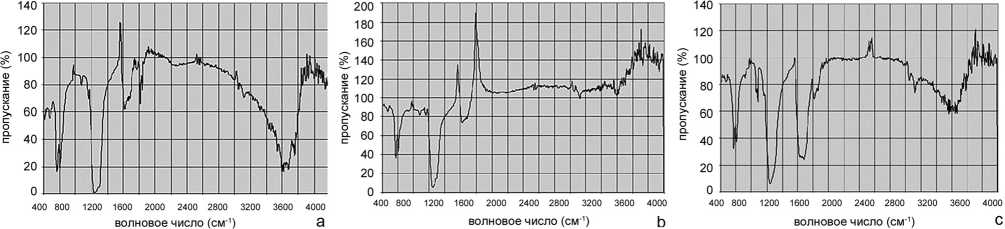
Рис. 1. IR спектры: (a) CP1, (b) CP2, (c) CP3

Рис. 2. Структура CP материалов по данным сканирующей электронной микроскопии: (a) CP1, увеличение 70×; (b) CP2, увеличение 80×; (c) CP3, увеличение 120×
Таблица 1
Содержание минеральных компонентов, M ± SD (%)
|
Ca |
P |
Mg |
S |
Са/Р |
|
|
Костная ткань |
22,8 ± 0,12 |
10,5 ± 0,09 |
0,27 ± 0,040 |
0,10 ± 0,004 |
2,17 |
|
CP1 |
33,18 ± 0,88 |
15,71 ± 0,52 |
0,43 ± 0,07 |
0,07 ± 0,03 |
2,11 |
|
CP2 |
30,20 ± 0,92 |
14,72 ± 0,82 |
0,59 ± 0,11 |
0 |
2,05 |
|
CP3 |
30,07 ± 0,87 |
10,25 ± 1,14 |
0,11 ± 0,03 |
0 |
2,93 |
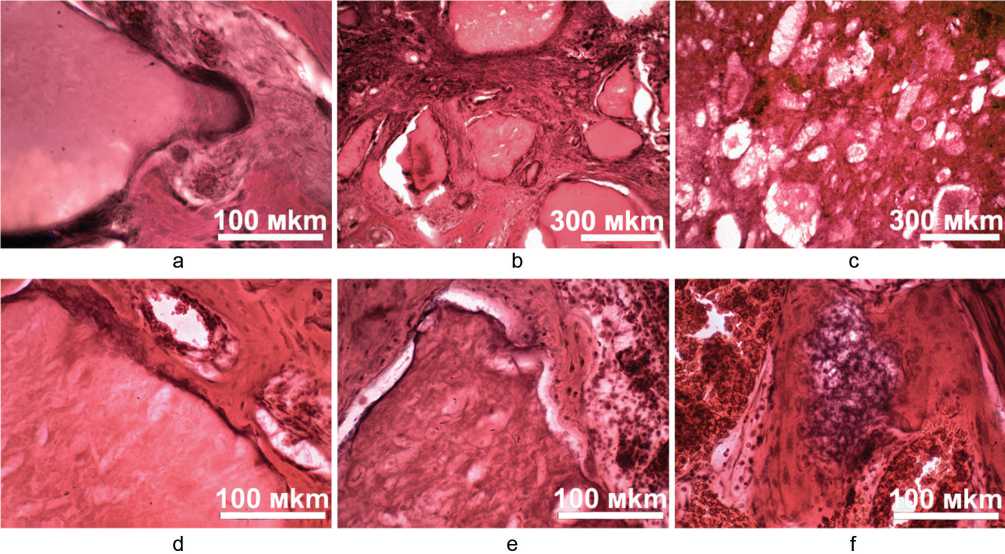
Рис. 3. Гранулы CP в тканях области дефекта на 21 сутки эксперимента: (a) CP1, (b) CP2, (c) CP3, (d) CP1+SP, (e) CP2+SP, (f) CP3+SP. Окрашивание гематоксилином и эозином; а, d-f – объектив 40x, окуляр 10×; b, c – объектив 10×, окуляр 10×
Таблица 2
Морфометрические параметры новообразованной костной ткани в области дефекта (21-е сутки эксперимента)
|
Параметр |
Контрольная группа |
|||||
|
Me |
95 % CI |
|||||
|
Vcb |
50,3 |
44,2–54,0 |
||||
|
Vtr |
29,6 |
23,7–34,6 |
||||
|
CP1 |
CP2 |
CP3 |
||||
|
Me |
95 % CI |
Me |
95 % CI |
Me |
95 % CI |
|
|
Vcb |
31,5* |
27,6–33,8 |
45,3 |
38,3–53,0 |
25,4* |
20,6–31,6 |
|
Vtr |
32,7 |
29,3–37,6 |
44,9** |
39,3–52,5 |
32,5 |
27,6–41,8 |
|
CP1+SP |
CP2+SP |
CP3+SP |
||||
|
Me |
95 % CI |
Me |
95 % CI |
Me |
95 % CI |
|
|
Vcb |
52,7 |
40,1–61,5 |
56,6 |
51,3–65,9 |
50,5 |
37,6–55,8 |
|
Vtr |
43,9** |
40,8–46,8 |
30,3 |
27,5–38,6 |
29,1 |
27,6–35,0 |
* – значимое снижение относительно контроля; ** – значимое увеличение относительно контроля.
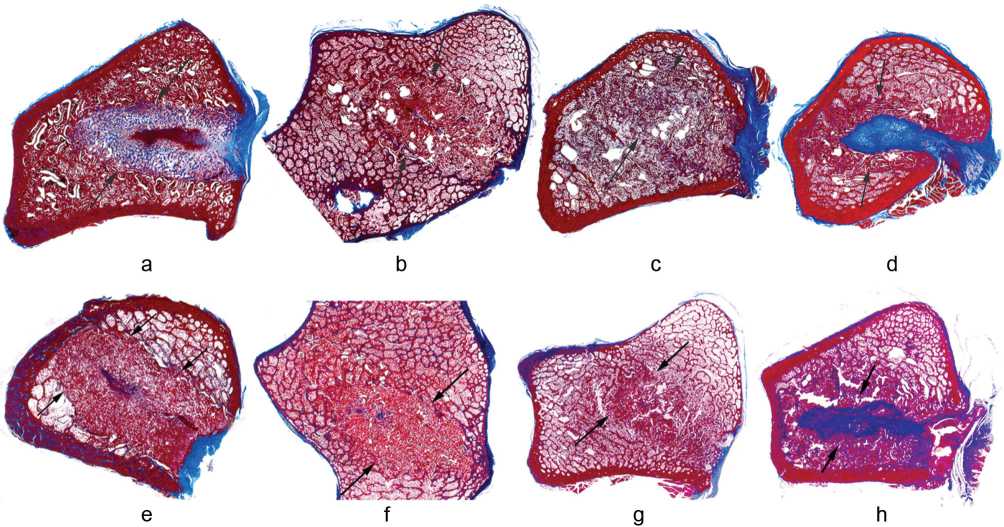
Рис. 4. Заполнение конусовидных дефектов в проксимальном метафизе большеберцовой кости: контрольная группа (a, e), CP1 (b), CP2 (c), CP3 (d), CP1+SP (f), CP2+SP (g), CP3+SP (h) на 42-е сутки эксперимента. Сканы гистотопографических целлоидиновых срезов. Окрашивание по Массону
Таблица 3
Морфометрические параметры новообразованной костной ткани в области дефекта (42-е сутки эксперимента)
|
Параметр |
Контрольная группа |
|||||
|
Me |
95 % CI |
|||||
|
Vcb |
71,3 |
62,7-79,9 |
||||
|
Vtr |
13,5 |
7,6-15,9 |
||||
|
CP1 |
CP2 |
CP3 |
||||
|
Me |
95 % CI |
Me |
95 % CI |
Me |
95 % CI |
|
|
Vcb |
85,8 |
74,5–90,4 |
67,7 |
63,4–72,0 |
58,3 |
49,8–70,4 |
|
Vtr |
12,6 |
9,6–15,5 |
29,4** |
26,0–32,2 |
32,8** |
24,1–39,6 |
|
CP1+SP |
CP2+SP |
CP3+SP |
||||
|
Me |
95 % CI |
Me |
95 % CI |
Me |
95 % CI |
|
|
Vcb |
88,1** |
84,9–91,7 |
78,7 |
74,3–85,0 |
43,5* |
36,1–49,7 |
|
Vtr |
12,5 |
10,8–18,3 |
23,9** |
20,7–26,1 |
17,6 |
15,9–18,9 |
* – значимое снижение относительно контроля; ** – значимое увеличение относительно контроля
Таблица 4
Диаметр CP гранул в области дефекта губчатой кости (мкм)
|
CP материалы |
21 день эксперимента |
42 дня эксперимента |
||
|
Me |
95 % CI |
Me |
95 % CI |
|
|
CP1 |
448 |
410–492 |
372 |
337–415 |
|
CP1+SP |
224 |
202–252 |
302 |
278–338 |
|
CP2 |
262 |
231–287 |
270 |
246–301 |
|
CP2+SP |
341 |
318–371 |
223 |
199–253 |
|
CP3 |
141 |
129–158 |
147 |
128–159 |
|
CP3+SP |
215 |
204–249 |
0 |
0 |
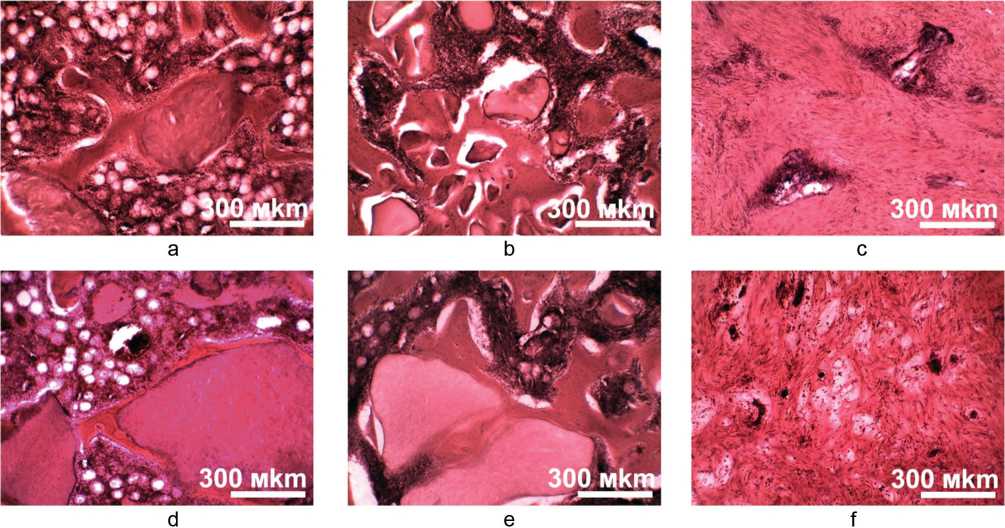
Рис. 5. Гранулы CP в тканях области дефекта на 42-е сутки эксперимента: CP1 (a), CP2 (b), CP3 (c), CP1+SP (d), CP2+SP (e), CP3+SP (f). Окрашивание гематоксилином и эозином. Объектив 10×; окуляр 10×
Гранулы CP материала в области дефекта 21-е сутки эксперимента
Исследование образцов тканей в области имплантации показало, что гранулы CP1 в их составе имели наибольший средний диаметр, составляющий около 400 мкм. Средний диаметр частиц матералов CP2 и CP3 составлял около 260 и 140 мкм соответственно. Добавление SP оказывало существенное влияние на их биодеградацию, так, среднее значение диаметра гранул CP1 снижалось приблизительно до 220 мкм,
а гранул CP2 и CP3 – напротив, возрастало, соответственно, до 340 и 215 мкм (табл. 4). Среди гранул в материалах CP1 и CP2 пребладали частицы большого и среднего диаметра, тогда как в материале CP3 – частицы среднего и малого диаметра. Добавление SP стимулировало резорбцию крупных, увеличивая этим доли мелких и средних гранул CP1 и CP2. Однако в материале CP3+SP первоочередная резорбция мелких и средних частиц приводила к снижению их доли в области имплантации (рис. 6, a).
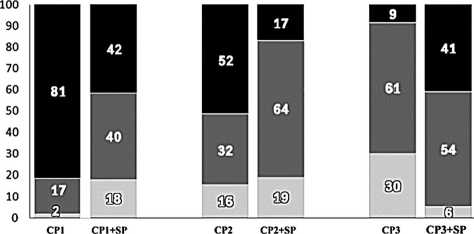
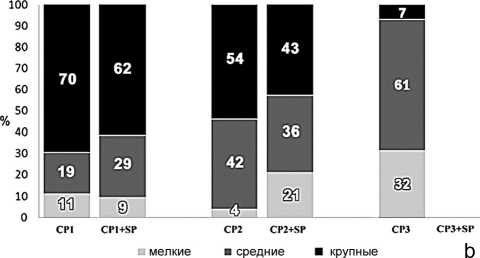
Рис. 6. Соотношение фракций гранул CP (%) в тканях области дефекта в соответствии с их размерными характеристиками: 21-е сутки эксперимента (a); 42-е сутки эксперимента (b)
42-е сутки эксперимента
Средний диаметр частиц имплантированных материалов без добавления SP не претерпевал существенных изменений в сравнении с предыдущим сроком эксперимента. Однако при использовании биокомпозитов средний диаметр гранул СР1+SP значительно увеличивался, в группе СР2+SP – напротив, снижался, а в группе CP3+SP частицы были полностью резорбированы (табл. 4). Изменения размеров частиц по сравнению с предыдущим периодом исследования отражали баланс между процессами биодеградации и биоинтеграции. При имплантации CP материалов без добавления SP
небольшое отличие размеров в сравнении с предыдущим периодом эксперимента свидетельствовало о замедлении процесса резорбции. В случае CP1 и CP2 это явление было связано с остеоинтеграцией, а в группе CP3 – с инкапсуляцией плотной волокнистой соединительной тканью. Введение в материалы SP ускоряло их биодеградацию, что проявлялось снижением доли мелких частиц и увеличением доли крупных, интегрированных в костную ткань гранул в группах CP1+SP и CP2+SP. В то же время, в группе CP3 добавление SP приводило к полной биодеградации материала и замещению его рыхлой соединительной тканью (рис. 6, b).
ДИСКУССИЯ
Анализ результатов исследования показал, что материалы CP1 и CP2 близки к нативной костной ткани по составу минерального компонента. Продукты деградации СР (ионы кальция, фосфат-ионы, полипептиды) являются естественными метаболитами и индуцируют биологические реакции, сходные с естественными процессами ремоделирования кости. Присутствие значительного количества белковых соединений в материале CP1 может оказывать стимулирующее влияние на адгезию и дифференциацию коммитированных клеток и остеобластов, определяя его остеоиндуктивные и осте-окондуктивные свойства [21]. Содержание небольшого количества Mg, как это показано для материала CP1, может оптимизировать его механические свойства, остеоиндуктивность, а также снижать степень резорбции или биодеградации [22]. Тем не менее, остеоиндуктивность CP1, по всей видимости, не является оптимальной, поскольку скорость образования костной ткани замедлена в сравнении с контрольной группой. Скорее всего, это явление связано с размером частиц CP1, составившим в среднем 400 мкм. Теоретические расчеты свидетельствуют о том, что более предпочтительный диапазон значений Dg находится в пределах 100-200 мкм. Данный размер частиц может обеспечить как высокую удельную поверхность резорбции, так и свободные промежутки между гранулами, достаточные для врастания сосудов и новообразованной костной ткани [23].
Материал CP2 содержит меньшее количество Mg, протеинов и не является остеокондуктивным. Тем не менее, в течение первых трех недель после его имплантации отмечено более активное, в сравнении с контролем, заполнение дефекта новообразованной губчатой костью, что свидетельствует о высокой остеоиндуктивности материала. Среднее значение Dg гранул CP2 на ранних этапах эксперимента составляет около 260 мкм, что приближено к оптимальным значениям для врастания вновь образованных тканей. Тем не менее, после 21 суток имплантации образование костной ткани снижается по сравнению с контрольной группой. Скорее всего, это связано с уменьшением скорости биодеградации материала, поскольку соотношения мелких, средних и крупных частиц остается неизменным вплоть до 42 суток эксперимента.
Материал CP3, в отличие от CP1 и CP2, в наибольшей степени отличается от нативной костной ткани. Он не содержит белковые соединения, а отношение
Са/Р превышает значения оптимального для СР материалов диапазона 2,0–2,5 [24], составляя 2,93. Средний диаметр Dg составляет около 140 мкм в течение всего эксперимента, что оптимально для биодеградации. Материал CP3 не является остеокондуктивным, а отсутствие макромолекул костного матрикса и Mg снижает механическую прочность гранул, что приводит к их разрушению и формированию плотных неструктурированных скоплений частиц малого диаметра. В целом, имплантация CP3 снижает скорость заполнения дефектов костной ткани. Полученные результаты подтверждают наблюдения, согласно которым CP частицы диаметром около 100 мкм и менее подавляют функционирование остеобластов [25]. Другая возможная причина низкой остеоиндуктивности может заключаться в особенностях химического состава материала CP3. Установлено, что кальцийфосфатные материалы с соотношением С/Р > 2, включающие СО, к которым относится и СР3, резорбируются, не проявляя свойств остеоиндуктивности и остеокондуктивности [24, 26].
Добавление SP к CP материалам улучшает их остеоиндукцию, остеокондукцию и ускоряет биодеградацию. Биокомпозиты CP1+SP и CP2+SP показали самую высокую биосовместимость, в то время как комбинация CP3+SP ускорила биодеградацию и способствовала улучшению остеоиндуктивности, но не оказала никакого влияния на остеокондуктивность материала. Наблюдаемые эффекты могут быть объяснены высокой сорбционной емкостью CP материалов по отношению к биологически активным соединениям, в частности, полипептидам сыворотки крови, полученным от экспериментальных животных на этапе дистракционного остеосинтеза и имеющим молекулярную массу в диапазоне от 20 до 30 кДа. Данная фракция сывороточных белков содержит остеогенные факторы роста, экспрессируемые в результате активизиции остеогенеза [17, 27, 28]. Влияние SP на минерализацию, резорбцию и биоинтеграцию при включении в состав CP материалов в последнее время широко обсуждается, при этом отмечено их стимулирующее влияние на регенерацию костной ткани [29]. В настоящее время известно несколько видов коммерческих CP материалов, однако их клиническое применение ограничено [30]. Лучшее понимание механизмов взаимодействия с биологическими тканями поможет раскрыть их потенциал для создания новой рациональной стратегии репарации костей после повреждения [31].
ЗАКЛЮЧЕНИЕ
Проведенное на собаках экспериментальное исследование показало, что остеокондуктивность, остеоиндуктивность и биодеградация разработанных нами биогенных кальцийфосфатных материалов зависит от технологии их производства. СР материалы, близкие по составу к матриксу нативной костной ткани, могут быть использованы для стимуляции костеобразования. Для улучшения характеристик остеоиндуктивности и биосовместимости их можно сочетать с гомологич-
ными белками сыворотки крови. По нашему мнению, подобные материалы должны найти свое место в лечении костной патологии, включая повреждения костей скелета, на фоне выраженного остеопороза, а также заполнения посттравматических костных дефектов, кист или компенсации дефицита костной ткани в ходе костнопластических операций.
Список литературы Биосовместимость кальцийфосфатных материалов биогенного происхождения при имплантации в область дефектов костей собак
- Pili D., Tranquilli Leali P. Biomaterials and bone//Aging Clin. Exp. Res. 2011. Vol. 23, 2 Suppl. P. 74-75.
- Bone formation with two types of grafting materials: a histologic and histomorphometric study/A.R. Rokn, M.A. Khodadoostan, A.A. Reza Rasouli Ghahroudi, P. Motahhary, M.J. Kharrazi, H.D. Bruyn, R. Afzalifar, E. Soolar, A. Soolari//Open Dent. J. 2011. Vol. 5. P. 96-104.
- Habibovic P., de Groot K. Osteoinductive biomaterials -properties and relevance in bone repair//J. Tissue Eng. Regen. Med. 2007. Vol. 1, N 1. P. 25-32.
- Osteoinductive biomaterials: current knowledge of properties, experimental models and biological mechanisms/A.M. Barradas, H. Yuan, C.A. van Blitterswijk, P. Habibovic//Eur. Cell Mater. 2011. Vol. 21. P. 407-429.
- Davies J.E. Bone bonding at natural and biomaterial surfaces//Biomaterials. 2007. Vol. 28, N 34. P. 5058-5067.
- McKee M.D. Management of segmental bony defects: the role of osteoconductive orthobiologics//J. Am. Acad. Orthop. Surg. 2006. Vol. 14, 10 Spec. No. P. 163-167.
- El-Ghannam A. Bone reconstruction: from bioceramics to tissue engineering//Expert Rev. Med. Devices. 2005. Vol. 2, N 1. P. 87-101.
- Le Geros R.Z. Biodegradation and bioresorption of calcium phosphate ceramics//Clin. Mater. 1993. Vol. 14, N 1. P. 65-88.
- Perry C.C., Patwardhan S.V., Deschaume O. From biominerals to biomaterials: the role of biomolecule-mineral interactions//Biochem. Soc. Trans. 2009. Vol. 37, Pt. 4. P. 687-691.
- Demineralized bone matrix and hydroxyapatite/tri-calcium phosphate mixture for bone healing in rats/A. Oztürk, H. Yetkin, L. Memis, E. Cila, S. Bolukbasi, C. Gemalmaz//Int. Orthop. 2006. Vol. 30, N 3. P. 147-152.
- Back-scattered electron imaging and elemental analysis of retrieved bone tissue following sinus augmentation with deproteinized bovine bone or biphasic calcium phosphate/C. Lindgren, M. Hallman, L. Sennerby, R. Sammons//Clin. Oral Implants Res. 2010. Vol. 21, N 9. P. 924-930.
- Tissue responses of calcium phosphate cement: a study in dogs/H. Yuan, Y. Li, J.D. de Bruijn, K. de Groot, X. Zhang//Biomaterials. 2000. Vol. 21, N 12. P. 1283-1290.
- An animal model in sheep for biocompatibility testing of biomaterials in cancellous bones/K.M. Nuss, J.A. Auer, A. Boos, B. von Rechenberg//BMC Musculoskelet. Disord. 2006. Vol. 7. P. 67.
- Hannink G., Arts J.J. Bioresorbability, porosity and mechanical strength of bone substitutes: what is optimal for bone regeneration?//Injury. 2011. Vol. 42, Suppl. 2. P. S22-S25.
- Badylak S.F., Freytes D.O., Gilbert T.W. Extracellular matrix as a biological scaffold material: Structure and function//Acta Biomater. 2009. Vol. 5, N 1. P. 1-13.
- Carano R.A., Filvaroff E.H. Angiogenesis and bone repair//Drug Discov. Today. 2003. Vol. 8, N 21. P. 980-989.
- The role of angiogenesis in a murine tibial model of distraction osteogenesis/R.S. Carvalho, T.A. Einhorn, W. Lehmann, C. Edgar, A. Al-Yamani, A. Apazidis, D. Pacicca, T.L. Clemens, L.C. Gerstenfeld//Bone. 2004. Vol. 34, N 5. P. 849-861.
- Шевцов В.И., Ерофеев С.А., Шрейнер А.А. Рентгенологическая динамика формирования дистракционного регенерата при удлинении конечности в условиях восьмикратной дробности дистракции//Гений Ортопедии. 2003. № 2. С. 5-9.
- Handbook of Histology Methods for Bone and Cartilage/Eds. H.A. Yuehuei, L.M. Kylie. Totowa-New Jersey: Humana Press Inc., 2003.
- Glantz S. Primer of Biostatistics. 6rd ed. New York: McGraw-Hill, 2005.
- Multiscale osteointegration as a new paradigm for the design of calcium phosphate scaffolds for bone regeneration/S.K. Lan Levengood, S.J. Polak, M.B. Wheeler, A.J. Maki, S.G. Clark, R.D. Jamison, A.J. Wagoner Johnson//Biomaterials. 2010. Vol. 31, N 13. P. 3552-3563.
- Phase composition, mechanical performance and in vitro biocompatibility of hydraulic setting calcium magnesium phosphate cement/U. Klammert, T. Reuther, M. Blank, I. Reske, J.E. Barralet, L.M. Grover, A.C. Kübler, U. Gbureck//Acta Biomater. 2010. Vol. 6, N 4. P. 1529-1535.
- Bohner M., Baumgart F. Theoretical model to determine the effects of geometrical factors on the resorption of calcium phosphate bone substitutes//Biomaterials. 2004. Vol. 25, N 17. P. 3569-3582.
- An in vitro evaluation of the Ca/P ratio for the cytocompatibility of nano-to-micron particulate calcium phosphates for bone regeneration/H. Liu, H. Yazici, C. Ergun, T.J. Webster, H. Bermek//Acta Biomater. 2008. Vol. 4, N 5. P. 1472-1479.
- The effects of calcium phosphate cement particles on osteoblast functions/D.P. Pioletti, H. Takei, T. Lin, P. Van Landuyt, Q.J. Ma, S.Y. Kwon, K.L. Sung//Biomaterials. 2000. Vol. 21, N 11. P. 1103-1114.
- Wang H., Lee J.K., Moursi A., Lannutti J.J. Ca/P ratio effects on the degradation of hydroxyapatite in vitro. J Biomed Mater Res A. 2003 Nov 1;67(2):599-608.
- Combes C., Rey C. Adsorption of proteins and calcium phosphate materials bioactivity//Biomaterials. 2002. Vol. 23, N 13. P. 2817-2823.
- Bab I., Chorev M. Osteogenic growth peptide: from concept to drug design//Biopolymers. 2002. Vol. 66, N 1. P. 33-48.
- Al-Sanabani J.S., Madfa A.A., Al-Sanabani F.A. Application of calcium phosphate materials in dentistry//Int. J. Biomater. 2013. Vol. 2013. P. 876132 DOI: 10.1155/2013/876132
- Larsson S., Hannink G. Injectable bone-graft substitutes: current products, their characteristics and indications, and new developments//Injury. 2011. Vol. 42, Suppl. 2. P. S30-S34.
- Kanczler J.M., Oreffo R.O. Osteogenesis and angiogenesis: the potential for engineering bone//Eur. Cell Mater. 2008. Vol. 15. P. 100-114.


