Брахитерапия рака предстательной железы источниками CS-131
Автор: Кавана Вильям
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Рак предстательной железы, рак почки
Статья в выпуске: 2-3, 2011 года.
Бесплатный доступ
Рак предстательной железы, брахитерапия
Короткий адрес: https://sciup.org/142187832
IDR: 142187832
Текст статьи Брахитерапия рака предстательной железы источниками CS-131
Т ехника трансперинеального внедрения радиоактивных частиц в предстательную железу впервые была применена в 1985 г. John Blasko совместно с Haakon Ragde в Северо-Западном госпитале в Сиэтле. Они адаптировали уже существовавший на тот момент метод, и использовали его для лечения РПЖ (Blasko J.C., 2002).
В конце 80-х годов прошлого века, когда в США был широко внедрен скрининг РПЖ при помощи измерения уровня ПСА среди правительственных организаций и институтов, например, в Национальном институте рака, возникло беспокойство. Оно было обусловлено тем, что среди сотен тысяч пациентов, перенесших РПЭ по поводу РПЖ, наблюдался высокий уровень осложнений, а смертность была сравнима с онкоспецифиче-ской смертностью (Blasko J.C., 2002, Grimm P.D., 2001).
Когда брахитерапия пришла в США, это был единственный минимально-инвазивный способ лечения РПЖ (Blasko J.C., 2002). Су- ществует огромное количество исследований, посвященных брахитерапии, и все они говорят о высокой эффективности и приемлемом профиле осложнений, что и обеспечило быстрое принятие брахитерапии на вооружение.
В настоящее время для выполнения брахитерапии применяется несколько радиоактивных изотопов. Первым из них был I-125, который используется уже на протяжении нескольких десятилетий (Blasko J.C., 2003, Sylvester J., 2000). В 80-е годы XX века стал доступен к применению Pd-103, хотя существовали некоторые трудности его внедрения в клиническую практику вплоть до 1990-х гг., связанные, в том числе, с логистикой доставки и быстрым периодом распада препарата (Cavanagh W., 2000, Sylvester J., 1999, Blasko J.C., 2000, Ragde H., 1997). С 1965 г. появился изотоп Cs-137. Причина, по которой он считается потенциально очень важным для брахитерапии – это сочетание проникающей в ткани энергии изотопа, что является важным показателем для определения радикальности лечения, и безопасностью, связанной
Cs131-brachytherapy for prostate cancer
W. Cavanagh
с коротким временем полураспада (таблица 1).
ИЗОТОП СS-131
Почему же Сs-131 – это не просто очередной изотоп для брахитерапии РПЖ?
Когда мы говорим о короткоживущем изотопе для брахитерапии, какие преимущества перед долгосрочной брахитерапией мы имеем в виду? Радиобиологи, говоря об опухоли, в первую очередь обращают внимание на массу клеток, бесконтрольно делящуюся и увеличивающуюся в объеме. Брахитерапия – это внедрение радиоактивного изотопа в опухоль (Cavanagh W.,1997). Она позволяет доставить большую дозу облучения непосредственно в ткань новообразования. Однако, до получения летальной дозы ионизирующей радиации, клетки опухоли все еще могут продолжать делиться и расти. в
Таблица 1. Виды источников и их характеристики
|
Год внедрения |
Изотоп |
Период полураспада |
Энергия |
90% доза |
Общая доза |
|
2004 |
Cs-131 |
9,7 дней |
30,4 KeV |
33 дня |
115 Гр |
|
1986 |
Pd-103 |
17 дней |
20,8 KeV |
58 дней |
125 Гр |
|
1965 |
I-125 |
60 дней |
28,5 KeV |
208 дней |
145 Гр |
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №2-3 2011
У каждого вида опухоли есть определенная скорость роста. И чем она выше, тем чувствительнее опухоль к облучению. Существуют различные модели для описания этой зависимости. Если после имплантации радиоактивных зерен опухоль увеличилась в размерах, это означает, что на 1 г ее ткани придется меньшая доза облучения. Если опухоль растет быстро, то биологически активная доза облучения, полученная при брахитерапии, будет уменьшаться. Для I-125, который принят в качестве «золотого стандарта», биологически эффективная доза, в основном, близка к необходимой только в случае, если опухоль растет очень медленно (Cavanagh W., 1996). Для Au-95 биологически эффективная доза также эквивалентна предписанной только для медленно растущей опухоли (рисунок 1). В случае быстрого роста опухоли, она получает только часть той дозы облучения, которая необходима для ее подавления. Именно поэтому мы должны использовать высокоэнергетические изотопы с коротким периодом полураспада. Такой подход основан на радиобиологии опухолевой ткани. Уровень излучаемой изотопом энергии имеет квадратичную зависимость, и с этих позиций короткоживущие изотопы обладают преимуществом, потому что они обеспечивают более быструю доставку биологически активной дозы в ткань (Blasko J.C., 1995).
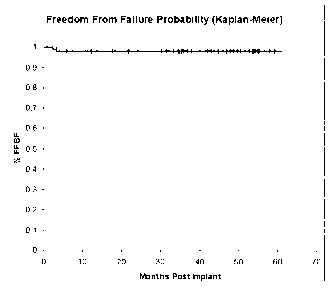
Сегодня клинический опыт применения Cs-131 насчитывает более 1000 пациентов. В одном из исследований в период с 2004 по 2006 гг. приняли участие 100 пациентов с локализованным РПЖ. Им была произведена имплантация Cs-131. Исходный уровень ПСА был менее 20 нг/мл, а сумма баллов по Глисону не превышала 7. Анализ данных показал, что уровень биохимического контроля составил 97,9% при сро- ке наблюдения в 60 месяцев (рисунок 2). И это очень хороший показатель, свидетельствующий о высокой эффективности данного метода (Cavanagh W., 2010).
Среди 100 пациентов мы наблюдали только 2 случая рецидива заболевания. У этих мужчин, также, как и у всех остальных, наблюдалось резкое снижение уровня ПСА. Однако через 2-3 месяца после имплантации вновь был отмечен рост его уровня. Оба пациента входили в группу высокого риска и имели сумму баллов по Глисону равную 7, и предоперационный уровень ПСА 13-14 нг/мл. Поэтому, такие результаты лечения у этих больных были, в какой-то степени, ожидаемы (Cavanagh W., 2010).
Существует множество исследований, в которых специалисты в области радиационной онкологии детально изучают время полураспада, энергию изотопов, их преиму-щества/недостатки с точки зрения радиобиологии. Многие из этих факторов в брахитерапии никак не связаны с клиническим применением метода.
В 2010 г. Moran провел исследование по брахитерапии Cs-131 у пациентов с РПЖ промежуточного риска. Это исследование показало очень хорошие результаты. Биохимическая безрецидивная выживаемость в течение 4 лет составила 91%. Появляющиеся новые данные подтверждают высокий уровень эффективности и низкую частоту осложнений монотерапии Cs-131 (Moran, 2010).
ВЫВОД
Популярность брахитерапии заключается в том, что это минимально-инвазивная техника лечения РПЖ, с небольшим числом осложнений, особенно по сравнению с радикальной простатэктомией. Результаты новейших исследований показывают, что брахитерапия может стать не только альтернативой
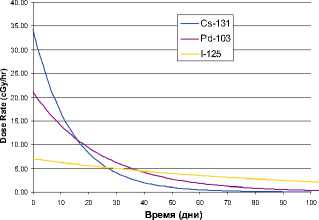
Рисунок 1. Изменение мощности дозы по времени
Prestidge, et al, 2010,
Рисунок 2. Пятилетние результаты биохимического контроля после перманентной брахитерапии Cs-131
хирургическому вмешательству, но и выступать в качестве адъювантной терапии . Это принципиально новый подход, суть которого заключается в размещении радиоактивных зерен по краю резекции органа, что значительно улучшает локальный контроль над опухолью. Подобные работы были проведены при раке легких, однако, я считаю, что в скором будущем могут появиться подобные исследования и среди больных РПЖ.


