Частота и факторы риска раннего рестеноза стента у больных, перенесших острый коронарный синдром
Автор: Стародубцева И.А., Мешкова М.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 2 т.20, 2024 года.
Бесплатный доступ
Цель: оценить частоту и выявить факторы риска развития рестеноза стента у больных с острымкоронарным синдромом (ОКС) после перенесенной чрескожной транслюминальной коронарной ангиопластики.Материал и методы. Проводился ретроспективный анализ 665 историй болезни пациентов с ОКС, перенесших стентирование коронарных артерий с января по ноябрь 2023 г. Определяли распространенность рестенозастента через 1 мес после индексного вмешательства у 117 пациентов. Анализировали факторы риска развития рестеноза стента на основе клинико-лабораторных данных больных с рестенозом (n=62) и без рестеноза(n=55).
Рестеноз стента, факторы риска, ишемическая болезнь сердца, чрескожная транслюминальная ангиопластика
Короткий адрес: https://sciup.org/149146930
IDR: 149146930 | УДК: 616.132.2-089.843:368.025.6 | DOI: 10.15275/ssmj2002181
Текст научной статьи Частота и факторы риска раннего рестеноза стента у больных, перенесших острый коронарный синдром
EDN: LEWNPU
1 Введение. Сердечно-сосудистые заболевания оказывают прогрессирующее влияние на сужение артерий вследствие образования бляшек на внутренних стенках кровеносных сосудов, что приводит к затруднению кровотока и, как следствие, к сердечному приступу, инсульту и даже смерти, если обструкция гемодинамически значимая. Эффективным методом лечения является использование внутрисосудистого механического устройства, называемого стентом, для немедленного восстановления кровотока. Однако физическая стимуляция, вызванная расширением стента, может вызвать воспаление ткани сосуда. Повторное сужение сосуда как одно из наиболее частых постстентирующих осложнений — основная патология, приводящая к внутристентовому рестенозу, индуцированному избыточным ростом ткани над развернутым стентом. Рестеноз внутри стента широко признан серьезной причиной смерти во всем мире. Следовательно, мониторинг и ранняя диагностика действительно имеют большое значение в профилактике серьезных осложнений [1]. Внедрение и последующие разработки технологий стентов с лекарственным покрытием существенно повысили эффективность и безопасность чрескожных коронарных вмешательств (ЧКВ). Тем не менее частота рестеноза стента и, как следствие, необходимость повторной реваскуляризации по-прежнему составляет 1-2% в год. Во многих случаях рестеноз можно рассматривать как относительно доброкачественное состояние, обычно проявляющееся симптомами стабильной стенокардии, однако есть сведения о том, что рестеноз стента — независимый фактор риска летального исхода наряду с другими важными клиническими факторами: возрастом, полом, сахарным диабетом (СД), курением, аортокоронарным шунтированием и снижением фракции выброса левого желудочка [2]. Проблемы, связанные с процессами воспаления и неоваскуляризации, требуют более пристального внимания. Малоизучено и проанализировано сочетание одновременно несколько клинических факторов риска, включая формирование неоинтимы, коморбидности, особенность гиполипи-демической терапии, COVID-19, тип использованного стента и др. Учитывая, что каждый год во всем мире имплантируются миллионы стентов с лекарственным покрытием, рестеноз внутри стента можно рассматривать как патологическое явление, имеющее значение для здравоохранения [3, 4].
Цель — оценить частоту и выявить факторы риска развития рестеноза стента у больных ишемической болезнью сердца после перенесенной чрескожной транслюминальной коронарной ангиопластики.
Материал и методы. Дизайн исследования и общая характеристика пациентов, включенных в исследование. В ретроспективное исследование включены 665 пациентов, поступивших с диагнозом «острый коронарный синдром» (ОКС) в кардиологический диспансер ГУЗ «Липецкая областная клиническая больница» в 2023 г. Острый инфаркт миокарда (ОИМ) с подъемом сегмента ST выявлен у 391 (59%) больного, нестабильная стенокардия — у 216 (32%), ОИМ без подъема ST — у 58 (9%) пациентов.
I этап: во время ОКС всем пациентам выполнена успешная селективная коронарография (СКГ) с реканализацией инфарктсвязанной артерии с достижением дистального кровотока по шкале TIMI (Thrombolysis in Myocardial Infarction — Оценка коронарного кровотока) III. Параллельно оценивался визуально кровоток в остальных коронарных артериях. II этап: при наличии сужения артерии, не связанной с инфарктом на 70-90%, пациент был запланирован на проведение повторной СКГ в лечебных целях в плановом порядке через 1 мес.
Клиническая характеристика анализируемых пациентов представлена на рис. 1, 2.
Основные критерии включения на повторную СКГ:
– клинически значимое (при наличии ангинозных болей) сужение диаметра просвета нативной коронарной артерии >70%;
– преходящая ишемия миокарда при стресс-эхокардиографии (ЭхоКГ) с появлением новых зон гипокинезии по данным ЭхоКГ, а при использовании
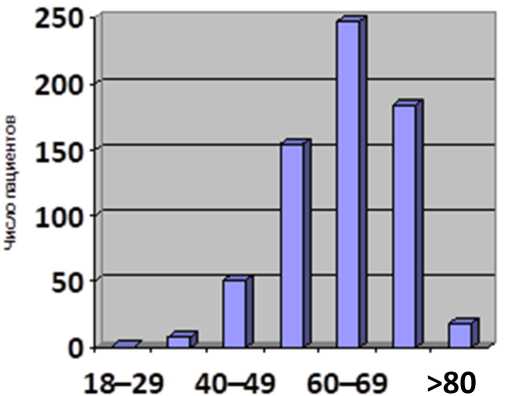
Рис. 1. Распределение пациентов по возрастным группам, лет
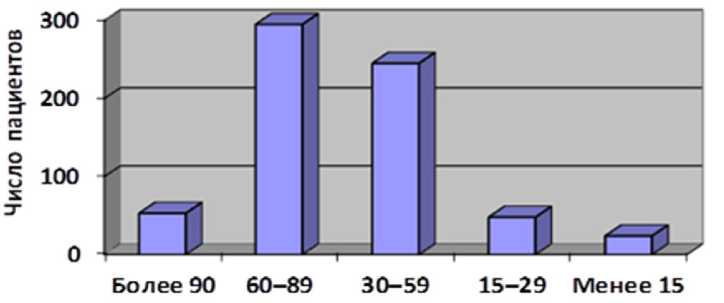
Рис. 2. Распределение пациентов с хронической болезнью почек по уровню скорости клубочковой фильтрации, мл/мин/1,72 м2
тредмил-теста — патологическая динамика сегмента ST (считается только тот случай, если точка J сместилась по отношению к исходному состоянию не менее чем на 0,1 мВ (т. е. не менее чем на 1 мм) относительно изоэлектрической линии);
– пациентам, у которых сохранялась или возобновлялась клиника стенокардии, не выполняли нагрузочные тесты;
- наличие сужения коронарной артерии на 70-90% во всех случаях без указания на рецидив стенокардии.
Ангиографическое исследование проводили 665 пациентам исходно при поступлении и 117 — через 1 мес после перенесенного ОКС с целью поэтапной реваскуляризации миокарда при ранее выявленных значимых стенозах неинфарктсвязанных коронарных артерий в момент ОКС [5]. В ходе анализа выявлены больные, у которых по результатам диагностической СКГ через 1–2 мес визуально отмечалось формирование неоинтимы и рестеноза внутри стента с различным процентом поражений нативной артерии.
Критерием наличия рестеноза было выявление ангиографически подтвержденного сужения в области установленного на I этапе стента >10% просвета сосуда внутри стента или формирование неоинтимы в ранние сроки (1–2 мес) после перенесенного ОКС. В настоящем исследовании с целью определения рестеноза использовали метод инвазивной диагностически под рентгенологическим контролем, выполняемое в условиях рентгеноперационной путем раздельной катетеризации коронарных артерий и введением контрастного вещества в просвет артерии для выполнения рентгенокиносъемки. Как в клинической практике, так и по данным мировой литературы минимального порога рестеноза не существует, рентгенсосудистый хирург может отметить данное состояние и от 5% или посчитать незначимым без указания процента рестеноза. В этом исследовании минимальный порог составляет 10%, который фиксировался в протоколах операций.
Всего выявлены 62 пациента с рестенозом (рис. 3, табл. 1).
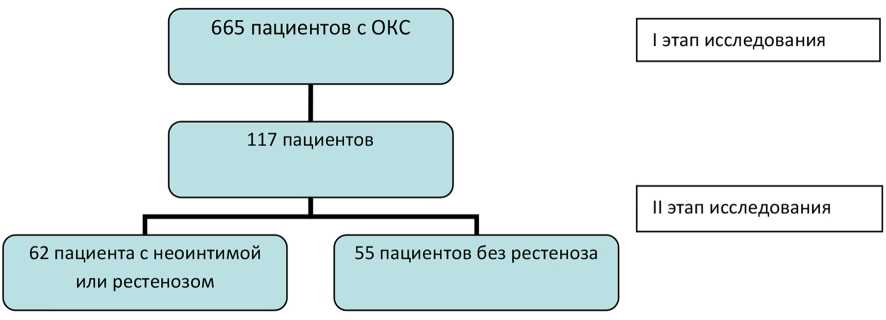
Рис. 3. Характеристика I и II этапов исследования
Таблица 1
Характеристика пациентов с ишемической болезнью сердца в сравниваемых группах
|
Характеристика |
Пациенты |
p |
||
|
общее число, n =117 |
c рестенозом, n =62 |
без рестеноза, n =55 |
||
|
Возраст, лет |
63 (57; 68) |
63 (58; 68) |
62 (55; 69) |
0,8 |
|
Женщины, абс. (%) |
20 (17) |
10 (16) |
10 (18) |
0,769 |
|
Мужчины, абс. (%) |
97 (83) |
52 (84) |
45 (82) |
|
|
Без рестеноза, абс. (%) |
55 (47) |
0 (0) |
55 (100) |
– |
|
Неоинтима, абс. (%) |
27 (23) |
27 (44) |
0 (0) |
|
|
Стеноз 10-30%, абс. (%) |
21 (18) |
21 (34) |
||
|
Стеноз 40-50%, абс. (%) |
12 (10) |
12 (19) |
||
|
Стеноз >70%, абс. (%) |
2 (2) |
2 (3) |
||
|
Нестабильная стенокардия (I20.0), абс. (%) |
45 (38) |
22 (34) |
23 (42) |
0,483 |
|
Стенокардия напряжения II–III ФК (I20.8), абс. (%) |
21 (18) |
9 (16) |
13 (24) |
0,307 |
|
ОИМ (I21.0), абс. (%) |
50 (43) |
31 (48) |
19 (34) |
0,134 |
|
Повторный ОИМ (I22.0), абс. (%) |
1 (0,9) |
1 (2) |
0 (0) |
0,952 |
|
Избыточная масса тела или ожирение, среди них: |
78 (66,7) |
46 (74) |
32 (58) |
0,102 |
|
избыточная масса тела, абс. (%) |
43 (37) |
24 (38) |
19 (36) |
0,784 |
|
ожирение 1-й степени, абс. (%) |
29 (25) |
16 (25) |
13 (25) |
0,955 |
Окончание табл. 1
|
Характеристика |
Пациенты |
p |
||
|
общее число, n =117 |
c рестенозом, n =62 |
без рестеноза, n =55 |
||
|
ожирение 2-й степени, абс. (%) |
5 (4,3) |
5 (7,8) |
0 (0) |
0,091 |
|
ожирение 3-й степени, абс. (%) |
1 (0,9) |
1 (1,6) |
0 (0) |
0,952 |
|
СД, абс. (%) |
37 (32) |
27 (42) |
10 (19) |
0,007 |
|
Артериальная гипертензия, абс. (%) |
108 (92) |
61 (95) |
47 (89) |
0,3 |
|
ОИМ, абс. (%) |
78 (67) |
47 (73) |
31 (58) |
0,088 |
|
Острое нарушение мозгового кровообращения, абс. (%) |
11 (9,4) |
8 (13) |
3 (5,7) |
0,3 |
|
Фибрилляция предсердий, абс. (%) |
15 (13) |
10 (16) |
5 (9,4) |
0,3 |
|
Хроническая болезнь почек (>3А-степени), абс. (%) |
27 (23) |
18 (28) |
9 (17) |
0,2 |
|
COVID-19 в анамнезе, абс. (%) |
17 (15) |
12 (19) |
5 (9,4) |
0,2 |
|
Продолжительность ИБС, мес |
10 (4; 12) |
10 (4; 12) |
6 (3; 24) |
0,3 |
|
Продолжительность ИБС >10 мес, абс. (%) |
33 (28) |
29 (46) |
4 (7) |
0,001 |
|
Онкологические заболевания, абс. (%) |
3 (2,6) |
3 (4,7) |
0 (0) |
0,3 |
|
Бронхиальная астма, абс. (%) |
2 (1,7) |
2 (3,1) |
0 (0) |
0,5 |
Группу сравнения составили 55 пациентов, перенесшие на II этапе СКГ, но без признаков рестеноза (рис. 3, табл. 1).
Критериями включения пациентов в группу сравнения были:
– соответствие полу и возрасту пациентов;
– отсутствие патологии, указанной в критериях исключения (хроническая почечная недостаточность (скорость клубочковой фильтрации <30 мл/мин/1,73 м 2 , рассчитанная по формуле CKD-EPI), аутоиммунные заболевания, носительство вируса иммунодефицита человека, гепатита В и С , противопоказание к приему аспирина, гематологические и иммунные заболевания, воспалительные заболевания в стадии обострения);
– высокая приверженность и хорошая переносимость терапии;
– подписанное информированное согласие пациентов в дальнейшем участие в исследовании.
Распределение пациентов по полу в группе с рестенозом внутри стента было следующим: 10 жен-щин/52 мужчины (16/84% соответственно), без рестеноза — 10 женщин и 45 мужчин (18/82%). Средний возраст пациентов в группе с рестенозом составил 63 (58; 68), в группе без рестеноза — 62 (55, 69) года.
Все пациенты получали базисную терапию: ти-кагрелор или клопидогрел, аторвастатин, ацетилсалициловую кислоту или антикоагулянт (в случае наличия у пациента фибрилляции предсердий в анамнезе), β-блокаторы и ингибиторы ангиотензин-превращающего фермента или антагонисты рецепторов ангиотензина II, по показаниям — препарат ангиотензиновых рецепторов и неприлизина.
Критерии невключения: хроническая почечная недостаточность (скорость клубочковой фильтрации <30 мл/мин/1,73 м2, рассчитанная по формуле CKD-EPI (Chronic Kidney Desease Epidemiology Collaboration), аутоиммунные заболевания, носительство вируса иммунодефицита человека, гепатита В и С , противопоказание к приему ацетилсалициловой кислоты, гематологические и иммунные заболевания, воспалительные заболевания в стадии обострения.
Ретроспективно для всех больных через 1 мес после развития ОКС собраны данные о показателях липидного спектра, анализировали клинико-лабораторные параметры, структуру коморбидной патологии, получаемую гиполипидемическую терапию и ангиографически оценили формирование начальных признаков рестеноза внутри стента или формирование неоинтимы в столь ранние сроки.
Общеклинические методы исследования: осмотр, сбор анамнеза для уточнения течения заболевания, наличия классических факторов риска атеросклероза, проводимой терапии.
Инструментальные методы исследования. Всем пациентам проводили запись электрокардиограммы покоя в 12 отведениях и трансторакальную ЭхоКГ в покое с целью оценки наличия очагово-рубцовых изменений миокарда. Прогрессирование коронарного атеросклероза внутри стента расценивали при наличии хотя бы одного из следующих критериев:
– появление субокклюзии внутри стента в исходно проходимом сегменте;
-
- появление новых рестенозов 10-30% в исходно нормальном сегменте;
-
- появление новых рестенозов 40-50% в исходно нормальном сегменте;
-
- появление новых рестенозов >70% в исходно нормальном сегменте;
-
– раннее формирование неоинтимы внутри стента [5].
Коронарную ангиографию проводили в двух ортогональных ракурсах. Перед всеми ангиографическими исследованиями вводили внутрикоронарный нитроглицерин (200 мг). Ангиограммы проанализированы в отделении рентгенохирургических методов диагностики и лечения заболеваний сердца и сосудов с использованием стационарного ангиографического комплекса Advantx LCV+ («Дженерал-Элек-трик», США). Края сосуда определяли с помощью компьютеризированного алгоритма, а диаметры просвета измеряли с помощью катетера, заполненного красителем, в качестве эталона. Диаметры нормальных сегментов проксимальнее и дистальнее обработанной области были усреднены для определения контрольного диаметра. Минимальный диаметр просвета, референтный диаметр и процент стеноза были рассчитаны как средние значения из двух ортогональных проекций. Кроме того, оценивали поражения коронарных артерий на предмет эксцентриситета, кальцификации, тромбирования, изъязвления бляшек, извитости и постпроцедурной диссекции.
Лабораторные методы исследования. Для проведения биохимического анализа крови у всех пациентов брали до 10 мл венозной крови натощак. Концентрацию показателей липидного спектра (общего холестерина, триглицеридов, холестерина липопротеинов высокой плотности) в сыворотке крови измеряли ферментативным колориметрическим методом на аппарате — биохимический анализатор Olympus AU480.
Статистические методы исследования. Статистическую обработку результатов проводили с использованием пакетов статистической обработки Microsoft Office Excel и Statistica 10.0. Для оценки нормальности распределения использовали критерий Колмогорова — Смирнова. Распределение для большинства изучаемых признаков отличалось от нормального, поэтому для сравнения групп по количественным признакам применяли непараметрический критерий Манна — Уитни, а для сравнения категориальных переменных использовали критерий Пирсона (χ2). Отличия считались статистически значимыми при р <0,05. Для оценки влияния клинических факторов на развитие рестеноза стента вычислялся относительный риск (ОР) и его 95% доверительный интервал (ДИ). Все пациенты подписали информированное согласие. Проведение исследования одобрил этический комитет ФГБОУ ВО «Воронежский государственный медицинский университет им. Н. Н. Бурденко» Минздрава России (протокол № 7 от 08.10.2021).
Результаты. Проанализированы данные 117 человек: 62 пациента ( n =62) с признаками рестеноза внутри стента и 55 пациентов ( n =55) — без рестеноза. Клинические характеристики пациентов обеих групп на момент выполнения ЧКВ со стентированием представлены в табл. 1. Пациенты обеих групп достоверно не отличались по возрасту, соотношению мужчин и женщин. При анализе сравниваемых групп достоверные отличия по частоте рестеноза стента выявлены по следующим признакам: СД 2-го типа (42%, ОР 1,6 (1,2-2,3); р =0,007), длительность ишемической болезни сердца (ИБС) более 10 мес (46%, ОР 2,24 (1,7–3,0); p =0,001) и стентирование голометаллическим стентом (89% ОР 1,8 (0,9-3,4); p =0,049) по сравнению с результатами контрольной группой: 19,7 и 76% соответственно. По данным коронарографии в группе пациентов с рестенозом внутри стента отмечалось формирование неоинтимы, что визуально подтвердилось в 44% (27 пациентов) случаев. У остальных больных группы сравнения выявлены различные рестенозы внутри стента в процентном соотношении на фоне достаточно интенсивной ли-пидснижающей терапии (94% пациента получали 40 мг аторвастатина). При распределении по нозологическим группам пациентов стоит отметить: в группе больных с рестенозом чаще перенесли острые события в виде ОИМ (48%), чем в группе без рестеноза (34%) (см. табл. 1).
Представляет большой научно-практический интерес структура коморбидной патологии и ее влияние на риск развития рестеноза. В ходе анализа индекса массы тела в целом большинство пациентов имели избыточную массу тела и ожирение, но при этом статистически достоверных различий в сравниваемых группах не отмечено. В структуре ко-морбидной патологии СД выявили у 32% анализируемых пациентов с ИБС, артериальную гипертензию (АГ) — у 92%, ОИМ, острое нарушение мозгового кровообращения, фибрилляцию предсердий диагностировали у 67; 9,4 и 13% пациентов соответственно (см. табл. 1).
Частота развития неоатеросклероза и неоинтимы статистически достоверно была выше при наличии у пациентов с СД 2-го типа в группе с рестенозом (ОР 1,6 (1,2; 2,3); p <0,05). АГ одинаково часто имели пациенты обеих групп сравнения. Не отмечено статистически достоверных значений влияния на риск развития рестеноза наличия следующих ко-морбидных состояний: острого нарушения мозгового кровообращения, ОИМ, фибрилляции предсердий, онкологических заболеваниях, бронхиальной астме и хронической болезни почек (>3А-степени). Кроме того, отмечена тенденция повышения риска рестеноза вследствие перенесенного COVID-19 согласно анамнестическим данным. Не только коморбид-ная патология, но продолжительность заболевания (ИБС — в среднем 10 мес в группе с рестенозом) способствовала развитию осложнений. У 62 пациентов в группе с рестенозом уровень общего холестерина через 2 мес. на фоне липидснижающей терапии составил в среднем 3,7±1,13 ммоль/л. Средний уровень холестерина липопротеинов низкой плотности (ХС ЛПНП) составил 1,84±0,84 ммоль/л, из них целевой показатель ЛПНП — менее 1,4 ммоль/л достигнут в 37,8% случаев (рис. 4). Большинство пациентов как в группе больных с рестенозом, так и без такового получали в качестве липидснижаю-щей терапии 40 мг аторвастатина (94 и 89% соответственно). В сравниваемых группах статистически достоверных отличий по уровню достигнутых целевых показателей липидного профиля отмечено не было.
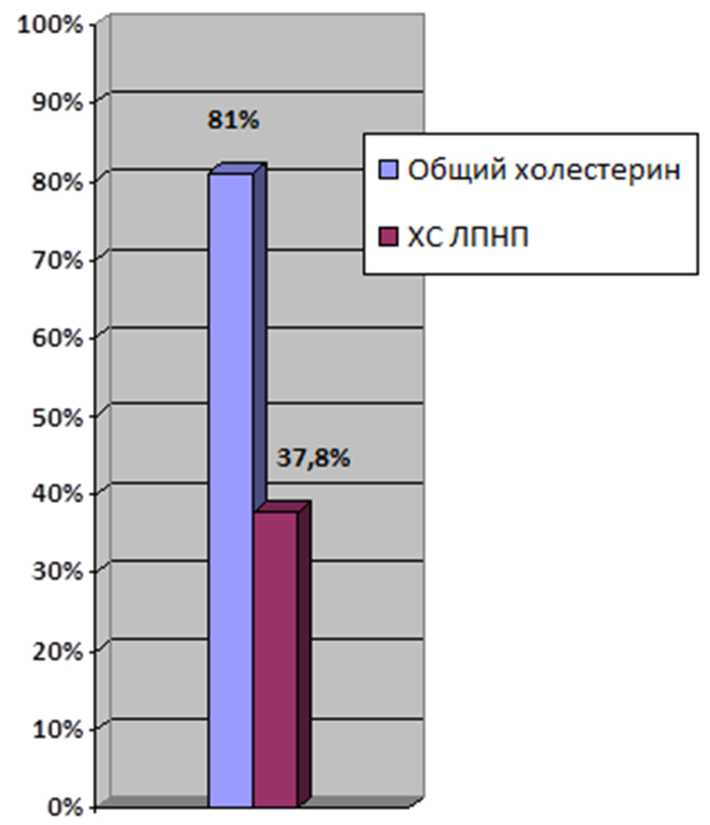
Рис. 4. Анализ достижения целевых значений липидного профиля у пациентов с рестенозом через 2 мес после перенесенного острого коронарного синдрома
Таблица 2
Результаты клинико-лабораторного анализа пациентов с ишемической болезнью сердца в сравниваемых группах
|
Показатель |
Пациенты |
р |
||
|
общее число, n =117 |
c рестенозом, n =62 |
без рестеноза, n =55 |
||
|
Холестерин, ммоль/л |
3,70 (3,15; 4,70) |
3,70 (3,15; 4,83) |
3,70 (3,16; 4,50) |
0,4 |
|
ХС ЛПНП, ммоль/л |
1,90 (1,44; 2,60) |
1,84 (1,32; 2,68) |
1,90 (1,50; 2,60) |
0,8 |
Тип стентов
|
DES, абс. (%) |
22 (19,0) |
7 (11,0) |
15 (24,0) |
0,049 |
|
BMS, абс. (%) |
95 (81,0) |
55 (89,0) |
40 (76,0) |
0,049 |
Локализация стенозов
|
Передняя нисходящая артерия, абс. (%) |
53 (45,0) |
28 (44,0) |
25 (47,0) |
0,7 |
|
Правая коронарная артерия, абс. (%) |
47 (40,0) |
23 (36,0) |
24 (45,0) |
0,3 |
|
Огибающая артерия, абс. (%) |
28 (24,0) |
14 (22,0) |
14 (26,0) |
0,6 |
|
Терапия Аторвастатин, мг |
||||
|
20, абс. (%) |
2 (3,4) |
2 (6,3) |
0 (0,0) |
0,530 |
|
40, абс. (%) |
109 (93,0) |
60 (94,0) |
49 (89,0) |
0,202 |
|
80, абс. (%) |
6 (3,4) |
0 (0,0) |
6 (11,0) |
0,025 |
Примечание. DES — drug eluting stent (стент с лекарственным покрытием); BMS — bare-metal stents (стент без лекарственного покрытия).
Целевой уровень ХС ЛПНП достигнут только у 37,8% пациентов на фоне приема 40 мг аторвастатина.
В настоящем исследовании статистически достоверных значимых различий по отношению к локализации стенозов в коронарной артерии не отмечалось. Зарегистрирована высокая частота рестеноза внутри стента без лекарственного покрытия, однако статистически достоверной разницы по сравнению с группой больных без рестеноза не выявлено (табл. 1, 2).
Обсуждение. Полученные результаты по частоте рестеноза стента сопоставимы с данными общемировых исследований [6]. Следует отметить достаточно высокую распространенность (4,9%) рестеноза внутри стента с кальцинированными узелками, по данным исследования японских авторов. Поскольку образование кальцинированных узелков может свидетельствовать о неблагоприятном исходе в случае повторного ЧКВ, нам следует это учитывать при определение показаний к ЧКВ и процедуры, позволяющие избежать формирование рестеноза. Как ранее отмечено, структура коморбидной патологии представляет большой научно-практический интерес и ее влияние на риск развития рестеноза. Известно, что повышенные показатели индекса массы тела связаны с риском развития рестеноза у больных с ожирением [7]. Значимые результаты влияния COVID-19 на риск развития осложнений получены в ходе многоцентрового исследования, согласно которому пациенты, перенесшие реваскуляризацию миокарда в прошлом, имели более высокий риск рестеноза стента на фоне коронавирусной инфекции из-за чрезмерной гиперплазии неоинтимы, гиперкоагуляции, усиления воспалительной реакции и эндотелиальной дисфункции [8]. Полученные данные были частично сопоставимы с результатами исследования Шандуньского университета традиционной китайской медицины, где, помимо СД 2-го типа, АГ, согласно одно- и многомерному регрессионному анализу факторов риска развития рестеноза стента авторы указали на влияние семейного анамнеза ИБС, курения, употребления алкоголя, отказа от приема ацетилсалициловой кислоты, кальцинированных поражений ≥3 имплантированных стентов, длины стента >30 мм, диаметра стента <3 мм и тандемного стентирования [9]. СД, гиперхолестеринемия, степень тяжести коронарного атеросклероза, а также количество одновременно имплантированных стентов установлены в качестве предикторов рестеноза стента в исследовании D. Shames и соавт. [10].
В настоящее время уделяют пристальное внимание высокоинтенсивной липидснижающей терапии. В данном исследовании не применялся персонифицированный подход к пациентам с целью достижения целевых значений липидного профиля. В соответствии с клиническими рекомендациями для всех пациентов с нарушениями липидного обмена рекомендована разработка индивидуального плана реабилитационных мероприятий, включающего решения по достижению целевого уровня ХС ЛПНП, повышению приверженности лечению, питанию и физической активности, контролю веса [11]. Согласно исследованию D. Nita и соавт. [12], больший диаметр стента и использование статинов положительно влияют на риск рестеноза стента в 1-й год после имплантации стента. Системную терапию статинами следует рассматривать у всех пациентов с СД, получающих интервенционное лечение, чтобы снизить риск рестеноза стента, особенно у пациентов из группы высокого риска.
Согласно данным F. Pelliccia и соавт., несмотря на то что частота рестеноза внутри стента снизилась с 30% через 6 мес при использовании голометаллических стентов до 7% через 4 г. при использовании стентов с лекарственным покрытием; ее возникновение актуально в абсолютном выражении из-за размеров популяции [13]. По данным настоящего исследования получены не столь однозначные результаты. Возможно, в дополнение к типу использованных стентов необходимо учитывать, помимо коморбидной патологии, индивидуальные анатомические особенности сосудов, на что указали в исследовании M. Gaudry и соавт. [14]. Кроме того, имеющиеся в настоящее время данные показывают очевидную перспективу разработки технологий генной терапии рестеноза [15].
Заключение. Таким образом, полученные результаты по частоте рестеноза стента не превышают 10% при использовании стентирования через 1 мес. На риск развития рестеноза внутри стента оказывают влияние сопутствующий СД 2-го типа, продолжительное течение основного заболевания и, возможно, перенесенный COVID-19. Так как у большинства пациентов применяли стенты без лекарственного покрытия, не удалось получить достоверных результатов о преимуществах и недостатках типов используемых стентов. Между тем стóит отметить, в группе с рестенозом достижение целевого показателя ЛПНП менее 1,4 ммоль/л отмечено в 37,8% случаев, что формирует острую необходимость активного поиска новых персонифицированных терапевтических подходов с целью предупреждения прогрессирования ИБС на амбулаторном этапе.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Частота и факторы риска раннего рестеноза стента у больных, перенесших острый коронарный синдром
- Yi Y, Wang B, Li C. Sensors-based monitoring and treatment approaches for in-stent restenosis. J Biomed Mater Res B Appl Biomater. 2023; 111 (2): 490–8. DOI: 10.1002/jbm.b.35164
- Cassese S, Byrne RA, Schulz S, et al. Prognostic role of restenosis in 10 004 patients undergoing routine control angiography after coronary stenting. Eur Heart J. 2015; 36 (2): 94–9. DOI: 10.1093 / eurheartj / ehu383
- Giustino G, Colombo A, Camaj A, et al. Coronary instent restenosis. J Am Coll Cardiol. 2022; 80 (4): 348–72. DOI: 10.1016 / j. jacc. 2022.05.017
- Megaly M, Alani F, Cheng CI, Ragina N. Risk factors for the development of carotid artery in-stent restenosis: Multivariable analysis. Cardiovasc Revasc Med. 2021; (24): 65–9. DOI: 10.1016 / j.carrev.2020.09.005
- Stable ischemic heart disease. Clinical guidelines 2020. Russian Journal of Cardiology. 2020; 25 (11): 4076. (In Russ.) Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020; 25 (11): 4076. DOI: 10.15829 / 1560‑4071‑2020‑4076
- Cortese B, Berti S, Biondi-Zoccai G, et al.; Italian Society of Interventional Cardiology. Drug-coated balloon treatment of coronary artery disease: A position paper of the Italian Society of Interventional Cardiology. Catheter Cardiovasc Interv. 2014; 83 (3): 427–35. DOI: 10.1002 / ccd.25149
- Veselovskaya NG. The prognosis of the risk of coronary arteries restenosis after their stenting in patients with obesity. Heart. 2013; 12 (5): 305–10. (In Russ.). Веселовская Н. Г. Прогнозирование риска рестеноза коронарных артерий после их стентирования у пациентов с ожирением. Сердце. 2013; 12 (5): 305–10.
- Batenova G, Pivina L, Dedov E, et al. Restenosis of coronary arteries in patients with coronavirus infection: Case series. Case Rep Med. 2023; 2023: 3000420. DOI: 10.1155 / 2023 / 3000420
- Zhang J, Zhang Q, Zhao K, et al. Risk factors for in-stent restenosis after coronary stent implantation in patients with coronary artery disease: A retrospective observational study Medicine (Baltimore). 2022; 101 (47): e31707. DOI: 10.1097 / MD.0000000000031707
- Shames DV. Coronary artery restenosis risk factors in emergency or planned stenting. The Bulletin of Contemporary Clinical Medicine. 2019; 12 (4): 116–23. (In Russ.) Шамес Д. В. Факторы риска рестенозов коронарных артерий при экстренном или плановом стентировании. Вестник современной клинической медицины. 2019; 12 (4): 116–23. DOI: 10.20969 / VSKM.2019.12(4):116–123
- Ezhov MV, Kukharchuk VV, Sergienko IV, et al. Disorders of lipid metabolism. Clinical Guidelines 2023. Journal of Cardiology. 2023; 28 (5): 5471. (In Russ.) Ежов М. В., Кухарчук В. В., Сергиенко И. В. и др. Клинические рекомендации 2023. Российский кардиологический журнал. 2023; 28 (5): 5471. DOI: 10.15829 / 1560‑4071‑2023‑5471
- Niţă D, Ionescu M, Mazilu L. Statins and the risk factors for coronary in-stent restenosis in diabetic patients. Farmacia. 2021; 69 (3): 576–84. DOI: 10.31925 / farmacia.2021.3.21
- Pelliccia F, Zimarino M, Niccoli G, et al. In-stent restenosis after percutaneous coronary intervention: Emerging knowledge on biological pathways. Eur Heart J Open. 2023; 3 (5): oead083. DOI: 10.1093 / ehjopen / oead083
- Gaudry M, Bartoli JM, Bal L, et al. Anatomical and technical factors influence the rate of in-stent restenosis following carotid artery stenting for the treatment of post-carotid endarterectomy stenosis. PLoS One. 2016; 11 (9): e0161716. DOI: 10.1371 / journal.pone.0161716
- Chochlov KA, Kozlov KL, Lebedenko EO, et al. Artery restenosis: Past, present, future. Cardiology: News, opinions, training. 2023; 11 (1): 34–41. (In Russ.) Хохлов К. А., Козлов К. Л., Лебеденко Е. О. и др. Артериальный рестеноз: прошлое, настоящее, будущее. Кардиология: новости, мнения, обучение. 2023; 11 (1): 34–41. DOI: 10 / 33029 / 2309‑1908‑2023‑11‑1‑34‑41


