Численное моделирование гемодинамики при повторном протезировании клапана сердца
Автор: Овчаренко Е.А., Онищенко П.С., Клышников Кирилл Юрьевич, Ганюков В.И., Шилов А.А., Верещагин И.Е., Коков А.Н., Тарасов Р.С., Борисов В.Г., Захаров Ю.Н., Барбараш Л.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 3 т.23, 2019 года.
Бесплатный доступ
Цель. Статья посвящена численному анализу причин и гемодинамических эффектов парапротезной регургитации при повторном транскатетерном протезировании клапана аорты по типу «протез-в-протез» с позиции прогностической ценности компьютерного моделирования. Методы. Инструментом численного анализа гемодинамики стало пациент-специфическое моделирование потока крови комплекса «протез-в-протез», сформированного из каркасного и транскатетерного самораскрывающегося биопротезов клапана аорты. Основой для получения трехмерных компьютерных моделей корня аорты, первичного каркасного несостоятельного и повторного транскатетерного биопротезов стали данные мультиспиральной компьютерной томографии пациента Т., 61 год, которому выполнена имплантация «протез-в-протез» самораскрывающегося клапана CoreValve™ (Medtronic, Дублин, Ирландия). Компьютерное моделирование проводили методом погруженной границы с учетом гемодинамических характеристик пациента, полученных при трансторакальном эхокардиографическом постоперационном исследовании. В работе анализировали качественные и количественные показатели тока крови: средние и пиковые скорости кровотока, пристеночное, вязкое напряжение и напряжение Рейнольдса, а также распределение данных показателей в объеме кровотока исследуемой области. Результаты. Полученные при численном моделировании высокие значения скорости кровотока в области интереса - зоне парапротезного сброса крови, - а также значения напряжений (вязкого и напряжения Рейнольдса) не могут приводить к значимым механическим разрушениям эритроцитов в сравнении с пороговыми литературными данными вследствие малого времени экспозиции. Полученное в результате моделирования высокое сдвиговое пристеночное напряжение в области фистулы, как следствие высоких скоростей тока крови, может инициировать тромбообразование. Тем не менее данных показателей клинически не выявлено. Выводы. Парапротезная регургитация I степени, вызванная низким положением транскатетерного протеза CoreValve™ относительно первичного каркасного биопротеза, привела к росту скоростей и напряжений в области патологического сброса крови, которые для данного случая не проявлялись гемолизом или тромбообразованием, однако могут быть учтены как факторы риска данных осложнений. Пациент-специфическая методика оценки гемодинамических эффектов, возникающих при транскатетерном протезировании, удовлетворительно воспроизводит клиническую картину парапротезной регургитации и может лечь в основу численных прогностических моделей аналогичных вмешательств.
Биопротез, парапротезная регургитация, транскатетерная имплантация, репротезирование, численное моделирование
Короткий адрес: https://sciup.org/142230702
IDR: 142230702 | DOI: 10.21688/1681-3472-2019-3-30-38
Текст научной статьи Численное моделирование гемодинамики при повторном протезировании клапана сердца
23(2):30-38. http://
org/10.21688/1681-3472-2019-2-30-38
Конфликт интересов
Финансирование
Исследование поддержано грантом Российского научного фонда, проект № 18-75-10061 по теме «Исследование и реализация концепции роботизированного малоинвазивного протезирования клапана аорты».
А.А. Шилов, https://orcid. org/0000-0002-4194-6623
А.Н. Коков, https://orcid. org/0000-0002-7573-0636
Р.С. Тарасов, https://orcid. org/0000-0003-3882-709X
Ю.Н. Захаров, https://orcid. org/0000-0002-2895-1428
Л.С. Барбараш, https://orcid. org/0000-0001-6981-9661
Статья открытого доступа, распространяется по лицензии Creative Commons Attribution 4.0 .
Е.А. Овчаренко 1, П.С. Онищенко 1, К.Ю. Клышников 1,
В.И. Ганюков 1, А.А. Шилов 1, И.Е. Верещагин 1, А.Н. Коков 1, Р.С. Тарасов 1, В.Г. Борисов 2, Ю.Н. Захаров 2, 3, Л.С. Барбараш 1
-
1 Федеральное государственное бюджетное научное учреждение Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний, Кемерово, Российская Федерация
-
2 Федеральное государственное бюджетное образовательное учреждение высшего образования «Кемеровский государственный университет», Кемерово, Российская Федерация 3Кемеровский филиал Федерального государственного бюджетного учреждения науки Института вычислительных технологий Сибирского отделения Российской академии наук, Кемерово, Российская Федерация
Цель. Статья посвящена численному анализу причин и гемодинамических эффектов парапротезной регургитации при повторном транскатетерном протезировании клапана аорты по типу «протез-в-протез» с позиции прогностической ценности компьютерного моделирования.
Методы. Инструментом численного анализа гемодинамики стало пациент-специ-фическое моделирование потока крови комплекса «протез-в-протез», сформированного из каркасного и транскатетерного самораскрывающегося биопротезов клапана аорты. Основой для получения трехмерных компьютерных моделей корня аорты, первичного каркасного несостоятельного и повторного транскатетерного биопротезов стали данные мультиспиральной компьютерной томографии пациента Т., 61 год, которому выполнена имплантация «протез-в-протез» саморас-крывающегося клапана CoreValve™ (Medtronic, Дублин, Ирландия). Компьютерное моделирование проводили методом погруженной границы с учетом гемодинамических характеристик пациента, полученных при трансторакальном эхокардиографическом постоперационном исследовании. В работе анализировали качественные и количественные показатели тока крови: средние и пиковые скорости кровотока, пристеночное, вязкое напряжение и напряжение Рейнольдса, а также распределение данных показателей в объеме кровотока исследуемой области.
Результаты. Полученные при численном моделировании высокие значения скорости кровотока в области интереса — зоне парапротезного сброса крови, — а также значения напряжений (вязкого и напряжения Рейнольдса) не могут приводить к значимым механическим разрушениям эритроцитов в сравнении с пороговыми литературными данными вследствие малого времени экспозиции. Полученное в результате моделирования высокое сдвиговое пристеночное напряжение в области фистулы, как следствие высоких скоростей тока крови, может инициировать тромбообразование. Тем не менее данных показателей клинически не выявлено.
Выводы. Парапротезная регургитация I степени, вызванная низким положением транскатетерного протеза CoreValve™ относительно первичного каркасного биопротеза, привела к росту скоростей и напряжений в области патологического сброса крови, которые для данного случая не проявлялись гемолизом или тромбо-образованием, однако могут быть учтены как факторы риска данных осложнений. Пациент-специфическая методика оценки гемодинамических эффектов, возникающих при транскатетерном протезировании, удовлетворительно воспроизводит клиническую картину парапротезной регургитации и может лечь в основу численных прогностических моделей аналогичных вмешательств.
Актуальность
Стеноз клапана аорты является наиболее распространенным вариантом приобретенных пороков сердца в развитых странах: ежегодное количество вмешательств для лечения данной патологии составляет более 10 тыс. в РФ и до 275 тыс. в мире [1–3]. Доказанная связь высокой смертности и тяжелого стеноза клапана аорты без лечения определяет тактику ведения таких пациентов — протезирование клапана [4]. При хирургической замене аортального клапана широкое применение получили биологические протезы — до 21,8–26,1% относительно всего объема вмешательств [2], а для США данный показатель в некоторых случаях достигал 50,2% [4]. Основной недостаток биопротезов — относительно ранняя структурная дисфункция дегенеративной природы, приводящая к необходимости повторного протезирования.
Современные исследователи сходятся во мнении, что срок свободы от дисфункции для большинства биопротезов не превышает 10–15 лет [5–7]. При этом риск развития такого состояния в послеоперационном периоде обратно пропорционален возрасту, и для пациентов 60 и 65 лет (пороговые значения возрастов согласно рекомендациям ESC/ EACTS 2017 г. [8]), прошедших процедуру биопротезирования, может достигать 25 и 21% соответственно [9]. Дисфункция биопротезов с последующей хирургической заменой демонстрирует высокий риск летальности и послеоперационных осложнений, несмотря на совершенствование методик и конструкций [10–12].
Поиск альтернативных решений проблемы реопераций привел к использованию транскатетерного протезирования (англ. Transcatheter Aortic Valve Replacement, TAVR), хорошо зарекомендованного в хирургии клапанных пороков пациентов высокого риска [13, 14]. Применяемый в таком случае метод протезирования по типу «протез-в-протез» (TAVR-in-SAVR) демонстрирует высокую эффективность с позиции клинических результатов [10, 12], однако сопряжен с рядом осложнений, прежде всего парапротезной регургитацией (от 4 до 25%) [3, 15]. Механизм данного осложнения обусловлен присутствием крупных кальциевых конгломератов, которые ограничивают прилегание TAVR-протеза к исходному биопротезу (англ. Surgical Aortic Valve Replacement, SAVR), а не сохранением герметично- сти [16]. Однако прогнозирование данного осложнения в случае некальцинированной дисфункции, например в результате структурной дегенерации, нарастания паннуса или эндокардита, становится более сложной задачей, требующей тщательного изучения. Дополнительно задача усложняется отсутствием четких рекомендаций для оптимального взаимного расположения первичного SAVR- и TAVR-протезов, прежде всего глубины имплантации [17].
Ценным прогностическим инструментом могут стать численные методы, прежде всего трехмерное компьютерное моделирование [18–20], воспроизводящее детальное взаимное расположение исследуемых объектов (TAVR- и SAVR-протезов) и гемодинамику, сформированную в результате повторного протезирования.
Цель исследования — анализ причин и гемодинамических эффектов парапротезной регургитации при повторном транскатетерном протезировании клапана аорты по типу «протез-в-протез» с позиции прогностической ценности компьютерного пациент-специфического моделирования.
Методы
Основой численного моделирования стали данные мультиспиральной компьютерной томографии (МСКТ) пациента Т., 61 год, которому выполнено транскатетерное протезирование аортального клапана для лечения дисфункции ранее установленного биологического протеза, имплантированного в 1985 г. На створках протеза выявлены флотирующие линейные структуры размером 1,2 см, регургитация III–IV ст. Пациенту выполнена транскатетерная имплантация самораскрывающегося биопротеза CoreValve™ ( Medtronic, Дублин, Ирландия) 29-го типоразмера в условиях искусственной вентиляции легких с использованием внутривенной анестезии. При повторном обследовании спустя 6 мес. обнаружена парапротезная регургитация I ст. в области митрально-аортального контакта. Анализ МСКТ-данных продемонстрировал отсутствие значимого кальциноза створок SAVR-биопротеза и симметричное раскрытие TAVR-протеза, что и стало основной предпосылкой поиска причины регургитации. Для детальной оценки развившейся парапротезной регургитации на основе МСКТ-дан-ных путем выделения объектов по рентгенологиче-
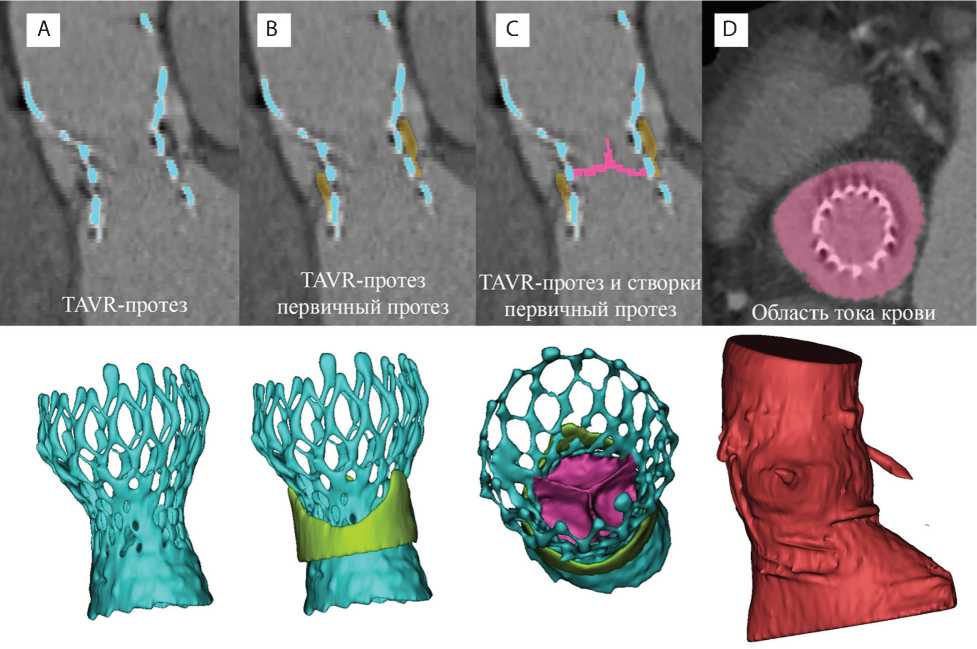
Рис. 1. Метод реконструкции объектов моделирования потоков с примерами масок на основе данных мультиспираль-ной компьютерной томографии конечного пациента: TAVR-протез CoreValve™ 29-го типоразмера (А); первичный SAVR-биопротез, у которого развилась дисфункция, потребовавшая повторного протезирования, сформированный комплекс «протез-в-протез» (B); створчатый аппарат TAVR-протеза (цвет изменен для наглядности визуализации) (C); расчетная область тока крови, соответствующая внутреннему просвету корня аорты — контрастированной области (D)
ской плотности и ручного корректирования масок реконструировали геометрии объектов:
-
а) TAVR-протеза CoreValve™ 29-го типоразмера, включающего опорный каркас, створчатый аппарат, облицовку приточной зоны (рис. 1, А, B);
-
б) первичного каркасного SAVR-биопротеза, у которого развилось состояние дисфункции, потребовавшей репротезирование (рис. 1, C);
-
в) корня аорты, включающего фиброзное кольцо, синусы Вальсальвы, восходящую часть (рис. 1, D).
Полученные трехмерные модели, основанные на треугольных полигонах, импортировали в программное средство Salome (OPEN CASCADE SAS, Франция), в котором определяли расчетную область моделирования течения жидкости, после чего проводили ее преобразование в сетку конечных элементов в HELYX-OS (ENGYS, Великобритания). В результате получали область, состоящую из
-
6,9 млн гексаэдрических элементов, с уплотнениями в областях интереса — пристеночных участках — и в окружении участка парапротезной регургитации. Численный расчет гемодинамических эффектов использовал модель несжимаемой ньютоновской жидкости со свойствами, аналогичными для крови, плотностью ρ = 1 050 кг/м3 и динамической вязкостью µ = 0,0035 Па×с. Непосредственное компьютерное моделирование проводили в программном комплексе OpenFOAM, версия 6 (The OpenFOAM Foundation Ltd, Великобритания), где для решения системы уравнений Навье – Стокса использовали алгоритм PISO (Pressure-Implicit with Splitting of Operators). Входные параметры тока крови соответствовали данным эхокардиографического исследования пациента, выполненного в период повторной госпитализации: частота сердечных сокращений 70 ударов в минуту, давление диастолы 60 мм рт. ст. С учетом того что интересующие в работе эффекты
возникают лишь на стадии диастолы, моделирование проводили только для данной фазы.
Важной прогностической особенностью пара-протезной регургитации являются эффекты, потенциально приводящие к механическому разрушению эритроцитов, вследствие образования значительных скоростей, вихрей и сдвиговых пристеночных напряжений в области утечки. Таким образом, в работе оценивали два компонента, критичных для разрушения эритроцитов: вязкое сдвиговое напряжение (для ламинарного тока) и напряжение Рейнольдса (для турбулентного) [21]. Для подробного анализа данных эффектов моделирование гемодинамики проводили с использованием двух решателей:
-
1) ламинарного, учитывающего только линейную структуру потока, без его смены, однако с возможностью формировать вихри;
-
2) турбулентного, моделирующего полный перечень эффектов изменения тока жидкости и переходов ламинарная – турбулентная структура.
В работе раздельно оценивали количественные значения описанных напряжений — вязкого и Рейнольдса, а также их качественное распределение на эпюрах и характеристики тока крови в области интереса — участке парапротезной регургитации. Кроме того, оценивали пристеночное сдвиговое напряжение как потенциальный предиктор запуска свертывающей системы крови с участием фактора фон Виллебранда [22, 23].
Статистический анализ
Статистическую обработку данных производили в программе Statistica 6.0 (StatSoft, Inc., США), в которую импортировали количественные значения ис- следуемых показателей из среды моделирования OpenFoam. Все количественные признаки представлены как средние и стандартные отклонения (М ± σ). Учитывая, что для компьютерной модели возможно регулировать количество точек для измерений, предварительно провели анализ сходимости на примере вычисления средней скорости кровотока по всей расчетной области (корня аорты). Для этого автоматически проводили измерения в 101, 5 × 101, 102, 5 × 102, 103, 5 × 103, 104, 5 × 104 и 105 точках, которые затем импортировали в программу Statistica для вычисления среднего и стандартного отклонения. Показано, что в данном расчете, 103 точек достаточно для получения средних значений и стандартного отклонения с ошибкой менее 1% при сравнении с результатами усреднения 105 точек. Таким образом, для расчета среднего и стандартного отклонений количественных признаков использовали 1 000 точек. Оценку статистической значимости производили с помощью t-критерия Стьюдента, достоверными считали различия при р<0,05.
Результаты
Согласно анализу геометрического взаимного расположения исследуемых объектов (трехмерных реконструкций по данным МСКТ) выявили основную причину возникновения парапротезной регургитации — низкое положение приточной зоны биопротеза CoreValve™ относительно опорного каркаса первичного SAVR-биопротеза. Данная особенность привела к неплотному контакту «протез-в-протез» (рис. 2, А, B), который был дополнительно усугублен присутствием крупных кальцинатов.
Распределение напряжений в исследуемых областях
|
Область измерения |
Напряжение вязкое, Па |
Напряжение Рейнольдса, Па |
Пристеночное сдвиговое напряжение, Па |
|
Среднее значение в области регургитации |
105,1 ± 15,6 1 |
76,4 ± 10,1 2 |
56,4 ± 12,8 3 |
|
Среднее значение по модели |
23,8 ± 5,4 1 |
15,4 ± 8,8 2 |
5,1 ± 15,8 3 |
|
Зона выше фиброзного кольца |
20,6 ± 4,1 |
17,0 ± 2,5 |
14,1 ± 12,3 |
|
Зона ниже фиброзного кольца |
26,6 ± 11,4 |
14,5 ± 6,1 |
10,6 ± 3,4 |
Примечание. 1, 2, 3 — индикаторы статистических различий между исследуемыми группами (p<0,05)
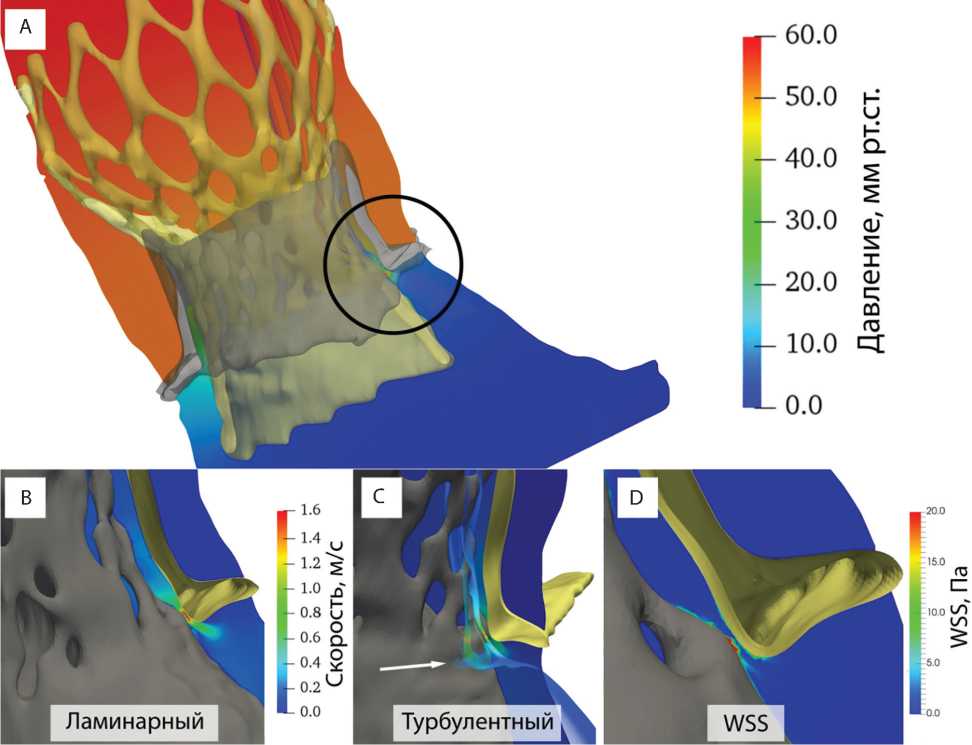
Рис. 2. Эпюры основных количественных показателей моделирования: распределение давления по расчетной области (А); область парапротезного сброса для ламинарного течения (B); область парапротезного сброса для турбулентного течения с визуализацией изолиний завихрения (белая стрелка, C); пристеночное сдвиговое напряжение в области сброса, для наглядности визуализации значения пристеночного сдвигового напряжения ограничены параметром 20 Па при максимуме 61,1 Па (D)
Моделирование потоков продемонстрировало значительное превышение количественных показателей в области парапротезной регургитации по сравнению со средними значениями расчетной области. Данный эффект наблюдали для обоих вариантов решения: ламинарного, для которого скорость в области регургитации составила 1,1 ± 0,2 м/с, и для турбулентного со скоростью 1,55 ± 0,13 м/с (рис. 2, C). При этом средние значения по расчетной области составили 0,35 ± 0,06 и 0,40 ± 0,09 м/с соответственно. Статистически получены достоверные различия при попарном сравнении средней скорости в области регургитации и в целом по расчетной области для обоих вариантов (p<0,05).
Напряжение, возникающее в кровотоке, — вязкое и Рейнольдса, а также напряжение в стенках исследуемых объектов в значительной мере различались от области интереса ( таблица ).
При качественном анализе линий тока и скоростей отмечено возникновение вихревых участков для случая турбулентного решателя. Вихри ожидаемо возникают после парапротезной фистулы, однако имеют незначительную выраженность, что отчетливо видно по изолиниям на эпюрах оценки скорости (рис. 2, C, белая стрелка).
Также качественно показана причина возникновения регургитации в области неплотного примыкания протеза с дисфункцией и TAVR-протеза за счет низкого расположения последнего таким образом, что отверстия приточной облицовки находятся вблизи границы контакта (рис. 2, B, C).
Обсуждение
Повторное протезирование аортального клапана относительно нечастое событие: мировой регистр данных процедур с 2011 по 2016 г. включает 2 936 случаев TAVR-in-SAVR против 68 545 операций первичного протезирования [24]. Такая диспропорция во многом обусловливает трудность прогноза гемодинамических эффектов, в особенности для нетипичных случаев: некальцинированная протезная дисфункция не предполагает развития парапротезной фистулы по классическому для транскатетерной имплантации механизму за счет массивных кальцификатов, нарушающих контакт протеза и окружающих тканей [25].
Приведенная в настоящем исследовании гемодинамическая модель позволила визуализировать причину возникновения регургитации: положение TAVR-протеза (прежде всего, облицовки его приточной зоны) ниже, чем место контакта «протез-в-протез». При этом важно отметить, что такое взаимное расположение протезов не корректируется в послеоперационном периоде. При парапротезной регургитации в случае кальциноза и неплотного прилегания возможна постоперационная дилатация TAVR-протеза [26], которая улучшает контакт TAVR-SAVR-протезов, однако для настоящего случая такое вмешательство (постдилатация) не оказало бы значимого положительного результата, так как причина сброса заключается не в полноте раскрытия TAVR-протеза, а высоте его расположения. В литературе в исследованиях положения TAVR-протеза при процедуре «протез-в-протез» демонстрируются аналогичные выводы: низкое положение протеза способно вызвать парапротезную регургитацию, однако четких количественных рекомендаций не приводится [17].
Помимо негативных гемодинамических эффектов парапротезной регургитации — обратного заброса крови — важным явлением, которое может сопровождать ее, является механический гемолиз двумя активаторами: высокими значениями вязкого сдвигового напряжения и напряжения Рейнольдса. Превышение обоими напряжениями пороговых значений, как показано в литературе, способно вызвать нарушение целостности мембраны эритроцитов [21]. В настоящем исследовании отмечен значительный рост данных напряжений: относительно среднего значения по расчетной области на 214% до значений, близких к критическим, согласно литературе. Экспериментальные работы с кровью крупного рогатого скота демонстрируют возникновение гемолиза при 150–300 Па для ламинарного и 400–4 000 Па для турбулентного потоков [21]. Приближение суммарного напряжения (вязкого + Рейнольдса = 181 Па) к пороговым может свидетельствовать о риске гемолиза в области парапротезного сброса, однако важным фактором является время экспозиции высоких напряжений. По данным литературы, время критических напряжений должно составлять до 120 с для разрушения эритроцитов. В настоящей работе высокие значения напряжений возникают лишь в короткий участок сердечного цикла — 0,10–0,15 с. Таким образом, непродолжительное время экспозиции (0,05 с за цикл) в нашем случае, вероятно, не вызывало разрушение эритроцитов, что подтверждается отсутствием клинических и лабораторных признаков гемолитической анемии.
Пристеночное (рис. 2, D) сдвиговое напряжение как показатель, характеризующий риск разрушения тканей в области высоких значений, в данном исследовании продемонстрировало значения, превышающие пороговые: 61,1 против критических 15 Па [22]. Показано, что высокие значения пристеночного сдвигового напряжения ассоциированы с риском тромбообразования с участием фактора фон Виллебранда за счет разрушения слоя эндотелия, выстилающего внутренний просвет сосудов, в результате чего запускается каскад свертывания крови [23]. Однако данное превышение стоит трактовать с осторожностью в случае биопротезов. Для описанного случая TAVR-in-SAVR высокое пристеночное сдвиговое напряжение воздействует на ксеноткань — обшивку и створки протезов, поверхность которых лишена эндотелия и, как следствие, фактора фон Виллебранда. Тем не менее, как показано в литературе [27], первичный SAVR-биопротез может быть мелкоочагово покрыт паннусом и/ или эндотелием, в том числе в рассматриваемой приточной области (рис. 2, А), и обладать потенциальной активностью с позиции инициации тромбо-образования. Однако сведения об эндотелизации биопротезов носят единичный характер. В целом несмотря на высокое пристеночное сдвиговое напряжение в области парапротезной регургитации, в настоящем исследовании клинических и эхокардиографических признаков тромбообразования и эмболии не отмечено.
Использованная в работе методика последовательного анализа клинических графических данных и компьютерного моделирования потоков может стать основой прогностического инструмента для предоперационного планирования транскатетерных вмешательств по типу «протез-в-протез». Достаточная разрешающая способность методов клинической визуализации (МСКТ) позволяет получать удовлетворительные трехмерные модели для воспроизведения гемодинамики с учетом па-циент-специфических характеристик кровотока. При этом возможна оценка подробных характеристик движения крови как в объеме, так и локальных участках интереса, например зоне парапротез-ной регургитации. Потенциально сравнительное компьютерное исследование гемодинамики двух и более вариантов типоразмера (26 против 29 мм) или даже моделей биопротезов (Evolut R™ против Sapien 3) для технологии «протез-в-протез», проведенное предварительно до вмешательства, может внести больше ясности в определение типоразмера и/или модели протеза для исключения негативных последствий — парапротезной регургитации. Несмотря на значительный прогресс в подборе необходимого протеза для транскатетерной имплантации, существуют случаи неопределенности в выборе типоразмера протеза, разрешающиеся лишь во время вмешательства. Применение данной методики возможно не только для геометрического анализа расположения комплекса «протез-в-про-тез» и выбора типоразмера или модели протеза, но и оценки риска негативных гемодинамических эффектов (тромбоза, эмболии, гемолиза).
Заключение
Причина и механизм парапротезной регургитации при повторной имплантации по типу «про-тез-в-протез» каркасного биопротеза с дисфункцией могут отличаться от принятых представлений (массивной кальцификации) и быть обусловлены особенностями взаимного относительного расположения протезов. Парапротезный сброс в данном случае возникает из-за низкого уровня имплантации TAVR-протеза относительно протеза с дисфункцией. Численный анализ гемодинамики воспроизвел основной эффект — парапротез-ную регургитацию в области неплотного контакта «протез-в-протез» двух медицинских изделий. Продемонстрирована возможность визуализации и оценки углубленных показателей гемодинамики: напряжений крови, потенциально способных стать предикторами негативных событий (гемолиза, эмболии и тромбообразования), возникающих вследствие образования патологического сброса. Подобная модель может стать основой прогностического инструмента предоперационного планирования, улучшающего исход вмешательства за счет оценки риска парапротезной регургитации и подбора оптимальных типоразмеров, моделей и позиции TAVR-протезов.
Список литературы Численное моделирование гемодинамики при повторном протезировании клапана сердца
- Midha P.A., Raghav V, Okafor I., Yoganathan A.P. The effect of valve-in-valve implantation height on sinus flow. Ann Biomed Eng. 2017;45(2):405-12. PMID: 27164838. https://doi. org/ DOI: 10.1007/s10439-016-1642-2
- Бокерия Л.А., Милиевская Е.Б., Кудзоева З.Ф., Прянишников В.В. Сердечно-сосудистая хирургия - 2017. Болезни и врожденные аномалии системы кровообращения. М.: НМИЦ ССХ им. А.Н. Бакулева Минздрава России, 2018. 252 с.
- Paradis J.M., Del Trigo M., Puri R., Rodes-Cabau J. Transcatheter valve-in-valve and valve-in-ring for treating aortic and mitral surgical prosthetic dysfunction. J Am Coll Cardiol. 2015;66(18):2019-37. PMID: 26516006. https://doi. org/ DOI: 10.1016/i.iacc.2015.09.015
- Carabello B.A., Paulus W.J. Aortic stenosis. Lancet. 2009;373(9667):956-66. PMID: 19232707. https://doi. org/ DOI: 10.1016/S0140-6736(09)60211-7
- Musumeci L., Jacques N., Hego A., Nchimi A., Lancellotti P., Oury C. Prosthetic aortic valves: challenges and solutions. Front Cardiovasc Med. 2018;5:46. PMID: 29868612; PMCID: PMC5961329. DOI: 10.3389/fcvm.2018.00046


